Содержание
- 2. Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде
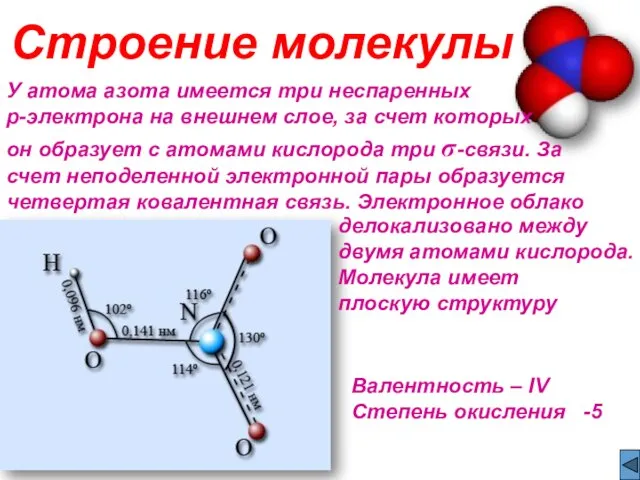
- 3. У атома азота имеется три неспаренных p-электрона на внешнем слое, за счет которых он образует с
- 4. Физические свойства Бесцветная жидкость, дымящая на воздухе. Едкий запах. Желтый цвет концентрированной кислоты (разложение с образованием
- 6. Химические свойства Разбавленная азотная кислота проявляет свойства, общие для всех кислот: Диссоциация в водном растворе: HNO3
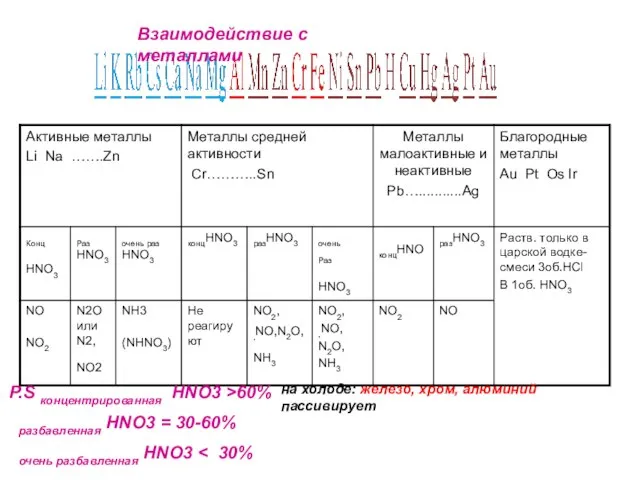
- 7. Специфические свойства – взаимодействие с металлами ЗАПОМНИ! При взаимодействии азотной кислоты любой концентрации с металлами водород
- 8. Окисление металлов: Продукты восстановления зависят от активности металла и разбавленности азотной кислоты (чем активнее металл и
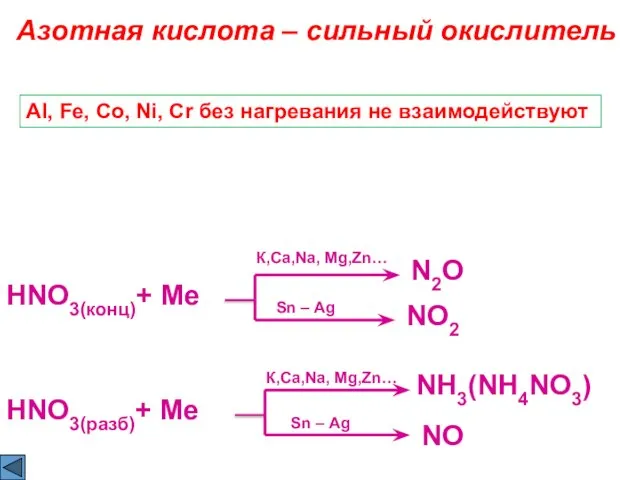
- 9. HNO3(конц)+ Ме Азотная кислота – сильный окислитель N2O Sn – Ag NO2 Al, Fe, Co, Ni,
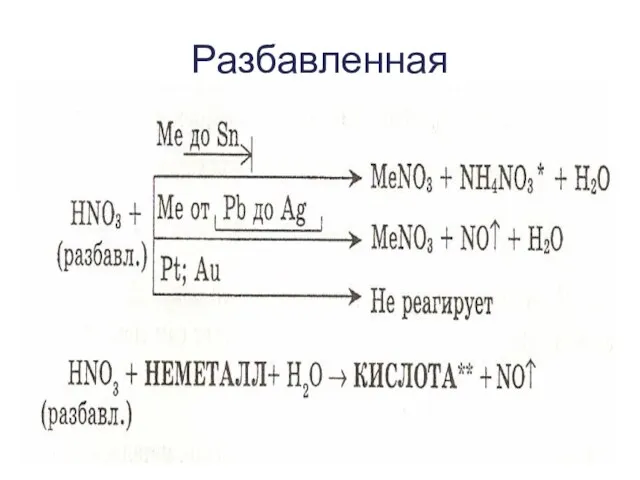
- 10. Разбавленная
- 11. Концентрированная
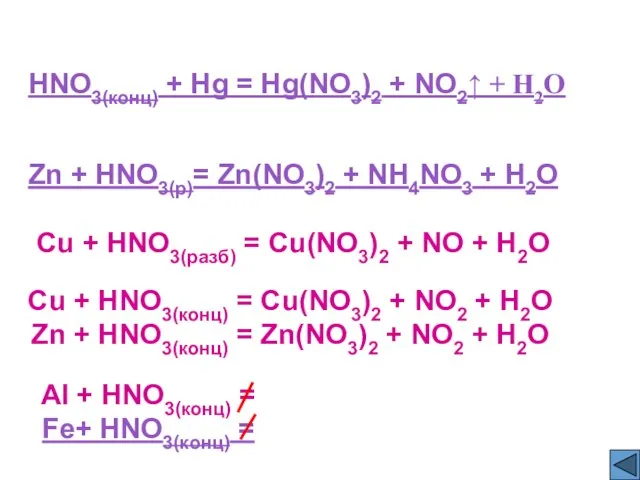
- 12. HNO3(конц) + Hg = Hg(NO3)2 + NO2↑ + H2O Zn + HNO3(р)= Zn(NO3)2 + NH4NO3 +
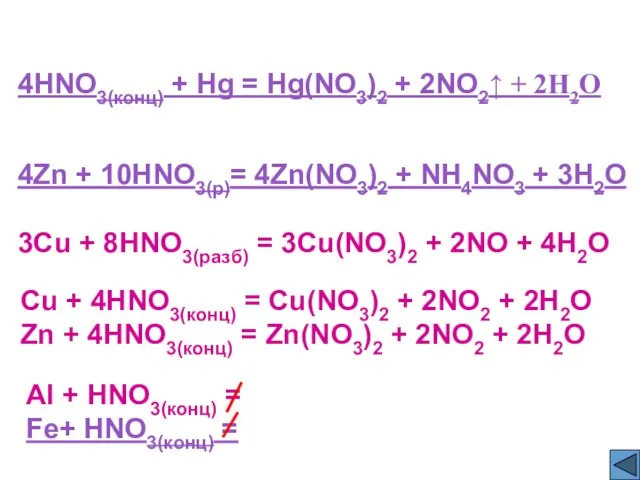
- 13. 4HNO3(конц) + Hg = Hg(NO3)2 + 2NO2↑ + 2H2O 4Zn + 10HNO3(р)= 4Zn(NO3)2 + NH4NO3 +
- 14. Взаимодействие с неметаллами При взаимодействии с неметаллами образуется кислота, в которой у неметалла высшая степень окисления,
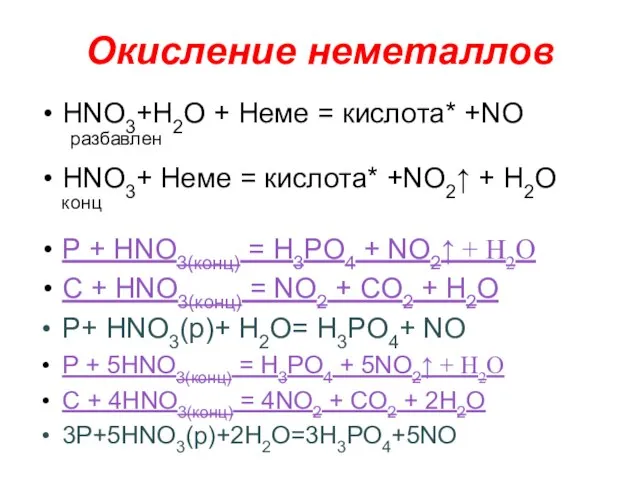
- 15. Окисление неметаллов НNO3+H2O + Неме = кислота* +NO разбавлен НNO3+ Неме = кислота* +NO2↑ + H2O
- 16. Органические вещества окисляются и воспламеняются в азотной кислоте. Белки при взаимодействии с конц. азотной кислотой разрушаются
- 17. Смесь концентрированных азотной и соляной кислот (соотношение по объему 1 :3) называется царской водкой; она растворяет
- 18. Получение азотной кислоты Окисления аммиaка в NO в присутствии платино-родиевого катализатора: 4NH3 + 5O2 = 4NO
- 19. Получение азотной кислоты – взаимодействием калиевой или натриевой селитры с концентрированной серной кислотой при нагревании: KNO3
- 20. Нитраты – соли азотной кислоты (cелитры) Получаются при взаимодействии азотной кислоты с металлами, оксидами металлов, основаниями,
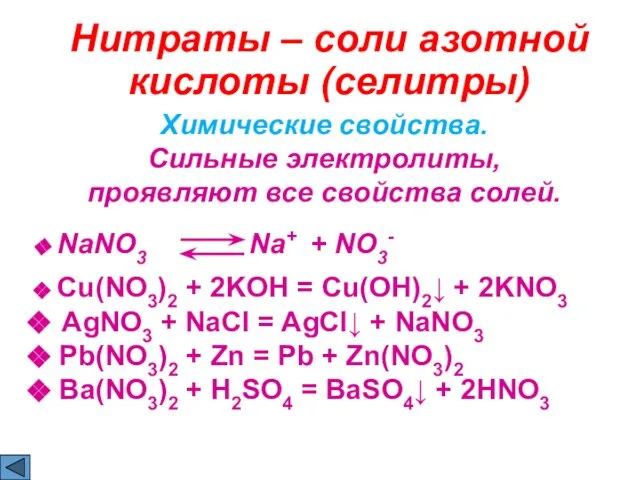
- 21. Нитраты – соли азотной кислоты (cелитры) Химические свойства. Сильные электролиты, проявляют все свойства солей. NaNO3 Na+
- 22. Разложение нитратов при нагревании Me(NO3)x Ca – Mg Me(NO2)x + O2↑ Mg - Cu MexOy +
- 23. Качественные реакции на азотную кислоту и ее соли NaNO3 + H2SO4 = NaHSO4 + HNO3 4HNO3
- 24. красители лекарства удобрения пластмасса пиротехника взрывчатые вещества Применение азотной кислоты и нитратов HNO3 и нитраты травление
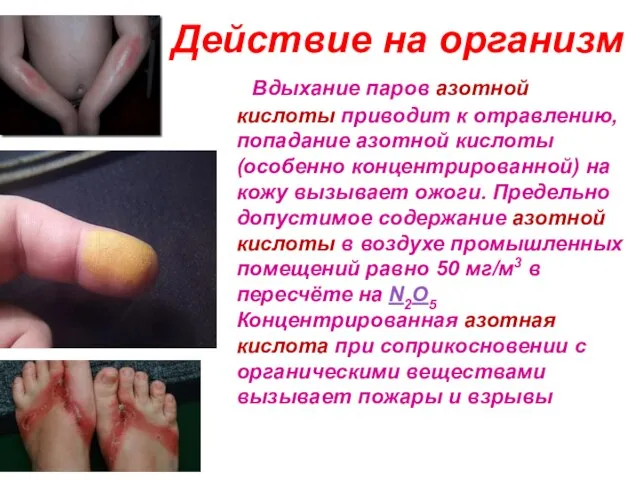
- 25. Действие на организм Вдыхание паров азотной кислоты приводит к отравлению, попадание азотной кислоты (особенно концентрированной) на
- 26. Исследования (задания по группам): (Повторение ПТБ!). 1 группа: провести реакцию раствора азотной кислоты и оксида меди
- 27. Группа №1 CuO + 2 HNO3 = Cu(NO3)2 + H2O - реакция ионного обмена, необратимая CuO
- 28. P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 на холоде: железо, хром, алюминий
- 29. Проверь себя: Степень окисления азота в HNO3 а)-3 б)0 в)+5 г)+4 При хранении на свету HNO3
- 30. 1 - в 2 - б 3 - а 4 - а 5 - б ключ
- 31. вывод: 1. Азотной кислоте характерны общие свойства кислот: реакция на индикатор, взаимодействие с оксидами металлов, гидроксидами,
- 33. Скачать презентацию




















 Россия - родина моя!
Россия - родина моя! Колебания Солнца и звезд и температурные волны в фотосфере
Колебания Солнца и звезд и температурные волны в фотосфере Презентация на тему ХИМИЯ - это наука о веществах и их превращениях
Презентация на тему ХИМИЯ - это наука о веществах и их превращениях  Организация и анализ приемки товаров по количеству и качеству в розничной торговле на примере АО ТД Южный
Организация и анализ приемки товаров по количеству и качеству в розничной торговле на примере АО ТД Южный Кабинет иностранного языка № 306
Кабинет иностранного языка № 306 Традиции и обычаи Японии
Традиции и обычаи Японии Методическое объединение учителей иностранных языков
Методическое объединение учителей иностранных языков Интеллектуал
Интеллектуал ДОМ СОЛНЦА
ДОМ СОЛНЦА Ассортимент магазина Fea tLab
Ассортимент магазина Fea tLab Синдром Иценко-Кушинга
Синдром Иценко-Кушинга Стрижка, окрашивание и укладка волос
Стрижка, окрашивание и укладка волос Презентация на тему Н-НН в суффиксах причастий
Презентация на тему Н-НН в суффиксах причастий  Центр образовательных услуг
Центр образовательных услуг Urok_161-162_Tekhnologia_uboya_i_pererabotki
Urok_161-162_Tekhnologia_uboya_i_pererabotki Красная книга Ростовской области. Животные
Красная книга Ростовской области. Животные Принятие управленческих решений
Принятие управленческих решений Сберегший душу потеряет, а потерявший – сбережет. Евангелие от Иоанна 12:24-26.
Сберегший душу потеряет, а потерявший – сбережет. Евангелие от Иоанна 12:24-26. Микены и Троя
Микены и Троя Хлеб. Откуда он берется?
Хлеб. Откуда он берется? Ключевые особенности и отличия федеральных государственных образовательных стандартов (ФГОС) от государственных образовательны
Ключевые особенности и отличия федеральных государственных образовательных стандартов (ФГОС) от государственных образовательны Mitsubishi Grandis
Mitsubishi Grandis Духовно-нравственное здоровье нации и будущее наших детей
Духовно-нравственное здоровье нации и будущее наших детей МЕЖДУНАРОДНЫЙ КОМИТЕТКРАСНОГО КРЕСТА
МЕЖДУНАРОДНЫЙ КОМИТЕТКРАСНОГО КРЕСТА Многогранники
Многогранники "Карагайский бор"
"Карагайский бор" Конкурс «Лучший следопыт» в области геометрии.
Конкурс «Лучший следопыт» в области геометрии. Список документов, для признания нуждающимися в улучшении жилищных условий
Список документов, для признания нуждающимися в улучшении жилищных условий