Слайд 2Химическое равновесие
Реакции, которые одновременно протекают в прямом и обратном направлении, называются обратимыми
Состояние

химического обратимого процесса, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием
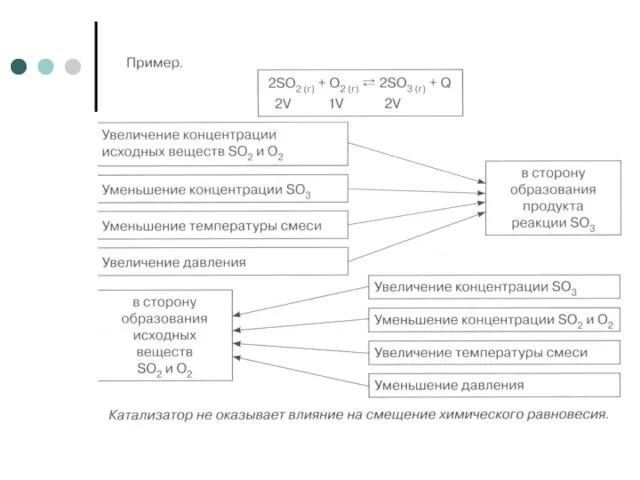
Слайд 3Смещение химического равновесия осуществляется в соответствии с принципом Ле Шателье
Если на систему,

находящуюся в состоянии химического равновесия, оказать внешнее воздействие (изменить концентрацию, температуру, давление), то равновесие смещается в сторону той реакции, которая ослабляет это воздействие
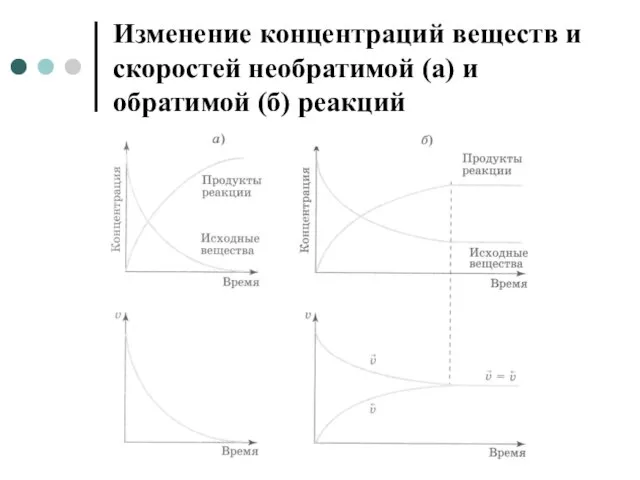
Слайд 5Процессы, протекающие при обратимых реакциях

Слайд 6Процессы, протекающие при обратимых реакциях
прямая реакция
αА + βВ γС +

δD
обратная реакция
υ ═ k1 · [A]α · [B]β
Слайд 7Изменение концентраций веществ и скоростей необратимой (а) и обратимой (б) реакций






 Золотарь. Повышение уровня работоспособности
Золотарь. Повышение уровня работоспособности Формирование гендерной принадлежности детей дошкольного возраста
Формирование гендерной принадлежности детей дошкольного возраста Склонение имен существительных в упражнениях
Склонение имен существительных в упражнениях Обработка фрезерованием
Обработка фрезерованием Презентация на тему Финансы и кредит Денежная система
Презентация на тему Финансы и кредит Денежная система  Система применения минеральных удобрений под посев озимой пшеницы урожая 2013 года
Система применения минеральных удобрений под посев озимой пшеницы урожая 2013 года Презентация на тему Слово о полку Игореве
Презентация на тему Слово о полку Игореве  ПРОВОДЯЩИЕ ПОЛИМЕРЫ
ПРОВОДЯЩИЕ ПОЛИМЕРЫ Die vier Kerzen
Die vier Kerzen Презентация на тему Саранча
Презентация на тему Саранча  Толықтауыш
Толықтауыш Особенности радиоактивного заражения при авариях на АЭС
Особенности радиоактивного заражения при авариях на АЭС Транспортно-экспедиционная деятельность на автомобильном транспорте. Контейнерные перевозки
Транспортно-экспедиционная деятельность на автомобильном транспорте. Контейнерные перевозки Проведение ГИА-9 в 2012 году
Проведение ГИА-9 в 2012 году Презентация на тему Преподавание истории и обществознания в условиях открытой информационно-образовательной среды
Презентация на тему Преподавание истории и обществознания в условиях открытой информационно-образовательной среды Русский язык будет жить. Язык в эпоху Интернета
Русский язык будет жить. Язык в эпоху Интернета Веселые моменты школьной жизни
Веселые моменты школьной жизни С днём рождения!
С днём рождения! Урок-соревнование в 3 классе Тема: «Wir kennen Deutsch super – ich kenne Deutsch am besten!»
Урок-соревнование в 3 классе Тема: «Wir kennen Deutsch super – ich kenne Deutsch am besten!» Презентация на тему Города воинской славы
Презентация на тему Города воинской славы  Бизнес-планирование. Бассейн
Бизнес-планирование. Бассейн Восточный веер
Восточный веер Lection2
Lection2 Сохранение психологического здоровья учащихся
Сохранение психологического здоровья учащихся Social network
Social network Роль ШМО естественно – математического цикла в работе со слабоуспевающими учащимися
Роль ШМО естественно – математического цикла в работе со слабоуспевающими учащимися Урок литературы в 11 классе Учитель русского языка и литературы Бокова Лидия Александровна
Урок литературы в 11 классе Учитель русского языка и литературы Бокова Лидия Александровна Прыжки в высоту с разбега способом перешагивание. 5 класс
Прыжки в высоту с разбега способом перешагивание. 5 класс