Содержание
- 2. Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого изменяется рН среды. В процессе
- 4. ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ
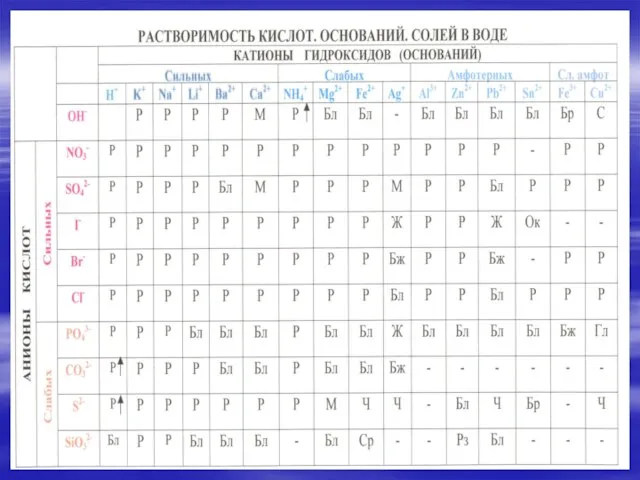
- 5. В зависимости от силы исходной кислоты и исходного основания, образовавших соль, выделяют 4 типа солей. Соли,
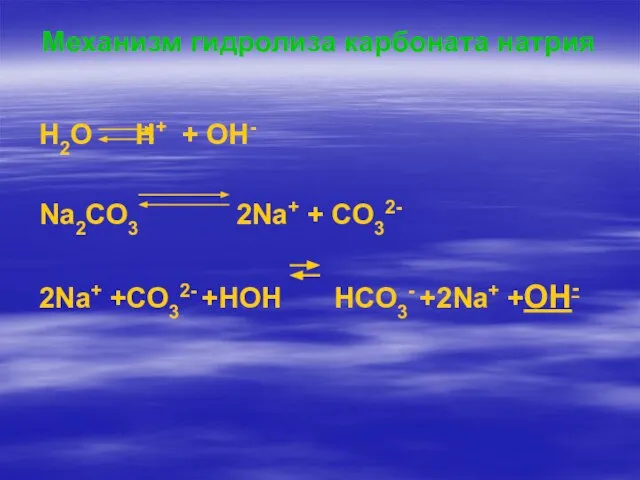
- 6. Механизм гидролиза карбоната натрия H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +HOH HCO3-
- 7. CO32- +HOH HCO3- +OH- Na2CO3 +H2O NaHCO3 +NaOH Одним из продуктов данной обменной реакции является кислая
- 8. Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней
- 9. FeCl2 ↔ Fe2+ + 2Cl- Fe2+ + H2O ↔ (FeOH)+ + H+ FeCl2 + H2O ↔
- 10. Механизм гидролиза хлорида алюминия H2O H+ + OH- AlCl3 Al3+ + 3Cl- Al3+ +3Cl- +HOH Al
- 11. Al3+ + HOH AlOH2+ + H+ AlCl3 + H2O AlOHCl2 + HCl Одним из продуктов данной
- 12. Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- (что сильней того и
- 13. 4. Соли, образованные катионом сильного основания и анионом сильной кислоты не подвергаются гидролизу. К таким солям
- 14. Механизм гидролиза хлорида натрия H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl-
- 15. NaCl + Н2О = Сформулируем вывод: Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.
- 16. Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е
- 17. Самостоятельно заполните таблицу
- 18. Самостоятельно заполните таблицу
- 19. Количественной характеристикой гидролиза является степень гидролиза α (которую выражают в процентах). где n - число моль
- 21. Скачать презентацию




![Схема гидролиза карбоната натрия Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372827/slide-7.jpg)



![Схема гидролиза хлорида алюминия AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372827/slide-11.jpg)



![Схема гидролиза карбоната натрия NaCl NaOH HCl сильное основание сильная кислота [OH]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/372827/slide-15.jpg)



 Сравнительная характеристика развития малого бизнеса в России и за рубежом
Сравнительная характеристика развития малого бизнеса в России и за рубежом Экономические и организационные основы денежно-кредитной политики. (Лекция 3)
Экономические и организационные основы денежно-кредитной политики. (Лекция 3) Семион Полоцкий
Семион Полоцкий "Ханох"
"Ханох" Презентация на тему Ожоги и обморожения
Презентация на тему Ожоги и обморожения Презентація 10 клас Урок 18
Презентація 10 клас Урок 18 Политология как наука
Политология как наука Тактика-специальная подготовка
Тактика-специальная подготовка Цели и виды сертификации
Цели и виды сертификации Александр Николаевич Островский (1823-1886гг.)
Александр Николаевич Островский (1823-1886гг.) Отдых будет приятным если….
Отдых будет приятным если…. Презентация на тему Храмы Древней Греции
Презентация на тему Храмы Древней Греции  Каталоги
Каталоги  Нужна ли seo-оптимизация для интернет-магазина?
Нужна ли seo-оптимизация для интернет-магазина? Кухня под старину из массива сосны
Кухня под старину из массива сосны Проблема риска в инновационной деятельности. Виды рисков. Методы оценки рисков. Методы уменьшения риска
Проблема риска в инновационной деятельности. Виды рисков. Методы оценки рисков. Методы уменьшения риска Олимпийские дисциплины в плавании
Олимпийские дисциплины в плавании Russian cuisine
Russian cuisine Общие сведения
Общие сведения Проблемы экологии в России и Великобритании в 21 веке Андрианова Н.Г.
Проблемы экологии в России и Великобритании в 21 веке Андрианова Н.Г. Организация приема в первый класс
Организация приема в первый класс Литературные премии как ориентир читательских предпочтений
Литературные премии как ориентир читательских предпочтений Dali
Dali Картины художников Великобритании
Картины художников Великобритании «Готовность младших школьников к обучению в среднем звене»
«Готовность младших школьников к обучению в среднем звене» ПАТРИОТИЗМ
ПАТРИОТИЗМ Русское искусство XVIII-XIX веков
Русское искусство XVIII-XIX веков Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс
Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс