Содержание
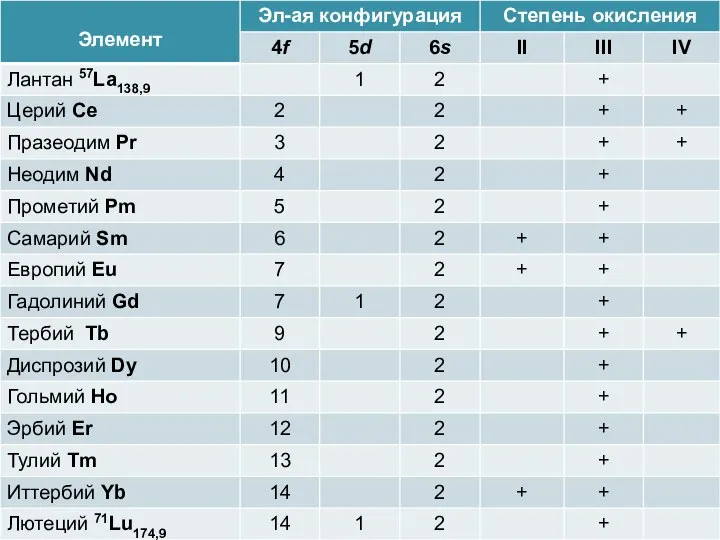
- 2. РЕДКОЗЕМЕЛЬНЫЕ ЭЛЕМЕНТЫ Термин "редкоземельные металлы" объединяет 17 химических элементов, включая лантаноиды, располагаются в таблице Менделеева под
- 3. РЗМ В ИСТОРИИ Название «редкоземельные элементы» исторически сложилось в конце XVIII, когда ошибочно считали, что минералы,
- 4. РЗМ В ИСТОРИИ 1794г. – И.Я. Гадолин из нового минерала, названного иттербитом, выделил окись нового элемента,
- 5. РАСПРОСТРАНЁННОСТЬ РЗЭ И ИХ МИНЕРАЛЫ Монацит (Се, La...) РО4 50 - 68% Ln2О3 , 22 -
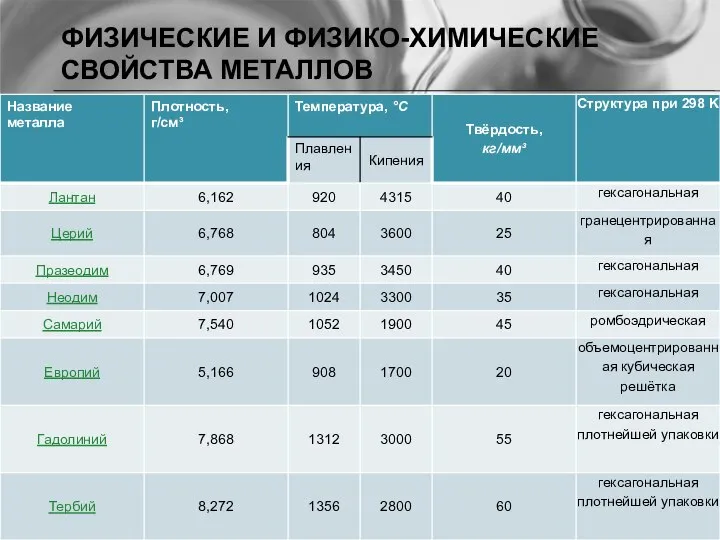
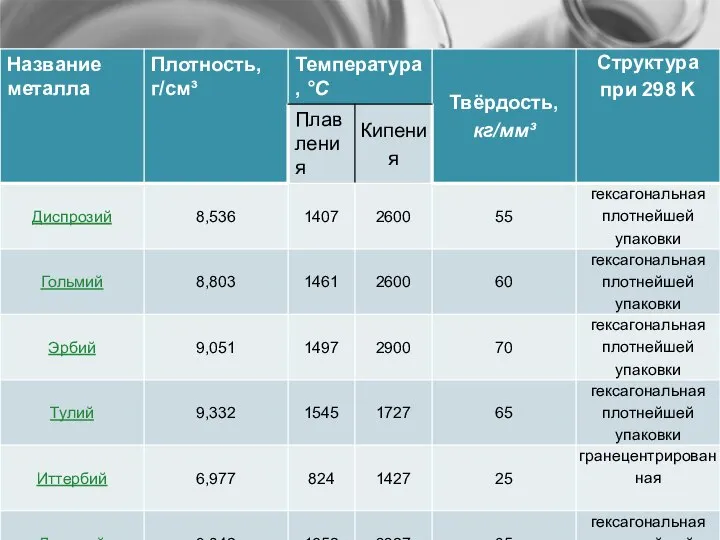
- 7. ФИЗИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
- 9. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Оксиды Высшие оксиды: Полуторные: Низшие:
- 10. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Гидроксиды Металлические свойства РЗЭ возрастают в следующем порядке Lu, Yb, Tu, Er, Ho,
- 11. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Сульфаты Ln2O3 + 6H2SO4 → 2Ln(HSO4)3 + ЗН2О 2Ln(HSO4)3 → Ln2(SO4)3 + 3S03
- 12. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Тиосульфаты В воде, подкисленной соляной кислотой, разлагаются: Ln2(S2O3)3 = Ln2(SO3)3 + 3S Двойные
- 13. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Селенаты Селенаты иттрия и лантаноидов и цериселенат Ln2(SeО4)3∙nH2O; Y2(SeO4)3∙nH2O; Ce(SeO4)2 Ln2O3 + 3H2SeO4
- 14. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Селениты Ln2(SeО3)3∙nH2О получают, действуя на растворы солей рзэ селенитом натрия или селенистой кислотой.
- 15. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Нитраты Ln2О3 + 6N2О4 → 2Ln(NO3)3 + 3N2O3. Ln2О3 + 6HNO3 → 2Ln(NO3)3
- 16. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Нитриты Ln(NО2)3 образуются в виде кристаллических осадков при прибавлении к нитрату или хлориду
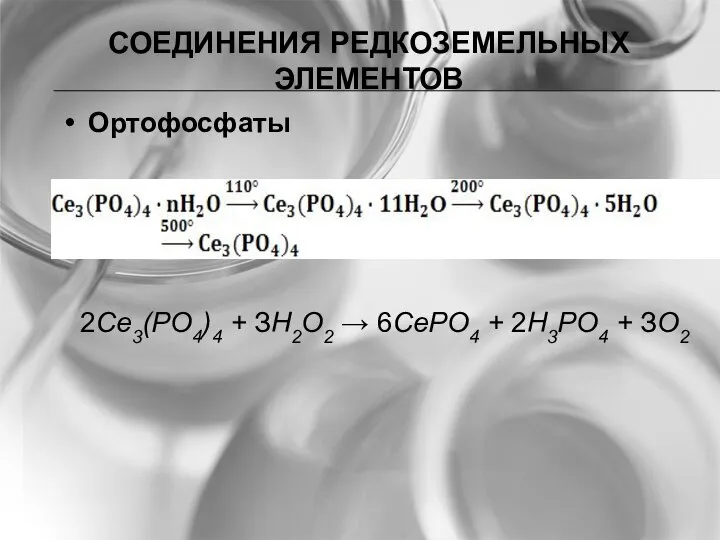
- 17. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Ортофосфаты 2Се3(РO4)4 + ЗН2O2 → 6СеРO4 + 2Н3РO4 + ЗО2
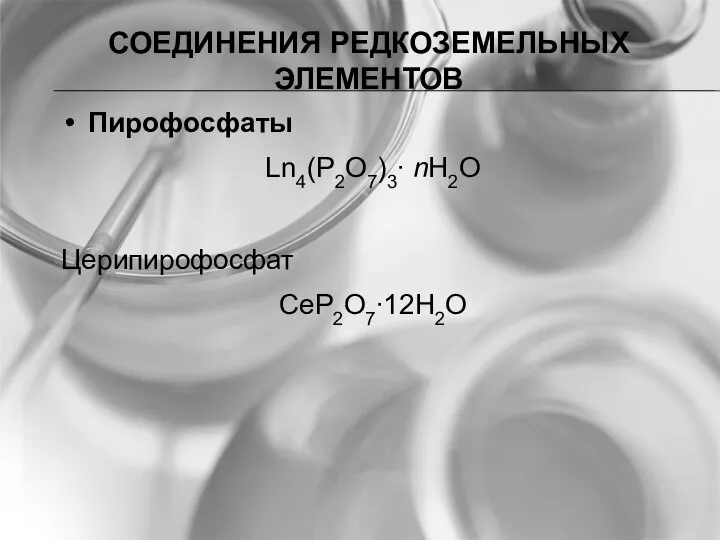
- 18. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Пирофосфаты Ln4(Р2O7)3∙ nН2O Церипирофосфат СеР2О7∙12Н2О
- 19. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Карбонаты Ln2(CО3)3 + 2Н2О → 2Ln(OH)CO3 + Н2СО3.
- 20. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Оксалаты Ln2(SО4)3 + ЗН2С2О4 = Ln2(C2О4)3 + 3H2SО4. Редкоземельные элементы с оксалатами щелочных
- 21. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Фториды Ln2О3 + 6HF = 2LnF3 + 3H2О Ln2О3 + 6NH4HF2 = 2LnF3
- 22. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Гидриды Максимальное содержание водорода в гидридах соответствует формуле LnH3. LnH3 + 3НС1 =
- 23. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Комплексные соединения 1. ЭДТА – этилендиаминтетрауксусная кислота С14H16O8N2: 2. Кислые алкилфосфаты:
- 24. СОЕДИНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ Комплексные соединения 3. Нейтральные экстрагенты: Состав комплексов зависит от рН раствора и изменяется
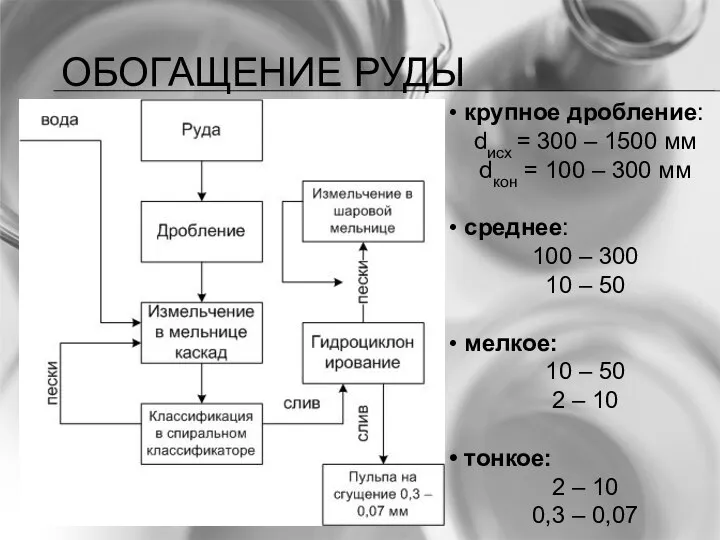
- 25. ОБОГАЩЕНИЕ РУДЫ крупное дробление: dисх = 300 – 1500 мм dкон = 100 – 300 мм
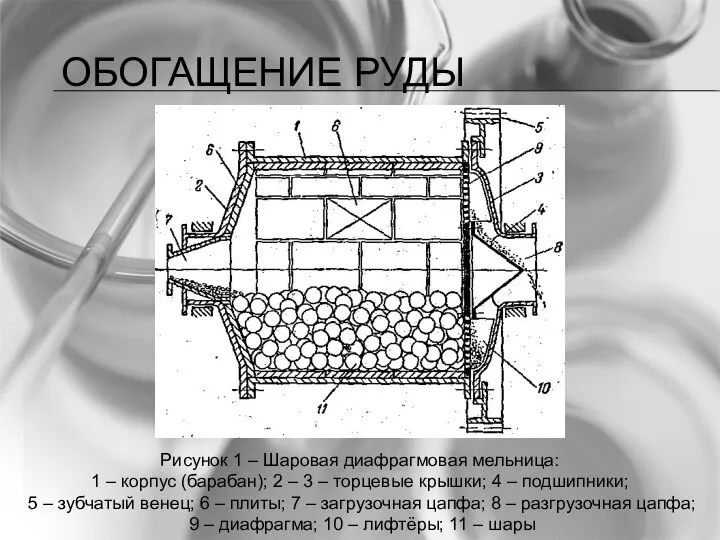
- 26. ОБОГАЩЕНИЕ РУДЫ Рисунок 1 – Шаровая диафрагмовая мельница: 1 – корпус (барабан); 2 – 3 –
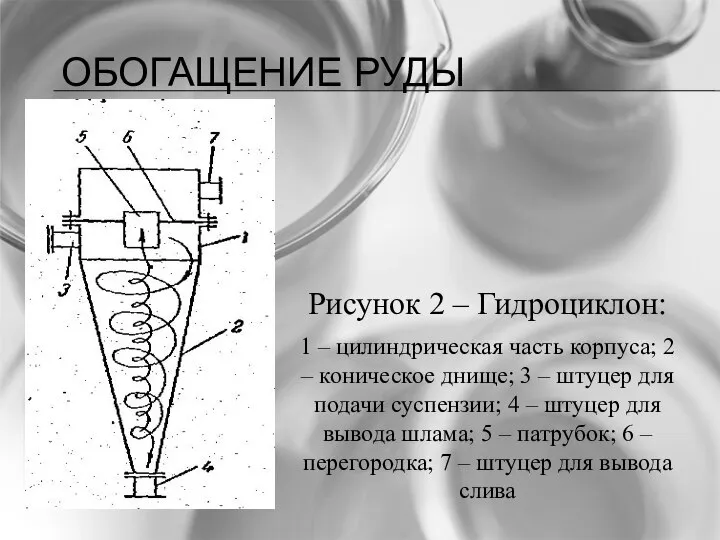
- 27. ОБОГАЩЕНИЕ РУДЫ Рисунок 2 – Гидроциклон: 1 – цилиндрическая часть корпуса; 2 – коническое днище; 3
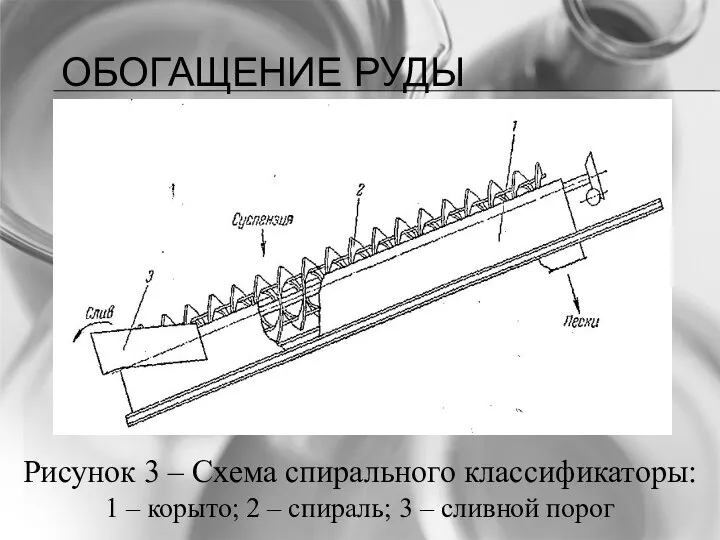
- 28. ОБОГАЩЕНИЕ РУДЫ Рисунок 3 – Схема спирального классификаторы: 1 – корыто; 2 – спираль; 3 –
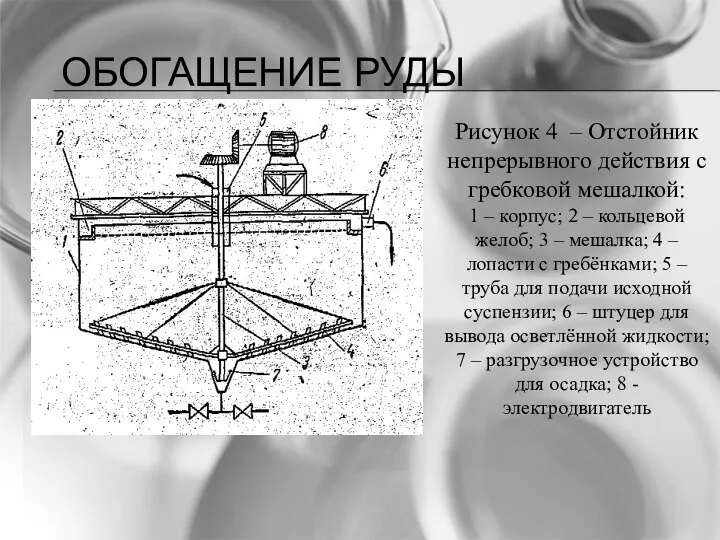
- 29. ОБОГАЩЕНИЕ РУДЫ Рисунок 4 – Отстойник непрерывного действия с гребковой мешалкой: 1 – корпус; 2 –
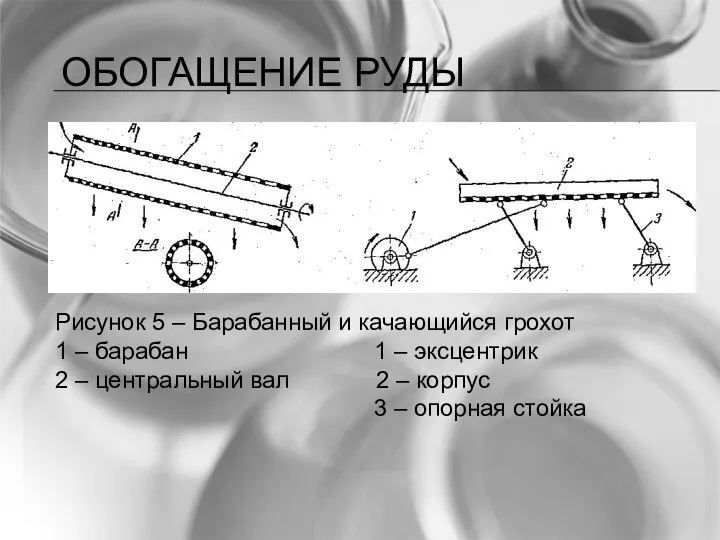
- 30. ОБОГАЩЕНИЕ РУДЫ Рисунок 5 – Барабанный и качающийся грохот 1 – барабан 1 – эксцентрик 2
- 31. МЕТОДЫ РАЗДЕЛЕНИЯ РЗЭ Для разделения рзэ применимы следующие методы: 1) дробная кристаллизация и дробное осаждение; 2)
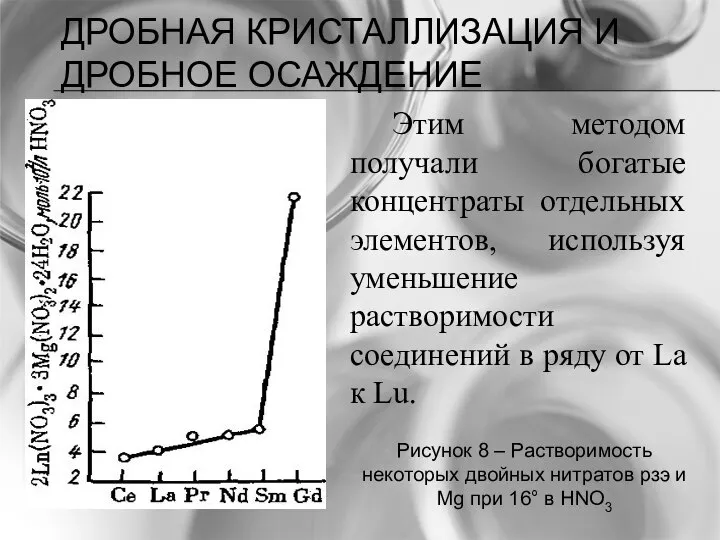
- 32. ДРОБНАЯ КРИСТАЛЛИЗАЦИЯ И ДРОБНОЕ ОСАЖДЕНИЕ Рисунок 8 – Растворимость некоторых двойных нитратов рзэ и Mg при
- 33. ОСАЖДЕНИЕ ОКСАЛАТОВ рН выделения оксалатов некоторых РЗЭ в присутствии трилона А: La— 6,0, Рг —5,5, Nd
- 34. ИЗБИРАТЕЛЬНОЕ ОКИСЛЕНИЕ — ВОССТАНОВЛЕНИЕ Электродные потенциалы РЗЭ с изменением степени окисления следующие: Ce3+→Ce4+ 1,74; Pr3+→ Pr4+
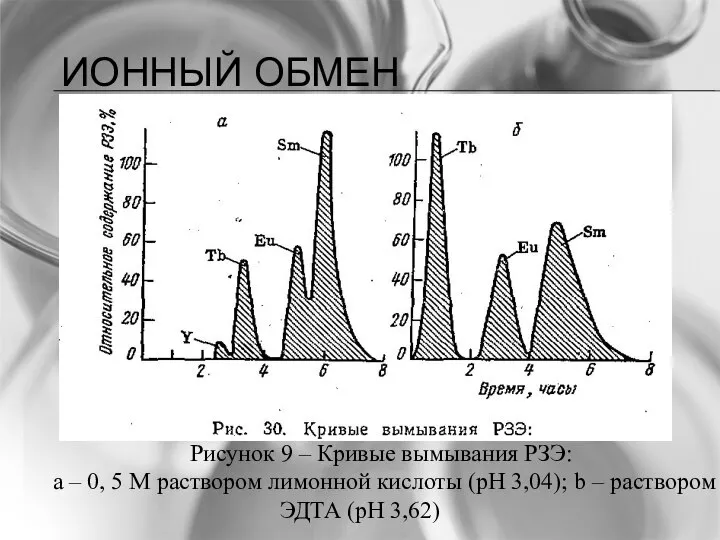
- 35. ИОННЫЙ ОБМЕН Рисунок 9 – Кривые вымывания РЗЭ: а – 0, 5 М раствором лимонной кислоты
- 36. ЭКСТРАКЦИЯ «+»: получение высококачественных соединений большая производительность процесса В качестве экстракторов для разделения РЗЭ чаще всего
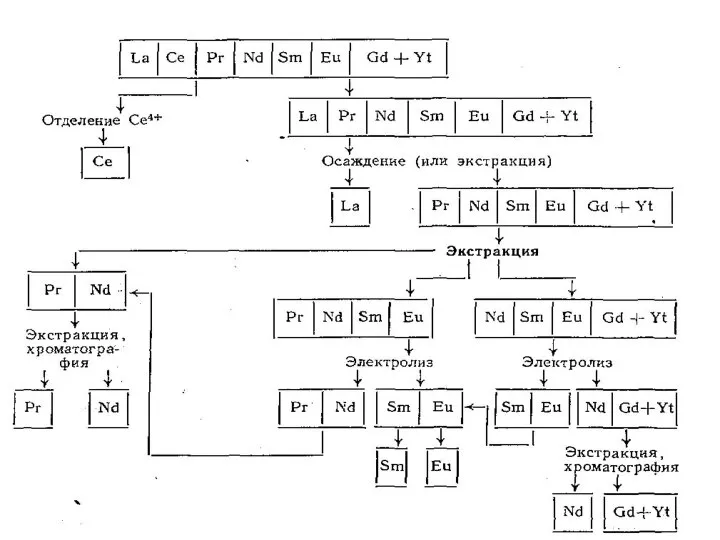
- 37. ПРИНЦИПИАЛЬНАЯ СХЕМА РАЗДЕЛЕНИЯ РЗЭ
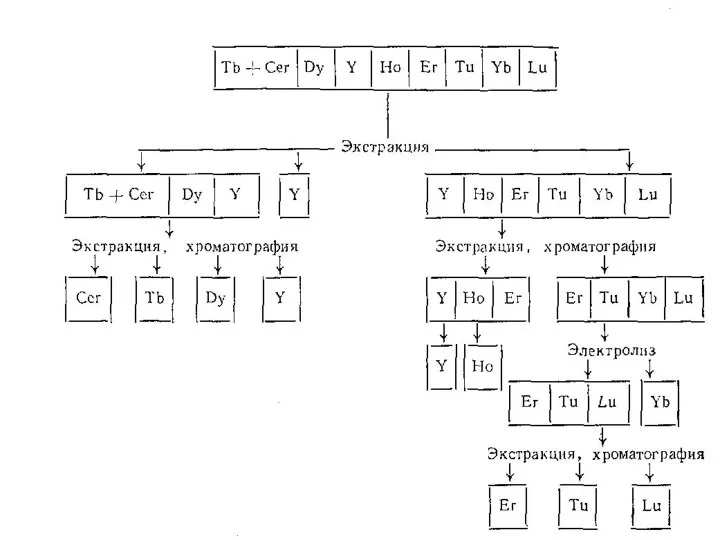
- 38. ПРИНЦИПИАЛЬНАЯ СХЕМА РАЗДЕЛЕНИЯ РЗЭ
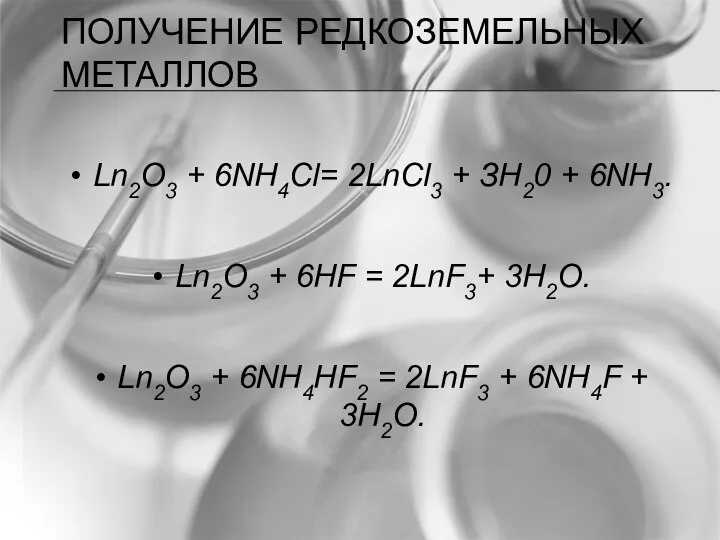
- 39. ПОЛУЧЕНИЕ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ Ln2О3 + 6NH4Cl= 2LnCl3 + ЗН20 + 6NH3. Ln2О3 + 6HF = 2LnF3+
- 40. МЕТАЛОТЕРМИЧЕСКИЙ СПОСОБ I группа: La, Ce, Pr, Nd, мишметалл с tплав. ~ 1100ºС. У хлоридов повышенная
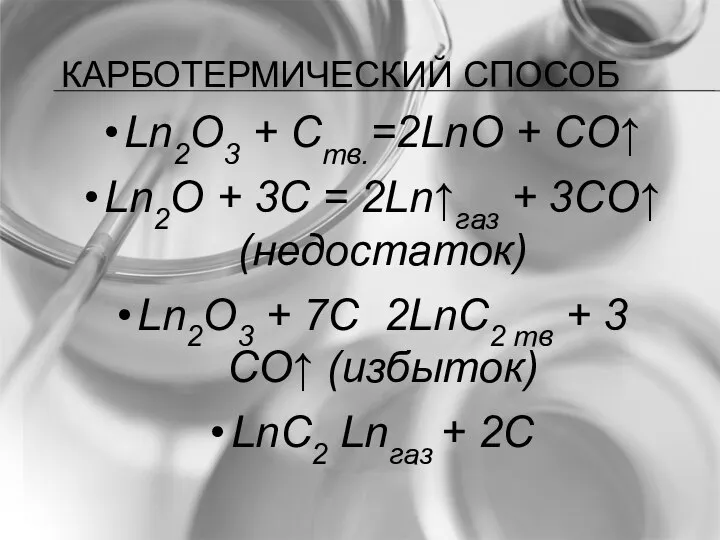
- 41. КАРБОТЕРМИЧЕСКИЙ СПОСОБ Ln2O3 + Cтв.=2LnO + CO↑ Ln2O + 3C = 2Ln↑газ + 3CO↑ (недостаток) Ln2O3
- 42. АЛЮМОТЕРМИЧЕСКИЙ СПОСОБ Термодинамика: Ln2O3 + Al = 2Ln + Al2O3 + G, если в шихту ввести
- 43. ПОЛУЧЕНИЕ РЗМ ЛИТИЙ ТЕРМИЧЕСКИМ ВОССТАНОВЛЕНИЕМ ИЗ ХЛОРИДА Выход металла в слиток при использовании Na и K
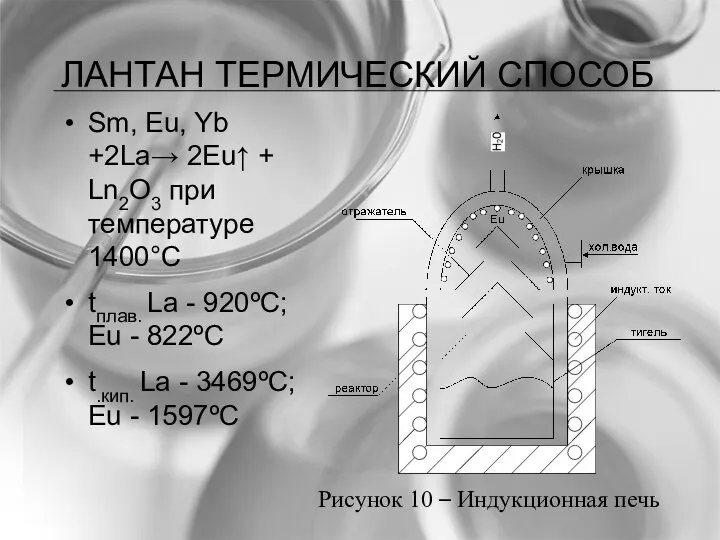
- 44. ЛАНТАН ТЕРМИЧЕСКИЙ СПОСОБ Sm, Eu, Yb +2La→ 2Eu↑ + Ln2O3 при температуре 1400°С tплав. La -
- 45. КАЛЬЦИЙТЕРМИЧЕЙСКИЙ СПОСОБ 2LnF3 тв. + 3Caтв. = 2Lnж + 3CaF2 ж - ∆G T = 1700-1800ºC
- 46. ПРИМЕНЕНИЕ Скандий – высокопрочные AlSc сплавы, элетроннолучевые трубки; Иттрий – люминофоры, стекло, сенсоры, радары, лазеры, сверхпроводники;
- 47. ПРИМЕНЕНИЕ Самарий – постоянные магниты, микроволновые фильтры, ядерная промышленность; Европий – люминофоры; Тербий – люминофоры; Диспрозий
- 49. Скачать презентацию




























 Литература Европы 19 в
Литература Европы 19 в Договор строительного подряда.
Договор строительного подряда. Оригами и геометрия
Оригами и геометрия  ИЗУЧЕНИЕ ТВОРЧЕСКОЙ ИССЛЕДОВАТЕЛЬСКОЙ АКТИВНОСТИ ДОШКОЛЬНИКОВ В УСЛОВИЯХ ПЕДАГОГИЧЕСКОГО ЭКСПЕРИМЕНТА
ИЗУЧЕНИЕ ТВОРЧЕСКОЙ ИССЛЕДОВАТЕЛЬСКОЙ АКТИВНОСТИ ДОШКОЛЬНИКОВ В УСЛОВИЯХ ПЕДАГОГИЧЕСКОГО ЭКСПЕРИМЕНТА Презентация на тему Энергия солнца
Презентация на тему Энергия солнца 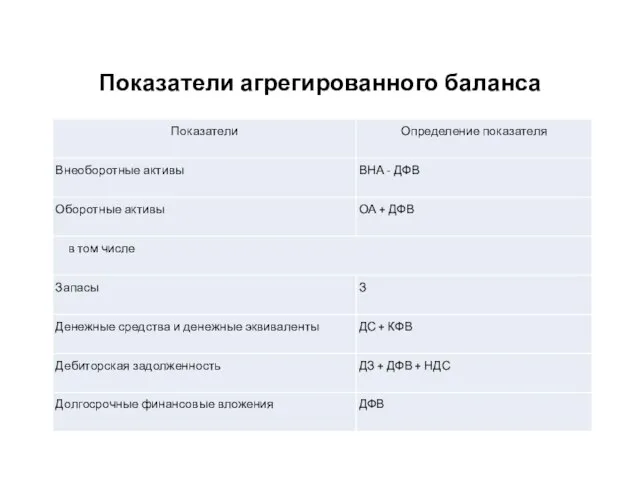 Показатели агрегированного баланса
Показатели агрегированного баланса Целеполагание, планирование
Целеполагание, планирование Принципиальная схема информационного поиска
Принципиальная схема информационного поиска Пляж Греция
Пляж Греция Животный мир Евразии
Животный мир Евразии Начало Реформации в Европе. Обновление христианства.
Начало Реформации в Европе. Обновление христианства.  Вступ. Державотворча роль мови. Функції мови. Стилі, типи і форми мовлення
Вступ. Державотворча роль мови. Функції мови. Стилі, типи і форми мовлення Государство и общество
Государство и общество Социальная защита населения: понятие и источники финансирования. Тема 1
Социальная защита населения: понятие и источники финансирования. Тема 1 Прямая речь в предложении
Прямая речь в предложении Принципы обеспечения учреждений медико-социальной экспертизы экспертно-реабилитационным оборудованием
Принципы обеспечения учреждений медико-социальной экспертизы экспертно-реабилитационным оборудованием Презентация на тему Маргарет Тэтчер
Презентация на тему Маргарет Тэтчер Турагентство Делфи тревел
Турагентство Делфи тревел Центральный уфимский велопрокат UFa-bike. Проект
Центральный уфимский велопрокат UFa-bike. Проект Важнейшие аспекты разработки ВВПтеория и практика
Важнейшие аспекты разработки ВВПтеория и практика Дифференцированное задание по теме «Числительное»
Дифференцированное задание по теме «Числительное» Лекция 3. 2.2. Управление персоналом. Теоретические и правовые основы управленческой деятельности
Лекция 3. 2.2. Управление персоналом. Теоретические и правовые основы управленческой деятельности Административные методы государственного регулирования деятельности кафе
Административные методы государственного регулирования деятельности кафе Синтаксические свойства инфинитива
Синтаксические свойства инфинитива Представление социальной государственной помощи на основании социального контракта
Представление социальной государственной помощи на основании социального контракта ПОРТФОЛИО 2 КЛАССА «Б»
ПОРТФОЛИО 2 КЛАССА «Б» Проектная деятельность Воскресный обед
Проектная деятельность Воскресный обед Музыкальный театр Республики Крым
Музыкальный театр Республики Крым