Содержание
- 2. Сухий залишок організму людини – 5 кг Організм людини на 65-90% складається з води, її частка
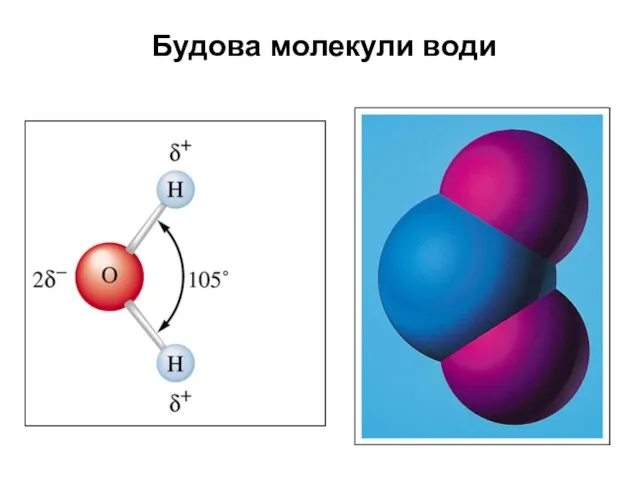
- 3. Будова молекули води
- 4. властивості води: високий поверхневий натяг, низька в’язкість, високі температури плавлення; високі температури кипіння; більш висока густина
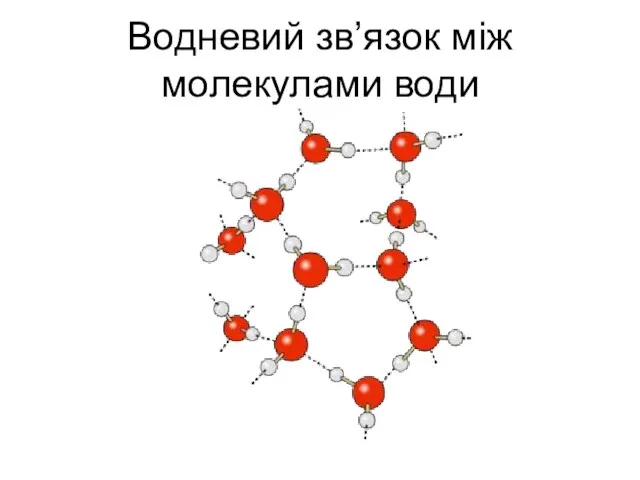
- 5. Водневий зв’язок між молекулами води
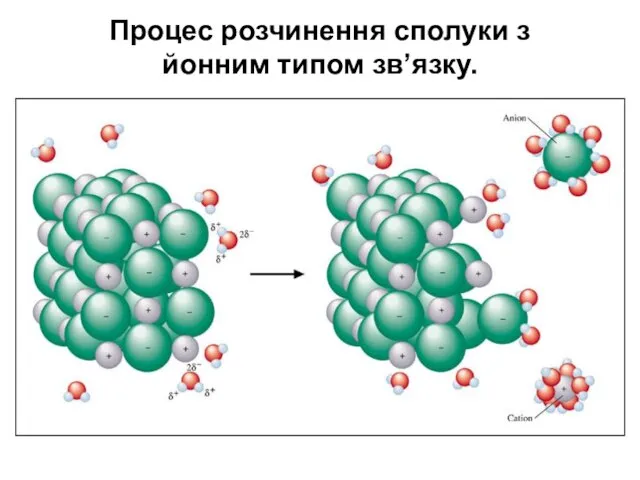
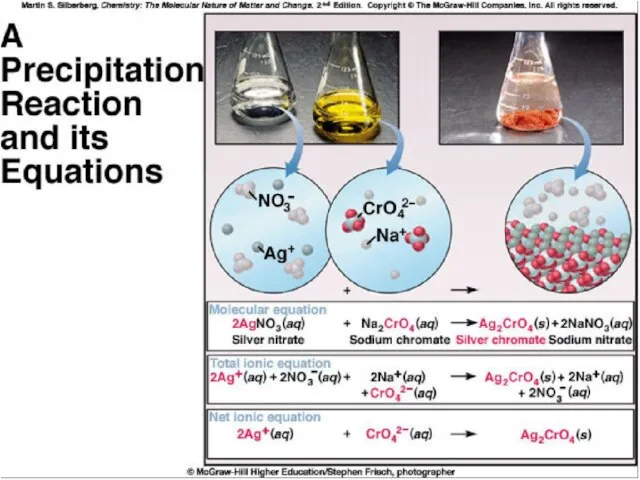
- 6. Процес розчинення сполуки з йонним типом зв’язку.
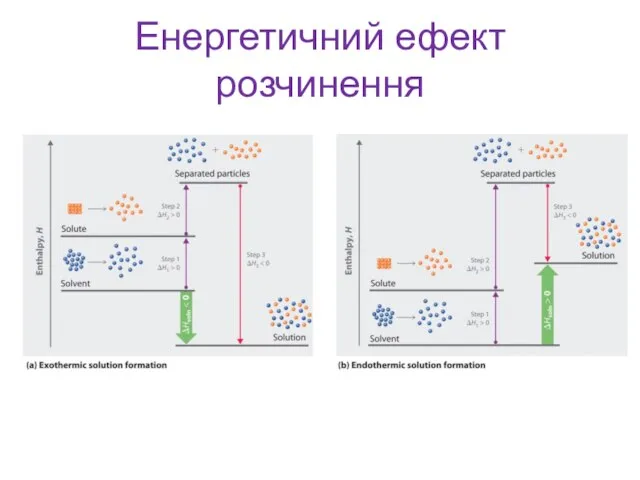
- 7. Енергетичний ефект розчинення При розчиненні руйнується зв'язок між молекулами в речовині, що розчиняється і розчиннику, що
- 8. Енергетичний ефект розчинення
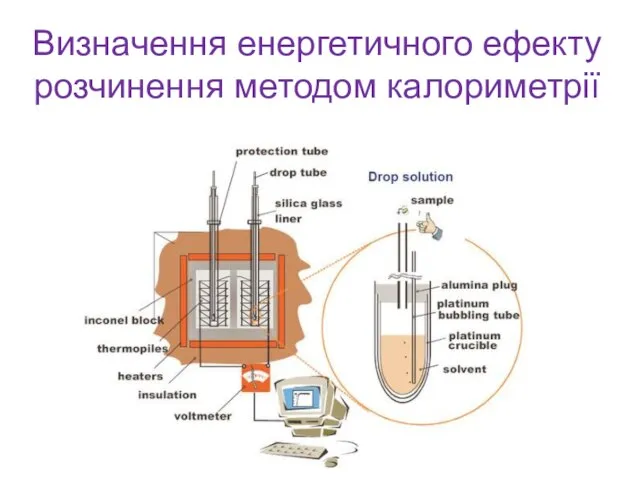
- 9. Визначення енергетичного ефекту розчинення методом калориметрії
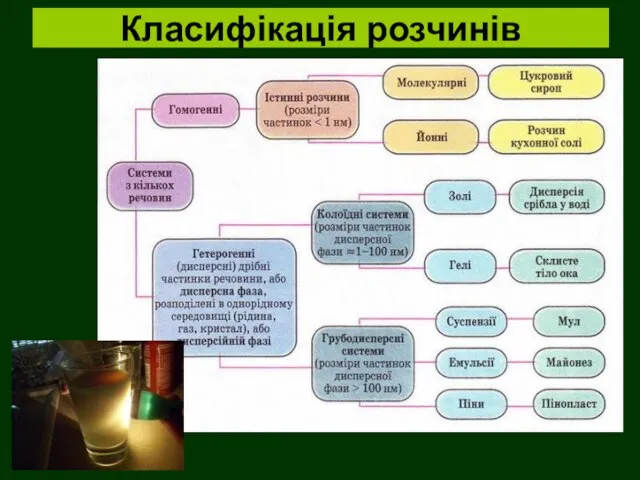
- 10. Класифікація розчинів
- 11. Розчин (за агрегатним станом) Твердий Рідкий Газоподібний
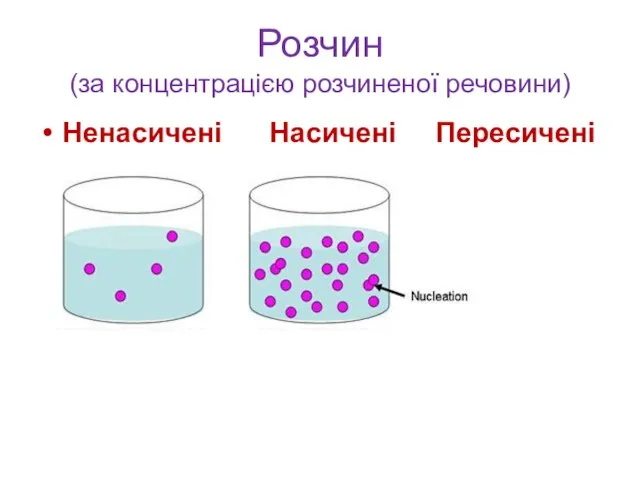
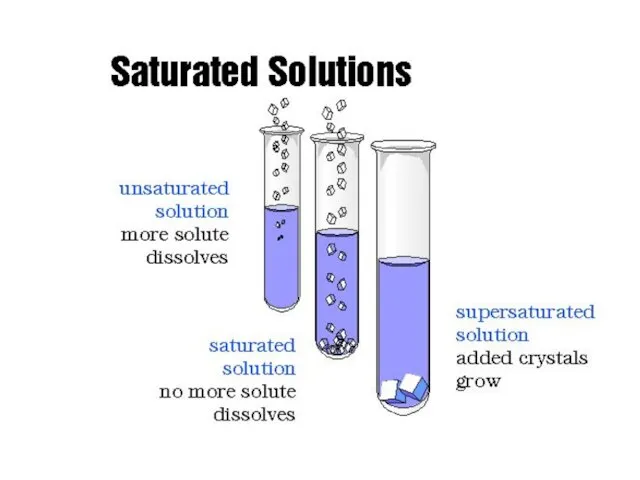
- 12. Розчин (за концентрацією розчиненої речовини) Ненасичені Насичені Пересичені
- 14. Вирощення кристалів натрій ацетату
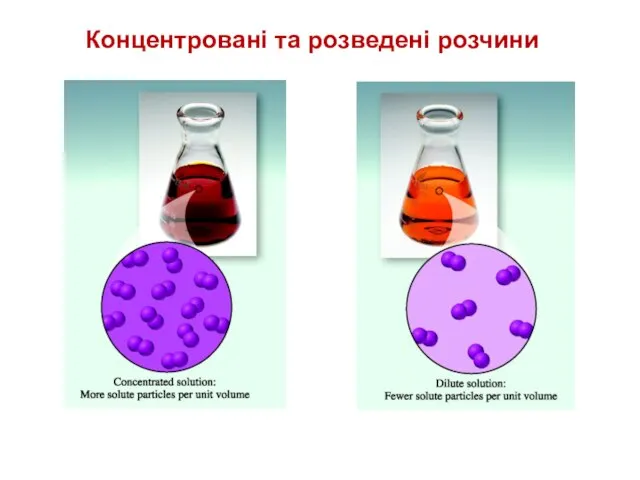
- 15. Концентровані та розведені розчини
- 16. Розчини електролітів та неелектролітів
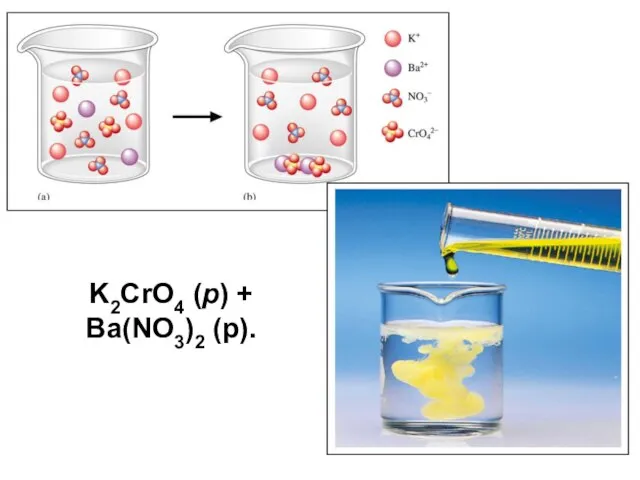
- 18. K2CrO4 (р) + Ba(NO3)2 (р).
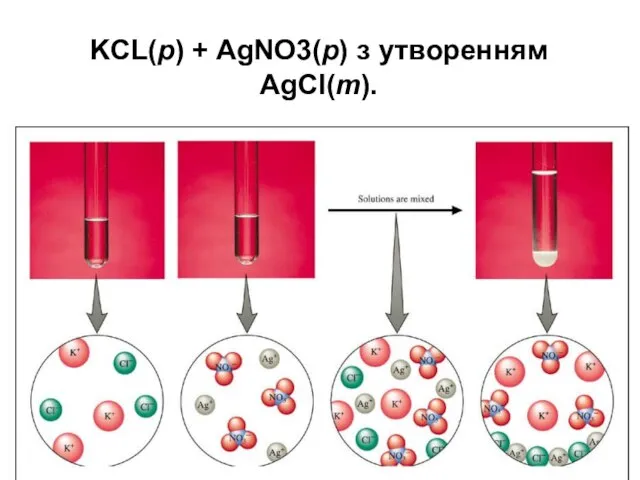
- 19. KCL(р) + AgNO3(р) з утворенням AgCl(т).
- 21. Розчинність Розчинність – це максимальна маса речовини, яка може за даних умов (температури, тиску) розчинитись у
- 22. Добуток розчинності
- 23. Масова частка – це відношення маси розчиненої речовини до маси розчину. W = m(розч.реч-ни) / m(р-ну)
- 24. Закон Генрі: маса m газу, розчиненого в рідині даного об'єму, при сталій температурі пропорційна парціальному тиску
- 25. На великих глибинах, де зовнішній тиск збільшується, збільшується розчинність газів в крові. При швидкому підйомі з
- 26. Колігативні властивості розчинів зменшення тиску насиченої пари; зменшення температури плавлення; підвищення температури кипіння; поява осмотичного тиску
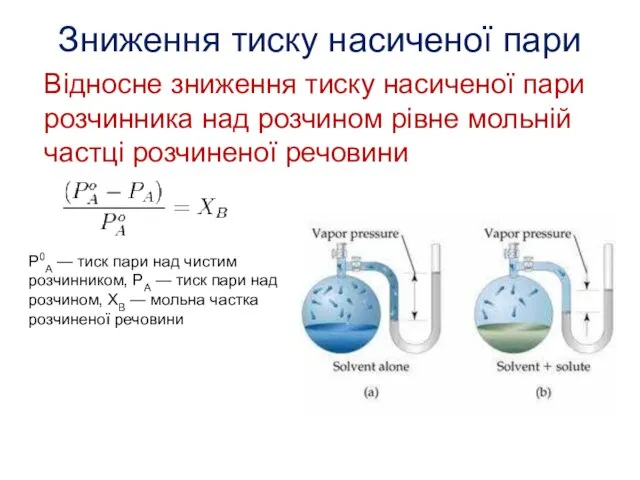
- 27. Зниження тиску насиченої пари Відносне зниження тиску насиченої пари розчинника над розчином рівне мольній частці розчиненої
- 28. Змішали 1 моль бензолу та 1 моль толуолу. При температурі 79,6 ˚С тиск насиченої пари бензену
- 29. Зниження температури замерзання (кріоскопія) При затвердінні розчину спочатку випадають кристали чистого розчинника, в результаті чого розчин
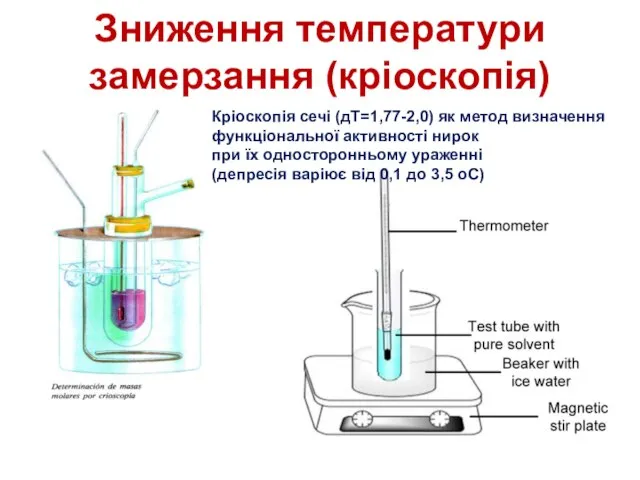
- 30. Зниження температури замерзання (кріоскопія) Кріоскопія сечі (дТ=1,77-2,0) як метод визначення функціональної активності нирок при їх односторонньому
- 31. Зниження температури замерзання ΔTf = - kf m Визначте точку замерзання 2.00л морської води (kf =
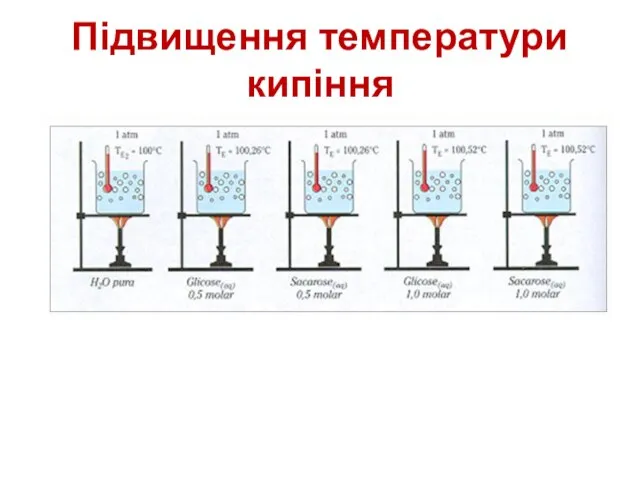
- 32. Підвищення температури кипіння
- 33. Підвищення температури кипіння (ебуліоскопія) Підвищення температури кипіння розчину прямопропорційне молярній концентрації розчиненої речовини. ΔTb = kb
- 34. Підвищення температури кипіння ΔTb = kb m Температура кипіння розчину, що містить 40 г невідомої речовини,
- 35. Осмос Процес односторонньої дифузії молекул через напівпроникну мембрану називається осмосом
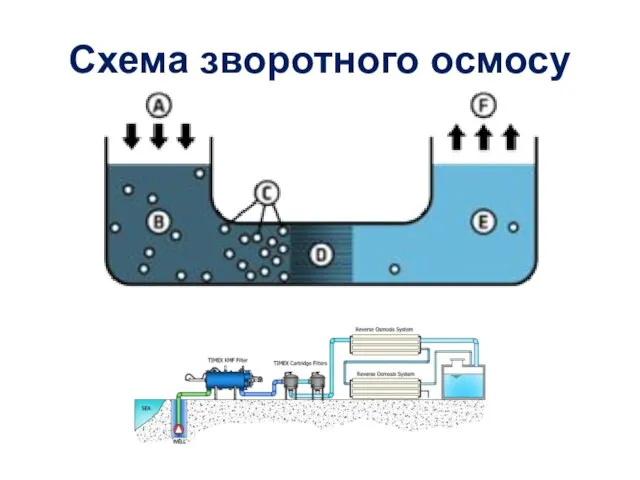
- 36. Схема зворотного осмосу
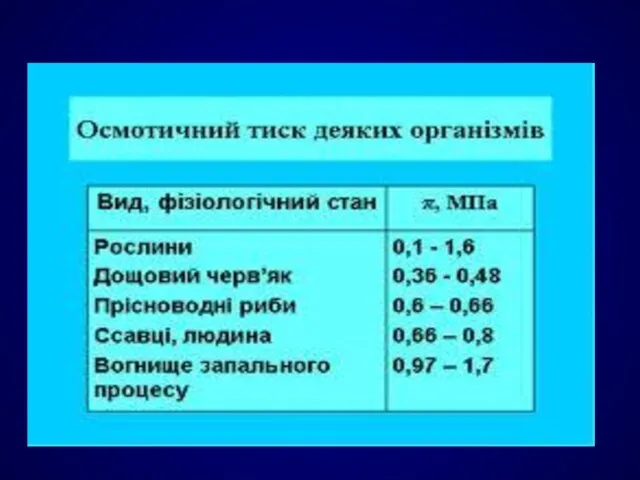
- 37. Осмос і вимірювання осмотичного тиску
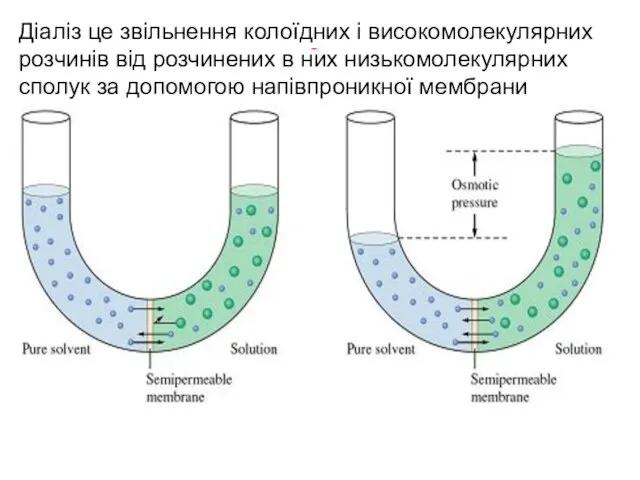
- 39. Діаліз це звільнення колоїдних і високомолекулярних розчинів від розчинених в них низькомолекулярних сполук за допомогою напівпроникної
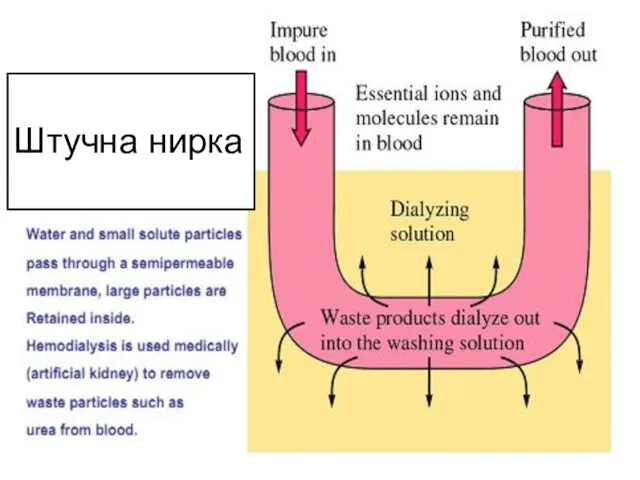
- 40. Штучна нирка
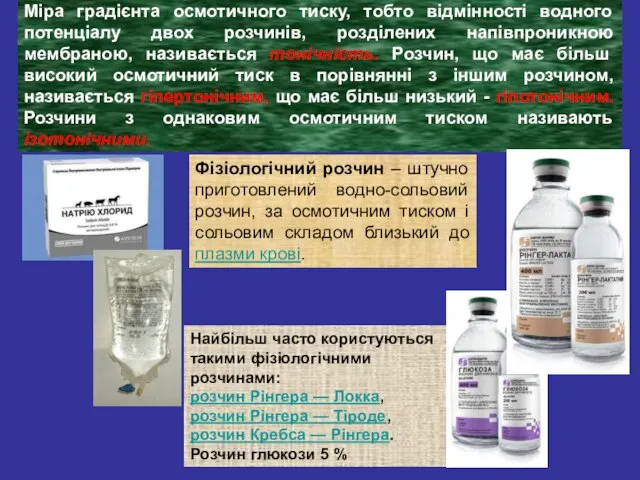
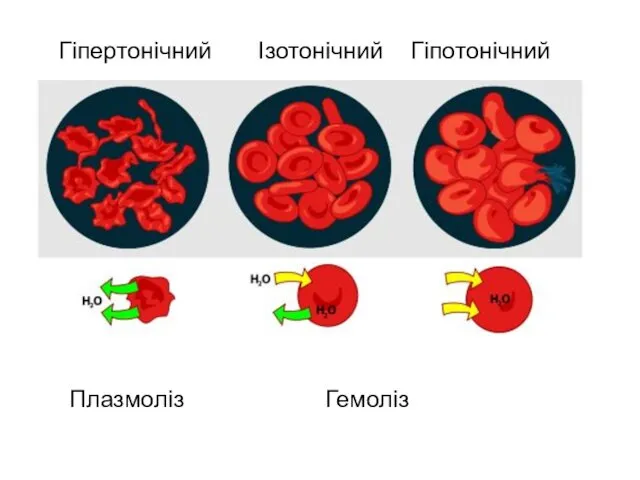
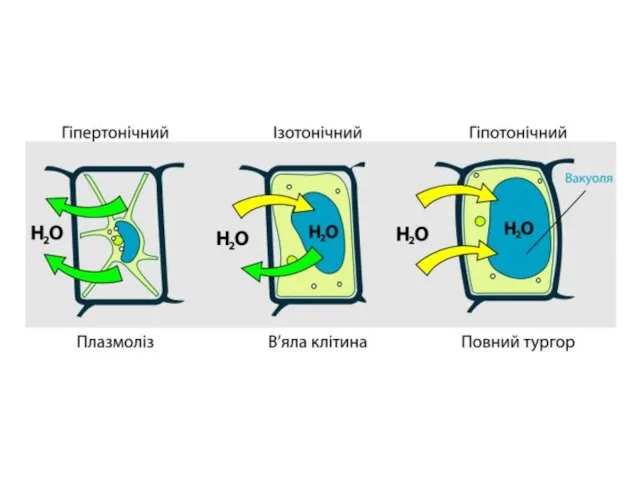
- 41. Міра градієнта осмотичного тиску, тобто відмінності водного потенціалу двох розчинів, розділених напівпроникною мембраною, називається тонічність. Розчин,
- 42. Плазмоліз Гемоліз Гіпертонічний Ізотонічний Гіпотонічний
- 45. Скачать презентацию




















 Презентация "Архитектура старого Новокубанска" - скачать презентации по МХК
Презентация "Архитектура старого Новокубанска" - скачать презентации по МХК Инвожолы 30
Инвожолы 30 Профессии 5 класс
Профессии 5 класс Международный день чая
Международный день чая Трудовое право
Трудовое право Развитие памяти у детей дошкольного возраста через игры и упражнения
Развитие памяти у детей дошкольного возраста через игры и упражнения Foundations of planning
Foundations of planning  Отгадайте ребус
Отгадайте ребус Религии в современном мире
Религии в современном мире Презентация на тему Царства живой природы
Презентация на тему Царства живой природы  С днем медика (открытки)
С днем медика (открытки) Avez-vous des tomates?
Avez-vous des tomates? РЕФЕРАТ как средство формирования познавательной активности и творческих способностей учащихся
РЕФЕРАТ как средство формирования познавательной активности и творческих способностей учащихся Создание электронного учебника
Создание электронного учебника Концепции анализа спроса
Концепции анализа спроса Великое открытиеМайкла Фарадея
Великое открытиеМайкла Фарадея ОСОБЕННОСТИ ПРОТИВОЭПИДЕМИЧЕСКИХМЕРОПРИЯТИЙ ПРИ ЗАБОЛЕВАНИИ КРЫМСКОЙ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКОЙ
ОСОБЕННОСТИ ПРОТИВОЭПИДЕМИЧЕСКИХМЕРОПРИЯТИЙ ПРИ ЗАБОЛЕВАНИИ КРЫМСКОЙ ГЕМОРРАГИЧЕСКОЙ ЛИХОРАДКОЙ Прочитайте отрывок из труда Н.И. Костомарова об отношении к реформам населения в XVII в.? «…а мы от разумных людей слыхали: которая зе
Прочитайте отрывок из труда Н.И. Костомарова об отношении к реформам населения в XVII в.? «…а мы от разумных людей слыхали: которая зе TrendAgent — сервис для сотрудников и партнеров ТРЕНДа (Агентств недвижимости)
TrendAgent — сервис для сотрудников и партнеров ТРЕНДа (Агентств недвижимости) Коммуникативная грамматика
Коммуникативная грамматика Совершенствование системы мотивации персонала предприятия за счет внедрения дополнительного социального пакета Кафетерия льгот
Совершенствование системы мотивации персонала предприятия за счет внедрения дополнительного социального пакета Кафетерия льгот Эдуард Шпрангер (1882 – 1963). Немецкий философ-идеалист. Психолог, педагог
Эдуард Шпрангер (1882 – 1963). Немецкий философ-идеалист. Психолог, педагог Экономическая сущность и функции страхования
Экономическая сущность и функции страхования Презентация на тему Готическая архитектура
Презентация на тему Готическая архитектура OON_preza (1)
OON_preza (1) Часть С. Позиция автора
Часть С. Позиция автора Астероиды
Астероиды Навыки эффективной научной презентации
Навыки эффективной научной презентации