Содержание
- 2. План лекції 1. Теорії, що пояснюють процес само-спалахування 2. Температура самоспалахування речовин. Фактори, що впливають на
- 3. 1. ТЕОРІЇ, ЩО ПОЯСНЮЮТЬ ПРОЦЕС САМОСПАЛАХУВАННЯ Самоспалахування – виникнення горіння внаслідок різкого збільшення швидкості екзотермічних реакцій
- 4. 1.1. Теплова теорія самоспалахування За тепловою теорією умовою виникнення горіння є досягнення критичної температури в системі,
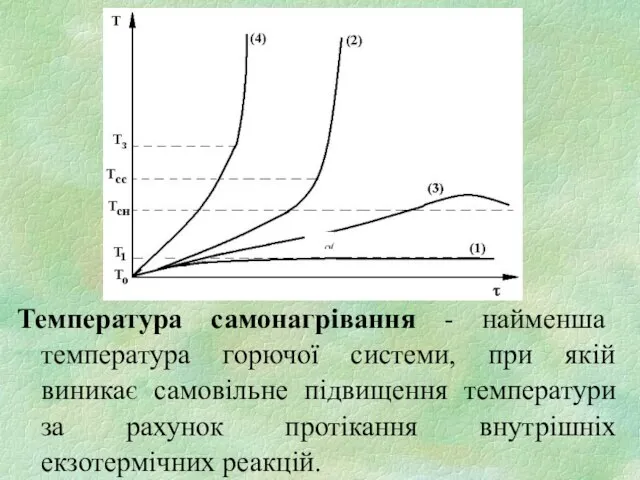
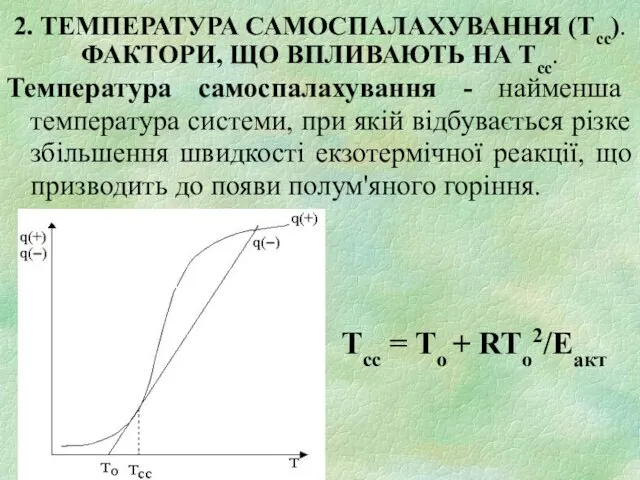
- 5. Температура самонагрівання - найменша температура горючої системи, при якій виникає самовільне підвищення температури за рахунок протікання
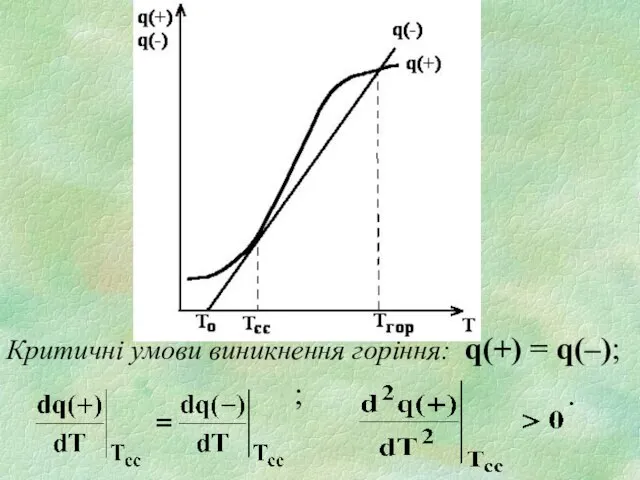
- 6. Інтенсивність тепловиділення: Графік зміни швидкості тепловиділення q(+) з температурою відображається експоненційною кривою. Інтенсивність тепловіддачі: q(-) =
- 7. Критичні умови виникнення горіння: q(+) = q(–); ; .
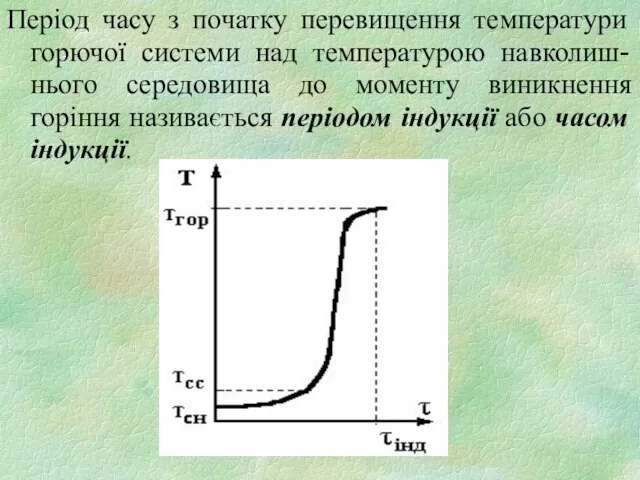
- 8. Період часу з початку перевищення температури горючої системи над температурою навколиш-нього середовища до моменту виникнення горіння
- 9. 1.2. Ланцюгова теорія самоспалахування За ланцюговою теорією виникнення горіння (тобто різке збільшення швидкості реакції окислення) є
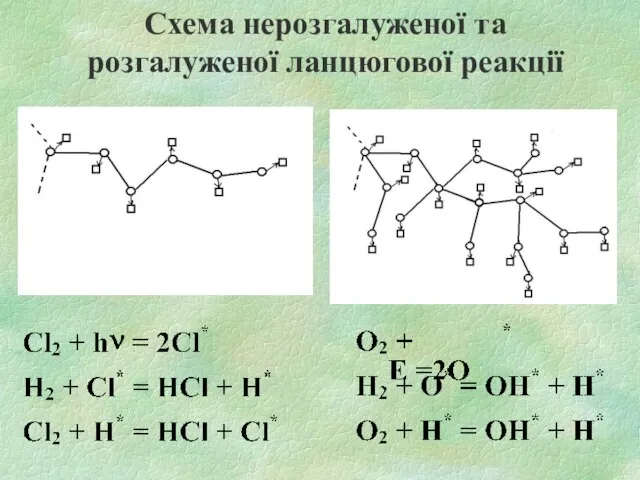
- 10. ТИПИ ЛАНЦЮГОВИХ РЕАКЦІЙ Зародження (ініціювання) ланцюгів - стадія ланцюгової реакції, в якій утворюються вільні радикали з
- 11. Розгалуження ланцюгів - стадія ланцюгового процесу, у якій перетворення активних проміжних продуктів реакції призводить до збільшення
- 12. Схема нерозгалуженої та розгалуженої ланцюгової реакції
- 13. Швидкість ланцюгової реакції: де n – концентрація активних центрів, ωо - швидкість початкового ініціювання (утворення) АЦ,
- 14. 2. ТЕМПЕРАТУРА САМОСПАЛАХУВАННЯ (Тсс). ФАКТОРИ, ЩО ВПЛИВАЮТЬ НА Тсс. Температура самоспалахування - найменша температура системи, при
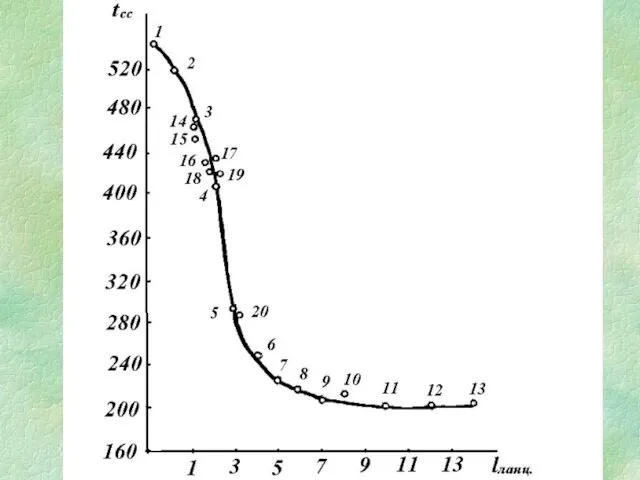
- 15. На Tсс речовин впливають три групи факторів: 1) вид горючої речовини середня довжина вуглецевого ланцюга lсер;
- 16. 2.1. Хімічна будова горючої речовини При збільшенні енергії розриву зв'язку реакція окислення, а отже й процес
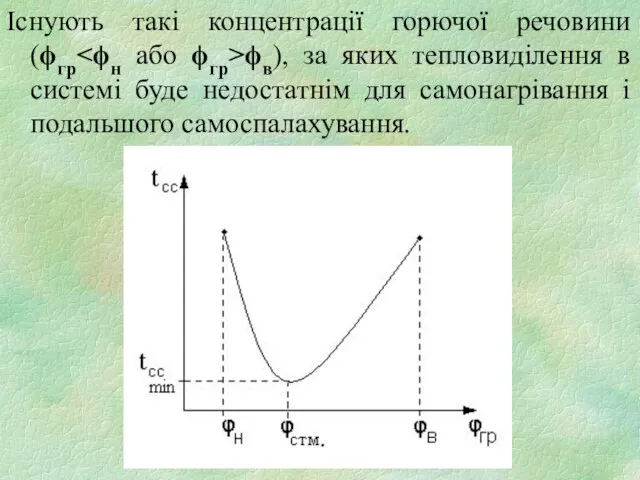
- 18. 2.2. Склад горючої суміші Концентрація горючої речовини q(+)=QнVгсwхр Найбільша швидкість хімічної реакції, а отже і тепловиділення
- 19. Існують такі концентрації горючої речовини (ϕгр ϕв), за яких тепловиділення в системі буде недостатнім для самонагрівання
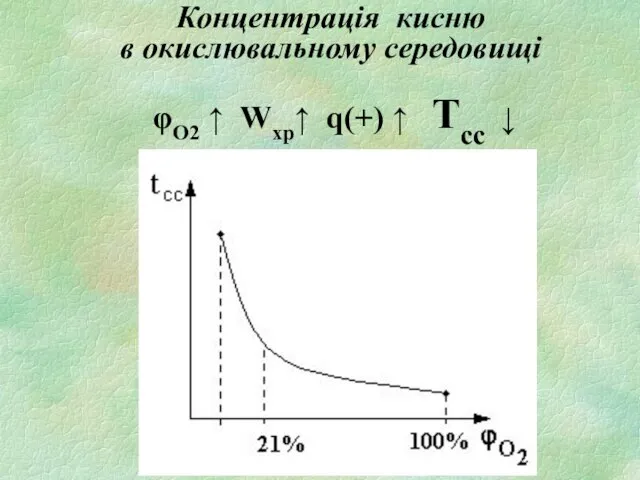
- 20. Концентрація кисню в окислювальному середовищі φО2 ↑ Wхр↑ q(+) ↑ Tсс ↓
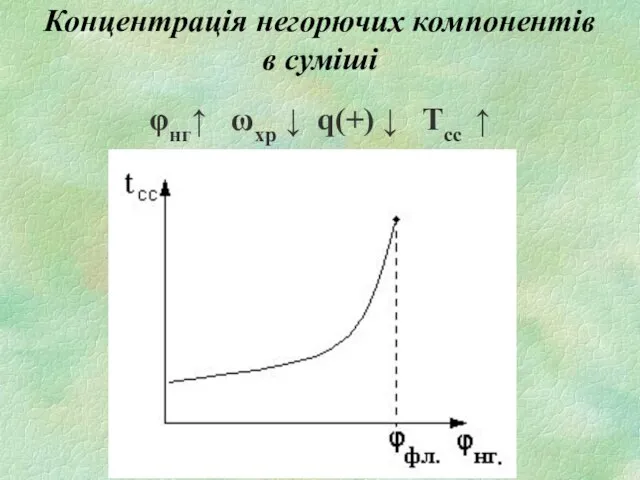
- 21. Концентрація негорючих компонентів в суміші φнг↑ ωхр ↓ q(+) ↓ Tсс ↑
- 22. 2.3. Умови, в яких знаходиться система Об'єм і діаметр посудини. q(+) = QнVгсwхр q(-) = α
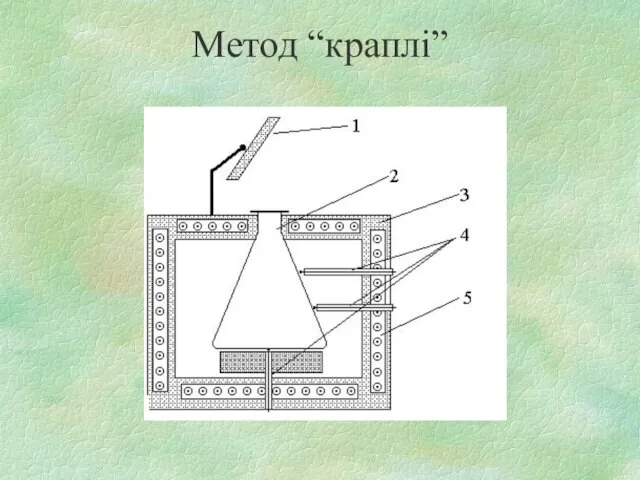
- 23. 3. ВИЗНАЧЕННЯ Тсс Експериментальні методи 1) метод впускання заздалегідь готової холодної суміші у вакуумовану нагріту посудину;
- 24. Метод “краплі”
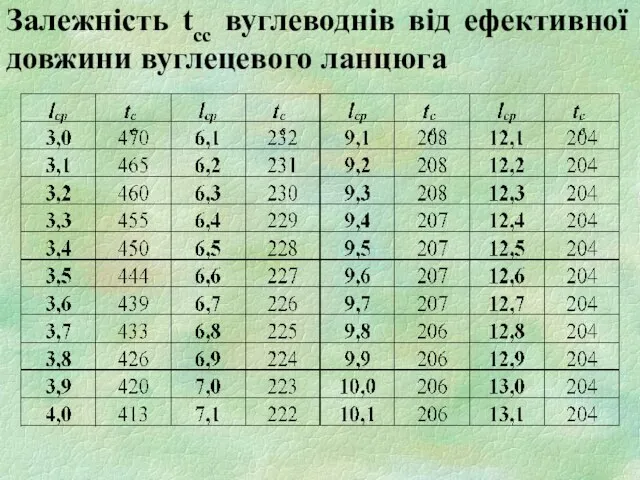
- 25. Розрахункове визначення Tсс при lcеp ≤ 5 при lcеp ≥ 5 Ланцюг - безперервна послідовність пов'язаних
- 26. Залежність tсс вуглеводнів від ефективної довжини вуглецевого ланцюга
- 27. Температуру самоспалахування інших класів органічних сполук можна розрахувати за формулою: tсс = а⋅tссалк + b де
- 28. 4. Практичне значення температури самоспалахування Тсс використовують для оцінки пожежної небезпеки речовин Чим нижче температура самоспалахування
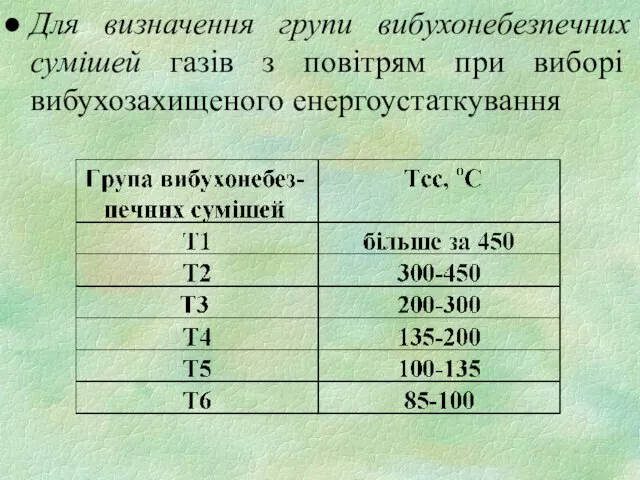
- 29. Для визначення групи вибухонебезпечних сумішей газів з повітрям при виборі вибухозахищеного енергоустаткування
- 31. Скачать презентацию
















 Слово о полку Игореве
Слово о полку Игореве лекция 9 (2)
лекция 9 (2) Тренажёр. Конституция РФ
Тренажёр. Конституция РФ Организация труда и производства на швейной фабрике
Организация труда и производства на швейной фабрике Одежда. Европа XII – XIX веков
Одежда. Европа XII – XIX веков Итоги диагностики качества письма и УУД в 1-м классе
Итоги диагностики качества письма и УУД в 1-м классе Гостиница Англетер
Гостиница Англетер Презентация на тему Импульс тела (7 класс)
Презентация на тему Импульс тела (7 класс) Отчет по работе проекта Бизнес-наставничество
Отчет по работе проекта Бизнес-наставничество Подготовка научной статьи. Лекция 4
Подготовка научной статьи. Лекция 4 Геометрия.
Геометрия. Предыстория информатики
Предыстория информатики Презентация на тему Украденное детство. Великая Отечественная война в воспоминаниях
Презентация на тему Украденное детство. Великая Отечественная война в воспоминаниях Физическая культура. Олимпийские игры
Физическая культура. Олимпийские игры Супер-бабушка
Супер-бабушка Исследование конкурентов и разработка стратегии позиционирования компании ООО “Леверекс Интернешнл”
Исследование конкурентов и разработка стратегии позиционирования компании ООО “Леверекс Интернешнл” Комбинационные логические схемы
Комбинационные логические схемы Мой любимый учитель.
Мой любимый учитель. ПЛЕНАРНЫЙ ДОКЛАД А.Ю.РоманченкоЗаместителя Руководителя Федерального агентства по печати и массовым коммуникациям22 марта 2006
ПЛЕНАРНЫЙ ДОКЛАД А.Ю.РоманченкоЗаместителя Руководителя Федерального агентства по печати и массовым коммуникациям22 марта 2006  Что нужно знать родителям об отношениях ребенка с друзьями
Что нужно знать родителям об отношениях ребенка с друзьями Бихевиоризм. Экспериментальные и концептуальные нововведения
Бихевиоризм. Экспериментальные и концептуальные нововведения ГТО – шаг к вершине мастерства
ГТО – шаг к вершине мастерства Эксперимент и его обработка на олимпиаде
Эксперимент и его обработка на олимпиаде Дидактические игры
Дидактические игры Образы и настроения природы в стихотворениях русских поэтов XIX века (Ф.И. Тютчева, А.А. Фета, А.Н. Майкова, Е.А. Баратынского, И.С. Никит
Образы и настроения природы в стихотворениях русских поэтов XIX века (Ф.И. Тютчева, А.А. Фета, А.Н. Майкова, Е.А. Баратынского, И.С. Никит Вадя Сталь-2
Вадя Сталь-2 Презентация на тему Геометрические фигуры. Узнавание и называние
Презентация на тему Геометрические фигуры. Узнавание и называние Проектирование здания учебно-тренажерного комплекса Саратовского подразделения Приволжского УЦПК
Проектирование здания учебно-тренажерного комплекса Саратовского подразделения Приволжского УЦПК