Содержание
- 2. Цель урока: познакомиться с историей открытия и распространением щелочных металлов в природе и живых организмах; изучить
- 3. Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью.
- 7. История открытия Нахождение в природе Нахождение в живых объектах природы Физические свойства, особенности строения атомов Химические
- 8. В ЧЁМ УНИКАЛЬНОСТЬ ЩЕЛОЧНЫХ МЕТАЛЛОВ?
- 9. ИСТОРИКИ
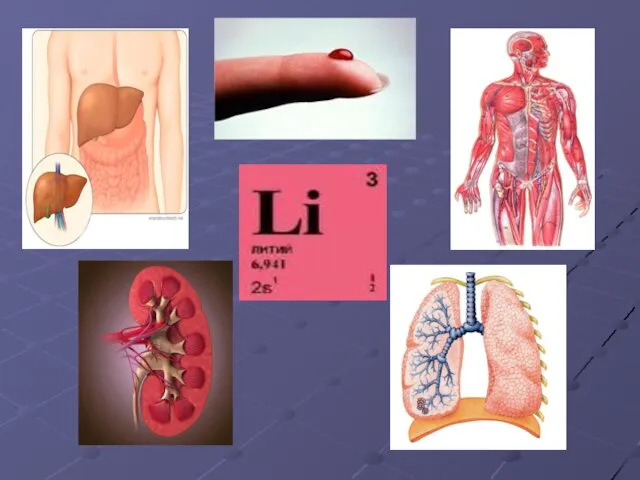
- 10. ЛИТИЙ (Lithium) 3Li Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским
- 11. Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важнейшим минералом элемента № 3. В 1818
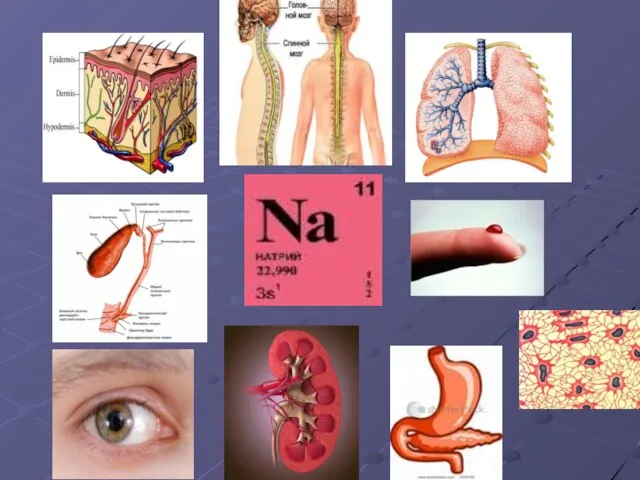
- 12. НАТРИЙ (Natrium)11Na Натрий – мягкий, серебристо – белый металл. В чистом виде получен при электролизе едкого
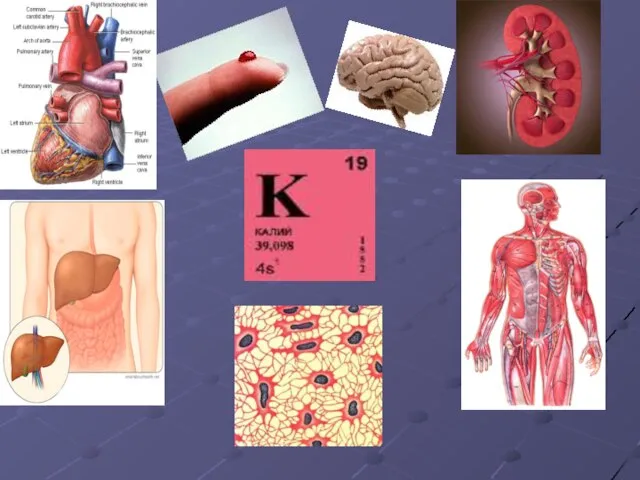
- 13. КАЛИЙ (Kalium) 19K Калий – серебристо-белый, очень мягкий и легкоплавкий металл. Получен при электролизе едкого кали
- 14. РУБИДИЙ (Rubidium) 37Rb Рубидий – лёгкий и очень мягкий (как воск),серебристо-белый металл. Открыт в 1861 году
- 15. ЦЕЗИЙ (Caesium) 55Cs Блестящая поверхность цезия имеет бледно-золотистый цвет. В 1860 году немецкие учёные Р. Бунзен
- 16. Цезий, как известно, был первым элементом, открытым с помощью спектрального анализа, разработанного в 1859 году немецкими
- 17. Франций (Franium) 87Fr Возможность существования и основные свойства элемента №87 были предсказаны Д.И.Менделеевым. В 1871 году
- 18. Первое сообщение об открытии 87-элемента как продукта радиоактивного распада актиния-228 сделал в 1913 году английский химик
- 19. ГЕОЛОГИ
- 20. Нахождение в природе Натрий и калий широко распространены в природе в виде солей Соединения других щелочных
- 21. БИОЛОГИ
- 25. Среднее содержание в организме человека 608мг. Суточная потребность 1.5-6мг.
- 26. Суточная потребность 0,004-0,03мг
- 27. В организме человека не содержится.
- 28. ФИЗИКИ
- 29. ХИМИКИ
- 30. ТЕХНОЛОГИ - ПРАКТИКИ
- 31. LI
- 32. Na
- 33. K
- 34. Rb
- 35. Cs
- 36. Франций . Последний член семейства щелочных металлов франций настолько радиоактивен, что его нет в земной коре
- 37. Правильные ответы Б В Г В А
- 38. Согласны синий Не согласны красный
- 39. ИТОГОВАЯ ОЦЕНКА 10 – 12 баллов 5 8 – 10 баллов 4 6 – 8 баллов
- 40. ПАРАД МЕТАЛЛОВ, КАК ПАРАД ПЛАНЕТ, НЕТ ГЛАВНЫХ И ВТОРОСТЕПЕННЫХ НЕТ. МЕТАЛЛЫ РАЗНЫЕ ПО-СВОЕМУ ВАЖНЫ И В
- 42. Скачать презентацию



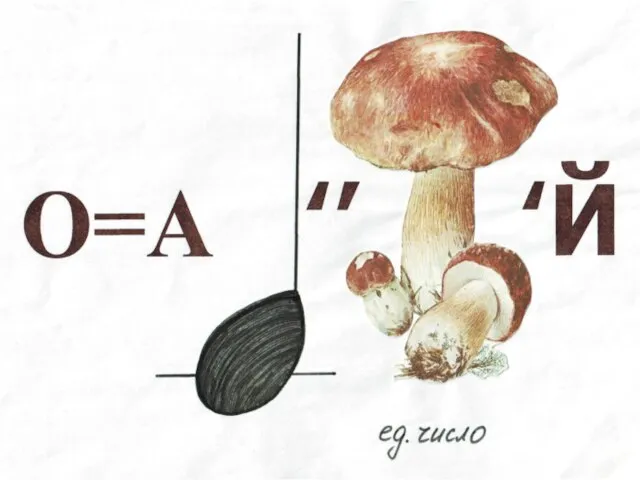




![Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важнейшим минералом элемента](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/276433/slide-10.jpg)


























 Понятие, предмет, метод и система гражданского права. Тема 1
Понятие, предмет, метод и система гражданского права. Тема 1 Лень - как психологическое явление
Лень - как психологическое явление Литература, музыка, живопись
Литература, музыка, живопись Презентация на тему Порядок и особенности производства дознания в сокращенной форме
Презентация на тему Порядок и особенности производства дознания в сокращенной форме  Презентация на тему Художники-передвижники
Презентация на тему Художники-передвижники  Сабантуй
Сабантуй Здоровый образ жизни (5 класс)
Здоровый образ жизни (5 класс) Метаморфозы в картинах художников
Метаморфозы в картинах художников Тюбетейка
Тюбетейка Материально-техническая база одно из условий эффективной реализации профильного обучения.
Материально-техническая база одно из условий эффективной реализации профильного обучения. Ответственность подростков за противоправные действия
Ответственность подростков за противоправные действия Использование административных источников для актуализации бизнес регистра в Кыргызской Республике
Использование административных источников для актуализации бизнес регистра в Кыргызской Республике Республика. Монархия
Республика. Монархия Реализация профильного обучения математике в условиях сельской школы.
Реализация профильного обучения математике в условиях сельской школы. Кафе Choco-latte
Кафе Choco-latte Отчет по проведению недели профмастерства по профессии Мастер отделочных строительных работ
Отчет по проведению недели профмастерства по профессии Мастер отделочных строительных работ Урок 23. Практическая работа
Урок 23. Практическая работа Проблема двигательной активности
Проблема двигательной активности Клинические исследования лекарственных средств в Российской Федерации в I квартале 2005 года
Клинические исследования лекарственных средств в Российской Федерации в I квартале 2005 года Классный часИдентификация 7 «Г»
Классный часИдентификация 7 «Г» Правовые основы брака и семьи 11 класс
Правовые основы брака и семьи 11 класс Лирика Ивана Алексеевича Бунина
Лирика Ивана Алексеевича Бунина Виды документации. Лекция №10
Виды документации. Лекция №10 Судейско-тренерский семинар МФД 2017 Баку (AZE)
Судейско-тренерский семинар МФД 2017 Баку (AZE) Фазы в развитии любви И. М. Сеченов
Фазы в развитии любви И. М. Сеченов «Семья, друзья и просто Я»
«Семья, друзья и просто Я» Переговоры как процесс: этапы, стратегии функции. Тема 1
Переговоры как процесс: этапы, стратегии функции. Тема 1 Инновационная деятельность учителя в контексте современной образовательной политики: требования времени и введение ФГОС Бонд
Инновационная деятельность учителя в контексте современной образовательной политики: требования времени и введение ФГОС Бонд