Содержание
- 2. Цель урока: познакомиться с историей открытия и распространением щелочных металлов в природе и живых организмах; изучить
- 3. Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью.
- 7. История открытия Нахождение в природе Нахождение в живых объектах природы Физические свойства, особенности строения атомов Химические
- 8. В ЧЁМ УНИКАЛЬНОСТЬ ЩЕЛОЧНЫХ МЕТАЛЛОВ?
- 9. ИСТОРИКИ
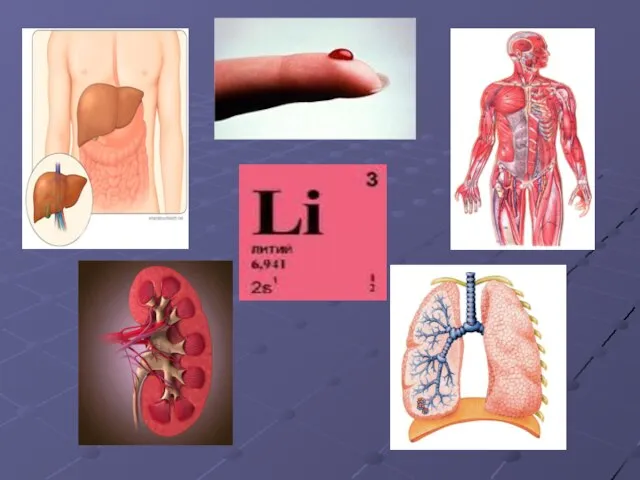
- 10. ЛИТИЙ (Lithium) 3Li Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским
- 11. Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важнейшим минералом элемента № 3. В 1818
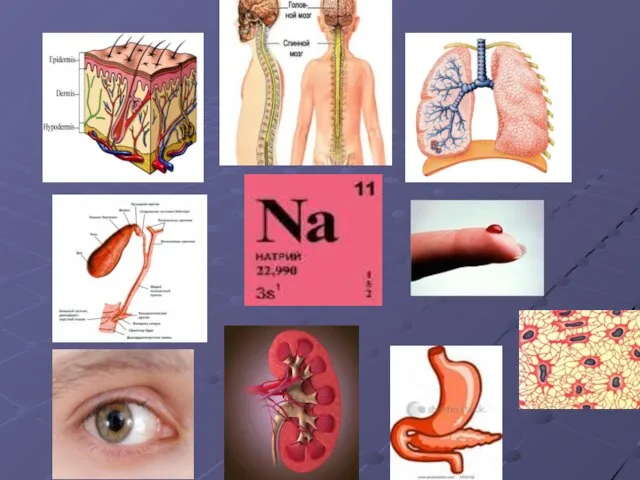
- 12. НАТРИЙ (Natrium)11Na Натрий – мягкий, серебристо – белый металл. В чистом виде получен при электролизе едкого
- 13. КАЛИЙ (Kalium) 19K Калий – серебристо-белый, очень мягкий и легкоплавкий металл. Получен при электролизе едкого кали
- 14. РУБИДИЙ (Rubidium) 37Rb Рубидий – лёгкий и очень мягкий (как воск),серебристо-белый металл. Открыт в 1861 году
- 15. ЦЕЗИЙ (Caesium) 55Cs Блестящая поверхность цезия имеет бледно-золотистый цвет. В 1860 году немецкие учёные Р. Бунзен
- 16. Цезий, как известно, был первым элементом, открытым с помощью спектрального анализа, разработанного в 1859 году немецкими
- 17. Франций (Franium) 87Fr Возможность существования и основные свойства элемента №87 были предсказаны Д.И.Менделеевым. В 1871 году
- 18. Первое сообщение об открытии 87-элемента как продукта радиоактивного распада актиния-228 сделал в 1913 году английский химик
- 19. ГЕОЛОГИ
- 20. Нахождение в природе Натрий и калий широко распространены в природе в виде солей Соединения других щелочных
- 21. БИОЛОГИ
- 25. Среднее содержание в организме человека 608мг. Суточная потребность 1.5-6мг.
- 26. Суточная потребность 0,004-0,03мг
- 27. В организме человека не содержится.
- 28. ФИЗИКИ
- 29. ХИМИКИ
- 30. ТЕХНОЛОГИ - ПРАКТИКИ
- 31. LI
- 32. Na
- 33. K
- 34. Rb
- 35. Cs
- 36. Франций . Последний член семейства щелочных металлов франций настолько радиоактивен, что его нет в земной коре
- 37. Правильные ответы Б В Г В А
- 38. Согласны синий Не согласны красный
- 39. ИТОГОВАЯ ОЦЕНКА 10 – 12 баллов 5 8 – 10 баллов 4 6 – 8 баллов
- 40. ПАРАД МЕТАЛЛОВ, КАК ПАРАД ПЛАНЕТ, НЕТ ГЛАВНЫХ И ВТОРОСТЕПЕННЫХ НЕТ. МЕТАЛЛЫ РАЗНЫЕ ПО-СВОЕМУ ВАЖНЫ И В
- 42. Скачать презентацию







![Вскоре Арфведсон обнаружил литий в сподумене LiAl[Si2O6], позже ставшем важнейшим минералом элемента](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/303943/slide-10.jpg)


























 Сегодня осень в дверь мне позвонила
Сегодня осень в дверь мне позвонила Индивидуальное обучение на дому
Индивидуальное обучение на дому Статистика требований работодателей к соискателям. Тенденции рынка. Компетенции современной среды
Статистика требований работодателей к соискателям. Тенденции рынка. Компетенции современной среды Повторение курса алгебры за 7 класс
Повторение курса алгебры за 7 класс Демографическая составляющая национальной безопасностина Дальнем Востоке России
Демографическая составляющая национальной безопасностина Дальнем Востоке России Поэзия родной природы
Поэзия родной природы Паттерны и антипаттерны дизайна
Паттерны и антипаттерны дизайна Числовые суеверия
Числовые суеверия Троица
Троица Репродуктивное здоровье подростка
Репродуктивное здоровье подростка Организация деятельности управляющего проектом строительства и взаимодействие с ключевыми участниками проекта.Опыт работы с кр
Организация деятельности управляющего проектом строительства и взаимодействие с ключевыми участниками проекта.Опыт работы с кр Портфолио. Фотообъеденение Мир в объективе
Портфолио. Фотообъеденение Мир в объективе Материалы для подготовки учащихся к ЕГЭ
Материалы для подготовки учащихся к ЕГЭ Автоматизация звука Ш
Автоматизация звука Ш «Развитие творческого потенциала учителя»
«Развитие творческого потенциала учителя» Проектирование стандартных элементов цифровых интегральных схем
Проектирование стандартных элементов цифровых интегральных схем  Sports in America
Sports in America Gоршки от Vовочки. Проект
Gоршки от Vовочки. Проект Полимер DF.. Полимер комплексного действия
Полимер DF.. Полимер комплексного действия Обучение ребенка различию близких по звучанию звукоподражаний
Обучение ребенка различию близких по звучанию звукоподражаний ПОРТАЛ НОВГУ. ТЕХНОЛОГИЧЕСКИЕ И ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ
ПОРТАЛ НОВГУ. ТЕХНОЛОГИЧЕСКИЕ И ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ Гордыня и ее проявления
Гордыня и ее проявления Оборудование устройствами диспетчерской централизации Диалог
Оборудование устройствами диспетчерской централизации Диалог Центр по содействию в трудоустройстве выпускников
Центр по содействию в трудоустройстве выпускников Екатерина 2
Екатерина 2 Предложения по развитию избирательного права на 2017-2018 годы
Предложения по развитию избирательного права на 2017-2018 годы Политика ЕС в отношении Восточноевропейских государств в российской историографии
Политика ЕС в отношении Восточноевропейских государств в российской историографии Нравственное здоровье семьи
Нравственное здоровье семьи