Содержание
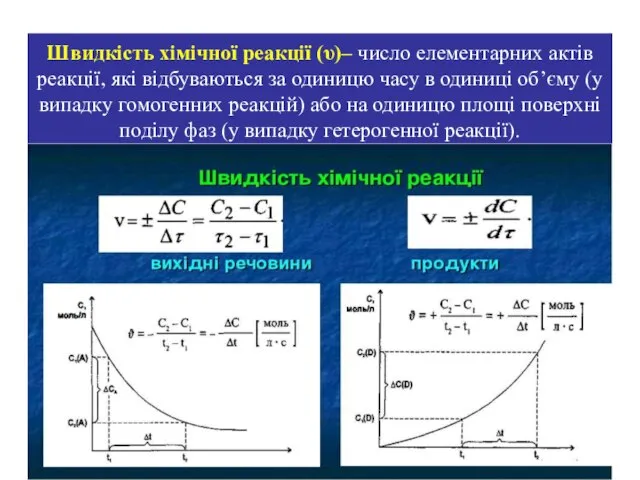
- 4. Швидкість хімічної реакції (υ)– число елементарних актів реакції, які відбуваються за одиницю часу в одиниці об’єму
- 5. Якщо в моменти τ1 і τ2 концентрації одного з вихідних речовин рівні С1 і С2 ,
- 6. Швидкість хімічних реакцій залежить від: природи реагуючих речовин; концентрації реагуючих речовин; температури; наявності каталізатора; зовнішніх факторів.
- 7. Закон діючих мас. Закон Гульдберга-Вааге Залежність швидкості реакції від концентрації реагентів Для реакції А(г) + В(г)
- 9. Класифікація за механізмом реакції Механізм реакції - сукупність елементарних стадій хімічного процесу Простий процес протікає в
- 11. РЕАКЦІЇ НУЛЬОВОГО ПОРЯДКУ v = k -dC/dτ = k [k] = моль/л⋅с СаСO3 = CaO +
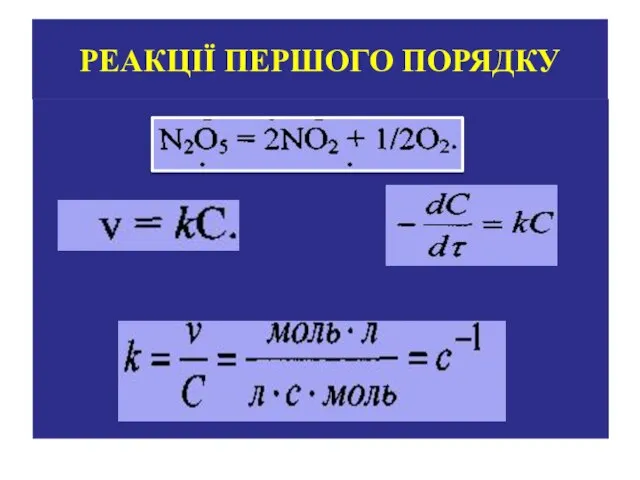
- 12. РЕАКЦІЇ ПЕРШОГО ПОРЯДКУ
- 13. РЕАКЦІЇ ДРУГОГО ПОРЯДКУ
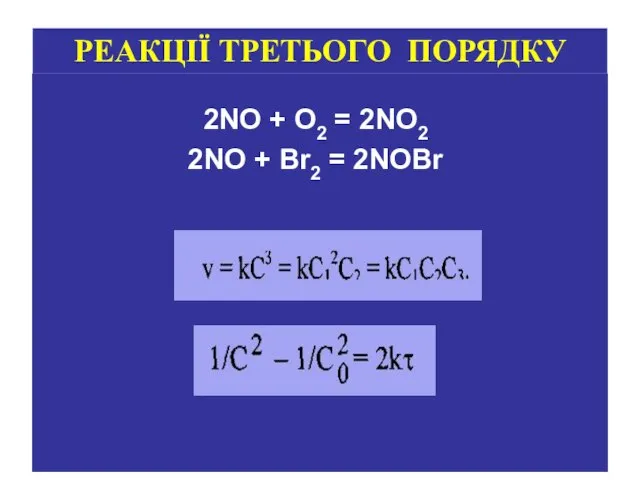
- 14. 2NO + O2 = 2NO2 2NO + Br2 = 2NOBr РЕАКЦІЇ ТРЕТЬОГО ПОРЯДКУ
- 15. В елементарному акті реакції можуть приймати участь одна, дві або три молекули. За цією ознакою реакції
- 16. Молекулярність реакцій Бімолекулярними називають реакції, елементарний акт яких здійснюється при зіткненні двох молекул: I2 + Н2
- 17. ТЕОРІЯ АКТИВАЦІЇ АРЕНІУСА Умовою елементарного акту взаємодії є зіткнення частинок реагуючих речовин. Проте не кожне зіткнення
- 18. Наявність енергетичного бар’єру приводить до того, що багато хімічних реакцій, перебіг яких цілком можливий, самовільно не
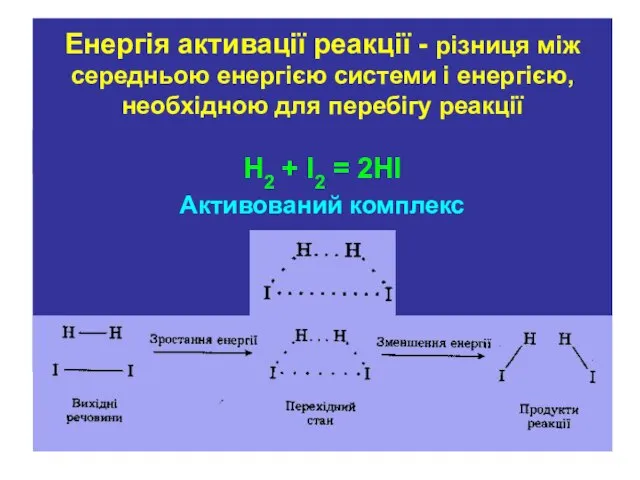
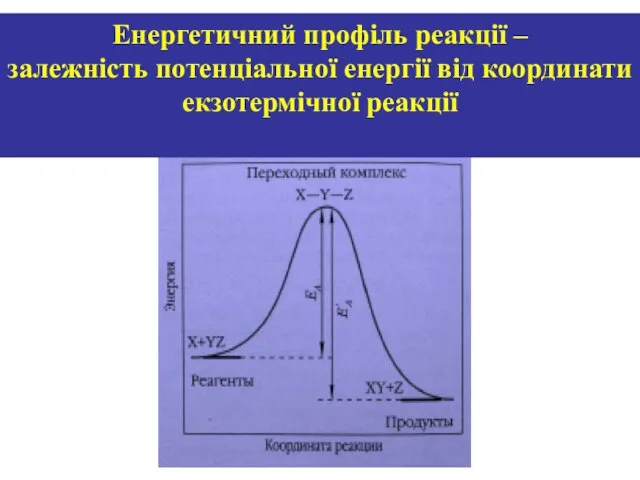
- 19. А2 + В2 →А2В2 →АВ Перехідний стан системи характеризує і відповідає утворенню так званого активованого комплексу
- 20. Енергія активації реакції - різниця між середньою енергією системи і енергією, необхідною для перебігу реакції Н2
- 21. Енергетичний профіль реакції – залежність потенціальної енергії від координати екзотермічної реакції
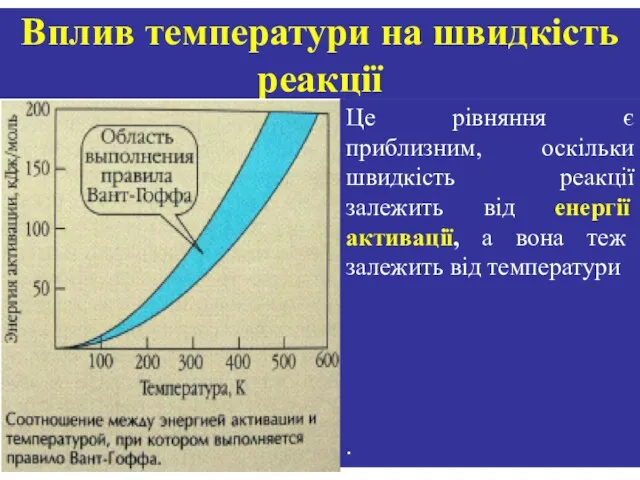
- 22. Правило Вант-Гоффа: з підвищенням температури на кожні 10 градусів швидкість реакції зростає в 2- 4 рази:
- 23. Вплив температури на швидкість реакції Це рівняння є приблизним, оскільки швидкість реакції залежить від енергії активації,
- 24. Вплив температури і енергії активації на швидкість хімічних реакцій можна виразити за допомогою залежності констант швидкості
- 25. РОЗРАХУНОК ЕНЕРГІЇ АКТИВАЦІЇ
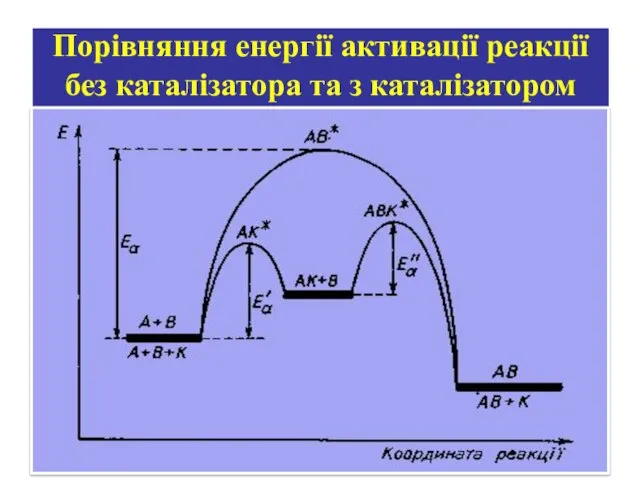
- 26. КАТАЛІЗ Каталізатор — це речовина, яка бере участь у проміжних стадіях, змінює швидкість реакції, але не
- 27. Порівняння енергії активації реакції без каталізатора та з каталізатором
- 28. Гомогенний і гетерогенний каталіз КАТАЛІЗ Каталіз може бути гомогенним, якщо реагуючі речовини і каталізатор знаходиться в
- 29. Каталітична активність різних каталізаторів може різко змінюватися в присутності деяких речовин іншої хімічної природи, які самі
- 30. Хімічна рівновага Хімічною рівновагою називають стан системи, який не змінюється з часом при постійному тиску, об’ємі
- 31. Хімічна рівновага Оборотні реакції -ΔН, -ΔS 2H2 + O2 ⇔ 2H2O 800–1500°С – пряма; 3000 –
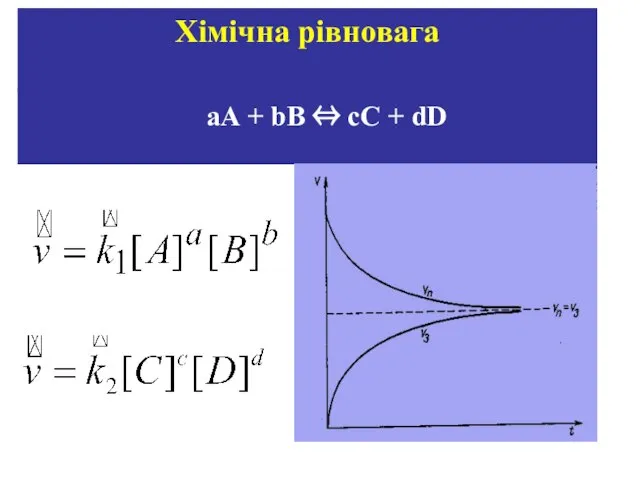
- 32. aA + bB ⇔ cC + dD Хімічна рівновага
- 33. У стані хімічної рівноваги v1 = v2 Хімічна рівновага
- 34. Константа хімічної рівноваги якщо на систему, яка знаходиться в дійсній хімічній рівновазі, діяти ззовні шляхом зміни
- 35. Принцип Ле Шательє
- 36. Принцип Ле Шательє
- 38. Скачать презентацию








![РЕАКЦІЇ НУЛЬОВОГО ПОРЯДКУ v = k -dC/dτ = k [k] = моль/л⋅с](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/366605/slide-10.jpg)


















 Ребус пропорция
Ребус пропорция Урок 15 Електричний струм у вакуумі. Електровакуумні прилади
Урок 15 Електричний струм у вакуумі. Електровакуумні прилади Napoli (Napule)
Napoli (Napule) Повторение.«Функции и графики».
Повторение.«Функции и графики». КОМПЛЕКС ES TECK СОСТОИТ ИЗ 4-Х МЕТОДИК (HRV, SPo2, BC, EIS)
КОМПЛЕКС ES TECK СОСТОИТ ИЗ 4-Х МЕТОДИК (HRV, SPo2, BC, EIS) Новый 2021 год
Новый 2021 год Газовая смесь на службе сварщика
Газовая смесь на службе сварщика Географическая карта 1 класс
Географическая карта 1 класс Способы сближения с вооруженным преступником, находящимся в укрытии и меры безопасности сотрудников ОВД при этом
Способы сближения с вооруженным преступником, находящимся в укрытии и меры безопасности сотрудников ОВД при этом «Семь ступеней в прошлое» История - свидетельница веков, факел истины, ду
«Семь ступеней в прошлое» История - свидетельница веков, факел истины, ду Инфинитив
Инфинитив Подумай – не ленись!
Подумай – не ленись! русский язык - язык международного общения
русский язык - язык международного общения Тестовые технологии в курсе МХК
Тестовые технологии в курсе МХК ALPHA HOMME CARBON TURBO Средства по уходу за кожей
ALPHA HOMME CARBON TURBO Средства по уходу за кожей Реализация метода ELECTRE средствами пакета EXCEL
Реализация метода ELECTRE средствами пакета EXCEL ТЕМА: «Применение географических информационных систем для предупреждения и ликвидации чрезвычайных ситуаций» Время занятия: - 2
ТЕМА: «Применение географических информационных систем для предупреждения и ликвидации чрезвычайных ситуаций» Время занятия: - 2  Nouns
Nouns Киянка
Киянка Презентация основных косметических продуктов Gemma
Презентация основных косметических продуктов Gemma Logisticheskie_sistemy_passazhirskogo_transporta
Logisticheskie_sistemy_passazhirskogo_transporta Государственная (итоговая) аттестация 2011
Государственная (итоговая) аттестация 2011 Цифровое фото и видео
Цифровое фото и видео Презентация на тему Изобразительно-выразительные средства языка
Презентация на тему Изобразительно-выразительные средства языка Презентация на тему Правильные многогранники и их построение
Презентация на тему Правильные многогранники и их построение Сечения
Сечения Дружеская верность Анести
Дружеская верность Анести Экономика бизнеса. Бакалавриат
Экономика бизнеса. Бакалавриат