Содержание
- 2. Хімічна термодинаміка вивчає перетворення енергії при хімічних реакціях та здатність хімічних систем виконувати корисну роботу. Завдання
- 3. Будь-які хімічні реакції завжди супроводжуються тими або іншими енергетичними ефектами: виділенням або поглинанням теплоти, світла, здійсненням
- 4. Основные понятия и определения
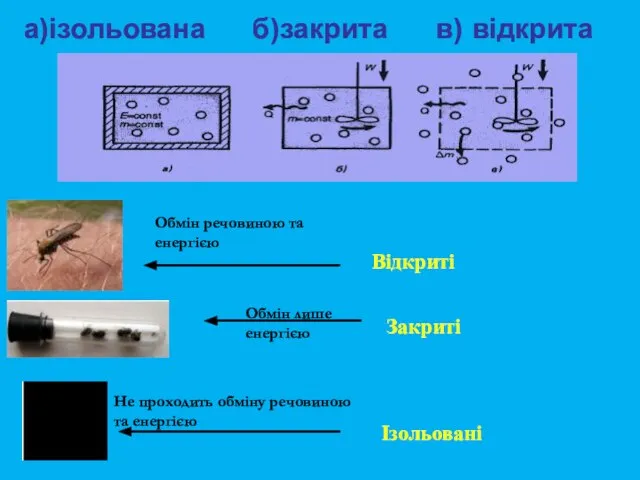
- 6. Відкриті Закриті Ізольовані Не проходить обміну речовиною та енергією Обмін речовиною та енергією Обмін лише енергією
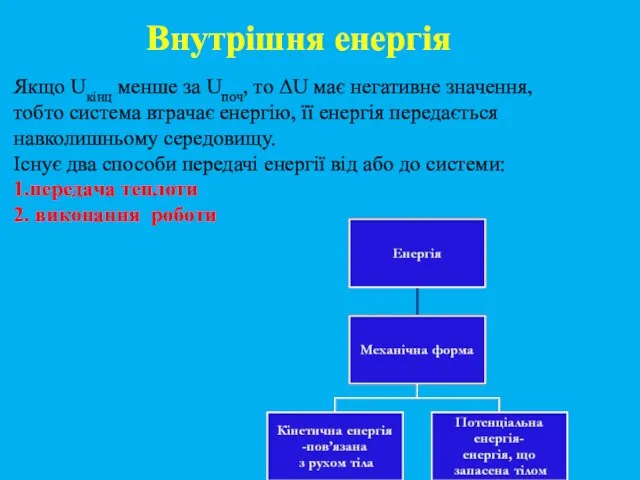
- 11. Якщо Uкінц менше за Uпоч, то ΔU має негативне значення, тобто система втрачає енергію, її енергія
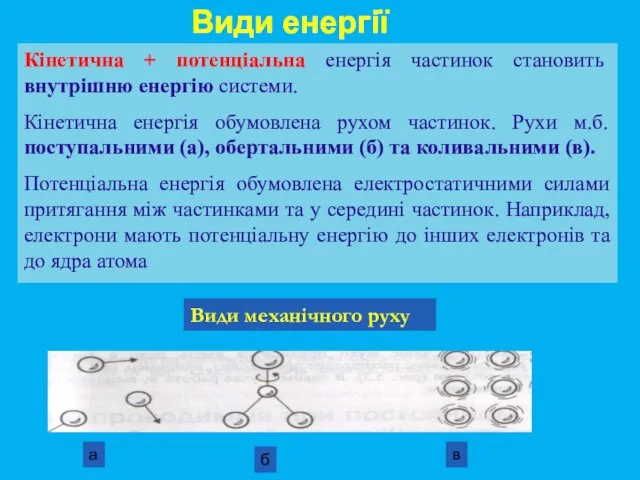
- 12. Види енергії Кінетична + потенціальна енергія частинок становить внутрішню енергію системи. Кінетична енергія обумовлена рухом частинок.
- 13. Основные понятия и определения
- 15. Перший закон термодинаміки Перший закон термодинаміки – одна із форм закону збереження енергії Енергія не створюється
- 20. Тепловий ефект відносять або до всієї реакції (одиниця – кДж), або до 1 моль одного з
- 23. Застосування законів Гесса для реакцій електролітичної дисоціації NaCl + aq = Na+aq + Cl-aq ΔНf°298 -410,9
- 24. Тепловий ефект розчинення характеризує хімічну взаємодію молекул розчинника з розчиненою речовиною і залежить від : кількості
- 25. Утворення СО2 при безпосередній взаємодії простих речовин: С(графіт) +О2(г) = СО2(г) ΔН1 = -393, 6 кДж,
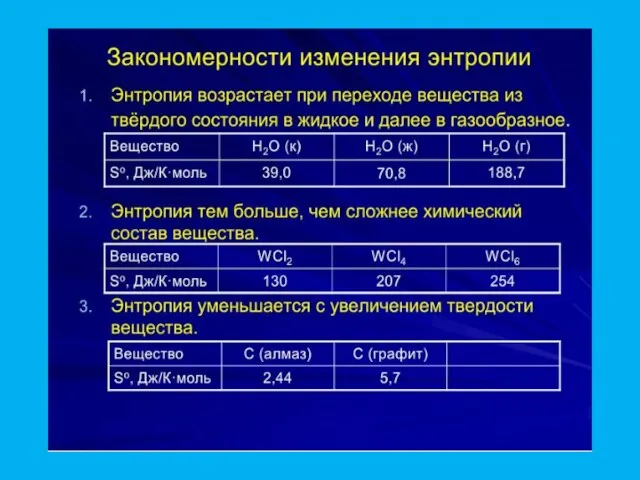
- 28. Статистическаое определение энтропии В изолированной системе самопроизвольно могут протекать только такие процессы, которые ведут к увеличению
- 33. Для обрахунків ентропії системи користуються наступним рівнянням: ΔSх.р. = Σ Sfпрод.р - Σ Sfвих.р Для реакції
- 40. Енергія Гіббса є критерієм самочинного протікання хімічних реакцій та термодинамічної стійкості хімічних сполук. Будь-яка система прагне
- 41. Розрахунки ΔG при Т ≠298 К і С≠1М Для процесу в загальному вигляді: aA + bB→
- 43. Скачать презентацию




































 Безопасный новый год
Безопасный новый год Przed Świętem Paschy
Przed Świętem Paschy Презентация на тему Формулы дифференцирования
Презентация на тему Формулы дифференцирования Пусть много новых знаний ждет
Пусть много новых знаний ждет Анимация
Анимация Заседание городского методического объединения учителей информатики
Заседание городского методического объединения учителей информатики Презентация на тему: Строка, оборванная войной
Презентация на тему: Строка, оборванная войной МОНИТОРИНГразвития субъектов малого и среднего предпринимательства города Когалыма
МОНИТОРИНГразвития субъектов малого и среднего предпринимательства города Когалыма Масленица. Празднование масленицы
Масленица. Празднование масленицы Персонифицированное дополнительное образование детей в Ярославской области
Персонифицированное дополнительное образование детей в Ярославской области Немного о чае
Немного о чае Снос объектов капитального строительства
Снос объектов капитального строительства Султанат Оман. Особенности конституционной истории и общественного строя Омана
Султанат Оман. Особенности конституционной истории и общественного строя Омана беспризорные дети
беспризорные дети Определение целевой аудитории
Определение целевой аудитории Право в системе социальных норм
Право в системе социальных норм МАТЕРИНСТВО И ОТЦОВСТВО
МАТЕРИНСТВО И ОТЦОВСТВО Рекомендации для родителей
Рекомендации для родителей Några nya prepositioner. Шведский язык
Några nya prepositioner. Шведский язык Шахматы. Нарушение основных принципов игры в начале партии
Шахматы. Нарушение основных принципов игры в начале партии Азбука предпринимательства. Юридические аспекты и налоги
Азбука предпринимательства. Юридические аспекты и налоги Вибум иллюстарции
Вибум иллюстарции Модель воспитания в историческом романе А.С.Пушкина«Капитанская дочка»
Модель воспитания в историческом романе А.С.Пушкина«Капитанская дочка» Функция денег
Функция денег Результаты школьного и муниципального (окружного) этапов всероссийской олимпиады школьников
Результаты школьного и муниципального (окружного) этапов всероссийской олимпиады школьников Типы односоставных предложений 8 класс
Типы односоставных предложений 8 класс Кодирование информации с помощью знаковых систем Знаки: форма и значение Знаковые системы Кодирование информации
Кодирование информации с помощью знаковых систем Знаки: форма и значение Знаковые системы Кодирование информации Микрорайон. Концепция реновации квартала
Микрорайон. Концепция реновации квартала