Содержание
- 2. ЕЛЕКТРОЛІТИ ТА НЕЕЛЕКТРОЛІТИ Речовини, розчини яких проводять електричний струм, були названі електролітами Арреніус припустив, що причиною
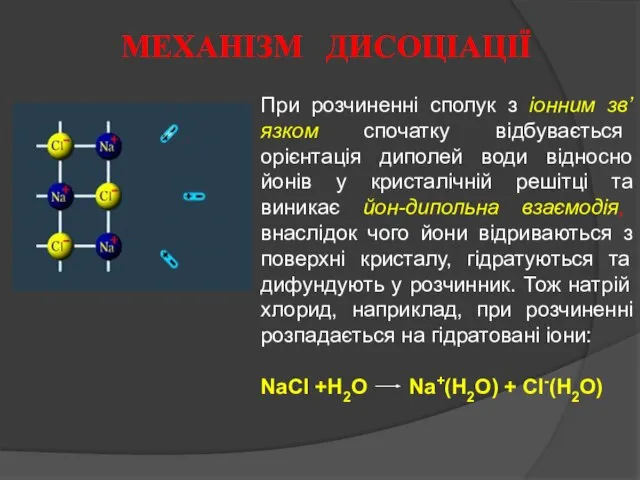
- 3. При розчиненні сполук з іонним зв’язком спочатку відбувається орієнтація диполей води відносно йонів у кристалічній решітці
- 4. При розчиненні полярної молекули молекули води (диполі)поляризують молекулу, внаслідок чого вона розпадається на іони: HCl +
- 5. Явище взаємодії іонів з молекулами води, внаслідок чого відбувається утворення гідратної оболонки, називається гідратацією іонів. Гідратовані
- 6. ВЗАЄМОДІЯ ГІДРАТОВАНИХ ЙОНІВ Приклади Ɛ для розчинників: (Ɛ =1 у вакуумі) у воді (Ɛ = 81),
- 7. ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ Отже, при розчиненні електролітів: - Молекули розщеплюються на іони - Іони взаємодіють з
- 8. ДИСОЦІАЦІЯ ЕЛЕКТРОЛІТІВ Процес електролітичної дисоціації зображають, користуючись хімічними рівняннями. Дисоціація кислот: При розгляді рівнянь електролітичної дисоціації
- 9. ДИСОЦІАЦІЯ ЕЛЕКТРОЛІТІВ Дисоціація середніх солей: Na2SO4 → 2Na+ + SO42– AlCl3 → Al3+ + 3Cl− Дисоціація
- 10. СТУПІНЬ ДИСОЦІАЦІЇ Існує кількісна оцінка здатності речовини розпадатися на іони − це ступінь дисоціації (α). Ступенем
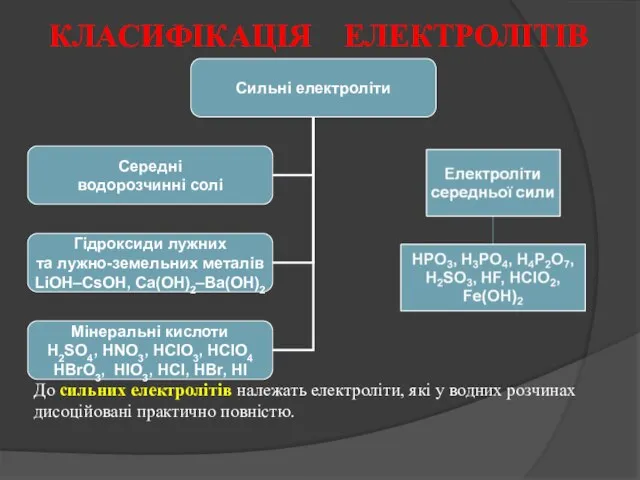
- 11. КЛАСИФІКАЦІЯ ЕЛЕКТРОЛІТІВ За величиною ступеня дисоціації 0,01 – 0,1 н розчинів усі електроліти поділяють на сильні,
- 12. До сильних електролітів належать електроліти, які у водних розчинах дисоційовані практично повністю. КЛАСИФІКАЦІЯ ЕЛЕКТРОЛІТІВ
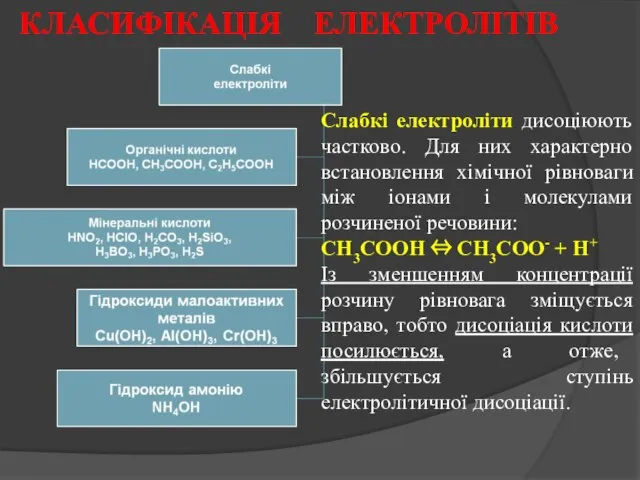
- 13. Слабкі електроліти дисоціюють частково. Для них характерно встановлення хімічної рівноваги між іонами і молекулами розчиненої речовини:
- 14. СТУПІНЬ ДИСОЦІАЦІЇ Величина ступеня дисоціації залежить: -Хімічної природи речовини -Концентрації розчину -Природи розчинника -Температури Отже, поділ
- 15. Варто враховувати вплив природи розчинника на ступінь дисоціації. Чим менша діелектрична проникність розчинника, тим більші сили
- 16. СТУПІНЬ ДИСОЦІАЦІЇ Для з’ясовуванні впливу концентрації на ступінь електролітичної дисоціації розглянемо дисоціацію слабкого електроліту − оцтової
- 17. СТУПІНЬ ДИСОЦІАЦІЇ Залежність від температури Розрив хімічних зв'язків, потребує затрати енергії, а при утворенні гідратів енергія,
- 18. Ступінь електролітичної дисоціації визначають експериментально за величиною ізотонічного коефіцієнта. Якщо, С – загальна концентрація електроліту, α
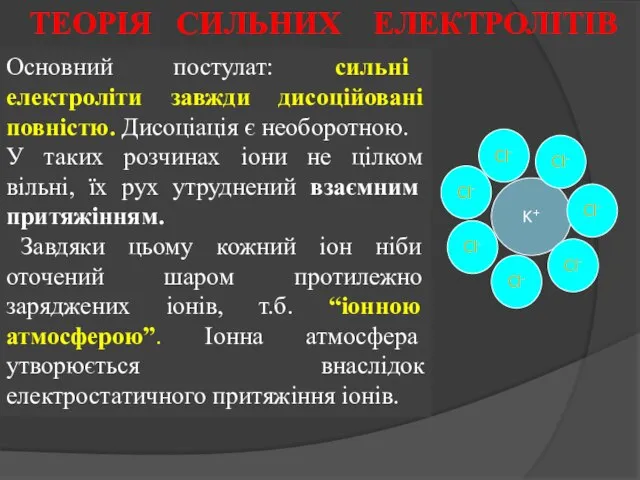
- 19. Основний постулат: сильні електроліти завжди дисоційовані повністю. Дисоціація є необоротною. У таких розчинах іони не цілком
- 20. В електричному струмі різнойменно заряджені іони починають рухатися в протилежні сторони. Кожний іон намагається рухатись в
- 21. Зменшення α пояснюється не утворенням молекул, а збільшенням гальмівної дії іонної атмосфери. Тому значення α для
- 22. Б’єрум та Дальтон відкрили закон іонної сили: коефіцієнт активності даного електроліту один і той самий в
- 23. Для рівноваги, яка встановлюється в розчині слабкого електроліту між молекулами і іонами можна записати вираз константи
- 24. ТЕОРІЯ СЛАБКИХ ЕЛЕКТРОЛІТІВ Наприклад, нітритна кислота, що є слабким електролітом та дисоціює: HNO2 ⇔ H+ +
- 25. Багатоосновні кислоти і багатокислотні основи дисоціюють ступінчасто. У розчинах цих кислот встановлюються складні рівноваги, в яких
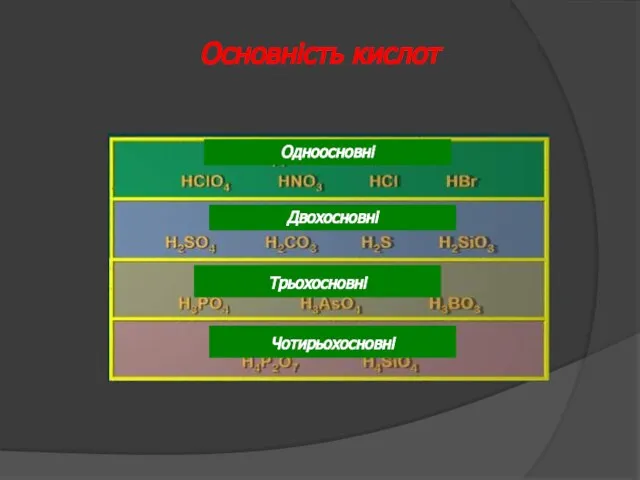
- 26. Основність кислот Одноосновні Двохосновні Трьохосновні Чотирьохосновні
- 27. Сульфатна кислота – сильний електроліт Сульфітна кислота – слабкий електроліт Основність кислот
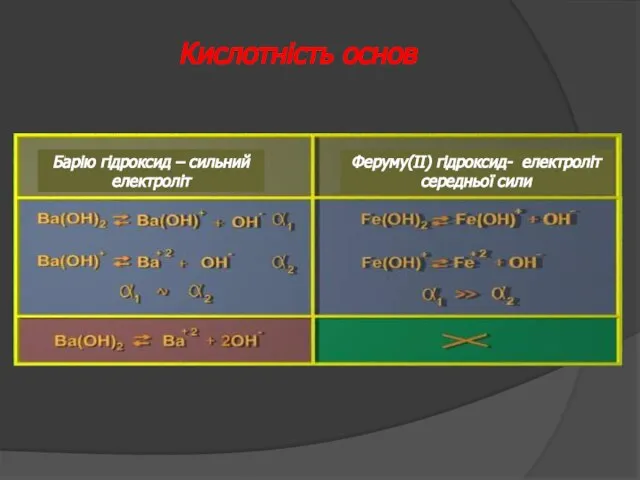
- 28. Кислотність основ Однокислотні Двокислотні Трьохкислотні
- 29. Кислотність основ
- 30. Натрію гідросульфат – сильний електроліт Натрію гідрокарбонат – слабкий електроліт Барію гідроксихлорид – сильний електроліт Феруму(ІІ)
- 31. ЗАКОН РОЗВЕДЕННЯ ОСТВАЛЬДА Між константою і ступенем дисоціації є зв’язок, відомий як закон розведення Оствальда. Нехай
- 32. Це рівняння є математичним виразом закону розведення Оствальда. Якщо електроліт є дуже слабким, то α 3
- 34. Скачать презентацию

























 Самое важное в жизни – жизнь! Светлана Радченко, врач александрийской выучки
Самое важное в жизни – жизнь! Светлана Радченко, врач александрийской выучки Новинки младшего отдела
Новинки младшего отдела Презентация на тему Особенности питания и пищеварения у животных
Презентация на тему Особенности питания и пищеварения у животных  Презентация на тему КРИСТАЛЛЫ
Презентация на тему КРИСТАЛЛЫ  Привычки полезные и вредные
Привычки полезные и вредные Презентация на тему Радиационная защита Дозиметрия
Презентация на тему Радиационная защита Дозиметрия  Организация работы учащихся в группе
Организация работы учащихся в группе Правоотношение
Правоотношение Николай Константинович Рерих (874 - 1947)
Николай Константинович Рерих (874 - 1947) Tre store norske språkforskere Torp, Vinje, Kulbrandstad
Tre store norske språkforskere Torp, Vinje, Kulbrandstad Мультимедийная лекцияна тему:Телекоммуникационные проекты
Мультимедийная лекцияна тему:Телекоммуникационные проекты Классификация преступлений
Классификация преступлений Pruthak Hindu law
Pruthak Hindu law III Международная научно-практическая конференция «Промышленная безопасность на взрывопожароопасных и химически опасных произв
III Международная научно-практическая конференция «Промышленная безопасность на взрывопожароопасных и химически опасных произв Сценарий. Новый Год.
Сценарий. Новый Год. Methods approaches in teachig English
Methods approaches in teachig English Рослинні тканини
Рослинні тканини Бунин о природе
Бунин о природе Презентация на тему Построение сечений тетраэдра
Презентация на тему Построение сечений тетраэдра Упрощёнка. Как записать сроки зарплаты
Упрощёнка. Как записать сроки зарплаты Презентация на тему Загадки сказки
Презентация на тему Загадки сказки  Презентация на тему Породы кроликов (4 класс)
Презентация на тему Породы кроликов (4 класс) Технологический уровень нефтехимии России
Технологический уровень нефтехимии России Запчасти Skoda
Запчасти Skoda Top-5 SKU. Лучшие продукты!
Top-5 SKU. Лучшие продукты! Страхование детей (1) (003)
Страхование детей (1) (003) Рисунок обрубовочной головы по Гудону
Рисунок обрубовочной головы по Гудону Безвоздушные шины – колеса будущего
Безвоздушные шины – колеса будущего