Содержание
- 2. Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород. Свойства оксидов и
- 3. Соединения металлов главной подгруппы I группы
- 4. Оксиды щелочных металлов Общая формула Ме2О Твердые, кристаллические вещества белого цвета Типичные основные оксиды: Взаимодействуют с
- 5. Гидроксиды щелочных металлов Общая формула – МеОН Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с
- 6. Гидроксиды щелочных металлов 1. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж
- 7. Гидроксиды щелочных металлов 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H2O
- 8. Соединения металлов главной подгруппы II группы
- 9. Оксиды металлов IIА группы Общая формула МеО Твердые, кристаллические вещества белого цвета ВеО – амфотерный оксид
- 10. Оксиды металлов IIА группы Взаимодействуют с водой(кроме ВеО), образуя щелочи(MgO – слабое основание): СаО + H2O
- 11. Гидроксиды металлов IIА группы Общая формула – Ме(ОН)2 Белые кристаллические вещества, в воде растворимы хуже, чем
- 12. Гидроксиды металлов IIА группы Ве(ОН)2 – амфотерный гидроксид Mg(ОН)2 – слабое основание Са(ОН)2, Sr(ОН)2, Ва(ОН)2 –
- 14. Скачать презентацию











 Презентация на тему Презентация Венгрия
Презентация на тему Презентация Венгрия Материалы к круглому столу на тему:«О возможных схемах и механизмах финансирования управляющих компаний (организаций), профессио
Материалы к круглому столу на тему:«О возможных схемах и механизмах финансирования управляющих компаний (организаций), профессио Описание пищевой (легкой) промышленности России
Описание пищевой (легкой) промышленности России Законы арифметических действий
Законы арифметических действий Анализ особенностей трансляционных рисков в промышленности
Анализ особенностей трансляционных рисков в промышленности Проблема бытия в философии Нового времени
Проблема бытия в философии Нового времени Презентация Нутрициология
Презентация Нутрициология Барокко как стиль в искусстве
Барокко как стиль в искусстве Приемы видеомонтажа. Восьмерка
Приемы видеомонтажа. Восьмерка Водоросли
Водоросли Сталинград перед войной Сталинградская битва 23 августа 1942 года – 2 февраля 1943 года.
Сталинград перед войной Сталинградская битва 23 августа 1942 года – 2 февраля 1943 года. Обзор продукции Valtec
Обзор продукции Valtec Презентация по географии на тему:«Санкт-Петербург»
Презентация по географии на тему:«Санкт-Петербург»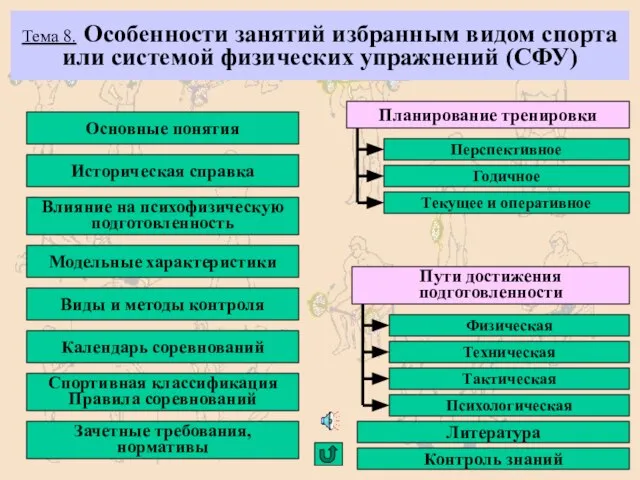 Особенности занятий избранным видом спорта
Особенности занятий избранным видом спорта «Основам информационных технологий»
«Основам информационных технологий» икона Николая Чудотворца
икона Николая Чудотворца История о том как Землю изгнали из центра Вселенной
История о том как Землю изгнали из центра Вселенной Old PostcardsСтарые почтовые открытки Музыка
Old PostcardsСтарые почтовые открытки Музыка Жужжалочка. Дидактическая игра для автоматизации звука Ж в словах
Жужжалочка. Дидактическая игра для автоматизации звука Ж в словах Дипломная работа. Виды диспетчерской документации, этапы обработки, документооборот диспетчера на автотранспортного предприятия
Дипломная работа. Виды диспетчерской документации, этапы обработки, документооборот диспетчера на автотранспортного предприятия «Система мониторинга освоения детьми планируемых результатов освоения Программы».
«Система мониторинга освоения детьми планируемых результатов освоения Программы». Об итогах социально – экономического развития Никифоровского сельского поселения Чусовского муниципального района Пермского кр
Об итогах социально – экономического развития Никифоровского сельского поселения Чусовского муниципального района Пермского кр Презентация на тему Паразиты человека
Презентация на тему Паразиты человека  Маска для искусственного сна
Маска для искусственного сна Работа с концептами как одна из форм реализации лингвокультурологического подхода
Работа с концептами как одна из форм реализации лингвокультурологического подхода Инкотермс 2010 Подготовили Столбова А.А.Т-086 Тихомирова Л.В.Т-083
Инкотермс 2010 Подготовили Столбова А.А.Т-086 Тихомирова Л.В.Т-083 Презентация на тему Динамика Масса и импульс тела Силы
Презентация на тему Динамика Масса и импульс тела Силы
 Урок по повести Н. В. Гоголя «Портрет»
Урок по повести Н. В. Гоголя «Портрет»