Содержание
- 2. Определение солей Со́ли — вещества, состоящие из катионов металла (или катионов аммония NH4 ; известны соли
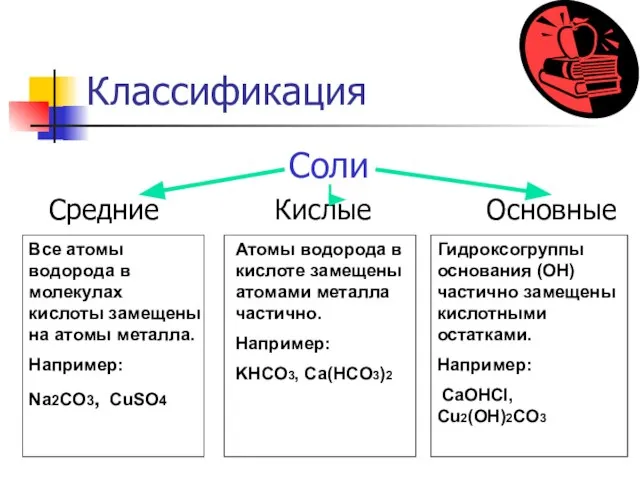
- 3. Классификация Соли Средние Кислые Основные Все атомы водорода в молекулах кислоты замещены на атомы металла. Например:
- 4. Физические свойства солей Как все ионные вещества, соли при н.у. – твердые кристаллы. Окраска зависит от
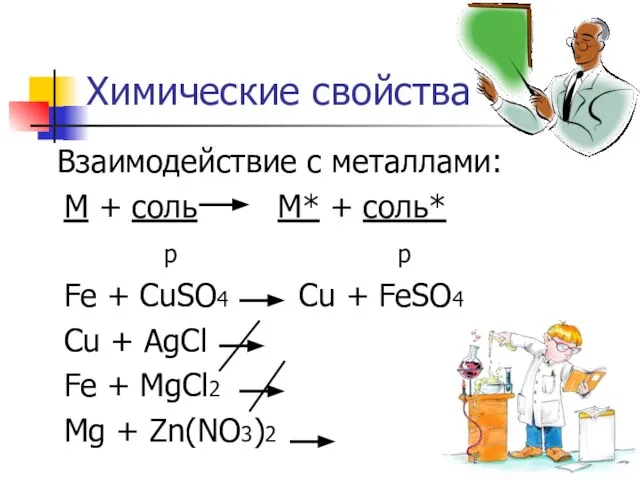
- 5. Химические свойства Взаимодействие с металлами: М + соль М* + соль* р р Fe + CuSO4
- 6. Химические свойства Взаимодействие со щелочами: NaOH + CuSO4 KOH + AgCl NaOH + K2CO3 Взаимодействие с
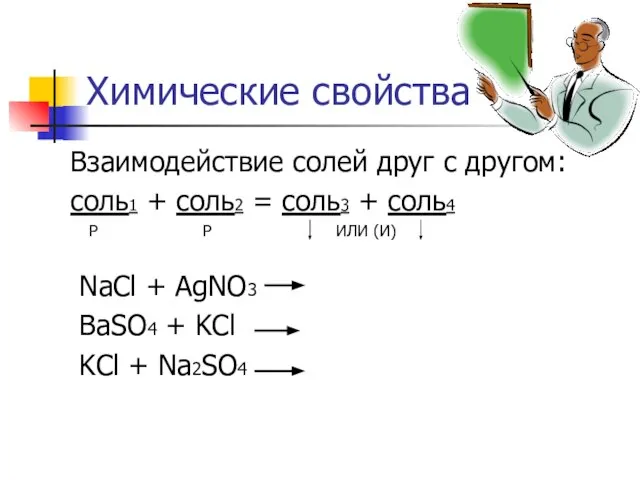
- 7. Химические свойства Взаимодействие солей друг с другом: соль1 + соль2 = соль3 + соль4 Р Р
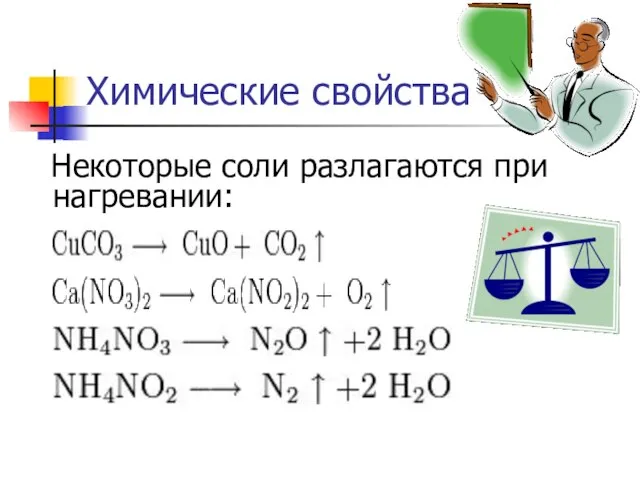
- 8. Химические свойства Некоторые соли разлагаются при нагревании:
- 9. Химические свойства Взаимодействие с водой: CuSO4 + 5H2O CuSO4 5H2O Al2S3 + 6H2O 2Al(OH)3 + 3H2S
- 10. Соли в природе Многие минералы — соли, образующие залежи (например, галит NaCl, сильвин KCl, флюорит CaF2).
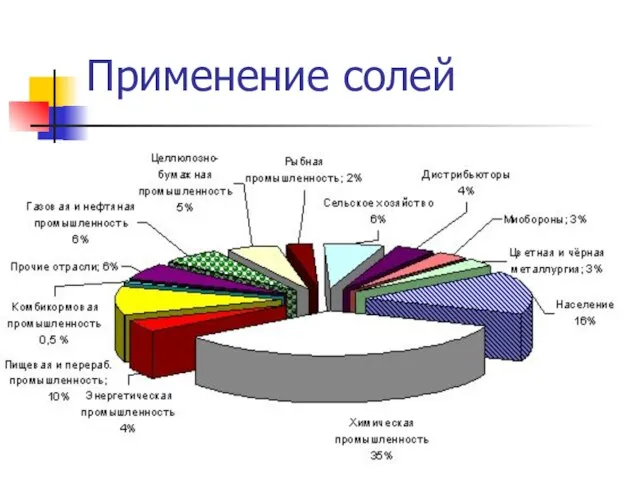
- 12. Применение солей
- 13. Выполните задания: 1. Установите соответствие между химической формулой соли и классом, к которому она относится. 1)
- 14. 2. Установите соответствие между химической формулой вещества и его названием. 1) FeCl3 A. нитрат меди(II) 2)
- 15. Общие способы синтеза солей 1.Получение средних солей: 1) металла с неметаллом: 2Na + Cl2 = 2NaCl
- 16. 6) основания с кислотным оксидом Ba(OH)2+ CO2 = BaCO3 + H2O 7) основания с кислотой: Ca(OH)2
- 17. 2.Получение кислых солей: 1. Взаимодействие кислоты с недостатком основания. KOH + H2SO4 = KHSO4 + H2O
- 18. 3.Получение основных солей: 1. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов AlCl3
- 19. 4.Получение комплексных солей: 1. Реакции солей с лигандами: AgCl + 2NH3 = [Ag(NH3)2]Cl FeCl3 + 6KCN]
- 21. Скачать презентацию













 Society and Social Interaction
Society and Social Interaction Скифы 11 класс
Скифы 11 класс Конфликтогены и техники профилактики конфликтов
Конфликтогены и техники профилактики конфликтов Дети Великой Отечественной войны
Дети Великой Отечественной войны Освоение углеводородных ресурсов полуострова Ямал
Освоение углеводородных ресурсов полуострова Ямал Использование инновационных технологий в обучении химии
Использование инновационных технологий в обучении химии Стихи и песни о Великой Отечественной войне
Стихи и песни о Великой Отечественной войне Критерии оценивания проектной деятельности и презентаций
Критерии оценивания проектной деятельности и презентаций Предмет и метод учебного курса Законодательная техника
Предмет и метод учебного курса Законодательная техника СЕМЕН ЗАХАРЫЧ МАРМЕЛАДОВ
СЕМЕН ЗАХАРЫЧ МАРМЕЛАДОВ Презентация на тему Индустриальная революции
Презентация на тему Индустриальная революции 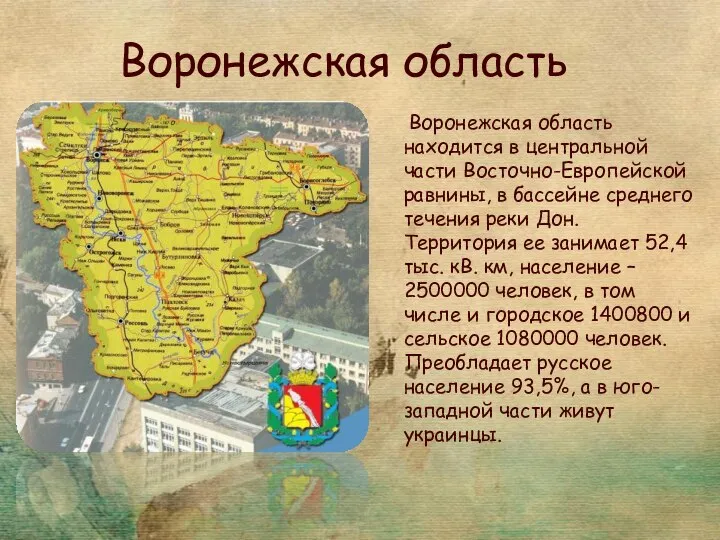 Воронежская область
Воронежская область ВИНО 1 часть
ВИНО 1 часть Отчет о реализации плана мероприятий Правительства Тверской области
Отчет о реализации плана мероприятий Правительства Тверской области Биология - совокупность наук о живом…
Биология - совокупность наук о живом… Бизнес-план проекта творческого развития детей SitPlay
Бизнес-план проекта творческого развития детей SitPlay Координационный совет по организации отдыха, оздоровления и занятости детей
Координационный совет по организации отдыха, оздоровления и занятости детей Презентация на тему Виды жилых помещений
Презентация на тему Виды жилых помещений  Present Simple
Present Simple  Коммерческое предложение по Генеральному спонсорству проекта «X Фактор» в эфире телеканала «Первый Канал «Евразия»
Коммерческое предложение по Генеральному спонсорству проекта «X Фактор» в эфире телеканала «Первый Канал «Евразия» История утюга. Параметры Braun TexStyle 7 TS 785 STP
История утюга. Параметры Braun TexStyle 7 TS 785 STP Стратегии
Стратегии С Прощёным воскресеньем, дорогие читатели!
С Прощёным воскресеньем, дорогие читатели! Time-менеджмент для управления своей жизнью
Time-менеджмент для управления своей жизнью Славный народ - собаки
Славный народ - собаки Использование национально-регионального компонента в обучении химии на элективных курсах
Использование национально-регионального компонента в обучении химии на элективных курсах Социальное государство. Задания для выполнения
Социальное государство. Задания для выполнения Лидия Алексеевна Чарская
Лидия Алексеевна Чарская