Содержание
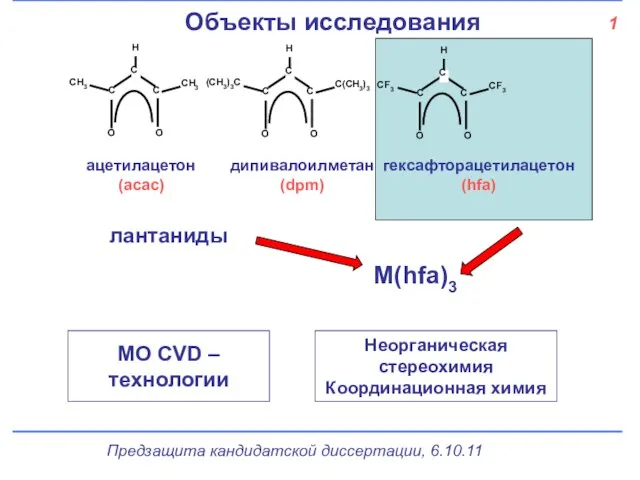
- 2. 1 Объекты исследования ацетилацетон (acac) дипивалоилметан (dpm) гексафторацетилацетон (hfa) лантаниды М(hfa)3 МО СVD – технологии Неорганическая
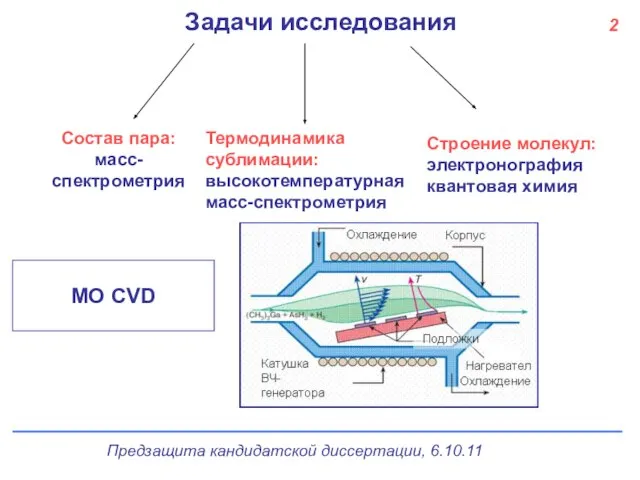
- 3. 2 Задачи исследования Термодинамика сублимации: высокотемпературная масс-спектрометрия Состав пара: масс-спектрометрия Строение молекул: электронография квантовая химия МО
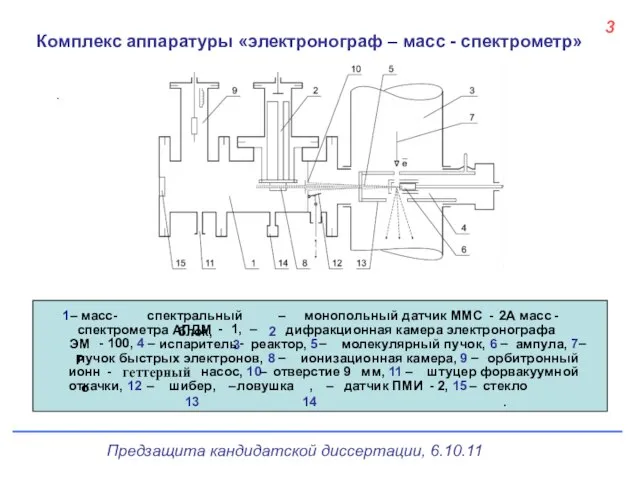
- 4. 3 Комплекс аппаратуры «электронограф – масс - спектрометр»
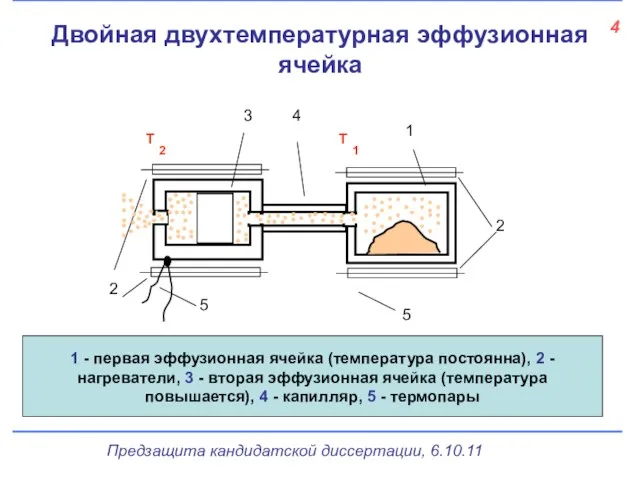
- 5. 4 Двойная двухтемпературная эффузионная ячейка 5 1 - первая эффузионная ячейка (температура постоянна), 2 - нагреватели,
- 6. МНСК, Новосибирск, 2007 Состав пара. Зарегистрированные ионы Мономерная группа: [LnL2-CF2]+ [LnL2]+ [LnL3] + Димерная группа: [Ln2L5]+
- 7. а – [Yb 2L3F2]+/ [Yb2L4F]+ б – [Yb2L4F]+/ [Yb2L4F]+ в – [Yb 2L5]+/[Yb2L4F]+; г – [YbL3]+/[Yb2L4F]+.
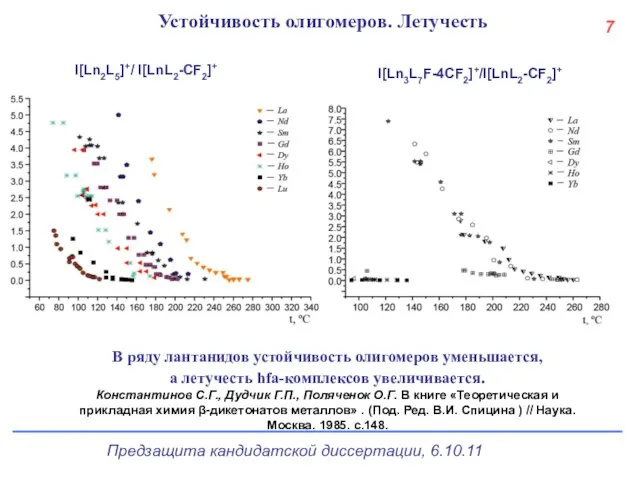
- 8. МНСК, Новосибирск, 2007 Устойчивость олигомеров. Летучесть В ряду лантанидов устойчивость олигомеров уменьшается, а летучесть hfa-комплексов увеличивается.
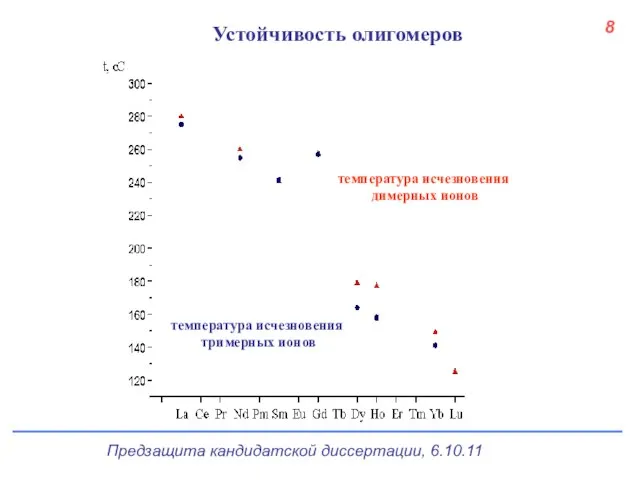
- 9. температура исчезновения димерных ионов температура исчезновения тримерных ионов Устойчивость олигомеров 8
- 10. 9 Термодинамика сублимации Yb(hfa)3 J.E.Sicre, J.T.Dubois, K.J.Eisentraut, R.E.Sievers J.Am.Chem.Soc. - 1969. - P.3476-3481. R.Amano,A.Sato,S.Suzuki Bull.Chem.Soc.Jpn.-1981.-V.54(5), p.1368-1374.
- 11. 10 Термодинамика сублимации Yb(hfa)3 Масс-спектрометрический контроль состава пара: магнитный масс-спектрометр МИ1201: 81-130 оС Эффузионный метод Кнудсена:
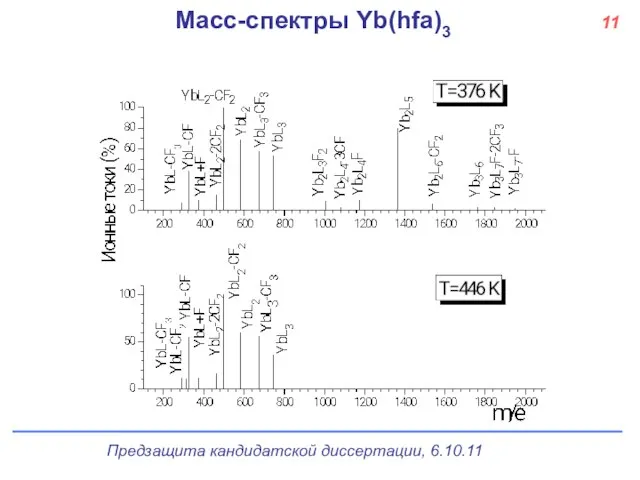
- 12. Масс-спектры Yb(hfa)3 11
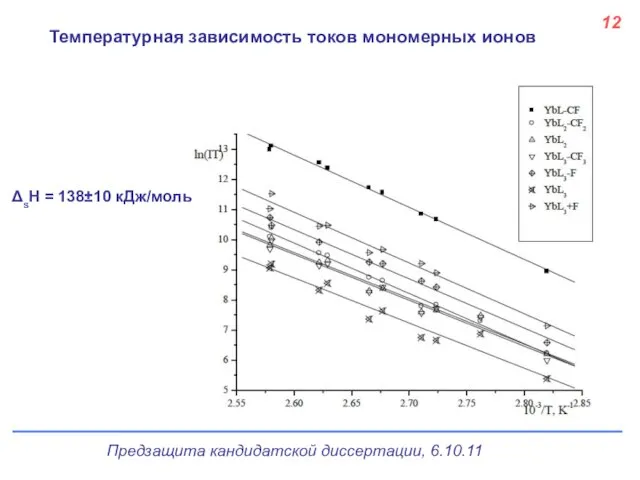
- 13. Температурная зависимость токов мономерных ионов 12 ΔsH = 138±10 кДж/моль
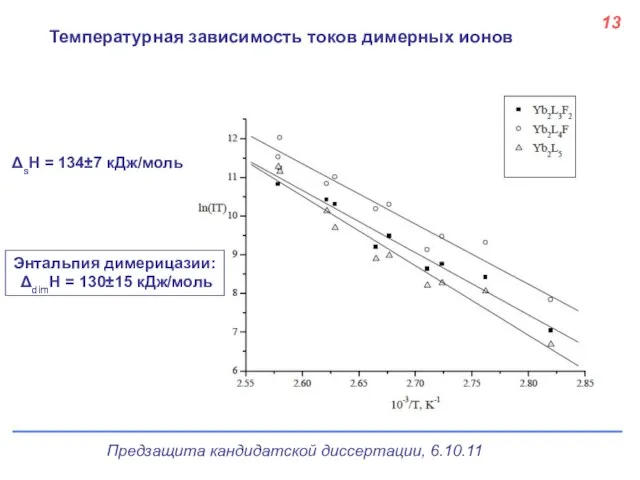
- 14. 13 Температурная зависимость токов димерных ионов ΔsH = 134±7 кДж/моль Энтальпия димерицазии: ΔdimH = 130±15 кДж/моль
- 15. 14 Квантовохимические расчеты (Gaussian 03) Использованы методы Хартри-Фока (HF) и DFT (B3LYP); Базисные наборы: металл –
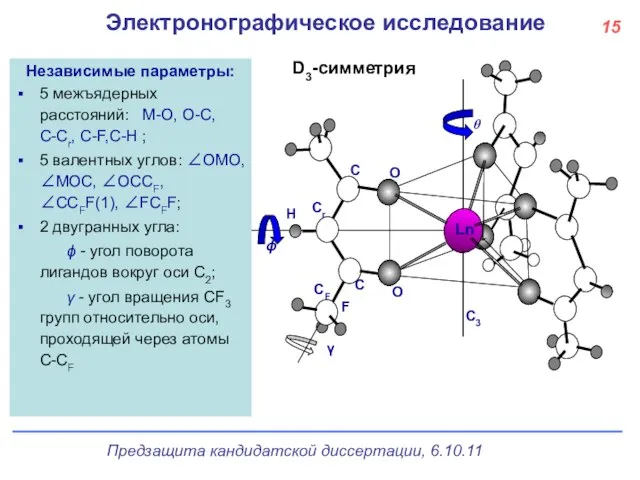
- 16. МНСК, Новосибирск, 2007 Электронографическое исследование D3-симметрия Независимые параметры: 5 межъядерных расстояний: M-O, O-C, C-Cr, C-F,C-H ;
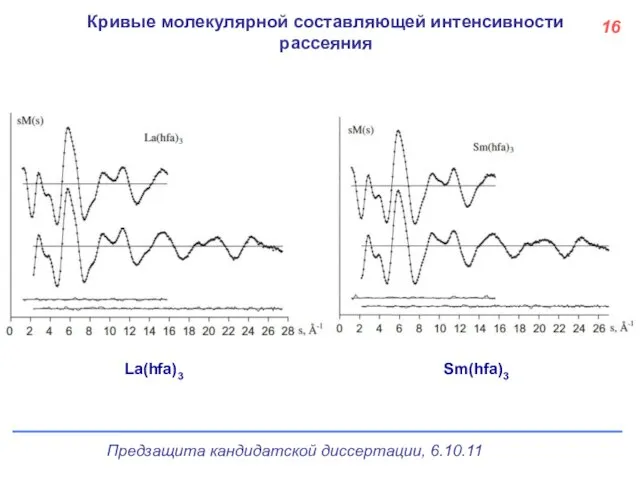
- 17. Кривые молекулярной составляющей интенсивности рассеяния La(hfa)3 Sm(hfa)3 16
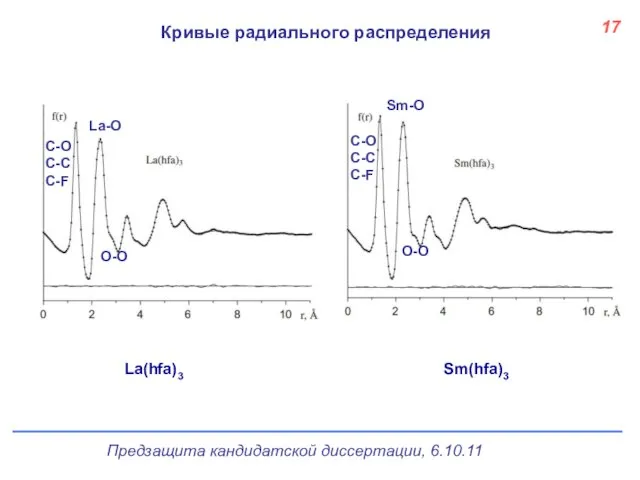
- 18. Кривые радиального распределения 17 La(hfa)3 Sm(hfa)3 C-O C-C C-F O-O La-O C-O C-C C-F Sm-O O-O
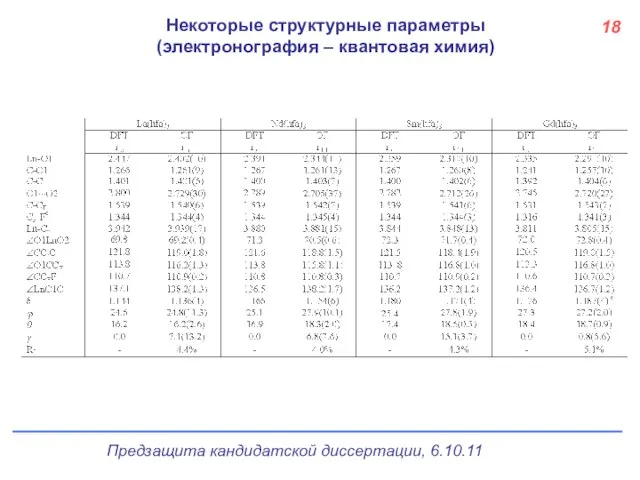
- 19. Некоторые структурные параметры (электронография – квантовая химия) 18
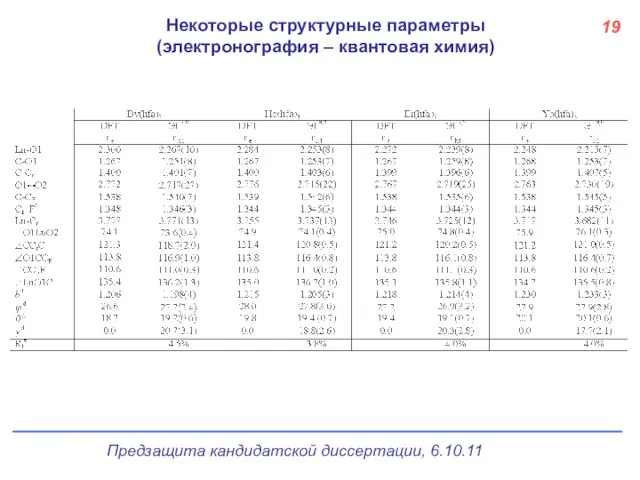
- 20. Некоторые структурные параметры (электронография – квантовая химия) 19
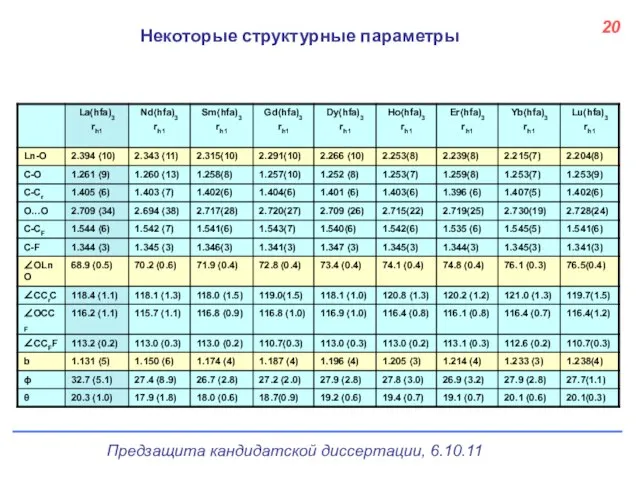
- 21. 20 Некоторые структурные параметры
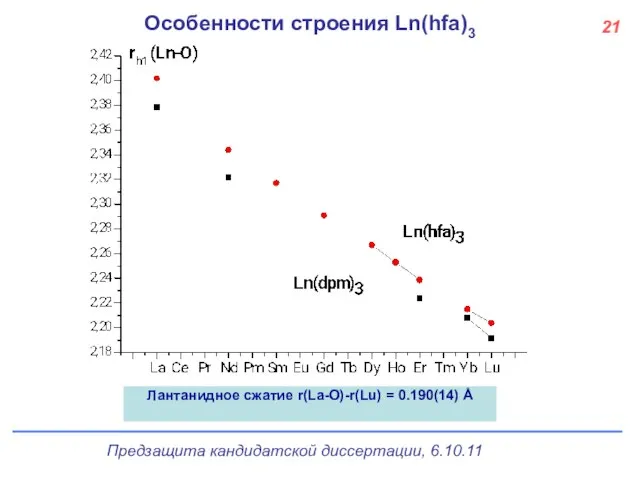
- 22. Особенности строения Ln(hfa)3 Лантанидное сжатие r(La-O)-r(Lu) = 0.190(14) Å 21
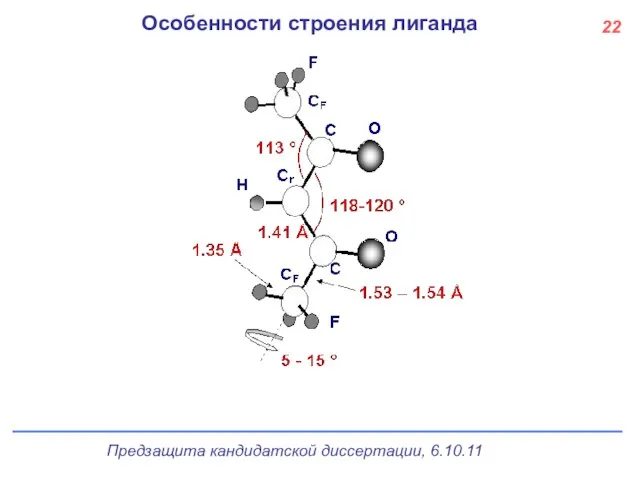
- 23. Особенности строения лиганда 22
- 24. 23 Основные результаты и выводы Исследован состав перегретых паров трис-гексафторацетилацетонатов лантанидов в широком температурном интервале масс-спектрометрическим
- 26. Скачать презентацию
![МНСК, Новосибирск, 2007 Состав пара. Зарегистрированные ионы Мономерная группа: [LnL2-CF2]+ [LnL2]+ [LnL3]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/411301/slide-5.jpg)
![а – [Yb 2L3F2]+/ [Yb2L4F]+ б – [Yb2L4F]+/ [Yb2L4F]+ в – [Yb](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/411301/slide-6.jpg)




 Взаємозв’язок хімії та енергетики
Взаємозв’язок хімії та енергетики 20170622_islandiya
20170622_islandiya Общая характеристика земноводных
Общая характеристика земноводных Подростковая культура
Подростковая культура Ядерное оружие и его боевые свойства
Ядерное оружие и его боевые свойства книжка - важливе джерело знань
книжка - важливе джерело знань Урок развития речи на публицистическую тему «Люби и охраняй природу»
Урок развития речи на публицистическую тему «Люби и охраняй природу» ОГНИ ЕКАТЕРИНБУРГА
ОГНИ ЕКАТЕРИНБУРГА НОУ ОЛ Довузовский комплекс ТвГУ
НОУ ОЛ Довузовский комплекс ТвГУ Линии чертежа
Линии чертежа Бюджетирование и контроль затрат в организации
Бюджетирование и контроль затрат в организации Вышивка крестом
Вышивка крестом Работа территориальной конфликтной комиссии в 2011 году
Работа территориальной конфликтной комиссии в 2011 году Презентация
Презентация Причины возникновения нарушений речи
Причины возникновения нарушений речи Романский стиль
Романский стиль Профессиональное командное соревнование молодежных команд
Профессиональное командное соревнование молодежных команд Вулканы Земли
Вулканы Земли Знаковая система театральных декораций
Знаковая система театральных декораций Walt disney and his heroes
Walt disney and his heroes Всемирный день спасибо
Всемирный день спасибо Презентация на тему Алгоритм выполнения заданий для формирования и развития учебных умений
Презентация на тему Алгоритм выполнения заданий для формирования и развития учебных умений Многообразие кишечнополостных их значение в природе и жизни человека
Многообразие кишечнополостных их значение в природе и жизни человека Презентация на тему Измерение глобальной и региональной торговой интеграции
Презентация на тему Измерение глобальной и региональной торговой интеграции  Структура и динамика конфликта. Лекция 2
Структура и динамика конфликта. Лекция 2 Вид, его критерии
Вид, его критерии Университет Синергия
Университет Синергия Изображения
Изображения