Содержание
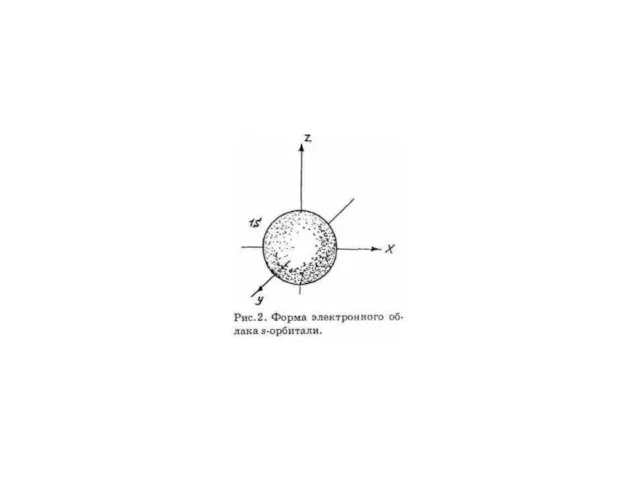
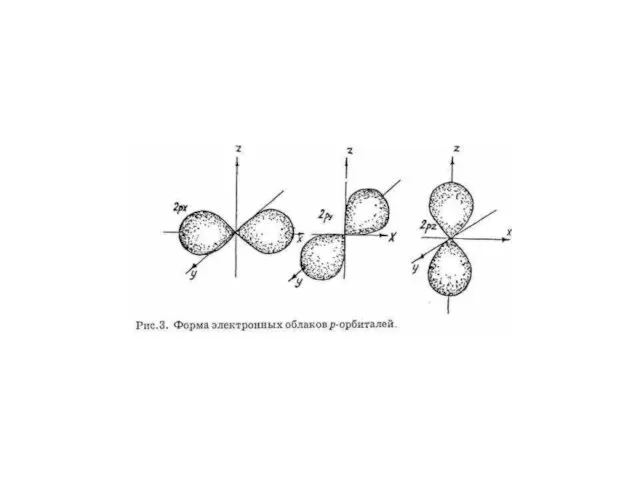
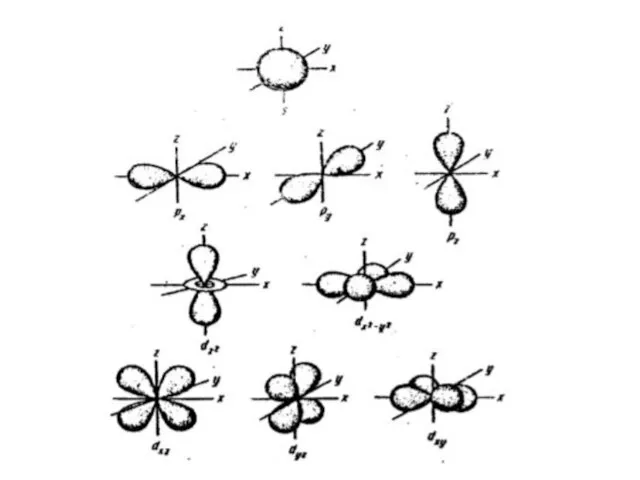
- 2. Орбитальное квантовое число Энергетический уровень включает в себя несколько орбиталей. Орбитали с одинаковой энергией, принадлежащие одному
- 6. Магнитное квантовое число Для того, чтобы различать электроны, занимающие одинаковые по энергии орбитали, введено магнитное квантовое
- 7. Спиновое квантовое число Спин электрона есть собственный момент количества движения. Хотя интерпретация этого свойства сложна, его
- 8. Согласно принципу наименьшей энергии, сначала заполняется энергетический уровень с n=1, затем, после заполнения первого уровня, с
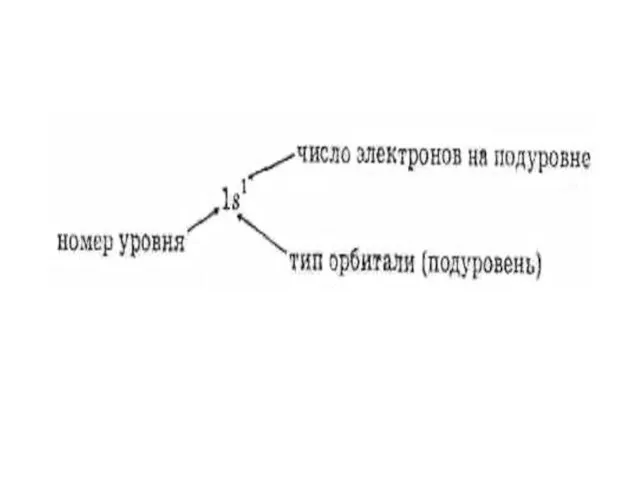
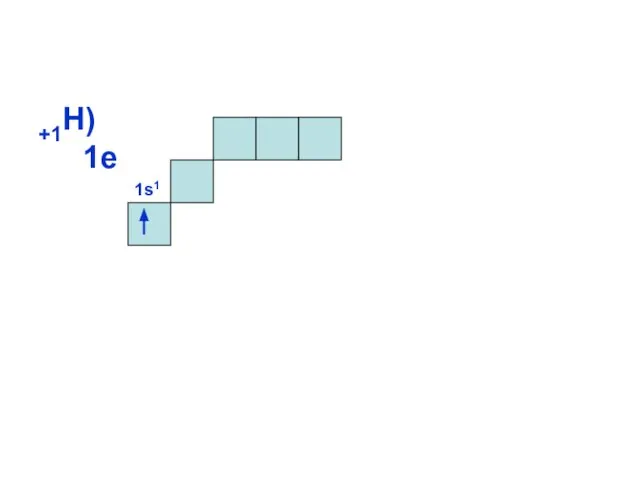
- 10. +1Н) 1е 1s1
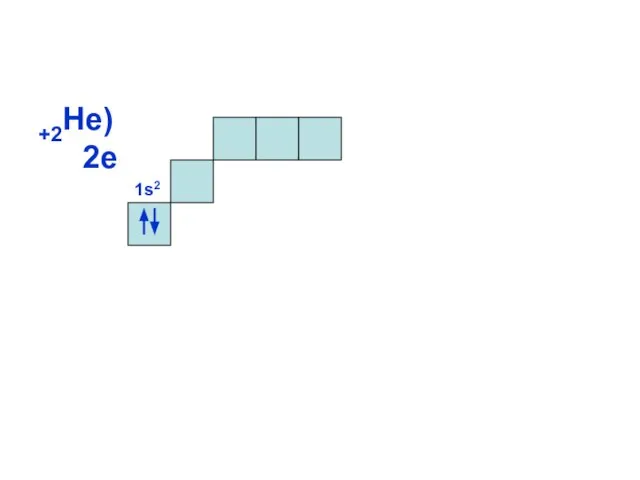
- 11. +2Не) 2е 1s2
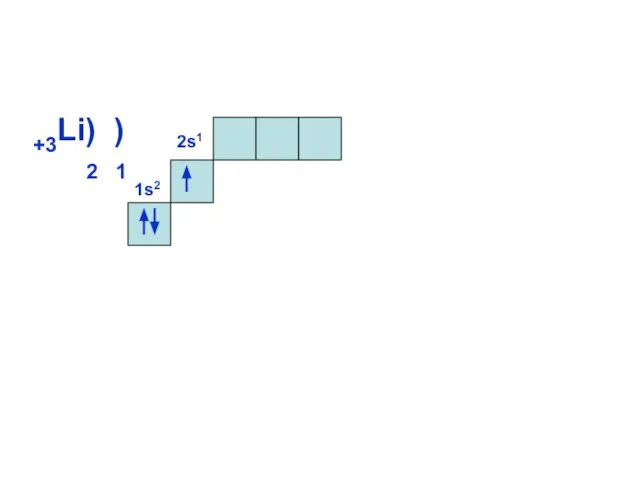
- 12. 1s2 +3Li) ) 2 1 2s1
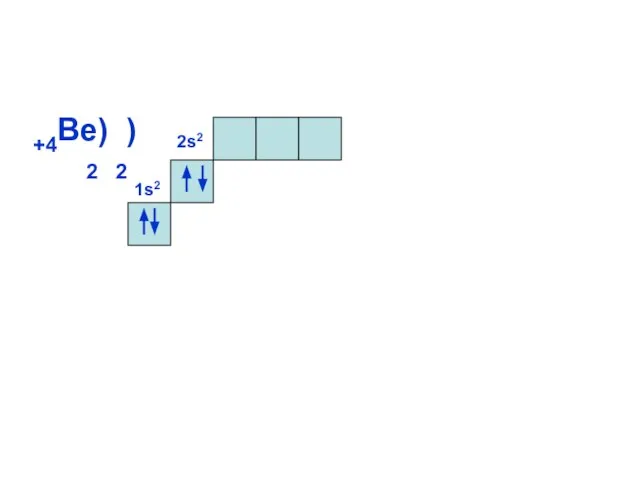
- 13. 1s2 +4Be) ) 2 2 2s2
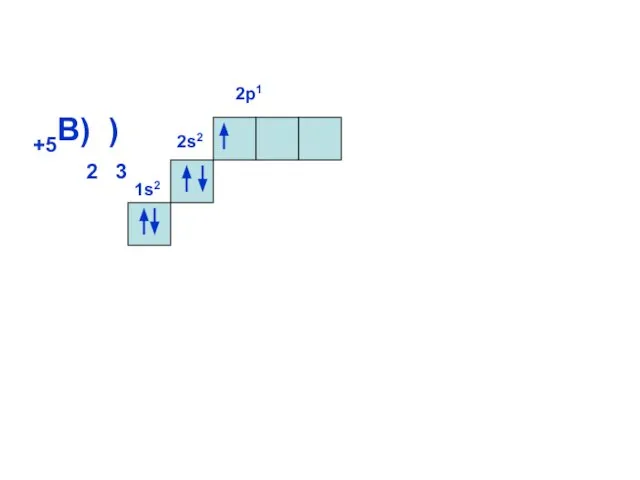
- 14. 1s2 +5B) ) 2 3 2s2 2р1
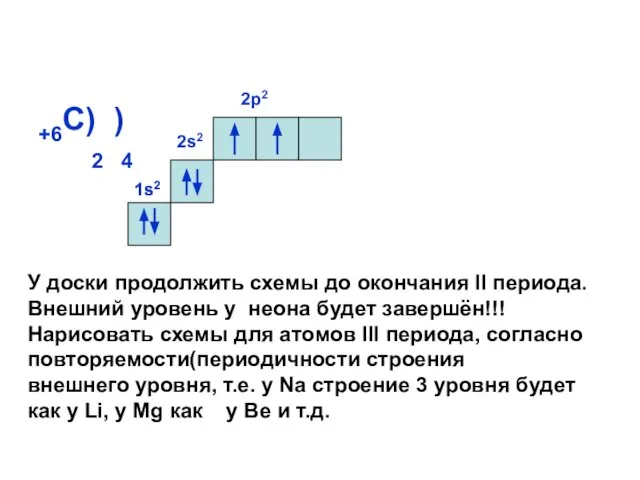
- 15. +6С) ) 2 4 2s2 2р2 1s2 1s2 У доски продолжить схемы до окончания II периода.
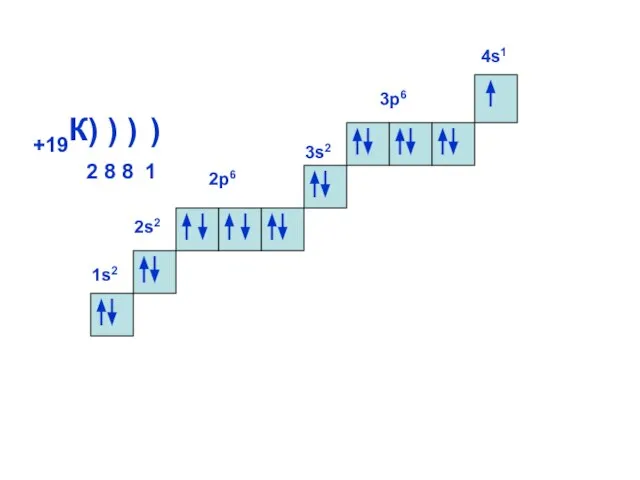
- 16. 1s2 +19К) ) ) 2 8 8 1 2s2 2р6 3s2 4s1 3р6 )
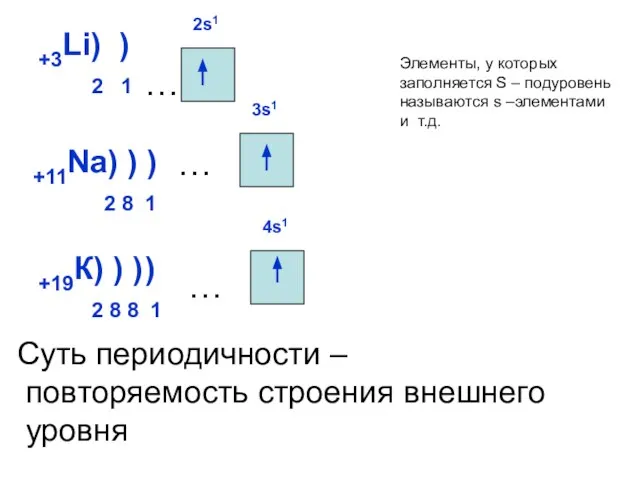
- 17. +3Li) ) 2 1 2s1 … +19К) ) ) 2 8 8 1 +11Na) ) )
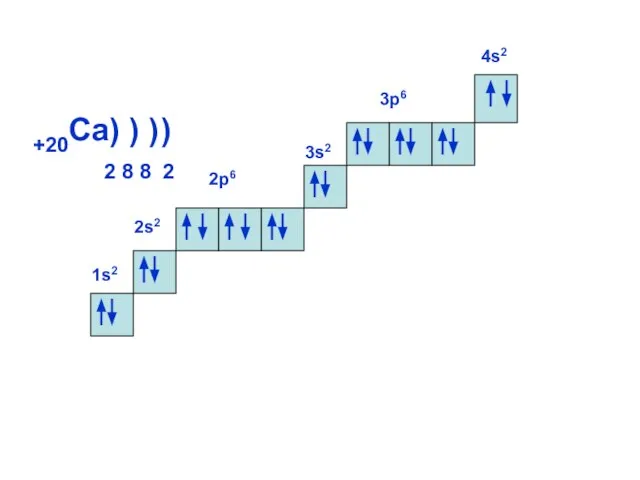
- 18. 1s2 +20Ca) ) ) 2 8 8 2 2s2 2р6 3s2 4s2 3р6 )
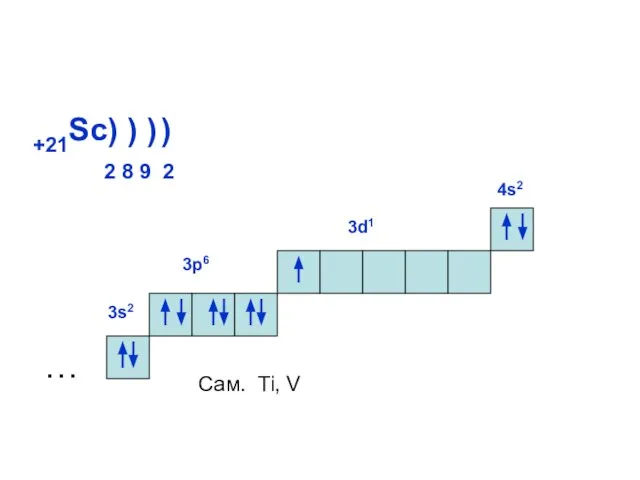
- 19. +21Sc) ) ) 2 8 9 2 ) … 3s2 3р6 4s2 3d1 Сам. Ti, V
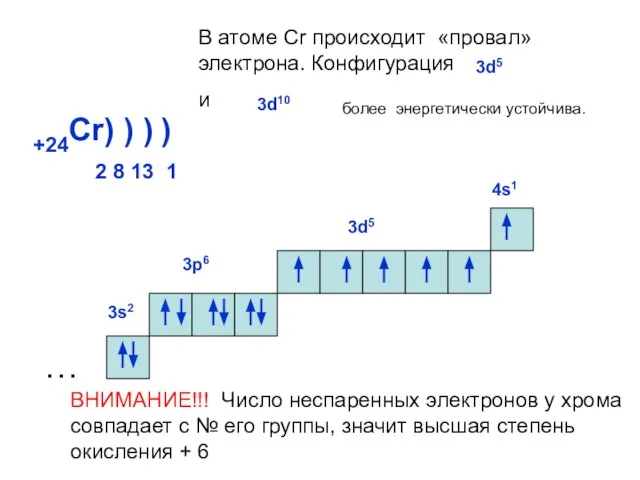
- 20. +24Cr) ) ) 2 8 13 1 ) … 3s2 3р6 3d5 В атоме Cr происходит
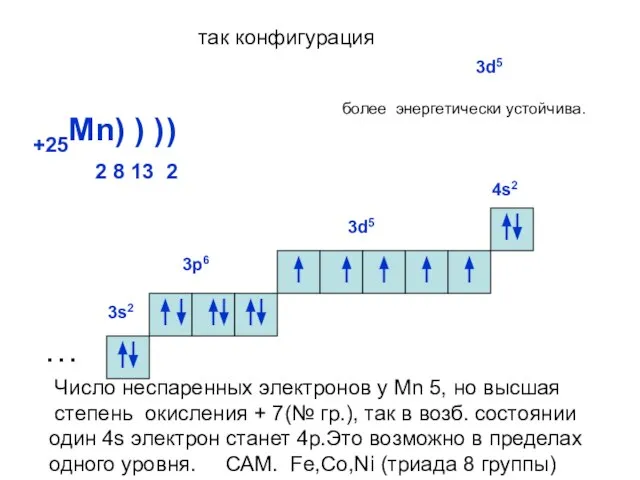
- 21. +25Mn) ) ) 2 8 13 2 ) … 3s2 3р6 3d5 так конфигурация 3d5 более
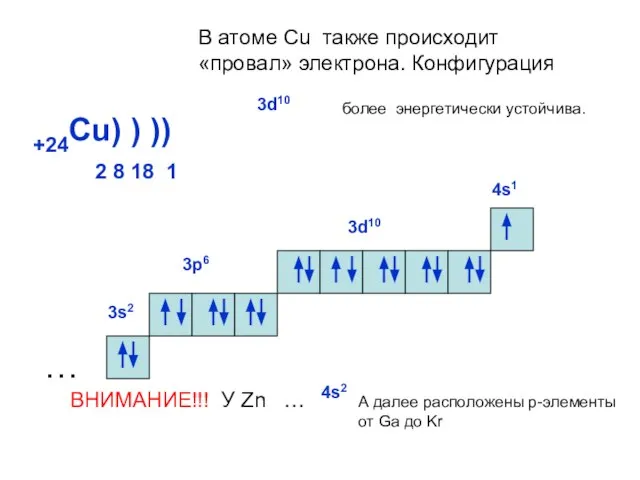
- 22. +24Cu) ) ) 2 8 18 1 ) … 3s2 3р6 3d10 В атоме Cu также
- 23. У элементов V периода идёт заполнение подуровней в следующем порядке: 5s ? 4d ? 5p и
- 24. В VI и VII периодах появляются f –элементы на 3-ем снаружи уровне. 4f- элементы – лантаноиды
- 25. Ряд последовательного заполнения электронами орбиталей атомов
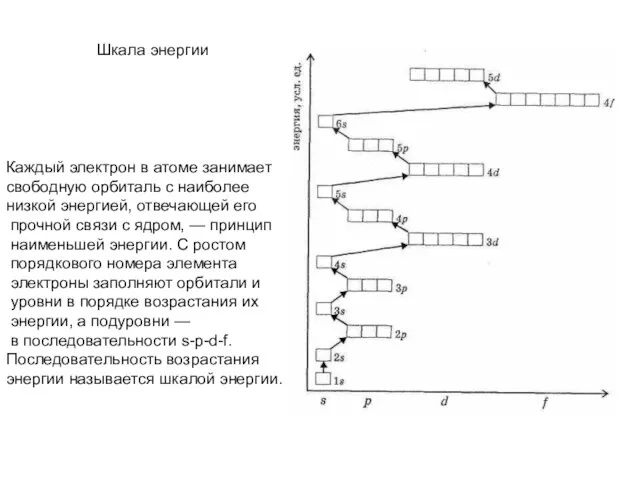
- 26. Шкала энергии Каждый электрон в атоме занимает свободную орбиталь с наиболее низкой энергией, отвечающей его прочной
- 28. Скачать презентацию







 Реактивный двигатель ,
Реактивный двигатель , Проблемы и перспективы «дачной амнистии»: взгляд экспертов
Проблемы и перспективы «дачной амнистии»: взгляд экспертов Государство, его признаки и формы
Государство, его признаки и формы Класифікація гідравлічних машин
Класифікація гідравлічних машин Образы в социальной рекламе
Образы в социальной рекламе Турция
Турция К ВОПРОСУ О РЕГИОНАЛЬНОМ ТЕЛЕМЕДИЦИНСКОМ ЦЕНТРЕСАНКТ-ПЕТЕРБУРГА(ТМЦ СПБ)
К ВОПРОСУ О РЕГИОНАЛЬНОМ ТЕЛЕМЕДИЦИНСКОМ ЦЕНТРЕСАНКТ-ПЕТЕРБУРГА(ТМЦ СПБ) Ежегодно команда юношей принимает участиев межрегиональных соревнованиях среди кадетских корпусов, православных гимназий, дет
Ежегодно команда юношей принимает участиев межрегиональных соревнованиях среди кадетских корпусов, православных гимназий, дет одготовка специалистов для работы с лицами с ОВЗ в Норвегии
одготовка специалистов для работы с лицами с ОВЗ в Норвегии Применение анкерного крепления и хим. упрочнения кровли в условиях Ярегского месторождения
Применение анкерного крепления и хим. упрочнения кровли в условиях Ярегского месторождения Путешествие в город огород
Путешествие в город огород Презентация на тему Духовная жизнь
Презентация на тему Духовная жизнь Питание растений
Питание растений Нормативно-правовые основы и финансово-хозяйственные механизмы перехода на новую систему финансирования
Нормативно-правовые основы и финансово-хозяйственные механизмы перехода на новую систему финансирования Спорт — это здорово
Спорт — это здорово Лев Николаевич Толстой
Лев Николаевич Толстой Prince2 - структурированный метод управления проектами в социальной сфере
Prince2 - структурированный метод управления проектами в социальной сфере Кайнозойская эра
Кайнозойская эра Все профессии важны, с математикой дружны
Все профессии важны, с математикой дружны Физиология, биохимия микроорганизмов (прокариотов: бактерий, эукариотов: простейших, грибов, вирусов)
Физиология, биохимия микроорганизмов (прокариотов: бактерий, эукариотов: простейших, грибов, вирусов) Парад Профессий - ХХI век. Автор Сохибкулова Марина
Парад Профессий - ХХI век. Автор Сохибкулова Марина Trinkgeld für azubis
Trinkgeld für azubis Семинар FCI для судей IGP
Семинар FCI для судей IGP Многогранники
Многогранники Чем интересны музеи
Чем интересны музеи "Пожарные
"Пожарные ОПТИМИЗАЦИЯ ШКОЛЬНОГО САЙТА
ОПТИМИЗАЦИЯ ШКОЛЬНОГО САЙТА к 8 марта с музыкой
к 8 марта с музыкой