Содержание
- 2. План изучения Важность познания атома. Модели строения атома. Опыт Эрнеста Резерфорда. Ядерная модель строения атома. Протонно-нейтронная
- 3. Возникновение понятия «атом» Понятие «атом» впервые появилось в работах древнегреческих философов Демокрита и Левкипта. Под атомом
- 4. Выдающийся физик современности, лауреат Нобелевской премии Роберт Фейнман говорил: «Если бы в результате какой-то мировой катастрофы
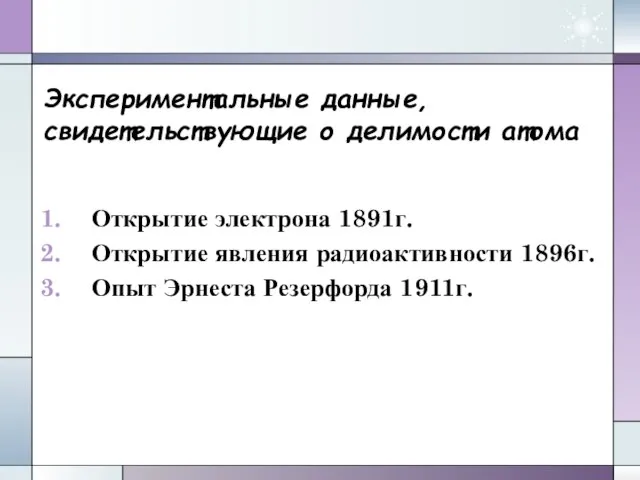
- 5. Экспериментальные данные, свидетельствующие о делимости атома Открытие электрона 1891г. Открытие явления радиоактивности 1896г. Опыт Эрнеста Резерфорда
- 6. Открытие электрона Занимаясь изучением газового разряда Д.Д.Томсон, совместно с сотрудниками выполнил серию классических работ, приведших к
- 7. Радиоактивность В 1896 году французский ученый Анри Беккерель открыл явление естественной радиоактивности - самопроизвольного распада ядер
- 8. Радиоактивность
- 9. Модель атома Томсона Одну из первых моделей атома предложил английский физик Дж. Томсон в 1903 г.
- 10. Опыт Э.Резерфорда Э. Резерфорд с учениками проверил состоятельность модели атома Томсона. Эрнест РЕЗЕРФОРД (1871 - 1937)
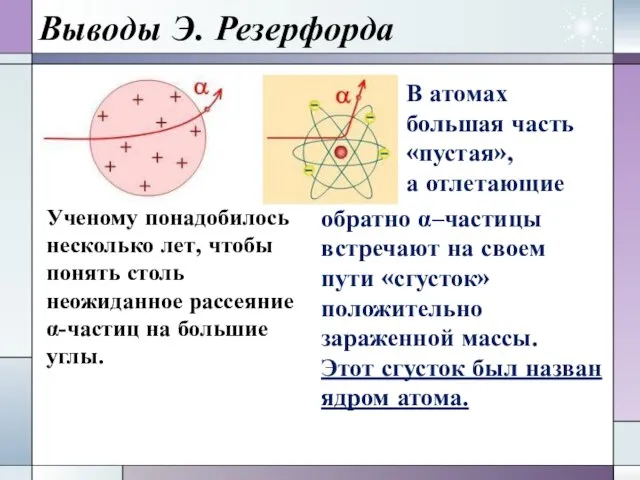
- 11. Выводы Э. Резерфорда Ученому понадобилось несколько лет, чтобы понять столь неожиданное рассеяние α-частиц на большие углы.
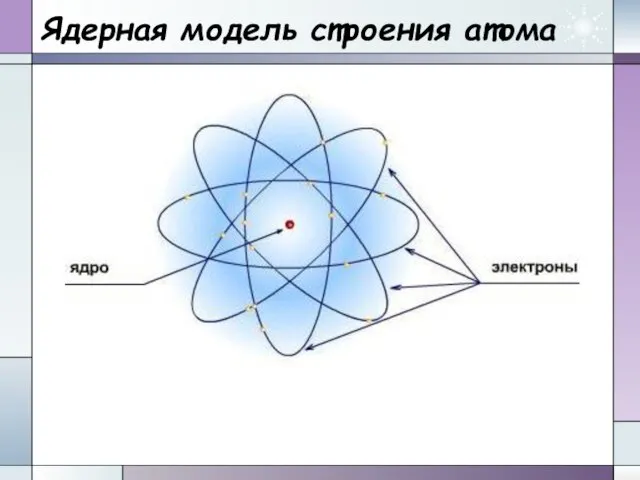
- 12. Ядерная модель строения атома
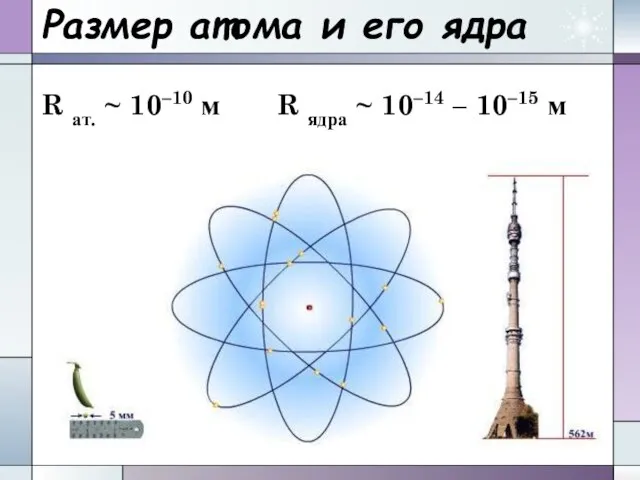
- 13. Размер атома и его ядра R ат. ~ 10–10 м R ядра ~ 10–14 – 10–15
- 14. Открытие протона 1913 г. Э.Резерфорд выдвинул гипотезу о том, что одной из частиц, входящих в состав
- 15. Открытие нейтрона 1920 г. Э.Резерфорд предположил существование электрически нейтральной частицы с массой, приблизительно равной массе протона.
- 16. Протонно-нейтронная модель ядра 1932 г. советские ученые Е.Н. Гапон, Д.Д.Иваненко и немецкий физик Гейзенберг Все ядра
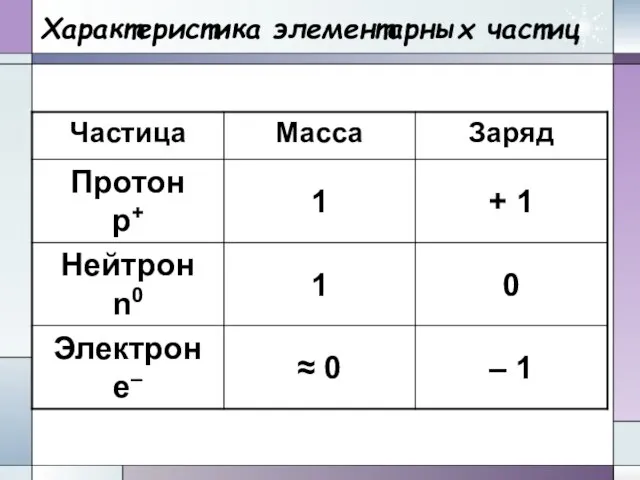
- 18. Характеристика элементарных частиц
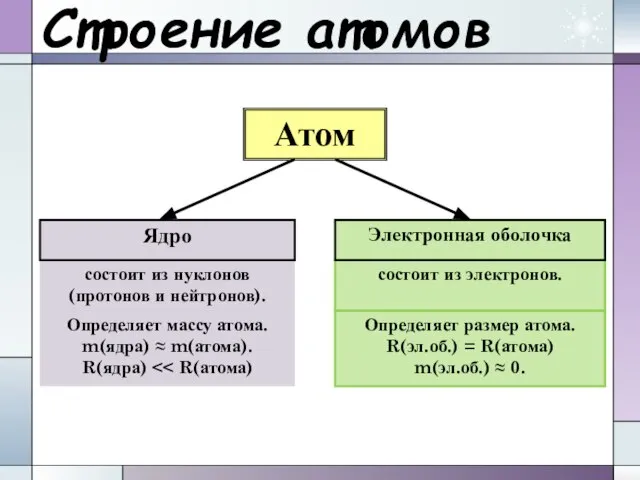
- 19. Строение атомов Атом Ядро состоит из нуклонов (протонов и нейтронов). состоит из электронов. Электронная оболочка Определяет
- 20. Состав атома Атомы химических элементов состоят из трех частиц: протоны или р+ нейтроны или n0 электроны
- 21. Атом – наименьшая частица химического элемента, носитель его свойств.
- 22. Количественная характеристика атомов А – массовое число атома Z – зарядовое число атома Масса атомов: 7
- 23. Опишите характеристики и состав атомов Масса атомов: 14 а.е.м. Заряд ядра: + 6 Состав ядра: число
- 25. Скачать презентацию
















 The geography of the USA
The geography of the USA  20140604_antarktida
20140604_antarktida EVENT-АЛЬБОМ
EVENT-АЛЬБОМ Творческий проект Лопатка кухонная
Творческий проект Лопатка кухонная Коварные Е
Коварные Е Huawei P30 lite vs Samsung А50
Huawei P30 lite vs Samsung А50 Презентация на тему Во времена Древней Руси
Презентация на тему Во времена Древней Руси  Request Reply The main aims of the writing
Request Reply The main aims of the writing Роль физической культуры и спорта в нашей жизни
Роль физической культуры и спорта в нашей жизни Влияние электромагнитного излучения на здоровье человека
Влияние электромагнитного излучения на здоровье человека Первое родительское собрание
Первое родительское собрание Автосцепка
Автосцепка «Теория и методика музыкального развития с практикумом»
«Теория и методика музыкального развития с практикумом» Технология педагогического общения
Технология педагогического общения Христианская церковь в раннее средневековье
Христианская церковь в раннее средневековье Бесплатный курс АвтоПраво
Бесплатный курс АвтоПраво 2b
2b Тепловые насосы BROS
Тепловые насосы BROS Участие центров правовой информации библиотек в профилактике наркомании и пропаганде здорового образа жизни
Участие центров правовой информации библиотек в профилактике наркомании и пропаганде здорового образа жизни Кто его раздевает, тот слёзы проливает
Кто его раздевает, тот слёзы проливает Эковожатый. Социальная сфера
Эковожатый. Социальная сфера Рациональное пользование полезных ископаемых Пермского края
Рациональное пользование полезных ископаемых Пермского края 571 В вышине под небесами
571 В вышине под небесами Какие бывают финансовые риски
Какие бывают финансовые риски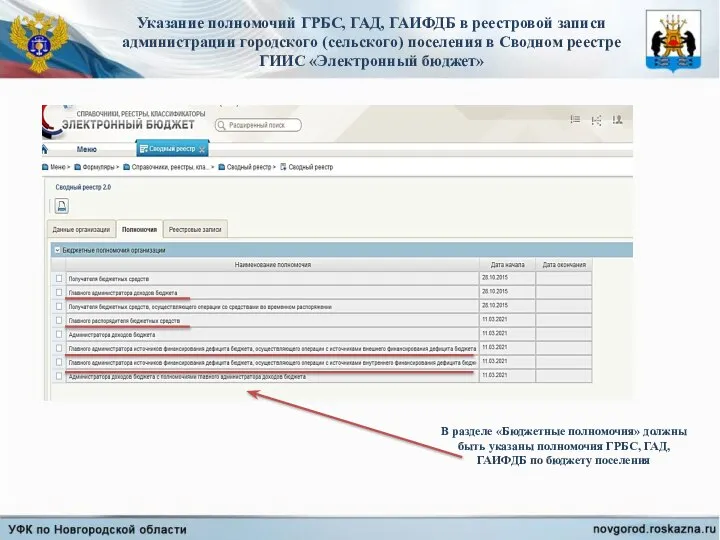 Полномочия ГРБС, ГАД, ГАИФДБ
Полномочия ГРБС, ГАД, ГАИФДБ Исполнение комплексного плана Совета ТОС «Правые Чемы» в 2011 году
Исполнение комплексного плана Совета ТОС «Правые Чемы» в 2011 году Пенопласт
Пенопласт Гуманитарная методология: прочтение, программа, профанация?
Гуманитарная методология: прочтение, программа, профанация?