Содержание
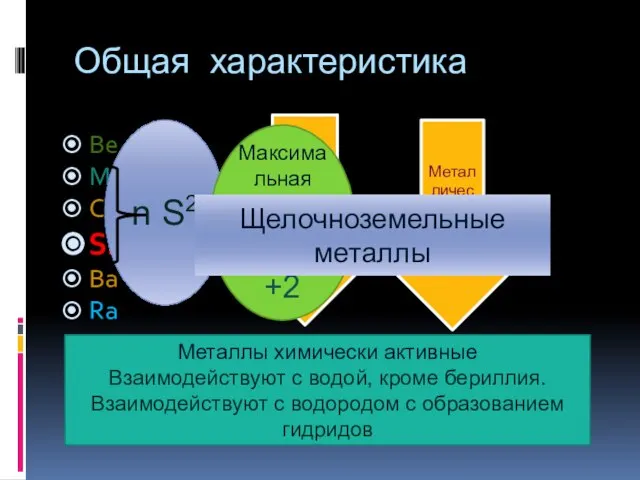
- 2. Общая характеристика Be Mg Ca Sr Ba Ra Радиус атома Металлические свойства n S2 Максимальная степень
- 3. ВНЕШНИЙ ВИД
- 4. Распространение в природе Среднее содержание Стронция в земной коре (кларк) 3,4·10-2% по массе, в геохимических процессах
- 5. Физические свойства При комнатной температуре решетка Стронция кубическая гранецентрированная (α-Sr) с периодом а = 6,0848Å; при
- 6. Химические свойства Конфигурация внешней электронной оболочки атома Sr 5s2; в соединениях обычно имеет степень окисления +2.
- 7. Химические свойства При нагревании на воздухе легко воспламеняется, а порошкообразный Стронций на воздухе самовозгорается, поэтому хранят
- 8. Химические свойства Из солей Стронция хорошо растворимы в воде галогениды (кроме фторида), нитрат, ацетат, хлорат; трудно
- 9. Получение Основным сырьем для получения соединений Стронция служат концентраты от обогащения целестина и стронцианита. Металлический Стронций
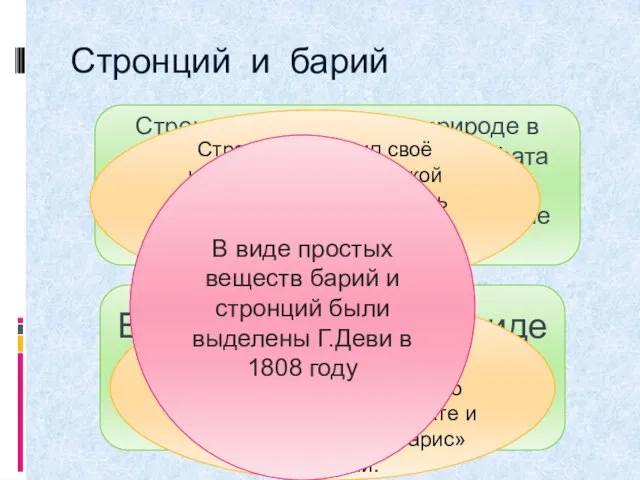
- 10. Стронций и барий Стронций встречается в природе в виде минерала целестина-сульфата стронция образующего красивые розово-красные или
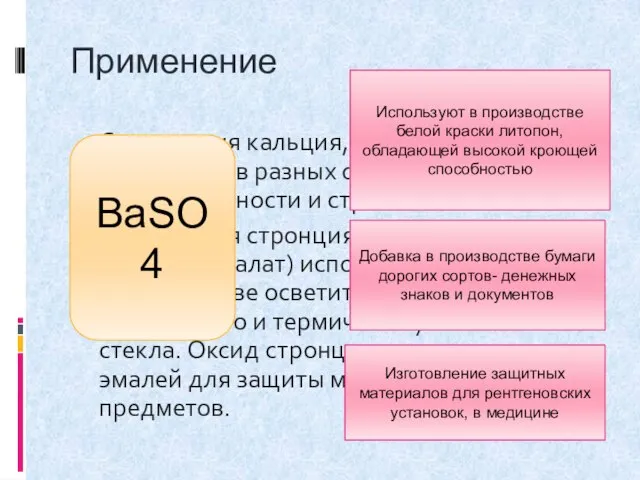
- 11. Применение Соединения кальция, стронция и бария применяют в разных отраслях промышленности и строительстве. Соединения стронция(нитрат, карбонат
- 13. Скачать презентацию







 Азбука в стихах
Азбука в стихах МДОУ детский сад № 6 «Буратино»
МДОУ детский сад № 6 «Буратино» Профессии. Швея
Профессии. Швея Технология обеспечения профориентационным минимумом учащихся школ города Краснодара
Технология обеспечения профориентационным минимумом учащихся школ города Краснодара Взаимодействие с Заказчиком
Взаимодействие с Заказчиком Федеральные государственные образовательные стандарты высшего профессионального образования в соответствии с принципами Болон
Федеральные государственные образовательные стандарты высшего профессионального образования в соответствии с принципами Болон ХУДОЖЕСТВЕННОЕ ОФОРМЛЕНИЕ МАГИЧЕСКИХ РИТУАЛОВ И ОБРЯДОВ
ХУДОЖЕСТВЕННОЕ ОФОРМЛЕНИЕ МАГИЧЕСКИХ РИТУАЛОВ И ОБРЯДОВ Внимание как познавательный процесс
Внимание как познавательный процесс Николай Алексеевич Заболоцкий 11 класс
Николай Алексеевич Заболоцкий 11 класс Аквариумные рыбки. Описание видов аквариумных рыб
Аквариумные рыбки. Описание видов аквариумных рыб Психические процессы
Психические процессы Food rap
Food rap Планирование и проектирование организаций. Бюджетирование
Планирование и проектирование организаций. Бюджетирование Что такое кровь? (окруж.мир 4 кл.)(Сложный ли это текст?) Надо ли это все помнить? (Нет – минимакс)
Что такое кровь? (окруж.мир 4 кл.)(Сложный ли это текст?) Надо ли это все помнить? (Нет – минимакс) Инновационные стеновые материалы
Инновационные стеновые материалы Изложение "Утренние лучи" 2 класс
Изложение "Утренние лучи" 2 класс Профессия «Дипломат».
Профессия «Дипломат». Государственное и муниципальное управление
Государственное и муниципальное управление Seasons
Seasons «Сушилка»
«Сушилка» МЕДИАКИТ | 2008-2009
МЕДИАКИТ | 2008-2009 Проверим домашнее задание!
Проверим домашнее задание! Изменение ненаследственное для нас несущественно. Чарльз Дарвин
Изменение ненаследственное для нас несущественно. Чарльз Дарвин Два мира, две судьбы
Два мира, две судьбы Научная электронная библиотека периодических изданий НАН Украины
Научная электронная библиотека периодических изданий НАН Украины Машины постоянного тока
Машины постоянного тока Внутренняя энергия
Внутренняя энергия Кулинарные жиры
Кулинарные жиры