Слайд 2ЦЕЛИ УРОКА:
ОЗНАКОМИТЬСЯ С О СТРОЕНИЕМ МОЛЕКУЛЫ ВОДЫ
РАССМОТРЕТЬ ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ
РАССМОТРЕТЬ

ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
Слайд 31. СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ.
МОЛЕКУЛА ВОДЫ СОСТОИТ ИЗ 2 АТОМОВ ВОДОРОДА И 1
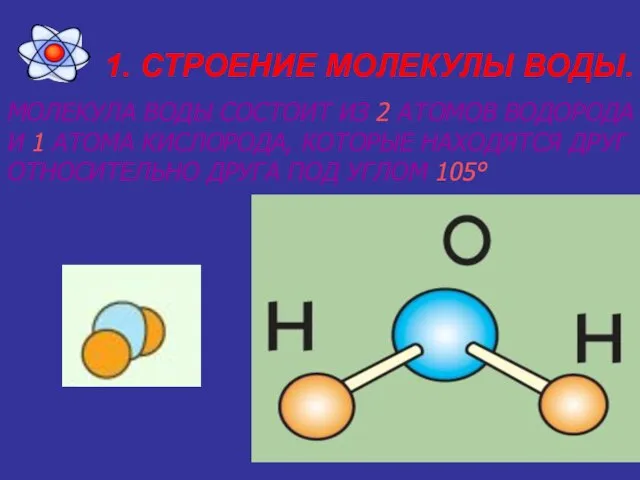
АТОМА КИСЛОРОДА, КОТОРЫЕ НАХОДЯТСЯ ДРУГ ОТНОСИТЕЛЬНО ДРУГА ПОД УГЛОМ 105°
Слайд 42. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ.
ЧИСТАЯ (ДИСТИЛЛИРОВАННАЯ) ВОДА – БЕСЦВЕТНАЯ ЖИДКОСТЬ, БЕЗ ЗАПАХА

И ВКУСА
ЕДИНСТВЕННОЕ ВЕЩЕСТВО, КОТОРОЕ НА ЗЕМЛЕ СУЩЕСТВУЕТ В ТРЕХ АГРЕГАТНЫХ СОСТОЯНИЯХ
ТЕМПЕРАТУРА КИПЕНИЯ 100°С
ТЕМПЕРАТУРА КРИСТАЛЛИЗАЦИИ (ПЛАВЛЕНИЯ) 0°С
Слайд 5 В XVIII ВЕКЕ ВОДА ПОСЛУЖИЛА ЭТАЛОНОМ ДЛЯ ВЫБОРА ЕДИНИЦЫ МАССЫ: МАССЕ

1 куб. см. БЫЛО ПРИПИСАНО ЗНАЧЕНИЕ 1г
МАКСИМАЛЬНАЯ ПЛОТНОСТЬ ПРИ 4°С ПРИНЯТА ЗА 1г/мл, ВСЕ ОСТАЛЬНЫЕ ВЕЩЕСТВА СРАВНИВАЮТСЯ ПО ПЛОТНОСТИ И МАССЕ С ВОДОЙ
ПЛОТНОСТЬ ЛЬДА МЕНЬШЕ, ЧЕМ У ЖИДКОЙ ВОДЫ, ЧТО ЯВЛЯЕТСЯ АНОМАЛЬНЫМ СВОЙСТВОМ ВОДЫ
ВОДА ОБЛАДАЕТ САМОЙ БОЛЬШОЙ ТЕПЛОЕМКОСТЬЮ
ОНА НЕ ПРОВОДИТ
ЭЛЕКТРИЧЕСКИЙ ТОК
Слайд 63. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ.
1. С МЕТАЛЛАМИ.
а) очень активные металлы при взаимодействии с
водой образуют гидроксид и водород
2Na + 2H2O = 2NaOH + H2
гидроксид натрия
2K + 2H2O = 2KOH + H2
гидроксид калия
Ca + 2H2O = Ca(OH)2 + H2
гидроксид кальция
Слайд 7б) средние по активности металлы при взаимодействии с водой при нагревании образуют

оксид металла и водород
Zn + H2O = ZnO + H2
оксид цинка
в) малоактивные металлы с водой
не реагируют
Слайд 82. С ОКСИДАМИ.
а) оксиды металлов при взаимодействии с водой образуют гидроксиды
CaO +

H2O = Ca(OH)2
гидроксид кальция
б) оксиды неметаллов при взаимодействии с водой образуют кислоты
SO3 + H2O = H2SO4
серная кислота
Слайд 9P2O5 + 3H2O = 2H3PO4
фосфорная кислота









 Лучший способ сделать детей хорошими – это сделать их счастливыми
Лучший способ сделать детей хорошими – это сделать их счастливыми Презентация на тему Cилы и средства ликвидации чрезвычайных ситуаций
Презентация на тему Cилы и средства ликвидации чрезвычайных ситуаций  Мудрые советы Лао Цзюня
Мудрые советы Лао Цзюня Новые функциональные возможности «1С:Управление торговлей 8» для решения оперативных задач специалистами торговых предприятий
Новые функциональные возможности «1С:Управление торговлей 8» для решения оперативных задач специалистами торговых предприятий ЧТО ТАКОЕ IELTS? www.studybady.comwww.studybady.com – полезная информация об обучении в Великобритании и получении студенческой визы www.studybady.comwww.studyba
ЧТО ТАКОЕ IELTS? www.studybady.comwww.studybady.com – полезная информация об обучении в Великобритании и получении студенческой визы www.studybady.comwww.studyba Наш друг компьютер
Наш друг компьютер Комплекс упражнений утренней гимнастики (1 класс)
Комплекс упражнений утренней гимнастики (1 класс) Личность и политик
Личность и политик «Времена не выбирают: в них живут и умирают…»
«Времена не выбирают: в них живут и умирают…» Целевой проектСпособный ребёнок
Целевой проектСпособный ребёнок Introduction to Management
Introduction to Management 23.04. uneployment
23.04. uneployment Е. Поплянова «Начинается урок»
Е. Поплянова «Начинается урок» Презентация на тему Роль учителя в современной школе
Презентация на тему Роль учителя в современной школе  Саргатская культурно- историческая общность
Саргатская культурно- историческая общность Гимнастика
Гимнастика портфолио воспитателя
портфолио воспитателя Национальные символы России
Национальные символы России Рейтинг застройщиков
Рейтинг застройщиков Буддизм
Буддизм Лаборатория 711, 713, 715. Планы. Долги
Лаборатория 711, 713, 715. Планы. Долги Презентация на тему Вторая война Рима с Карфагеном
Презентация на тему Вторая война Рима с Карфагеном  Ассортимент
Ассортимент Урок развития речи в 7 классеКомплексный анализ текста ”Памятник подлецу”
Урок развития речи в 7 классеКомплексный анализ текста ”Памятник подлецу” В стране веселого детства
В стране веселого детства Презентация на тему Наука и образование в Древней Греции
Презентация на тему Наука и образование в Древней Греции Роль имени прилагательного в речи.
Роль имени прилагательного в речи. Где обитают знаки препинания?
Где обитают знаки препинания?