Содержание
- 2. Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Различают
- 3. это связь, возникающая между атомами за счет образования общих электронных пар. По степени смещенности общих электронных
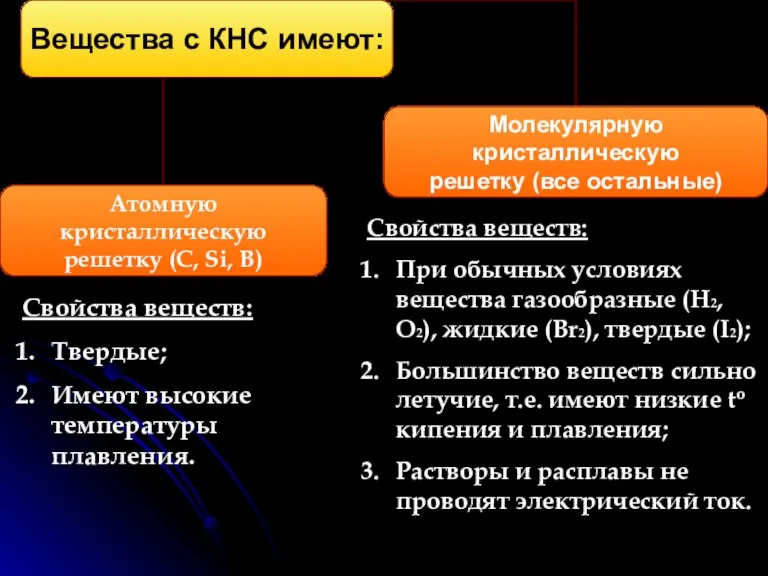
- 4. КНС образуют атомы одного и того же химического элемента. Механизм образования связи. Каждый атом неметалла отдает
- 5. Свойства веществ: Твердые; Имеют высокие температуры плавления. Свойства веществ: При обычных условиях вещества газообразные (H2, O2),
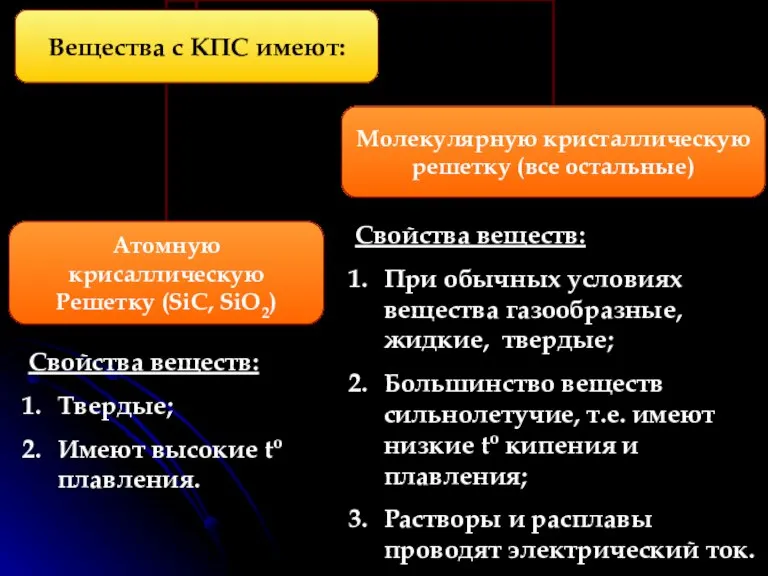
- 6. КПС образуют атомы разных неметаллов (с разной электороотрицательностью). Электроотрицательность (ЭО)- это свойство атомов одного элемента притягивать
- 7. Свойства веществ: При обычных условиях вещества газообразные, жидкие, твердые; Большинство веществ сильнолетучие, т.е. имеют низкие to
- 8. ИС образуется между атомами металлов и неметаллов, т.е. между атомами резко отличающимися друг от друга по
- 9. Свойства веществ: Все вещества при обычных условиях твердые. Имеют высокие температуры кипения и плавления. Расплавы и
- 10. Металлическая связь – связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов
- 11. Водородная связь – связь между атомами водорода одной молекулы и сильноотрицательными элементами (O, N, F) другой
- 13. Скачать презентацию








 Алгоритм презентации на защиту
Алгоритм презентации на защиту Современная киноиндустрия
Современная киноиндустрия Кто придумал ноль ?
Кто придумал ноль ? Направления деятельности изостудии Росинка
Направления деятельности изостудии Росинка Объединение Мир искусства. Часть 3
Объединение Мир искусства. Часть 3 Адаптация профессиональных спортсменов к выполнению предусмотренных нагрузок
Адаптация профессиональных спортсменов к выполнению предусмотренных нагрузок es-Persona индивидуальные заказы
es-Persona индивидуальные заказы Основы графической грамоты. Трудовое обучение
Основы графической грамоты. Трудовое обучение Установка разделения изотопов бора методом экстрактивной ректификации
Установка разделения изотопов бора методом экстрактивной ректификации Оценка уровня развития базовых способностей обучающихся
Оценка уровня развития базовых способностей обучающихся Презентация на тему Занятие по профориентации «Профессия - ветеринар»
Презентация на тему Занятие по профориентации «Профессия - ветеринар» История про маленьких лягушат….
История про маленьких лягушат…. Очистка и дезинфекция медицинских инструментов.
Очистка и дезинфекция медицинских инструментов. Особенности кредитно-модульной организации учебного процесса
Особенности кредитно-модульной организации учебного процесса Современные PLC телекоммуникации
Современные PLC телекоммуникации Здоровьесберегающие образовательные технологии на уроках английского языка
Здоровьесберегающие образовательные технологии на уроках английского языка Результаты инновационной работы педагогов ДОУ, представленных в СМИ 2011г.
Результаты инновационной работы педагогов ДОУ, представленных в СМИ 2011г. «Стабильный успех»
«Стабильный успех» Технологические среды в микроэлектронике. Газоподготовка в электронной технике
Технологические среды в микроэлектронике. Газоподготовка в электронной технике Я через 15 лет
Я через 15 лет The Golden Age
The Golden Age Машинные швы
Машинные швы РазработкаГосударственной Стратегии по развитию рынка трудадо 2020 года.
РазработкаГосударственной Стратегии по развитию рынка трудадо 2020 года. Криптосистемы с открытым ключем
Криптосистемы с открытым ключем Экскурсия в город Мастеров и Мастериц
Экскурсия в город Мастеров и Мастериц Битва за Днепр
Битва за Днепр Насилие в произведениях искусства
Насилие в произведениях искусства Страховая Компания «Согласие» является одной из крупнейших отечественных компаний, успешно работающей на Российском рынке страх
Страховая Компания «Согласие» является одной из крупнейших отечественных компаний, успешно работающей на Российском рынке страх