Содержание
- 2. Растворы – это… Растворитель – это… Растворенное вещество -
- 3. Пример: Вода – это растворитель, если растворить твердое вещество (глюкозу) или газ (СО2 ). - А
- 4. Концентрационный гомеостаз
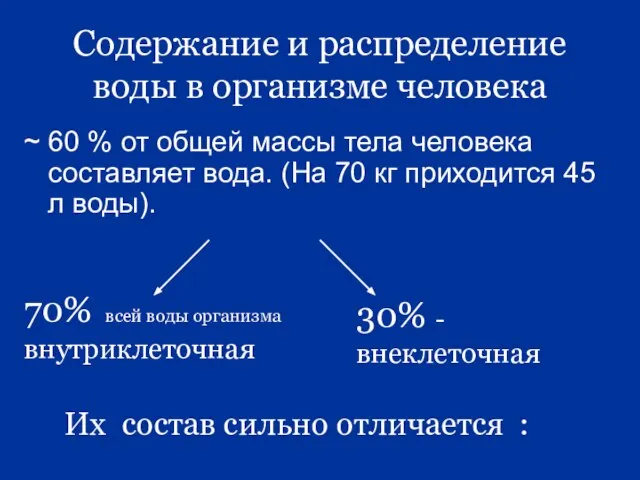
- 5. Содержание и распределение воды в организме человека ~ 60 % от общей массы тела человека составляет
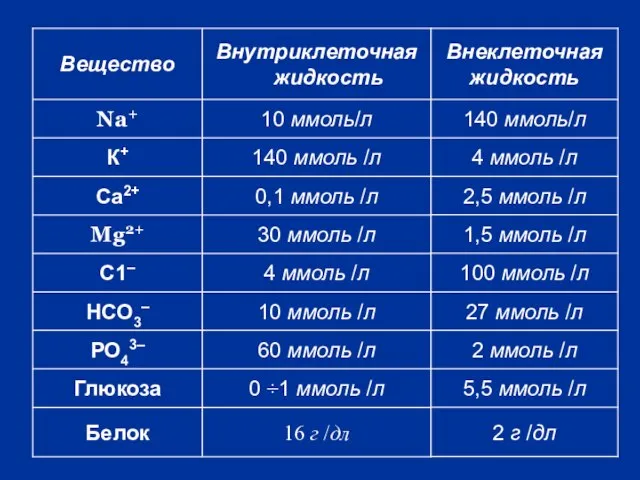
- 7. Внеклеточная жидкость (30%) Внутрисосудистая (7%) Межклеточная тканевая (23 %) Их состав почти одинаков, разница лишь в
- 8. В биохимических процессах вода выступает как : Растворитель Реагент Продукт реакции
- 9. 1. Вода- универсальный растворитель Существование межмолекулярных водородных связей определяет аномальные физические свойства воды: 1. Высокая теплоемкость
- 10. 2. Вода – реагент в биохимических реакциях кислотно-основных (автопротолиз воды) Н2О + Н2О ↔ Н3О+ +
- 11. 3. Вода- продукт биохимических реакций. 57 ккал/моль 2Н2+О2→ 2Н2О + Q Вывод: Н2О – универсальный растворитель,
- 12. «Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя не опишешь, тобой наслаждаешься, не
- 13. Термодинамика процесса растворения Растворение – процесс самопроизвольный, поэтому ∆Gрастворения ∆Gрастворения = ∆Н растворения –Т ∆Sрастворения
- 14. Энергетическая характеристика растворения ∆Н растворения = ∆Н фаз. перехода + ∆Н гидратации 1. Рассмотрим растворение твердого
- 15. 1. Если |∆Н ф. п. |> |∆Н гидр. |, то ∆Н растворения > 0, эндо-процесс, раствор
- 16. Энтропийная характеристика растворения ∆Sрастворения = ∆S фаз. перехода + ∆S гидратации >> 0 т.к. уменьшается число
- 17. 2. Рассмотрим растворение газообразного вещества в воде. Обычно ∆Sрастворения газов ∆Нрастворения=∆G растворения + Т ∆Sрастворения ∆Gраств.
- 18. Реальные и идеальные растворы Идеальные -… ∆Н р-ния = 0, ∆Gр-ния =– Т ∆Sр-ния ∆Sр-ния >0
- 19. Коллигативные свойства растворов осмотическое давление 2. понижение давления насыщенного пара растворителя над раствором по сравнению с
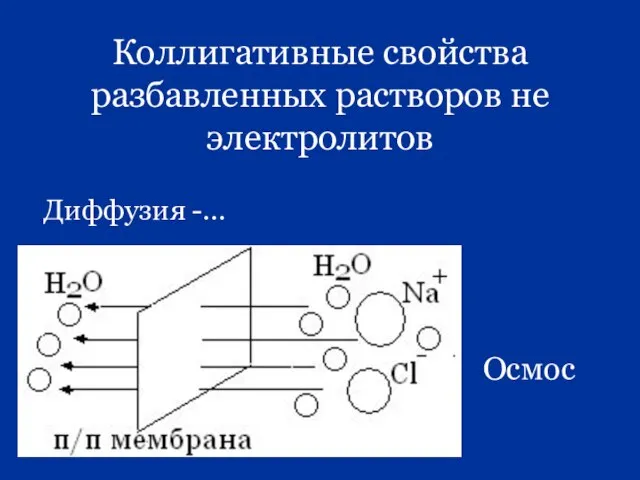
- 20. Коллигативные свойства разбавленных растворов не электролитов Диффузия -… Осмос
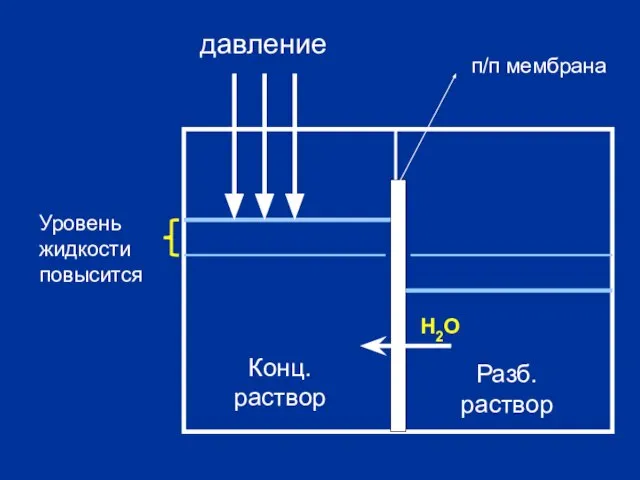
- 21. Конц. раствор Разб. раствор
- 22. В 1886 г. Вант-Гофф экспериментально установил, что Р осм. =СМRT – уравнение Вант-Гоффа. 1м3 = 1000
- 23. РVгаза= nRT уравнение Менделеева-Клапейрона.
- 24. Закон Вант-Гоффа: «Осмотическое давление раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно,
- 25. распределение воды между внутриклеточной жидкостью и внеклеточной распределение воды между сосудистым руслом и внесосудистым пространством. Осмос
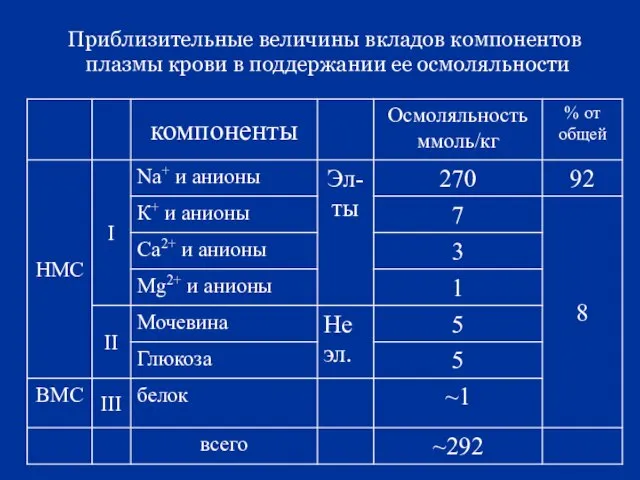
- 26. Для плазмы крови осмоляльность = 292 ммоль / кг. Она обусловлена: 1. низкомолекулярными веществами-электролитами: соли Na+,
- 27. Приблизительные величины вкладов компонентов плазмы крови в поддержании ее осмоляльности
- 28. форменные элементы крови на Росм. не влияют. Вывод: … Р осм. внутри и вне клетки одинаково,
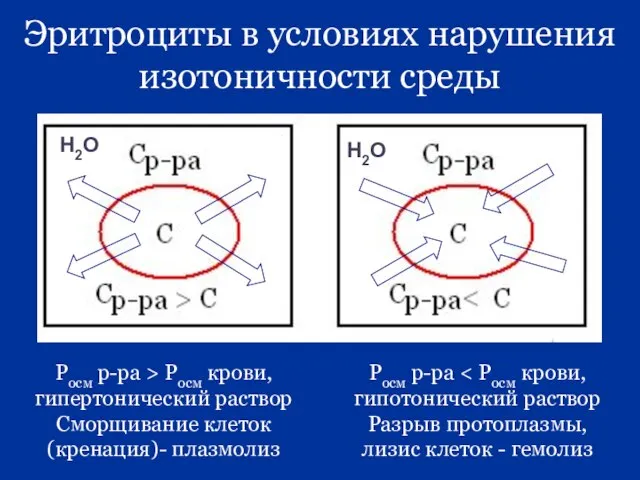
- 29. Эритроциты в условиях нарушения изотоничности среды Росм р-ра > Росм крови, гипертонический раствор Сморщивание клеток (кренация)-
- 30. Если раствор имеет Росм одинаковое с клеткой, то это изотонический раствор. При кровопотерях вводят растворы изотоничные
- 31. Распределение воды между сосудистым пространством и межтканевой жидкостью. Вывод… Онкотическое давление 0,5 %
- 32. II. Давление насыщенного пара растворителя испарение
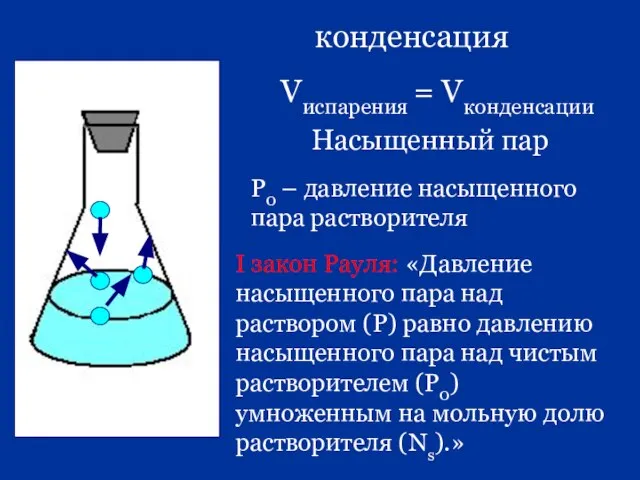
- 33. конденсация Vиспарения = Vконденсации Насыщенный пар Р0 – давление насыщенного пара растворителя I закон Рауля: «Давление
- 34. Р0 – Р = ΔР ; ΔР- абсолютное понижение давления насыщенного пара р-ля над р-ом Р
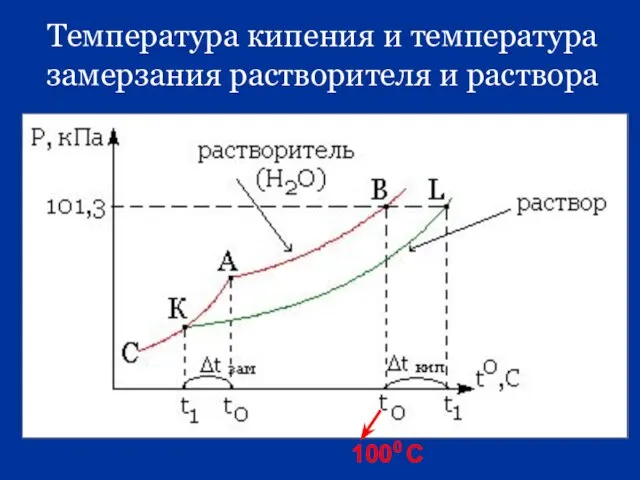
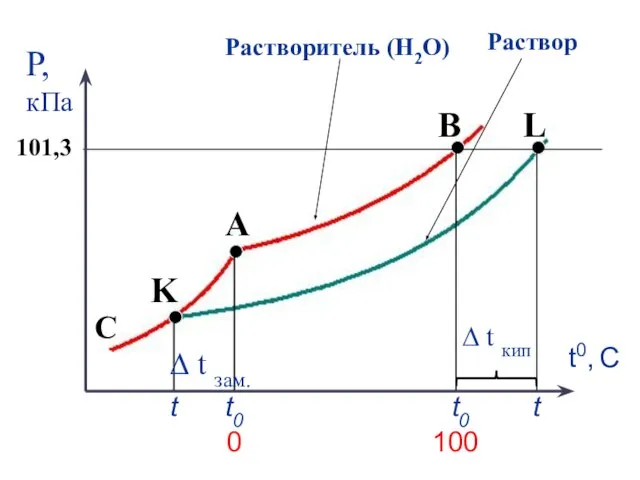
- 35. Температура кипения и температура замерзания растворителя и раствора
- 36. t0 t ∆ t кип t0 t ∆ t зам.
- 37. Е- эбулиоскопическая постоянная, К- криоскопическая постоянная, Сm- моляльность раствора. Для Н2О: Е= 0,53 кг⋅град / моль,
- 38. Криометрия, эбулиометрия
- 39. Коллигативные свойства разбавленных растворов электролитов Росм = См ⋅ R ⋅ T P = P0⋅ Ns
- 40. В 1887 г. Вант-Гофф ввел изотонический коэффициент – i (i>1) Росм = i ⋅ См ⋅
- 41. СН3СООН ↔ СН3СОО- + Н+ ; теор. i=2 практ. i =1,05 Степень диссоциации α Какова связь
- 42. (N - N⋅α) - число не распавшихся молекул (N⋅α⋅n + (N - N⋅α)) – общее число
- 43. С- исходная молярная концентрация кислоты, моль/л; α - степень диссоциации; С⋅α - число продиссоциировавших молекул; (С-
- 44. для слабых электролитов α→ 0 и (1- α) → 1, тогда закон разведения Оствальда (1888 г.)
- 45. Теория электролитической диссоциации (ТЭД) электролитов Аррениуса -это теория растворов слабых электролитов. Факторы, влияющие на α: 1.
- 46. 4. наличие одноименных ионов – принцип Ле-Шателье: а) НCl, H+, х.р.← , α ↓ б) СН3СООNa,
- 47. К дис. зависит: от природы электролита 2. от температуры: Т↑, Кдис ↑ Т.к. Кдис. ≠ f
- 48. Теория растворов сильных электролитов (1923 г, Дебай, Хюккель) 1. Сильные электролиты в водных растворах диссоциируют полностью,
- 49. Активность (а) – это … Для реальных растворов fa В сильно разбавленных растворах fa→ 1.
- 50. fa зависит от : 1. концентрации раствора а) С ↑, fa ↓ б) С → 0,
- 51. Ионная сила раствора (I) - … для разбавленных растворов Сm ~ Cм I биологических жидкостей, например
- 52. Для разбавленных растворов, в которых I ≤ 0,01: Предельный з-н Дебая-Хюккеля Для растворов электролитов одинаковозарядных (MgSO4):
- 53. Пример: Определить fa 0,001 М р-ра К2SO4.
- 54. Протонная теория кислот и оснований. Теория Бренстеда – Лоури (1923 г.) Основные положения : Кислота -
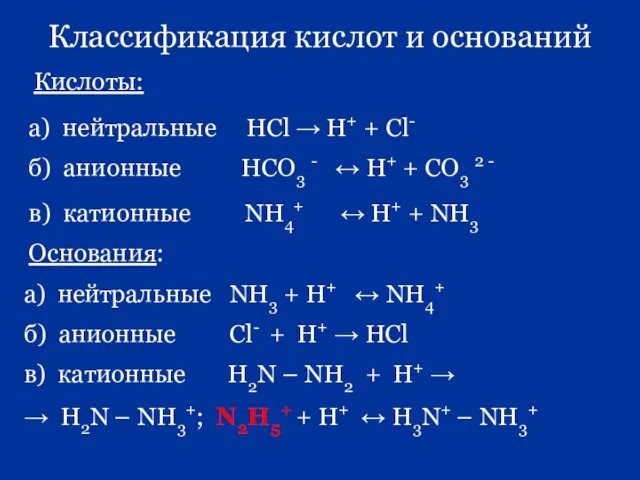
- 55. Классификация кислот и оснований Кислоты: а) нейтральные НCl → H+ + Cl- б) анионные HCO3 -
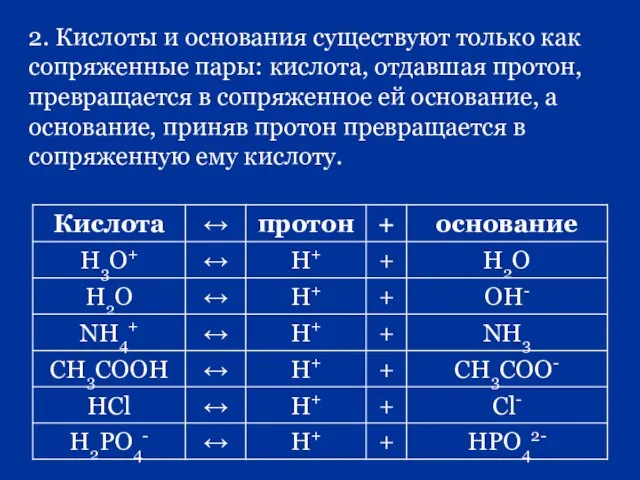
- 56. 2. Кислоты и основания существуют только как сопряженные пары: кислота, отдавшая протон, превращается в сопряженное ей
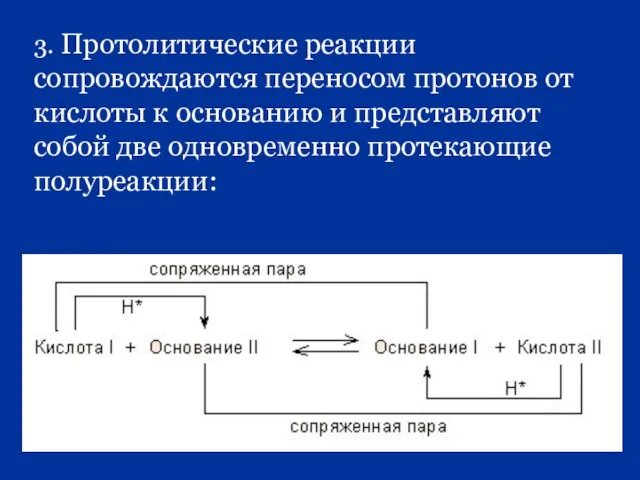
- 57. 3. Протолитические реакции сопровождаются переносом протонов от кислоты к основанию и представляют собой две одновременно протекающие
- 58. Типы протолитических реакций 1. нейтрализация 2. гидролиз 3. электролитическая диссоциация
- 59. 4. Кислотно-основные свойства вещество проявляет в конкретной химической реакции. В зависимости от партнера могут быть вещества
- 60. Сила кислот и оснований
- 61. Пример: СН4+Н+↔СН5+ в жестких условиях, но Кв (СН4) >10-20 , поэтому метан основанием не считают. Условно
- 62. Классификация растворителей 1. апротонные (нет Н+) : СS2, CCl4 и др. 2. протолитические : а) протогенные
- 63. Диссоциация воды. Нонное произведение воды. Н2О ↔ Н+ + ОН- Н+
- 64. (Н2О) =1,8 ⋅10-9 , это значит, что из 50 000 000 молекул распадается - 1
- 66. Водородный показатель (рН) 1909 г. Серенсен
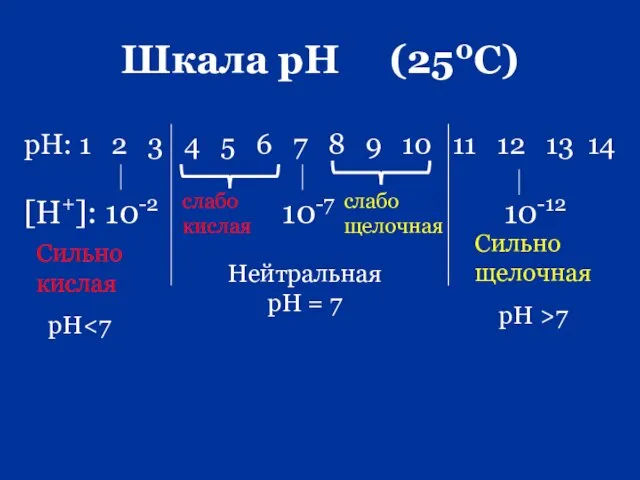
- 67. Шкала рН (250С)
- 68. Расчет рН растворов I. Сильных кислот и оснований fa ≈ 1
- 69. II. Слабых кислот и оснований
- 70. Если α неизвестно: [СН3СОО-]=[Н+]
- 71. Кислотность биологических жидкостей Общая кислотность -… Активная кислотность-… Потенциальная кислотность-…
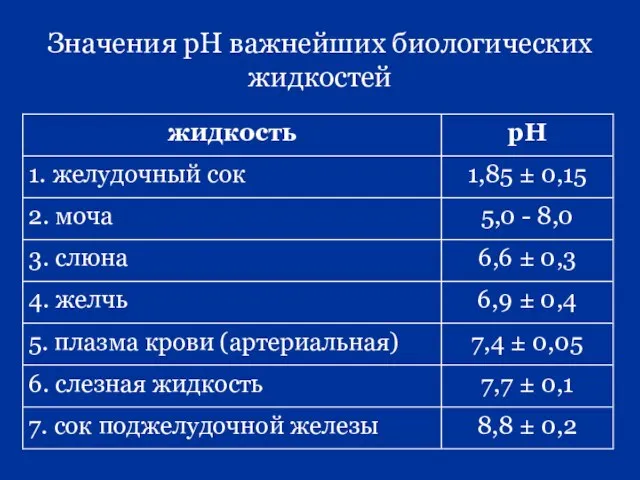
- 72. Значения рН важнейших биологических жидкостей
- 73. Буферные системы -…
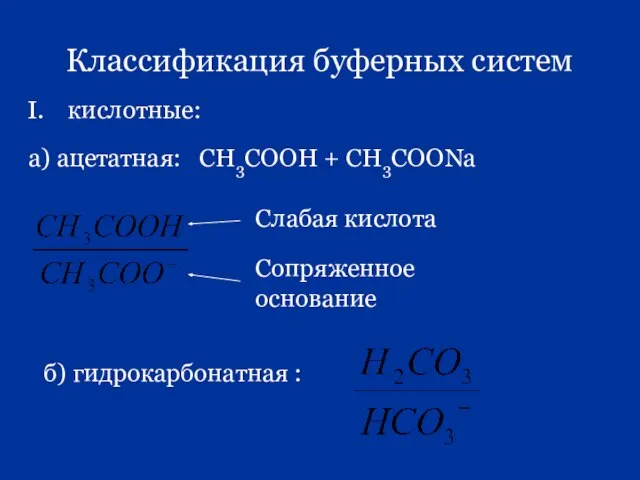
- 74. Классификация буферных систем I. кислотные: а) ацетатная: СН3СООН + СН3СООNa
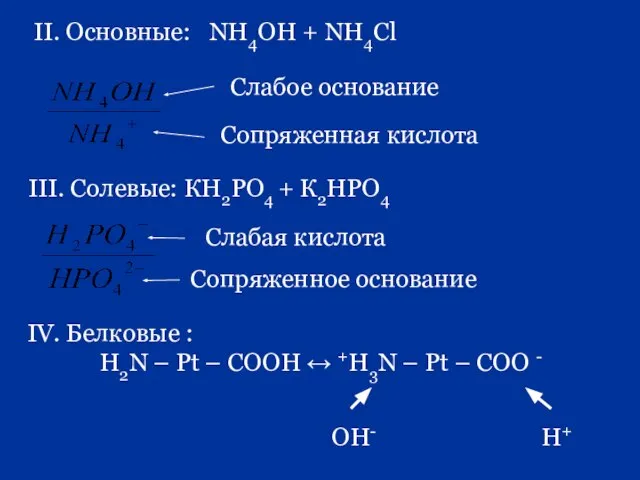
- 75. II. Основные: NH4OH + NH4Cl III. Солевые: КН2РО4 + К2НРО4
- 76. Расчет рН буферных систем СН3 СООН ↔ СН3 СОО- + Н+ (α→ 0) СН3 СООNa →
- 77. уравнение Гендерсона - Гассельбал(ь)ха
- 78. Буферная система устойчиво поддерживает рН раствора в пределах: рН = рК ± 1 для кислот; рН=
- 79. рН буферной системы зависит: - от величины рК (т.е. от Кд), а следовательно и от Т,
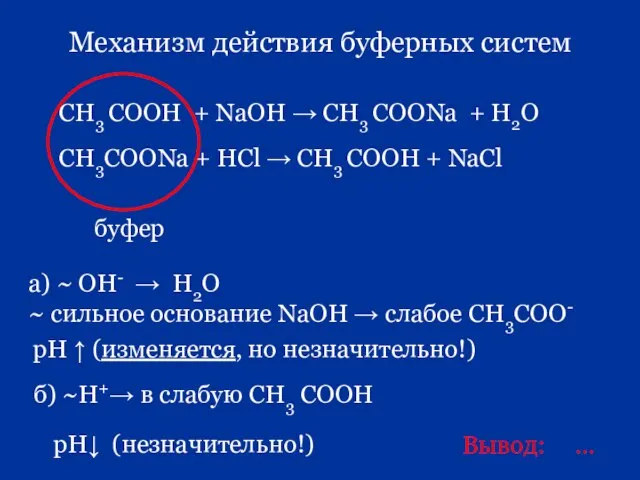
- 80. Механизм действия буферных систем а) ~ OH- → Н2О ~ сильное основание NaOH → слабое СН3СОО-
- 81. Буферная емкость
- 82. БЕ зависит: от абсолютных значений концентрации компонентов (влияет разбавление). При разбавлении раствора БЕ уменьшается! - от
- 83. Буферные системы крови Пределы изменения рН крови совместимые с жизнью 1. гидрокарбонатный буфер - 2. Белковый
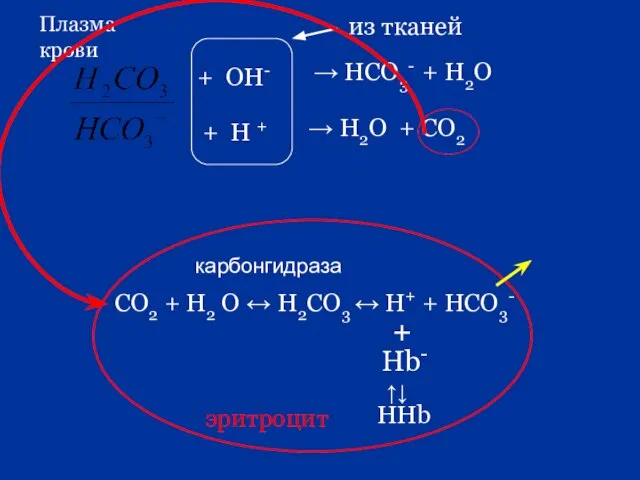
- 84. 4. Гемоглобиновая буферная система HHb + O2 ↔ HHbO2 Гемоглобиновый буфер HHb + OH - ↔
- 86. Растворимость газов Газ + жидкость ↔ нас. р-р газа растворимость газа (г/л) Парциальное давление газа -…
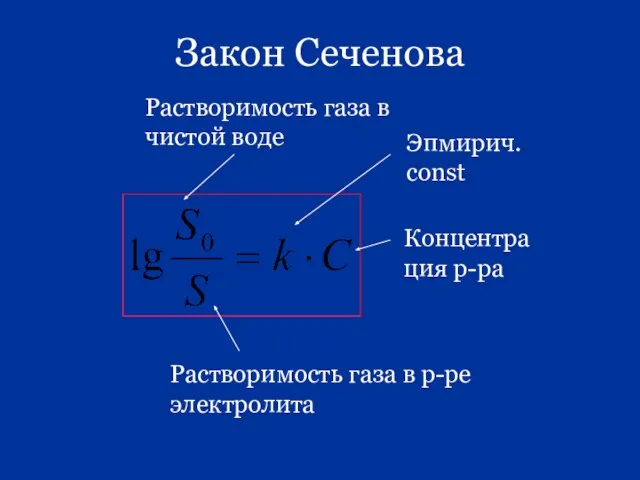
- 87. Закон Сеченова
- 90. Скачать презентацию






















































![Если α неизвестно: [СН3СОО-]=[Н+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/397949/slide-69.jpg)












 Учебный курсдля учащихся 4 классов
Учебный курсдля учащихся 4 классов Теории творчества и креативности
Теории творчества и креативности Русская трапеза
Русская трапеза ?
? Экслибрис. Задание по прикладной композиции
Экслибрис. Задание по прикладной композиции Большие гонки
Большие гонки Умники и умницы
Умники и умницы Презентация на тему Внешнее и внутреннее строение насекомого
Презентация на тему Внешнее и внутреннее строение насекомого Формула сайта:Успешный интернет-магазин от А до Я
Формула сайта:Успешный интернет-магазин от А до Я Управление Росприроднадзора по Свердловской области ОАО Уральский центр энергосбережения и экологии Сохранение и обустройство
Управление Росприроднадзора по Свердловской области ОАО Уральский центр энергосбережения и экологии Сохранение и обустройство  Основы тайм-менеджмента
Основы тайм-менеджмента Экслибрис – искусство книжного знака
Экслибрис – искусство книжного знака Securities fraud
Securities fraud Цикл менеджмента. Планирование
Цикл менеджмента. Планирование История возникновения логарифмов
История возникновения логарифмов Was ist in Deutschland
Was ist in Deutschland  Особенности делового этикета в Японии
Особенности делового этикета в Японии Социально-значимая деятельность школьников
Социально-значимая деятельность школьников Добро пожаловать в наш Педагогический колледж! Университетский Педагогический колледж №16 – это авторитетное, современное, дина
Добро пожаловать в наш Педагогический колледж! Университетский Педагогический колледж №16 – это авторитетное, современное, дина Управление проектами Тема 1 – введение в управление проектами Проф., д.т.н. А.А. Дульзон
Управление проектами Тема 1 – введение в управление проектами Проф., д.т.н. А.А. Дульзон Метапредметный подход при преподавании математики: использование технологии метапредмета «Задача»
Метапредметный подход при преподавании математики: использование технологии метапредмета «Задача» Питание и органы пищеварения
Питание и органы пищеварения Презентация на тему Конструирование текстов, предложений (2 класс)
Презентация на тему Конструирование текстов, предложений (2 класс) Божественный идеал в религиях мира (Буддизм)
Божественный идеал в религиях мира (Буддизм) Организация и проведение мероприятий направленных на привлечение детей занятиями лыжным спортом
Организация и проведение мероприятий направленных на привлечение детей занятиями лыжным спортом Совы
Совы Вглядываясь в человека. Портрет
Вглядываясь в человека. Портрет Визитная карточка начальной школы ГУО «Гимназия №20 г.Минска»
Визитная карточка начальной школы ГУО «Гимназия №20 г.Минска»