Слайд 2план
НЕКОТОРЫЕ ИСТОРИЧЕСКИЕ СВЕДЕНИЯ
КТО ТАКОЕ УЛ?
ЧТО ДОЛЖНО ЗНАТЬ УЛ?
ФУНКЦИИ И

ОБЯЗАННОСТИ УЛ
ОТВЕТСТВЕННОСТЬ УЛ
ПРАВА УЛ
ЗАЧЕМ И КОМУ НЕОБХОДИМО УЛ?
КТО МОЖЕТ БЫТЬ УЛ?
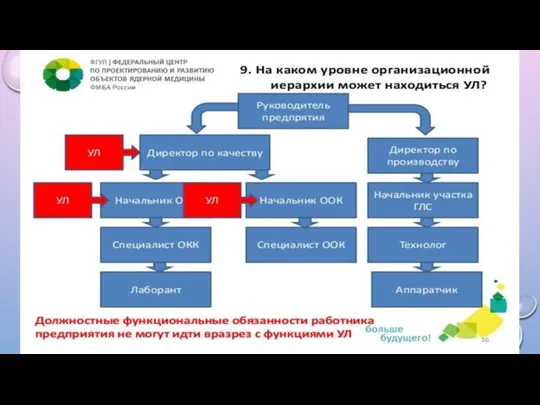
НА КАКОМ УРОВНЕ ОРГАНИЗАЦИОННОЙ ИЕРАРХИИ МОЖЕТ НАХОДИТЬСЯ УЛ?
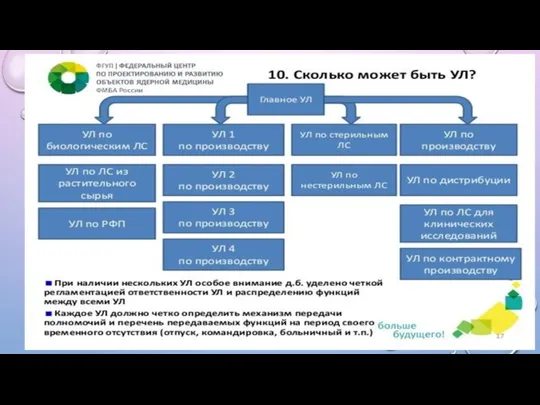
СКОЛЬКО МОЖЕТ БЫТЬ УЛ?
ЧТО ТАКОЕ КОДЕКС УЛ?
ЕВРОПЕЙСКИЙ ОПЫТ
КАКОВА ОНА СУРОВАЯ ОТЕЧЕСТВЕННАЯ ДЕЙСТВИТЕЛЬНОСТЬ?
Слайд 3Некоторые исторические сведения
1. ТРАДИЦИОННО, В НЕКОТОРЫХ ЗАПАДНЫХ СТРАНАХ (НАПРИМЕР, ВО ФРАНЦИИ,

ГЕРМАНИИ) СУЩЕСТВОВАЛА ПРАКТИКА ВОЗЛАГАТЬ ОТВЕТСТВЕННОСТЬ ЗА КАЧЕСТВО НА ТАК НАЗЫВАЕМЫХ «ОТВЕТСТВЕННЫХ ФАРМАЦЕВТОВ»
2. В 70-Х ГОДАХ ПРОШЛОГО ВЕКА С ВОЗНИКНОВЕНИЕМ ПРАВИЛ GMP ВОЗНИКЛА КОНЦЕПЦИЯ QP (QUALIFIED PERSON), ОБЕСПЕЧИВАЮЩАЯ ПРИНЦИП НЕЗАВИСИМОСТИ СЛУЖБЫ КАЧЕСТВА ОТ ПРОИЗВОДСТВА
3. СЕГОДНЯ УПОЛНОМОЧЕННОЕ ЛИЦО ОТНОСИТСЯ К КЛЮЧЕВОМУ ПЕРСОНАЛУ НА ПРЕДПРИЯТИИ И ТОЛЬКО ПО ЕГО РЕШЕНИЮ ВОЗМОЖНА РЕАЛИЗАЦИЯ СЕРИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Слайд 4Кто такое УЛ?
2. НОРМАТИВНОЕ ДОКУМЕНТЫ В КОТОРЫХ ОПИСЫВАЮТСЯ ТРЕБОВАНИЯ К УЛ

GMP ВОЗ. WHO/PHARM/96/588 – НАДЛЕЖАЩАЯ ПРОИЗВОДСТВЕННАЯ ПРАКТИКА: УПОЛНОМОЧЕННЫЕ ЛИЦА – ИХ РОЛЬ, ФУНКЦИИ И ПОДГОТОВКА
ЗАКОН РЕСПУБЛИКИ КАЗАХСТАН О ЛЕКАРСТВЕННЫХ СРЕДСТВАХ
ГОСТ Р 52249-2009 «ПРАВИЛА ПРОИЗВОДСТВА И КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ» 4
Слайд 5Что должно знать УЛ?
ЗНАНИЕ НОРМАТИВНОЙ ДОКУМЕНТАЦИИ
1) ЗАКОН РЕСПУБЛИКИ КАЗАХСТАН О

ЛЕКАРСТВЕННЫХ СРЕДСТВАХ
2) ГОСУДАРСТВЕННУЮ ФАРМАКОПЕЮ
3) ГОСТ Р 52249-2009 «ПРАВИЛА ПРОИЗВОДСТВА И КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ» GMP
4) РЕГИСТРАЦИОННОЕ ДОСЬЕ НА КАЖДОЕ ЛС
5) ЛИЦЕНЗИОННЫЕ ТРЕБОВАНИЯ НА ПРАВО ПРОИЗВОДСТВА (ТОРГОВАЯ ЛИЦЕНЗИЯ).
6) НОРМАТИВНЫЕ ДОКУМЕНТЫ УТВЕРЖДЕННЫЕ МИНЗДРАВОМ РК
Слайд 6Что должно знать УЛ?
ДОПОЛНИТЕЛЬНЫЕ ЗНАНИЯ В ОТНОШЕНИИ:
1) ФУНКЦИОНИРОВАНИЯ СИСТЕМЫ ФАРМАКОНАДЗОРА

2) МЕТОДОЛОГИИ УПРАВЛЕНИЯ РИСКАМИ ПО КАЧЕСТВУ, БИОЗАГРЯЗНЕНИЙ И Т.П.
3) ОСНОВНЫХ МЕР ПО ПРЕДОТВРАЩЕНИЮ ПЕРЕКРЕСТНОГО И МИКРОБНОГО ЗАГРЯЗНЕНИЯ, ОРГАНИЗАЦИИ ТЕКУЩЕГО КОНТРОЛЯ ЧИСТЫХ ПОМЕЩЕНИЙ
4) ПРОЦЕДУР ГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИ ЛС И ВНЕСЕНИЯ ИЗМЕНЕНИЙ ДЛЯ ВСЕХ СТРАН-ИМПОРТЕРОВ, В КОТОРЫЕ ЭКСПОРТИРУЕТСЯ ПРОДУКЦИЯ ПРЕДПРИЯТИЯ
5) БИОДОСТУПНОСТИ И БИОЭКВИВАЛЕНТНОСТИ ЛС, ОРГАНИЗАЦИИ И СОПРОВОЖДЕНИЯ КЛИНИЧЕСКИХ ИСПЫТАНИЙ
6) ПРОЦЕССНЫЙ ПОДХОД С ИСО 9001, ICH Q10
7) СИСТЕМЫ УПРАВЛЕНИЯ ПОСТАВЩИКАМИ ИСХОДНОГО СЫРЬЯ И УПАКОВОЧНЫХ МАТЕРИАЛОВ
Слайд 7Функции и обязанности УЛ Часть
. П. 2.4 ГОСТ Р 52249-2009 ГЛАСИТ:

1) В ОТНОШЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ВЫПУЩЕННЫХ В РФ, УЛ ДОЛЖНО ГАРАНТИРОВАТЬ, ЧТО КАЖДАЯ СЕРИЯ ПРОДУКЦИИ БЫЛА ИЗГОТОВЛЕНА И ПРОВЕРЕНА В СООТВЕТСТВИИ С УСТАНОВЛЕННЫМИ ТРЕБОВАНИЯМИ
2) В ОТНОШЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ВЫПУЩЕННЫХ ЗА ПРЕДЕЛАМИ РФ, УЛ ДОЛЖНО ГАРАНТИРОВАТЬ, ЧТО ИМПОРТИРУЕМАЯ СЕРИЯ ПРОДУКЦИИ ПРОШЛА ПРОВЕРКУ В ПОРЯДКЕ С УСТАНОВЛЕННЫМ В РФ
3) ДО ВЫДАЧИ РАЗРЕШЕНИЯ НА ВЫПУСК ЛС В СФЕРУ ОБРАЩЕНИЯ УЛ ДОЛЖНО ДОКУМЕНТАЛЬНО ПОДТВЕРДИТЬ, ЧТО КАЖДАЯ СЕРИЯ ПРОДУКЦИИ УДОВЛЕТВОРЯЕТ ТРЕБОВАНИЯМ УСТАНОВЛЕННЫМ ПРИ ГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИ
Слайд 8Функции и обязанности УЛ
ОБЯЗАННОСТИ ПО ГАРАНТИРОВАНИЮ КАЧЕСТВА ГОТОВОЙ ПРОДУКЦИИ ПРИ ЕЁ

СЕРТИФИКАЦИИ (ПАСПОРТИЗАЦИИ). УЛ ДОЛЖНО:
УДОСТОВЕРИТЬСЯ, ЧТО СЕРИЯ ЛС СООТВЕТСТВУЕТ РЕГИСТРАЦИОННОМУ ДОСЬЕ И ЛИЦЕНЗИИ НА ПРОИЗВОДСТВО
УДОСТОВЕРИТЬСЯ В ВЫПОЛНЕНИИ ПРИНЦИПОВ И ПРАВИЛ GMP ПРИ ПРОИЗВОДСТВЕ И КОНТРОЛЕ КАЧЕСТВА
УДОСТОВЕРИТЬСЯ, ЧТО ВСЕ РАБОТЫ ПО ПРОИЗВОДСТВУ СЕРИИ, ЕЁ КОНТРОЛЮ И ОЦЕНКЕ ДОСЬЕ СЕРИИ ВЫПОЛНЕНЫ КОМПЕТЕНТНЫМ ПЕРСОНАЛОМ
УДОСТОВЕРИТЬСЯ В ПРОВЕДЕНИИ ВАЛИДАЦИИ ТЕХНОЛОГИЧЕСКОГО ОБОРУДОВАНИЯ, ИНЖЕНЕРНЫХ СИСТЕМ, ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ, МЕТОДИК КОНТРОЛЯ КАЧЕСТВА И ПР.
УДОСТОВЕРИТЬСЯ, ЧТО ВСЕ ВЫЯВЛЕННЫЕ ОТКЛОНЕНИЯ НЕ ПОВЛИЯЮТ НА КАЧЕСТВО ЛС
УДОСТОВЕРИТЬСЯ, ЧТО ИМЕЕТСЯ ВСЯ НЕОБХОДИМАЯ ПЕРВИЧНАЯ ДОКУМЕНТАЦИЯ ОТНОСИТЕЛЬНО ПРОИЗВОДСТВА И КОНТРОЛЯ КАЧЕСТВА
ВЫДАТЬ РАЗРЕШЕНИЕ НА ВЫПУСК ЛС В ГРАЖДАНСКИЙ ОБОРОТ, ЛИБО ЗАПРЕТИТЬ ВЫПУСК ЛС
Слайд 9Функции и обязанности УЛ Обязанности связанные с обеспечением качества
ПРИНИМАТЬ РЕШЕНИЕ

О НАЧАЛЕ ПРОЦЕДУРЫ ОТЗЫВА ОПРЕДЕЛЕННЫХ СЕРИЙ ЛС УЧАСТВОВАТЬ В РАБОТЕ ПО: АНАЛИЗУ РЕКЛАМАЦИЙ И ЖАЛОБ, ИЗУЧЕНИЮ ВОЗМОЖНЫХ ПРИЧИН ИХ ВОЗНИКНОВЕНИЯ; НАРУШЕНИЮ ТЕХНОЛОГИИ ПРОИЗВОДСТВА; УХУДШЕНИЮ КАЧЕСТВА РАБОТ И ПР.
СОГЛАСОВАНИЕ ВСЕХ ПРОЕКТОВ НОРМАТИВНО-ТЕХНИЧЕСКОЙ ДОКУМЕНТАЦИИ НА ПРОИЗВОДСТВО ЛС
СОГЛАСОВАНИЕ ПЛАНЫ И ПРОЕКТЫ ОТНОСИТЕЛЬНО РЕКОНСТРУКЦИИ ПРОИЗВОДСТВЕННЫХ И СКЛАДСКИХ ПОМЕЩЕНИЙ, ТЕХНИЧЕСКОГО ПЕРЕОСНАЩЕНИЯ ПРОИЗВОДСТВА И ЛАБОРАТОРИИ КОНТРОЛЯ КАЧЕСТВА
АНАЛИЗИРОВАТЬ И ВИЗИРОВАТЬ КОНТРАКТЫ НА: ЗАКУПКУ ТЕХНОЛОГИЧЕСКОГО И ВСПОМОГАТЕЛЬНОГО ОБОРУДОВАНИЯ; КОНТРОЛЬНО-АНАЛИТИЧЕСКИХ ПРИБОРОВ И СРЕДСТВ ИЗМЕРЕНИЯ
СОГЛАСОВЫВАТЬ ПОСТАВЩИКОВ ОСНОВНОГО СЫРЬЯ И МАТЕРИАЛОВ
СОГЛАСОВЫВАТЬ ИЗМЕНЕНИЯ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССАХ, СПЕЦИФИКАЦИЙ КОНТРОЛЯ КАЧЕСТВА, ПРОЦЕДУР ОЧИСТКИ И ПР.
ПРЕДСТАВЛЯТЬ ИНТЕРЕСЫ ПРЕДПРИЯТИЯ В ВОПРОСАХ КАЧЕСТВА В ГОСУДАРСТВЕННЫХ УПОЛНОМОЧЕННЫХ ОРГАНАХ, ОКАЗЫВАТЬ ПОМОЩЬ ГОСУДАРСТВЕННЫМ ИНСПЕКТОРАМ ПО GMP ВО ВРЕМЯ ИНСПЕКЦИЙ И ПР.
РАССМАТРИВАТЬ ДОКУМЕНТАЦИЮ ПО ОБЕСПЕЧЕНИЮ КАЧЕСТВА (ВАЛИДАЦИИ, САМОИНСПЕКЦИИ, АУДИТУ ПОСТАВЩИКОВ, ОБУЧЕНИЮ ПЕРСОНАЛА И ПР.)
Слайд 10Ответственность УЛ
ГАРАНТИРОВАНИЕ ТОГО, ЧТО КАЖДАЯ СЕРИЯ ГОТОВОЙ ПРОДУКЦИИ БЫЛА ИЗГОТОВЛЕНА ПО

УТВЕРЖДЕННЫМ ДОКУМЕНТАМ РЕГИСТРАЦИОННОГО ДОСЬЕ, ПРАВИЛАМИ GMP И ДЕЙСТВУЮЩИМИ НА ТО ВРЕМЯ НОРМАТИВНЫМИ И АДМИНИСТРАТИВНЫМИ ДОКУМЕНТАМИ
ОБЪЕКТИВНОСТЬ СОБСТВЕННЫХ РЕШЕНИЙ, КОТОРЫЕ ПРИНИМАЮТСЯ
ДОСТОВЕРНОСТЬ И ПОЛНОТУ СОБСТВЕННОЙ РАБОТЫ
СОБЛЮДЕНИЯ КОНФИДЕНЦИАЛЬНОСТИ ИНФОРМАЦИИ, ПОЛУЧЕННОЙ ВО ВРЕМЯ ВЫПОЛНЕНИЯ СОБСТВЕННЫХ ОБЯЗАННОСТЕЙ
СОБЛЮДЕНИЯ КОДЕКСА ПОВЕДЕНИЯ
Слайд 11Права УЛ имеет право:
ЗАПРЕЩАТЬ ВЫПУСК ЛЕКАРСТВЕННЫХ СРЕДСТВ В ГРАЖДАНСКИЙ ОБОРОТ В

СЛУЧАЕ НЕСООТВЕТСТВИЯ ИХ РЕГИСТРАЦИОННОМУ ДОСЬЕ И ПРАВИЛАМ GMP
ОТМЕНЫ ИЛИ ПРИОСТАНОВКИ РАСПОРЯЖЕНИЙ РУКОВОДИТЕЛЕЙ СТРУКТУРНЫХ ПОДРАЗДЕЛЕНИЙ В СЛУЧАЕ КРИТИЧЕСКОГО НЕСООТВЕТСТВИЯ ТРЕБОВАНИЯМ НОРМАТИВНОЙ ДОКУМЕНТАЦИИ ИЛИ ДРУГОГО РИСКА ВЫПУСКА НЕКАЧЕСТВЕННОЙ ИЛИ ОПАСНОЙ ПРОДУКЦИИ
БЕСПРЕПЯТСТВЕННОГО И ПОСТОЯННОГО ДОСТУПА К РУКОВОДИТЕЛЮ ПРЕДПРИЯТИЯ И ЕГО ЗАМЕСТИТЕЛЯМ ПО ВОПРОСАМ КАСАЮЩИМСЯ ФУНКЦИОНИРОВАНИЯ СИСТЕМЫ КАЧЕСТВА И КАЧЕСТВА ПРОДУКЦИИ, КОТОРАЯ ВЫПУСКАЕТСЯ
БЕСПРЕПЯТСТВЕННО ПРОВОДИТЬ ОСМОТР ЛЮБЫХ ПРОИЗВОДСТВЕННЫХ И СКЛАДСКИХ ЗОН, ЛАБОРАТОРИЙ КОНТРОЛЯ КАЧЕСТВА С УЧЕТОМ РЕЖИМА РАБОТЫ И ПРАВИЛ
НА БЕСПРЕПЯТСТВЕННЫЙ ДОСТУП КО ВСЕЙ НОРМАТИВНОЙ И ОТЧЕТНОЙ ДОКУМЕНТАЦИИ ПРЕДПРИЯТИЯ, СВЯЗАННОЙ С СИСТЕМОЙ КАЧЕСТВА И КАЧЕСТВА ГОТОВОЙ ПРОДУКЦИЕЙ
ПРИОСТАНАВЛИВАТЬ РАБОТУ ЛЮБОГО ПЕРСОНАЛА, КОТОРАЯ ПРОВОДИТЬСЯ С ГРУБЫМИ (КРИТИЧЕСКИМИ) НАРУШЕНИЯМИ ТРЕБОВАНИЙ ДОКУМЕНТАЦИИ
ИНИЦИИРОВАТЬ ПРОВЕДЕНИЕ ВНЕПЛАНОВЫХ САМОИНСПЕКЦИЙ
ИНИЦИИРОВАТЬ ПРОВЕДЕНИЕ ВНЕПЛАНОВОЙ ВАЛИДАЦИИ
ОТКАЗЫВАТЬСЯ ОТ ВЫПОЛНЕНИЯ ОБЯЗАННОСТЕЙ, ПРИ ПОПЫТКАХ АДМИНИСТРАТИВНОГО ДАВЛЕНИЯ СО СТОРОНЫ РУКОВОДСТВА ПРЕДПРИЯТИЯ НА ОБЪЕКТИВНОСТЬ И/ИЛИ ДОСТОВЕРНОСТЬ ВЫВОДОВ ПО РЕЗУЛЬТАТАМ РАБОТЫ
Слайд 12Зачем и кому необходимо УЛ?
НАЛИЧИЕ НА ФАРМАЦЕВТИЧЕСКОМ ПРЕДПРИЯТИИ УЛ ЯВЛЯЕТСЯ

ТРЕБОВАНИЕ ФЗ «ОБ ОБРАЩЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ» И GMP
ПРИСУТСТВИЕ УЛ ЯВЛЯЕТСЯ ГАРАНТИЕЙ ТОГО, ЧТО КАЖДАЯ СЕРИЯ ЛС ПРОИЗВОДИТСЯ И ПРОХОДИТ КОНТРОЛЬ В СООТВЕТСТВИИ С ЗАЯВЛЕННЫМ РЕГИСТРАЦИОННОМ ДОСЬЕ НА ЛС И ПРАВИЛАМИ GMP
ПРИ ОТЗЫВЕ ЛС С РЫНКА УЛ, ОТВЕЧАЮЩЕЕ ЗА ВЫПУСК ТАКОГО ЛС, МОЖЕТ БЫТЬ СРАЗУ ЖЕ ИДЕНТИФИЦИРОВАНО
Слайд 13Кто может быть УЛ?
«ОБ ОБРАЩЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ» ГЛАСИТ:
РАБОТНИК ПРОИЗВОДИТЕЛЯ ЛЕКАРСТВЕННЫХ

СРЕДСТВ
ИМЕЮЩИЙ ВЫСШЕЕ ФАРМАЦЕВТИЧЕСКОЕ, ХИМИЧЕСКОЕ ИЛИ БИОЛОГИЧЕСКОЕ ОБРАЗОВАНИЕ
СТАЖ РАБОТЫ НЕ МЕНЕЕ ЧЕМ ПЯТЬ ЛЕТ В ОБЛАСТИ ПРОИЗВОДСТВА И КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
АТТЕСТОВАННЫЙ В ПОРЯДКЕ, УСТАНОВЛЕННОМ УПОЛНОМОЧЕННЫМ ФЕДЕРАЛЬНЫМ ОРГАНОМ ИСПОЛНИТЕЛЬНОЙ ВЛАСТИ
СТАЖ РАБОТЫ НА РУКОВОДЯЩИХ ДОЛЖНОСТЯХ ФАРМАЦЕВТИЧЕСКОГО ПРОИЗВОДСТВА
НАЛИЧИЕ ПОДТВЕРЖДЕННЫХ ЗНАНИЙ ПО ПРОИЗВОДСТВУ И КОНТРОЛЮ КАЧЕСТВА ЛЕКАРСТВЕННЫХ ФОРМ, В КОТОРЫХ СЕРТИФИЦИРУЕТСЯ СЕРИИ ПРОДУКЦИИ ПРЕДПРИЯТИЯ
Слайд 16. Что такое кодекс УЛ?
ПРОФЕССИОНАЛЬНЫЙ КОДЕКС УЛ ОПРЕДЕЛЯЕТ ОСНОВНЫЕ ПРИНЦИПЫ

И ЭТИЧЕСКИЕ НОРМЫ ПРОФЕССИОНАЛЬНОЙ ОТВЕТСТВЕННОСТИ И ПОВЕДЕНИЯ УЛ ФАРМАЦЕВТИЧЕСКИХ ПРЕДПРИЯТИЙ
КОДЕКС ПРЕДНАЗНАЧЕН ДЛЯ ПРИМЕНЕНИЯ РАБОТНИКАМИ ПРЕДПРИЯТИЙ, ИМЕЮЩИХ СТАТУС УЛ, КАК ПОСТОЯННО, ТАК И ВРЕМЕННО
КОДЕКС РАСПРОСТРАНЯЕТСЯ НА ВСЕХ УЛ, ЗАНЯТЫХ В СФЕРЕ ОБРАЩЕНИЯ ЛС – ПРОИЗВОДИТЕЛЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, АКТИВНЫХ СУБСТАНЦИЙ И ВСПОМОГАТЕЛЬНЫХ ВЕЩЕСТВ, А ТАКЖЕ ДИСТРИБУТОРОВ
КОДЕКС НЕ УСТАНАВЛИВАЕТ ДОПОЛНИТЕЛЬНЫХ НОРМАТИВНЫХ ТРЕБОВАНИЙ В ОТНОШЕНИИ GMP/GDP 18
Слайд 17Европейский опыт
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ВЫПУЩЕННЫЕ НА РЫНОК УЛ, НЕ НУЖДАЮТСЯ В ДОПОЛНИТЕЛЬНОМ

ГОСУДАРСТВЕННОМ КОНТРОЛЕ
УЛ В США И ЕС НЕСУТ УГОЛОВНУЮ ОТВЕТСТВЕННОСТЬ ЗА ПРИНЯТИЕ «ПРОТИВОПРАВНЫХ» РЕШЕНИЙ
УЛ НЕСУТ ОТВЕТСТВЕННОСТЬ НЕ ТОЛЬКО ПЕРЕД СВОИМ РАБОТОДАТЕЛЕМ, НО И ПЕРЕД РЕГИОНАЛЬНЫМ ЛИЦЕНЗИРУЮЩИМ ОРГАНОМ
ЛИЦЕНЗИРУЮЩИЙ ОРГАН ОСУЩЕСТВЛЯЕТ НАДЗОР ЗА ДЕЯТЕЛЬНОСТЬЮ УЛ
ЗА КАЧЕСТВО ПРОДУКТА ОТВЕЧАЕТ НАПРЯМУЮ ПРОИЗВОДИТЕЛЬ ЛС, ЧЕРЕЗ СВОЕ УЛ
ЗА НЕСОБЛЮДЕНИЕ ТРЕБОВАНИЙ ЗАКОНОДАТЕЛЬСТВА УЛ УСТРАНЯЕТСЯ С ПРЕДПРИЯТИЯ, А ПРЕДПРИЯТИЮ АННУЛИРУЕТСЯ (ПРИОСТАНАВЛИВАЕТСЯ) ЛИЦЕНЗИЯ НА ПРАВО ПРОИЗВОДСТВА
КОНТАКТНЫЕ ДАННЫЕ УЛ ВНОСЯТСЯ В ЛИЦЕНЗИЮ НА ПРОИЗВОДСТВО ЛС 19
Слайд 18Какова она суровая отечественная действительность?
ДО НАСТОЯЩЕГО ВРЕМЕНИ НЕТ ПОНИМАНИЯ:
1. КОГДА

И КАКИЕ ПРАВИЛА GMP БУДУТ ПРИНЯТЫ
2. В КАКОМ УЧЕБНОМ ЗАВЕДЕНИИ БУДУТ ОБУЧАТЬ УПОЛНОМОЧЕННЫХ ЛИЦ
3. КАКИМИ ПРАВАМИ БУДУТ ОБЛАДАТЬ УЛ
4. КАКИМИ МИНИМАЛЬНЫМИ ЗНАНИЯМИ ДОЛЖНЫ ОБЛАДАТЬ ПРЕТЕНДУЮЩИЕ НА СТАТУС УЛ
5. БУДЕТ ЛИ ЗАКОНОДАТЕЛЬНО ЗАФИКСИРОВАНО В КЛАССИФИКАТОРЕ ПРОФЕССИЙ ДОЛЖНОСТЬ «УПОЛНОМОЧЕННОЕ ЛИЦО»
6. КТО, КАК И ПО КАКИМ КРИТЕРИЯМ БУДЕТ АТТЕСТОВЫВАТЬ УПОЛНОМОЧЕННЫХ ЛИЦ 7. БУДУТ ЛИ ВПИСАНЫ В ТОРГОВУЮ ЛИЦЕНЗИЮ ФИО УЛ















 Структура системы исполнительных органов власти в Российской Федерации
Структура системы исполнительных органов власти в Российской Федерации Программа ПРЕСТИЖЭлитный курс для студентов и молодых специалистов
Программа ПРЕСТИЖЭлитный курс для студентов и молодых специалистов Понятие о буримости горных пород
Понятие о буримости горных пород Графическая часть проекта
Графическая часть проекта Блокчейн и криптовалюта. Полное погружение
Блокчейн и криптовалюта. Полное погружение Роль кластеров в развитии регионов
Роль кластеров в развитии регионов TOO “ND & Co”
TOO “ND & Co” «Работа – она штука долговекая, человек умрёт, а дело его останется.» П.П.Бажов Свою автобиографию писатель разместил на трёх стран
«Работа – она штука долговекая, человек умрёт, а дело его останется.» П.П.Бажов Свою автобиографию писатель разместил на трёх стран Ценности людей и БРЕНДОВ
Ценности людей и БРЕНДОВ Аэро тату
Аэро тату Медовый спас. Значение праздника
Медовый спас. Значение праздника Проект "Ні шкідливим звичкам!"
Проект "Ні шкідливим звичкам!" Chast_1_Upr_2_6_8_9_12_14_16_17 (1) (1)
Chast_1_Upr_2_6_8_9_12_14_16_17 (1) (1) Двадцатое декабряКлассная работаОсновные виды сложных предложений.
Двадцатое декабряКлассная работаОсновные виды сложных предложений. Знание домашнего адреса
Знание домашнего адреса Индия: насильственное разрушение традиционного общества
Индия: насильственное разрушение традиционного общества Проект: формирование издательским сообществом отраслевой организационно-правовой системы управления рынком продаж периодики
Проект: формирование издательским сообществом отраслевой организационно-правовой системы управления рынком продаж периодики Анализучебно-воспитательной работы МОУ СОШ № 4 за I четверть 2009-2010 учебного года
Анализучебно-воспитательной работы МОУ СОШ № 4 за I четверть 2009-2010 учебного года Презентация на тему 7 чудес света (4 класс)
Презентация на тему 7 чудес света (4 класс) История рождения Иисуса Христа
История рождения Иисуса Христа Глобальные спутниковые информационные системы
Глобальные спутниковые информационные системы Этот день мы приближали как могли
Этот день мы приближали как могли Я сердцем никогда не лгу…
Я сердцем никогда не лгу… Чередование звуков
Чередование звуков Кафедра Экономики и управления
Кафедра Экономики и управления Zadanie_2
Zadanie_2 Интернет-портал «Мобильные новости»Mnovosti.ru
Интернет-портал «Мобильные новости»Mnovosti.ru Асфальтобетоны
Асфальтобетоны