Содержание
- 2. Реформа системы регулирования фармацевтического рынка В т.г. намечается реформа системы регулирования фармацевтического рынка готовится новое законодательство
- 3. Глобальное видение проблемы При этом крайне желательно посмотреть как решается эта проблема в других странах (глобальное
- 4. Видение проблемы на глобальном уровне Из материалов международного совещания по фармацевтическому качеству, Голландия, ноябрь 2003 г.
- 5. Система регулирования фармацевтического рынка Недостатки нашего видения: в 2002 г. почти никто не возражал против включения
- 6. Система регулирования (продолжение) Терминология: - фармпродукт, - качество фармпродуктов, - обеспечение качества, - GMP – новое
- 7. Система регулирования (продолжение 2) Еще о недостатках видения
- 8. Система регулирования (продолжение 3) Причины недостатков видения
- 9. Правила GMP развиваются самоинспекция, валидация, Уполномоченное Лицо, аудит поставщиков, параметрический выпуск, приложения (порядка 20 приложений) За
- 10. Нововведения за 2003 г. Директива 2003/94/ЕС от 8.10.2003 г., изменившая трактовку понятия «качество лекарств» пересмотр двух
- 11. Что впереди? GMP+ Статистические методы контроля Управление рисками Непрерывный аналитический контроль процессов В перспективе - единая
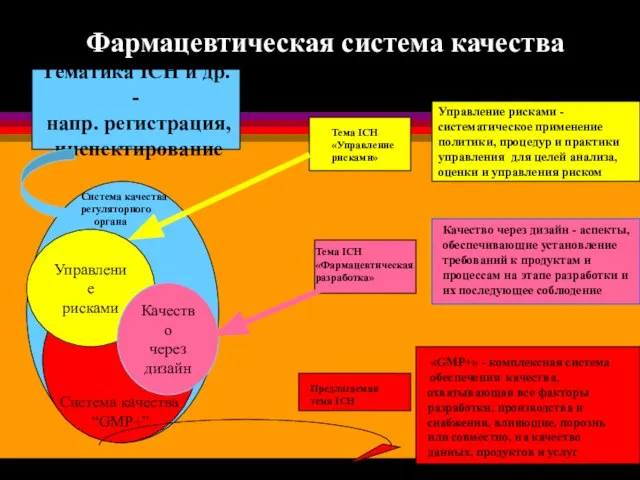
- 12. «Комплексная система обеспечения качества, охватывающая все факторы разработки, производства и снабжения, влияющие, порознь или совместно, на
- 13. Статистические методы контроля качества Анализ тенденций 6 сигма процесс Приемочный контроль Управление процессами Соответствие процесса и
- 14. Управление рисками пригодность для применения – верховенство потребителя приостановить ужесточение спецификаций, но более устойчивые свойства продукции
- 15. Единая система фармацевтического качества Разработку (качество через дизайн), Экспертизу регистрационных материалов, GMP, Инспектирование Пострегистрационные изменения ОБЪЕДИНЯЕТ
- 16. Единая система для всех стран Предполагается, что единая система будет принята во всех странах и на
- 17. Важнейшие элементы системы обеспечения качества лекарств на национальном уровне
- 18. Лаборатории Фармакопеи Инспекции GMP ОТД CTD-Q Контуры системы обеспечения фармацевтического качества 21 века КАЧЕСТВО
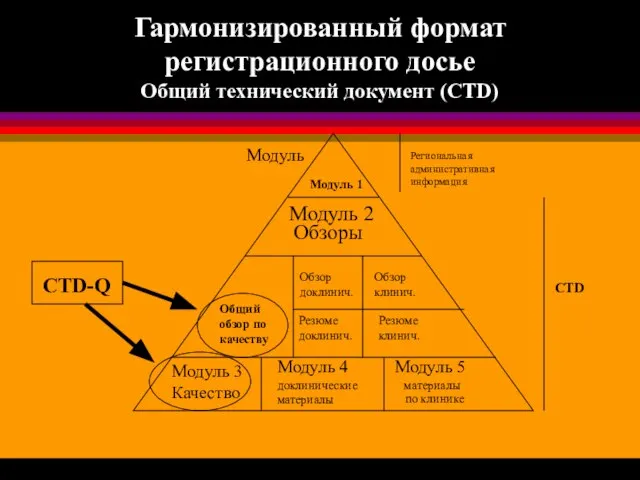
- 19. Гармонизированный формат регистрационного досье Общий технический документ (CTD) Модуль 1 Модуль 2 Обзор доклинич. Обзор клинич.
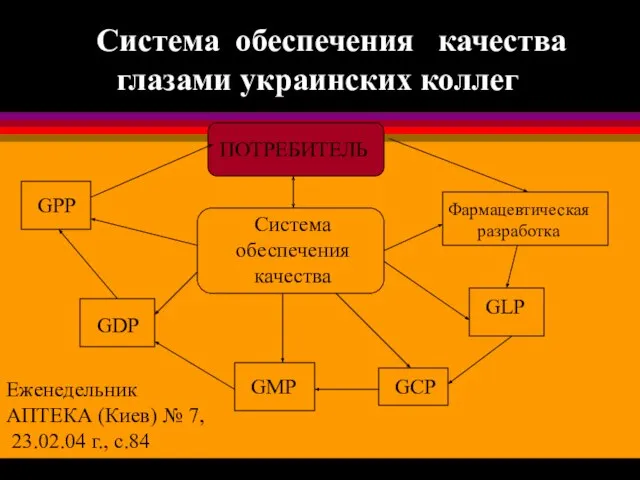
- 20. Система обеспечения качества глазами украинских коллег ПОТРЕБИТЕЛЬ Система обеспечения качества Фармацевтическая разработка GLP GCP GMP GDP
- 21. Управление рисками Качество через дизайн Управление рисками - систематическое применение политики, процедур и практики управления для
- 23. Скачать презентацию

















 ZACT (новая металлизированная упаковка)
ZACT (новая металлизированная упаковка) Акупунктурный электромассажер для ухода за телом Исюэтун
Акупунктурный электромассажер для ухода за телом Исюэтун Викторина «Весенняя капель»
Викторина «Весенняя капель» Ледяное Царство Зона арктических пустынь
Ледяное Царство Зона арктических пустынь С юбилеем Зилара Адисовна
С юбилеем Зилара Адисовна Спелеология
Спелеология Архитектура западноевропейского средневековья
Архитектура западноевропейского средневековья Предпринимательство и бизнес
Предпринимательство и бизнес Золотой ключик или приключения Буратино. Диафильм
Золотой ключик или приключения Буратино. Диафильм Презентация на тему Строчная и заглавная буквы Ц, ц
Презентация на тему Строчная и заглавная буквы Ц, ц Образовательный проект Профильная четверть
Образовательный проект Профильная четверть Презентация на тему Что такое сквернословие и как с ним бороться
Презентация на тему Что такое сквернословие и как с ним бороться Былины
Былины Круглый стол «НАРКОМАНИЯ - ДОБРОВОЛЬНОЕ САМОУБИЙСТВО?» По модулю «Граждановедение» Я.В. Соколова
Круглый стол «НАРКОМАНИЯ - ДОБРОВОЛЬНОЕ САМОУБИЙСТВО?» По модулю «Граждановедение» Я.В. Соколова СИУ
СИУ Доходность акций
Доходность акций Номинация №4«Здоровьесберегающие технологии на уроках МХК»
Номинация №4«Здоровьесберегающие технологии на уроках МХК» Стимуляция роста и контроль заболеваемости растений с помощью универсального биологического средства защиты.
Стимуляция роста и контроль заболеваемости растений с помощью универсального биологического средства защиты. Презентация на тему Ателье по пошиву изделий. Пошив наволочек
Презентация на тему Ателье по пошиву изделий. Пошив наволочек Биссектриса угла
Биссектриса угла Развитие акушерства и гинекологии в России
Развитие акушерства и гинекологии в России Новое поколение тракторов КИРОВЕЦ К-7М
Новое поколение тракторов КИРОВЕЦ К-7М Разнообразие животных
Разнообразие животных Мастерская БольшеЧемЕГЭ. Повышение уровня сдачи ВПР, ОГЭ, ЕГЭ
Мастерская БольшеЧемЕГЭ. Повышение уровня сдачи ВПР, ОГЭ, ЕГЭ Встреча кандидата с населением
Встреча кандидата с населением Презентация на тему Религия
Презентация на тему Религия Национальные Парки США и Великобритании
Национальные Парки США и Великобритании Предложения ARQA Technologies для брокеров Владимир Курляндчик Директор по развитию, ARQA Technologies
Предложения ARQA Technologies для брокеров Владимир Курляндчик Директор по развитию, ARQA Technologies