Содержание
- 2. Содержание Что такое вода? Водородная связь Использование воды Виды воды Жесткость воды. Смягчение воды Отчистка и
- 3. Что такое вода? Вода – Н2О Физические свойства: - прозрачная жидкость без вкуса, запаха и цвета
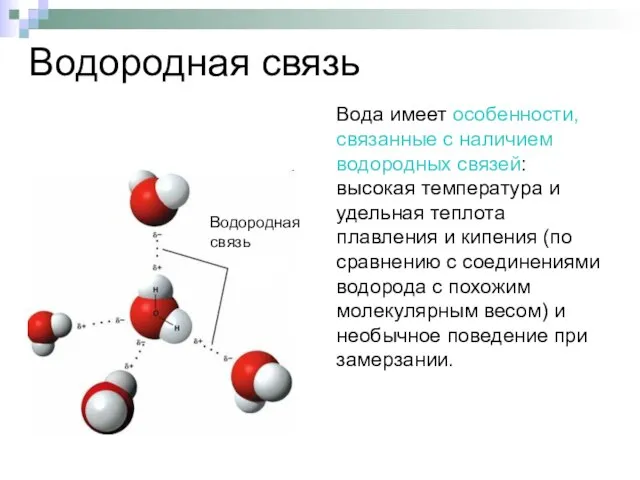
- 4. Водородная связь Вода имеет особенности, связанные с наличием водородных связей: высокая температура и удельная теплота плавления
- 5. Использование воды В повседневной жизни и в народном хозяйстве, в основном, употребляют пресную воду, которая состовляет
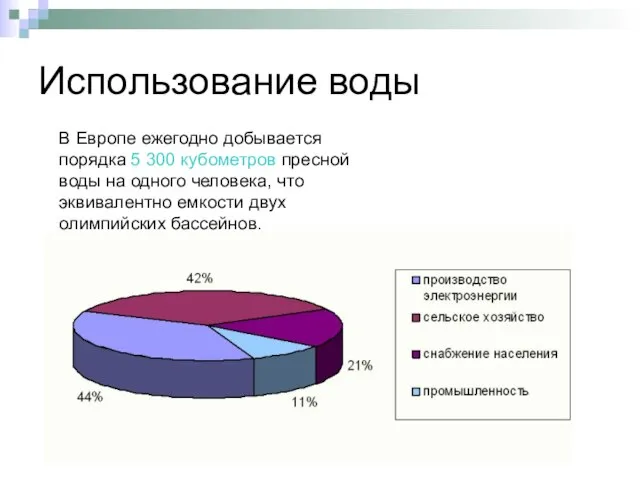
- 6. Использование воды В Европе ежегодно добывается порядка 5 300 кубометров пресной воды на одного человека, что
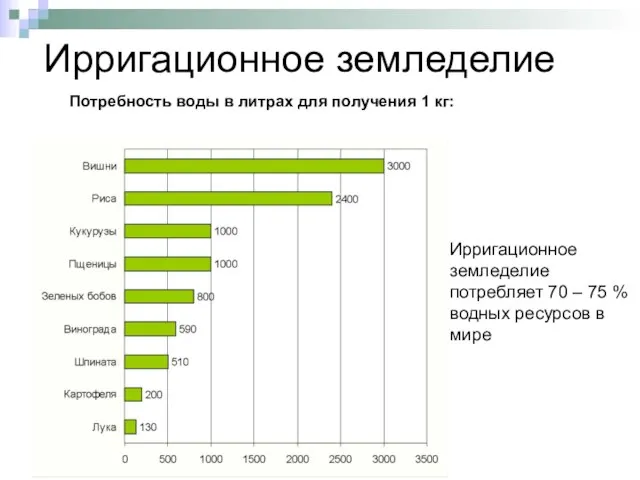
- 7. Ирригационное земледелие Потребность воды в литрах для получения 1 кг: Ирригационное земледелие потребляет 70 – 75
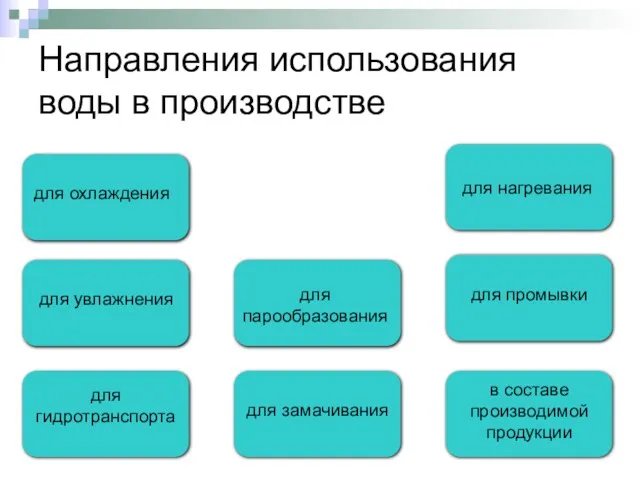
- 8. Направления использования воды в производстве для охлаждения для увлажнения для нагревания для парообразования для промывки для
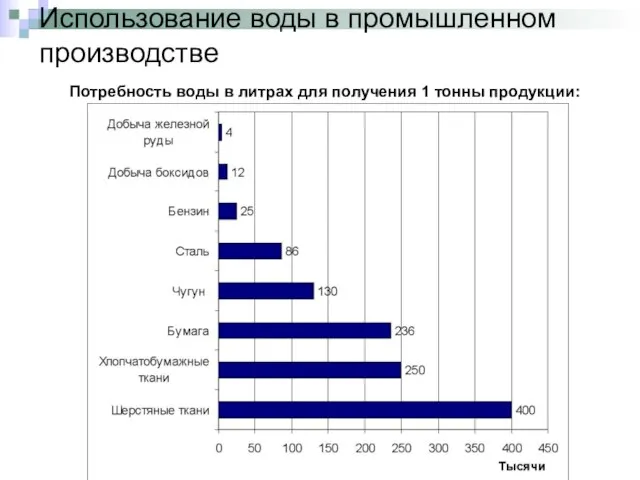
- 9. Использование воды в промышленном производстве Потребность воды в литрах для получения 1 тонны продукции:
- 10. Виды воды Талая вода Тяжелая вода Серебрянная вода Морская вода Омагниченная вода Минеральная вода
- 11. Талая вода - это чистая высококачественная вода, не содержит хлориды, соли, вредные вещества и соединения. Талая
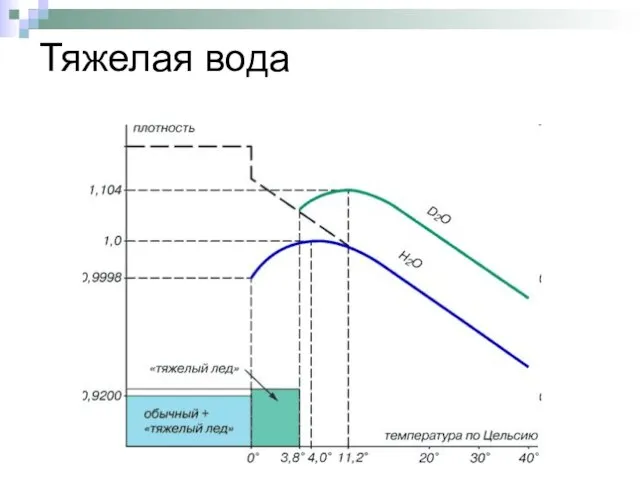
- 12. Тяжелая вода Тяжёловодородная вода имеет ту же химическую формулу, что и обычная вода, но вместо атомов
- 13. Тяжелая вода
- 14. Тяжелая вода Молекулы тяжёловодородной воды были впервые обнаружены в природной воде Гарольдом Юри в 1932 году.
- 15. Серебряная вода Медико-биологическими исследованиями установлено, что бактерицидные свойства серебра объясняются уникальной способностью его ионов блокировать ферменты
- 16. Минеральная вода Минеральные лечебные воды с общей минерализацией более 8 г/л. Сюда же относят и менее
- 17. В зависимости от количества и состава минеральных солей вода бывает: олигоминеральная, минеральная или слабоминеральная, сульфатная, хлоридная,
- 18. Жесткость воды. Химический состав подземных вод в большей мере зависит от взаимодействия между углекислым газом, растворенным
- 19. Жесткость воды Общая жесткость воды (С) – это сумма карбонатной и не карбонатной жесткости воды. Жесткость
- 20. Жесткость воды Жесткая вода для многих технических нужд непригодна. Образуется так называемый налет, который состоит из
- 21. Так выглядят трубы «заросшие» налетом.
- 22. Смягчение воды Это совокупность технологических приемов для устранения жесткости воды. Этого добиваются, путем отщепления ионов кальция
- 23. Смягчение воды Эффективнее всего смягчить воду возможно используя иониты. Иониты – это твердые вещества, которыми заполняют
- 24. Физические процессы отчистки воды. Решечение. Первая стадия водоочистки заключается в удалении из воды больших плавающих предметов
- 25. Физические процессы отчистки воды. Флоккуляция. Этот процесс включает осторожное взбалтывание воды, приводящие к конгломерации мелких частиц
- 26. Химические процессы водоподготовки Коагуляция. Для коагуляции взвешенных в воде мелких коллоидных частиц в нее добавляют специальные
- 27. Умягчение воды. В этом процессе устраняется жесткость воды, вызываемая растворенными в ней солями кальция и магния.
- 28. Очистка сточных вод Первичная очистка. Она включает решечение воды с целью извлечения из нее больших объектов
- 29. Третичная очистка. Эта стадия включает биологическую, химическую и физическую обработку сточных вод, при которой из них
- 30. Фильтры По данным Всемирной организации здравоохранения, сегодня на планете больше 80% заболеваний связаны с употреблением некачественной
- 32. Скачать презентацию























 Салат Цезарь по-домашнему
Салат Цезарь по-домашнему Мы сюда пришли учиться
Мы сюда пришли учиться Показатели вариации в статистике
Показатели вариации в статистике  Образовательная Технология «Учебная Фирма»
Образовательная Технология «Учебная Фирма» А.Л. Закгейм
А.Л. Закгейм Учёт и анализ расчетов с персоналом по оплате труда в ООО ИнвестСтрой
Учёт и анализ расчетов с персоналом по оплате труда в ООО ИнвестСтрой Час мужества интервью с поэтом Великой Отечественной Войны
Час мужества интервью с поэтом Великой Отечественной Войны Профилактика стресса
Профилактика стресса Алюминевая азбука
Алюминевая азбука Сфера политики и социального управления. Вопросы кодификатора
Сфера политики и социального управления. Вопросы кодификатора Millihilen. Флористика и дизайн. Необходимые инвестиции
Millihilen. Флористика и дизайн. Необходимые инвестиции Ответы на индивидуальную викторину кроссворд № 5
Ответы на индивидуальную викторину кроссворд № 5 Перегонка и ректификация
Перегонка и ректификация Международная торговля и внешнеторговая политика
Международная торговля и внешнеторговая политика Литература средних веков
Литература средних веков Стратегии разработки и запуска производства новых ЛС и риски связанные с выводом их на рынок
Стратегии разработки и запуска производства новых ЛС и риски связанные с выводом их на рынок Работа должностных лиц в походе
Работа должностных лиц в походе Политическая система Германии
Политическая система Германии Авиация МЧС РФ
Авиация МЧС РФ Банк USMANOFF
Банк USMANOFF Нашествие персидских войск на Элладу 5 класс
Нашествие персидских войск на Элладу 5 класс Весенняя неделя добра
Весенняя неделя добра БОУ ДО г. Омска ЦТТ Мечта. Дополнительная образовательная общеразвивающая программа Модуль
БОУ ДО г. Омска ЦТТ Мечта. Дополнительная образовательная общеразвивающая программа Модуль Сүзләргә күплек кушымчаларын ялгагыз
Сүзләргә күплек кушымчаларын ялгагыз Сөздіктерді аудару
Сөздіктерді аудару Критический реализм в творчестве П.А Федотова и В.Г Перова
Критический реализм в творчестве П.А Федотова и В.Г Перова Внимание как познавательный процесс
Внимание как познавательный процесс Презентация диссертацииСыроид Анны Сергеевны
Презентация диссертацииСыроид Анны Сергеевны