Содержание
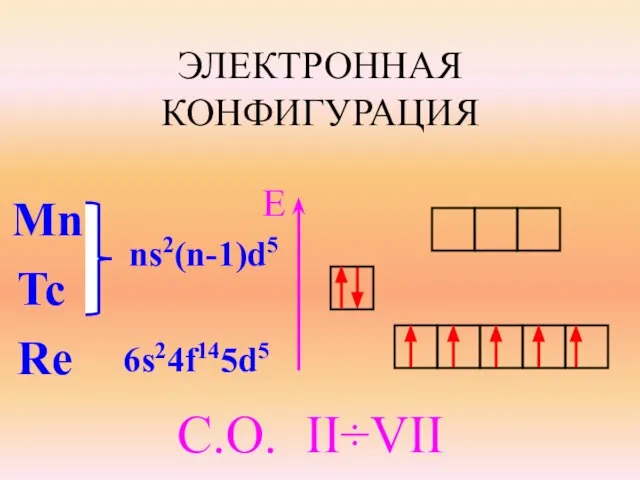
- 2. ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ Mn Tc Re ns2(n-1)d5 6s24f145d5 E C.О. II÷VII
- 3. ПРОСТЫЕ ВЕЩЕСТВА Mn Tc Re Iэв. 7.4 7.2 7.9 потенциал ионизации
- 4. ОБЩИЕ СВОЙСТВА к.ч. 4, 6 (Mn) Mn: катионы, анионы Tc, Re – только анионы [Mn(H2O)6]2+, MnO4-
- 5. В ПРИРОДЕ
- 6. ПРИМЕНЕНИЕ Тс – радиоактивный элемент τ1/2=2,12.105лет Получают из радиоактивных отходов атомной энергетики. Сейчас Tc (искусств.) больше,
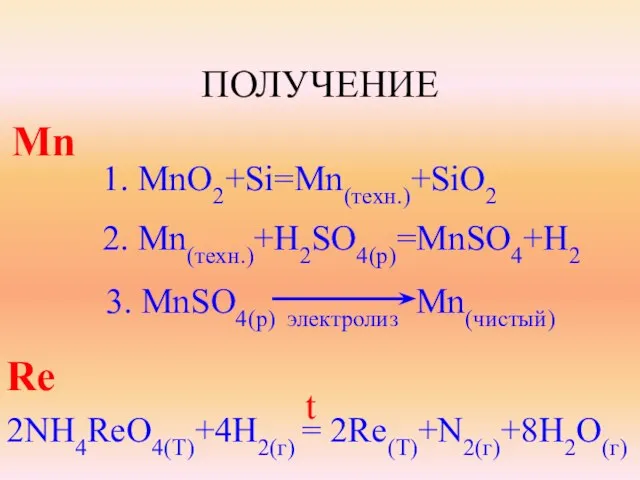
- 7. ПОЛУЧЕНИЕ Mn 1. MnO2+Si=Mn(техн.)+SiO2 2. Mn(техн.)+H2SO4(p)=MnSO4+H2 3. MnSO4(p) электролиз Mn(чистый) Re 2NH4ReO4(T)+4H2(г) = 2Re(T)+N2(г)+8H2O(г) t
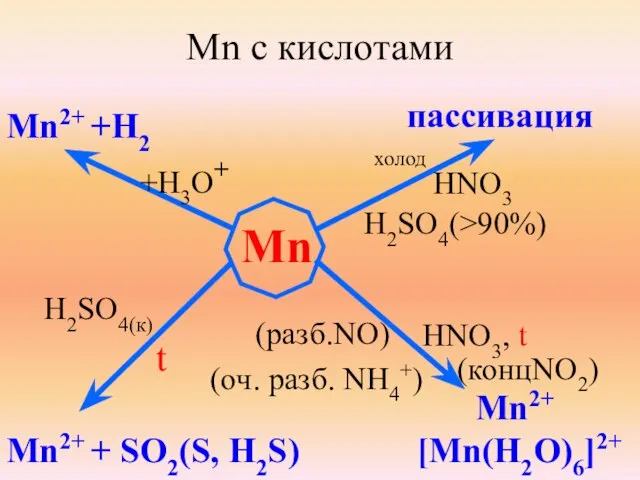
- 8. Mn с кислотами Mn Mn2+ +H2 +H3O+ холод пассивация HNO3 H2SO4(>90%) H2SO4(к) t Mn2+ + SO2(S,
- 9. Re с кислотами 3Re+7HNO3 = 3HReO4+7NO+2H2O средней концентр. 30% Re+HNO3(конц.)≠ 2Re+7H2O2 = 2HReO4+6H2O
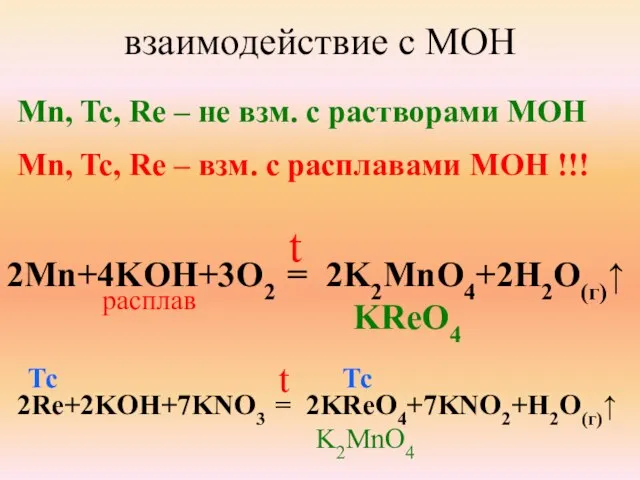
- 10. взаимодействие с MOH Mn, Tc, Re – не взм. с растворами МОН Mn, Tc, Re –
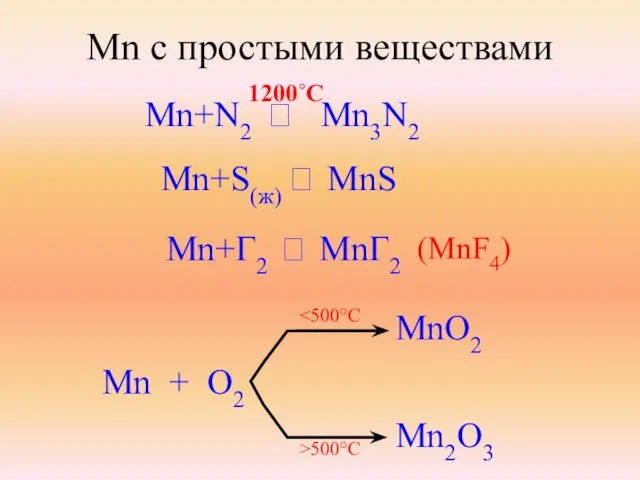
- 11. Mn с простыми веществами Mn+N2 ⭢ Mn3N2 1200˚C Mn+S(ж) ⭢ MnS Mn+Г2 ⭢ MnГ2 (MnF4) Mn
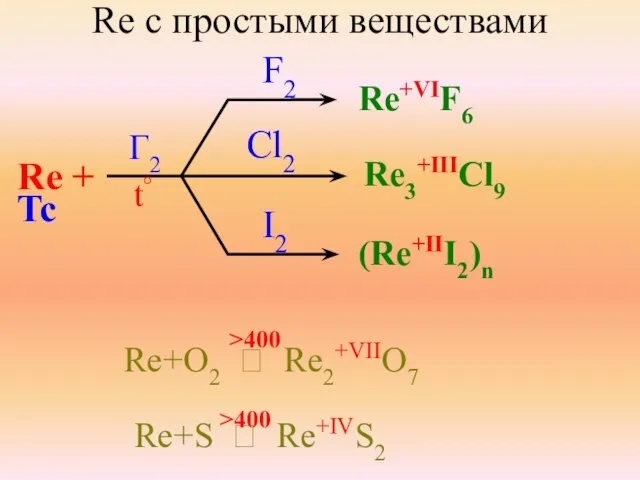
- 12. Re с простыми веществами Re + Tc F2 Cl2 I2 Re+VIF6 Re3+IIICl9 (Re+III2)n Re+O2 ⭢ Re2+VIIO7
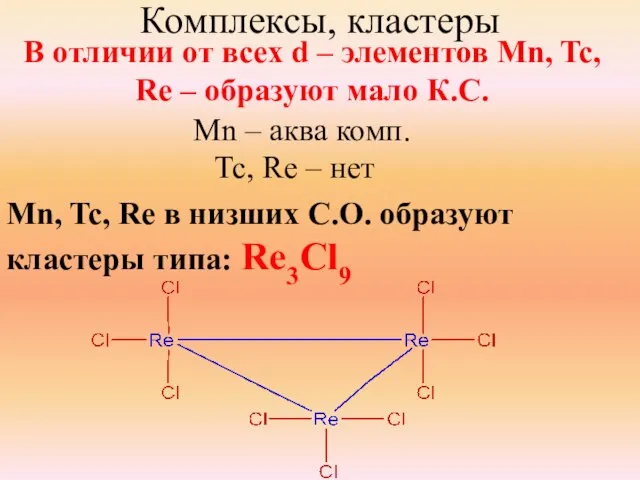
- 13. Комплексы, кластеры В отличии от всех d – элементов Mn, Tc, Re – образуют мало К.С.
- 14. Степень Окисления « 0 » [(CO)5Mn – Mn(CO)5]0 H2, P, t H[Mn(CO)5] Cl2 [Mn+I(CO)5Cl]0 хлоропентакарбонил-марганец(I)
- 15. Кислородные соединения Mn
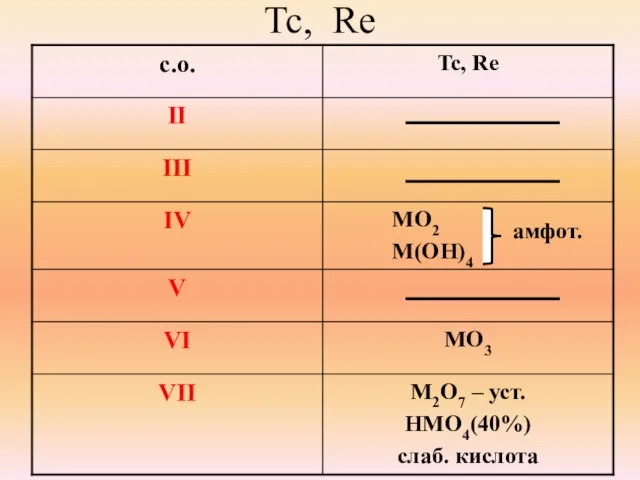
- 16. Tc, Re амфот.
- 17. Особенности химии Mn 1. Mn – активный металл (φ0=-1,19В) 2. Устойчивые СО: +II и +IV 3.
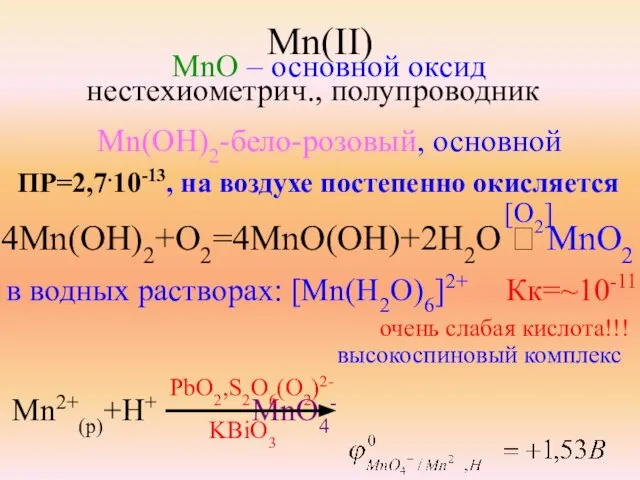
- 18. Mn(II) MnO – основной оксид нестехиометрич., полупроводник Mn(OH)2-бело-розовый, основной ПР=2,7.10-13, на воздухе постепенно окисляется 4Mn(OH)2+O2=4MnO(OH)+2H2O ⭢
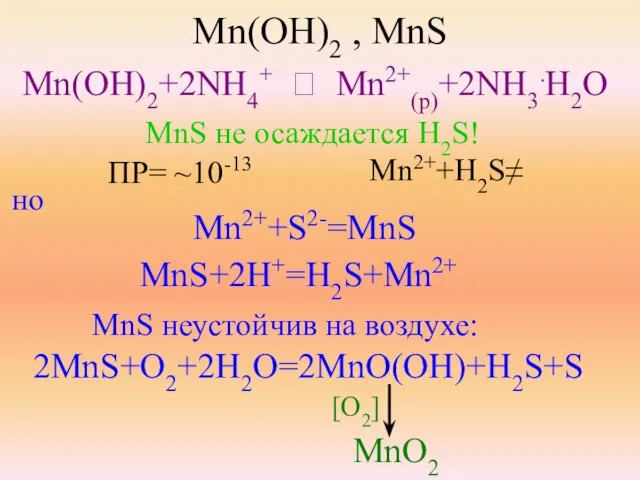
- 19. Mn(OH)2 , MnS Mn(OH)2+2NH4+ ⮀ Mn2+(p)+2NH3.H2O MnS не осаждается H2S! ПР= ~10-13 Mn2++H2S≠ но Mn2++S2-=MnS MnS+2H+=H2S+Mn2+
- 20. MnCO3 , MnSO4 , [Mn(H2O)6]2+ MnCO3 ⭢ MnO+CO2 N2 MnO+2H3O++3H2O = [Mn(H2O)6]2+ [Mn(H2O)6]2++2OH- = Mn(OH)2 NH3
- 21. 2MnO(OH) = Mn2O3+H2O Mn(III) Mn2O3, MnO(OH), MnF3, Mn2(SO4)3 Mn2O3: [Mn(H2O)6]3+ в водном растворе неустойчив гидролиз: [Mn(H2O)6]3+
- 22. Получение Mn2(SO4)3 , химич. cвойства MnO(OH) 2MnO(OH)+3H2SO4 = Mn2(SO4)3+4H2O Mn+III-окислитель! 2MnO(OH)+6HCl = 2MnCl2+Cl2+4H2O 2MnO(OH)+H2SO4(разб)=MnO2(т)+MnSO4+2H2O -1e диспропорционирование!
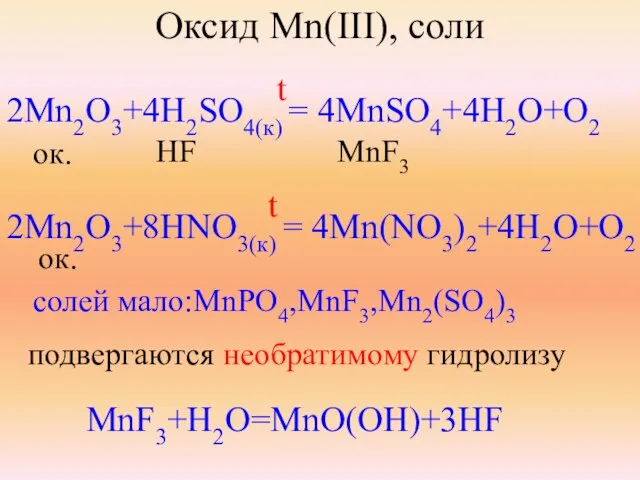
- 23. Оксид Mn(III), соли 2Mn2O3+4H2SO4(к) = 4MnSO4+4H2O+O2 ок. HF MnF3 2Mn2O3+8HNO3(к) = 4Mn(NO3)2+4H2O+O2 солей мало:MnPO4,MnF3,Mn2(SO4)3 подвергаются необратимому
- 24. Mn(IV), MnO2 1. Очень устойчив, не реагирует с Н3O+, OH- ∆G0298=-465 кДж/моль 2. окислитель: ϕ0 =
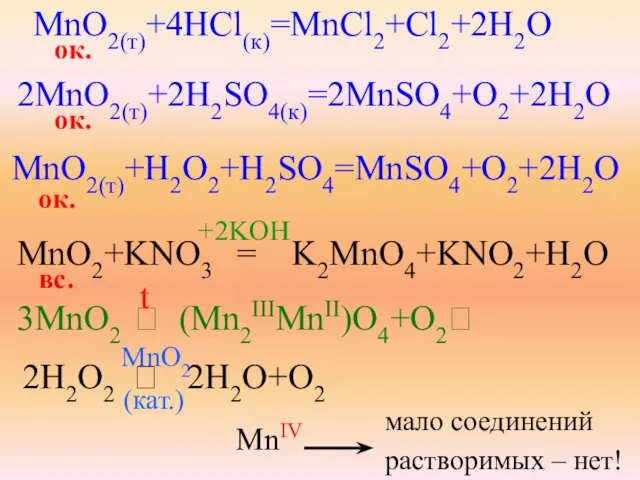
- 25. MnO2(т)+4HCl(к)=MnCl2+Cl2+2H2O ок. 2MnO2(т)+2H2SO4(к)=2MnSO4+O2+2H2O MnO2(т)+H2O2+H2SO4=MnSO4+O2+2H2O MnO2+KNO3 = K2MnO4+KNO2+H2O вс. 3MnO2 ⭢ (Mn2IIIMnII)O4+O2⭡ ок. ок. +2KOH t 2H2O2
- 26. Mn(VI) 1. Соединений очень мало 2. Устойч. тв. K2MnO4 3. В р-ре – устойчив в сильнощелочной
- 27. 4. Восстановительные св-ва: 2MnO42-+Cl2=2MnO4-+2Cl- 5. Окислительные св-ва H2O+MnO42-+C2H5OH = MnO2++CH3CHO+2H2O+2OH- MnO42-+2H2O+2e=MnO2+4OH- C2H5OH-2e = CH3CHO+2H+ 1 2
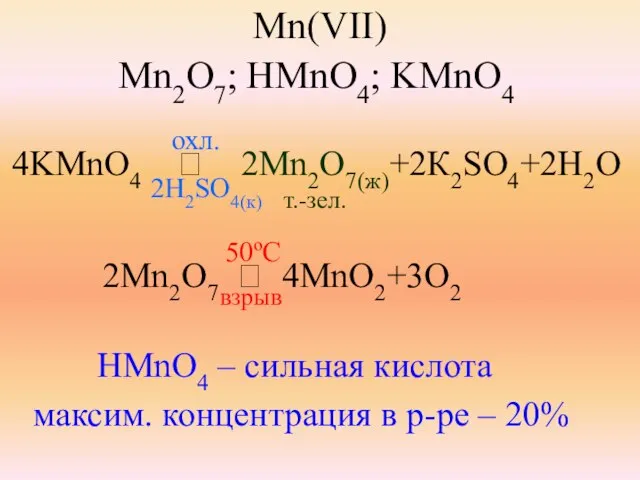
- 28. Mn(VII) Mn2O7; HMnO4; KMnO4 4KMnO4 ⭢ 2Mn2O7(ж)+2К2SO4+2H2O 2H2SO4(к) т.-зел. 2Mn2O7 ⭢ 4MnO2+3O2 взрыв HMnO4 – сильная
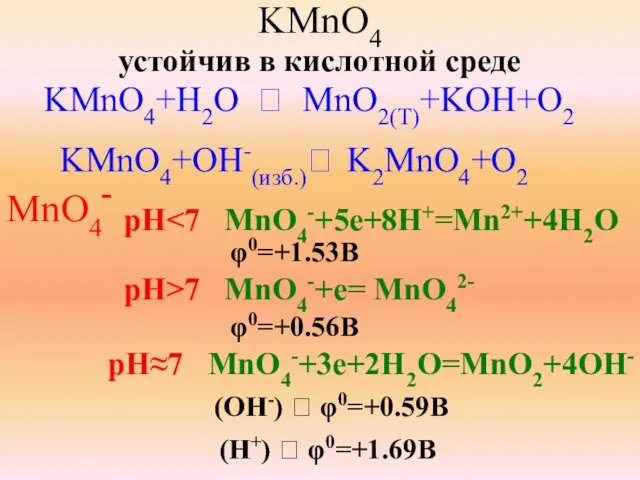
- 29. KMnO4 устойчив в кислотной среде KMnO4+H2O ⭢ MnO2(T)+KOH+O2 KMnO4+OH-(изб.)⭢ K2MnO4+O2 MnO4- pH φ0=+1.53B pH>7 MnO4-+e= MnO42-
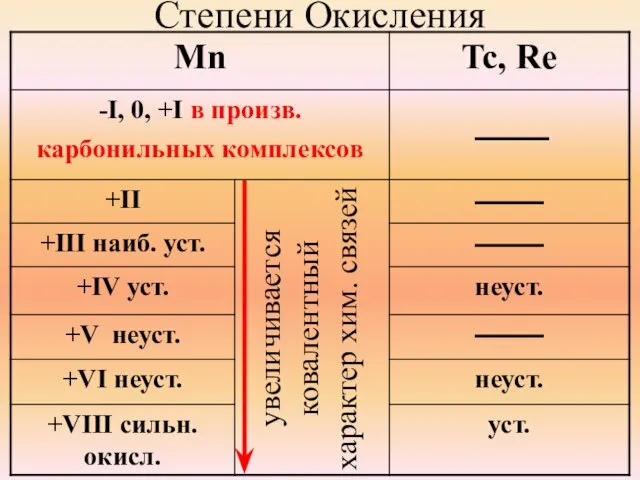
- 30. Степени Окисления увеличивается ковалентный характер хим. связей
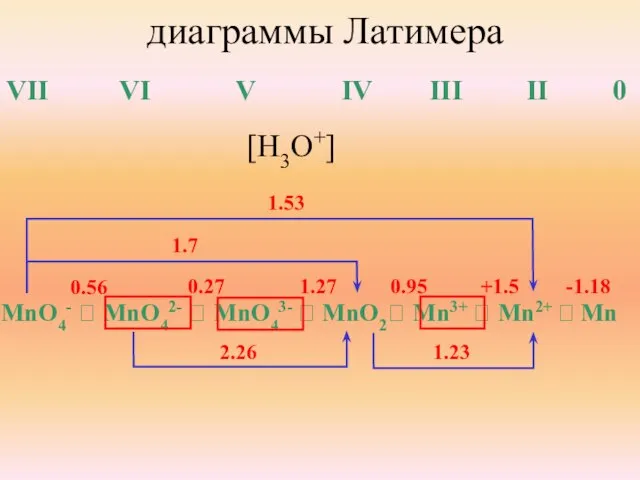
- 31. диаграммы Латимера VII VI V IV III II 0 MnO4- ⭢ MnO42- ⭢ MnO43- ⭢ MnO2⭢
- 33. Скачать презентацию





![Степень Окисления « 0 » [(CO)5Mn – Mn(CO)5]0 H2, P, t H[Mn(CO)5] Cl2 [Mn+I(CO)5Cl]0 хлоропентакарбонил-марганец(I)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/374223/slide-13.jpg)


![MnCO3 , MnSO4 , [Mn(H2O)6]2+ MnCO3 ⭢ MnO+CO2 N2 MnO+2H3O++3H2O = [Mn(H2O)6]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/374223/slide-19.jpg)
![2MnO(OH) = Mn2O3+H2O Mn(III) Mn2O3, MnO(OH), MnF3, Mn2(SO4)3 Mn2O3: [Mn(H2O)6]3+ в водном](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/374223/slide-20.jpg)




 Философия Общая характеристика предмета
Философия Общая характеристика предмета Программа Microsoft PowerPoint
Программа Microsoft PowerPoint Цветущие дворики села. Фотовыставка
Цветущие дворики села. Фотовыставка Источники трудового права
Источники трудового права Социальная защита несовершеннолетних в РФ
Социальная защита несовершеннолетних в РФ Выражение отношения к окружающему миру через изображение животных
Выражение отношения к окружающему миру через изображение животных Гиппиус
Гиппиус Методика проведения игровых программ: практические советы и рекомендации
Методика проведения игровых программ: практические советы и рекомендации Презентация1
Презентация1 Мировая религия Буддизм 7 класс
Мировая религия Буддизм 7 класс Османская империя в XIV-XVI веках
Османская империя в XIV-XVI веках Открытое акционерное общество «Сибвзрывкомплект»
Открытое акционерное общество «Сибвзрывкомплект» SQA DAYS 9:Опыт создания своей QA компании
SQA DAYS 9:Опыт создания своей QA компании БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Выпускная работа по«Основам информационных технологий» Минск – 2010 г.
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Выпускная работа по«Основам информационных технологий» Минск – 2010 г. НИР-2008
НИР-2008 Речевые ошибки
Речевые ошибки Силикатная промышленность
Силикатная промышленность Криптовалюты. Блокчейн и биткойн
Криптовалюты. Блокчейн и биткойн Отчет о проделанной работе ЮАО. Бизнес разведка Тайм кафе
Отчет о проделанной работе ЮАО. Бизнес разведка Тайм кафе 1 класс
1 класс Бизнес-план антикафе Час за минуту
Бизнес-план антикафе Час за минуту ГК РФ Статья 87. Основные положения об обществе с ограниченной ответственностью
ГК РФ Статья 87. Основные положения об обществе с ограниченной ответственностью Повторение
Повторение Основы коммерческой деятельности
Основы коммерческой деятельности Алкоголь
Алкоголь Жизненный цикл проекта. Инициация
Жизненный цикл проекта. Инициация Потестарно-политические институты обских угров в дореволюционной России и в советское время (Никифорова И.М.)
Потестарно-политические институты обских угров в дореволюционной России и в советское время (Никифорова И.М.) Принятие управленческих решений
Принятие управленческих решений