Содержание
- 2. Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью.
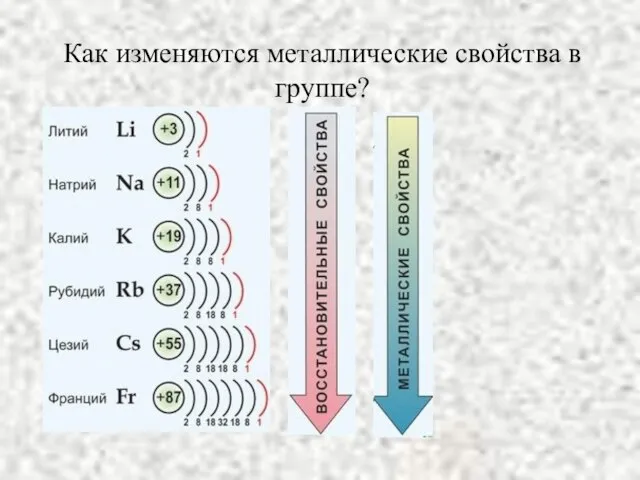
- 3. Как изменяются металлические свойства в группе?
- 4. Радиусы атомов элементов 1А группы
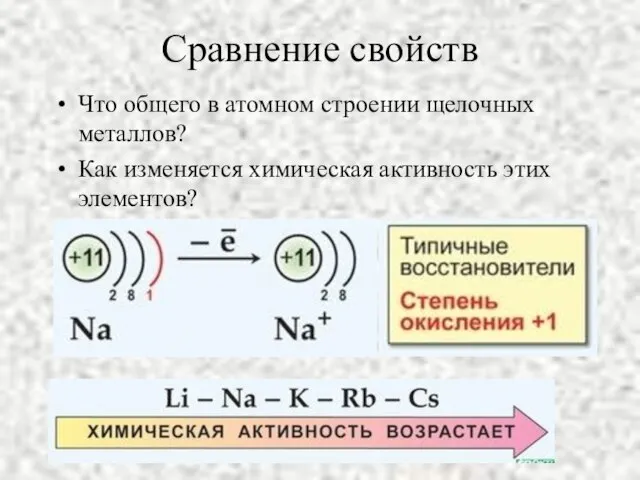
- 5. Сравнение свойств Что общего в атомном строении щелочных металлов? Как изменяется химическая активность этих элементов?
- 6. ИСТОРИЯ ОТКРЫТИЯ Натрий и калий – 1807г. Английский химик и физик Г.Дэви получил их в виде
- 7. Происхождение названий Li (1817) лат. " литос" - камень Na (1807) араб. "натрум" - сода К
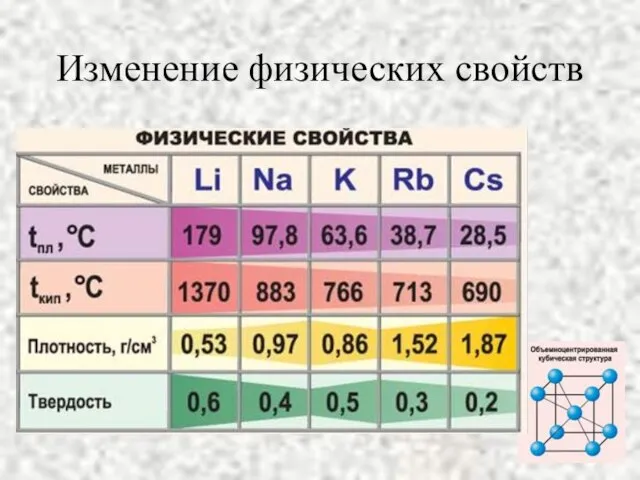
- 8. Изменение физических свойств
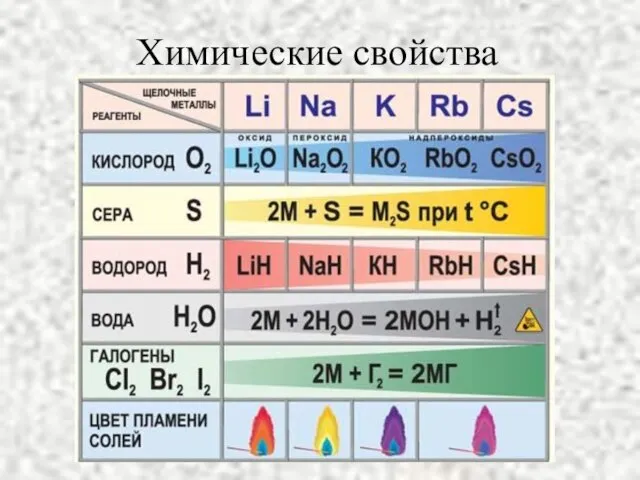
- 9. Химические свойства
- 10. Оксид лития Оксид натрия Оксиды щелочных металлов Составьте общую формулу оксидов.
- 11. KOH – гидроксид калия NaOH – гидроксид натрия LiOH – гидроксид лития Гидроксиды щелочных металлов Какова
- 12. Нахождение в природе Встречаются ли щелочные металлы в природе в свободном состоянии?
- 14. Немного истории Древнегреческий поэт Гомер, назвал поваренную соль «божественной». В те далекие времена она ценилась выше
- 15. Поваренная соль и география Поваренная соль известна человеку с незапамятных времен, и название ее сходно во
- 16. Поваренная соль в организме человека Соль – обязательная составная часть организма человека. Соль поддерживает нормальную деятельность
- 17. Применение поваренной соли Производство химических веществ --- соляной кислоты --- гидроксида натрия --- хлора --- соды
- 18. Сколько нужно времени для того, чтобы съесть пуд соли? Есть поговорка: «Чтобы хорошо узнать человека, надо
- 19. Карбонат калия - поташ Калийная селитра соли щелочных металлов
- 20. Задание На странице 130 учебника найдите ответ на вопрос: чем похожи и чем отличаются кальцинированная, стиральная
- 21. Проверьте Na2CO3 – кальцинированная сода Na2CO3*10Н2О – кристаллическая или стиральная сода Na2НCO3 – питьевая сода
- 22. Тест-проверка Вариант 1. 1-Б, 2-В, 3-В, 4-А,5-А. Вариант 2 1-Б, 2-В, 3-В, 4-Б, 5-А
- 23. Домашнее задание 1 уровень: Прочитать параграф 24, Выяснить: Какая связь между подводной лодкой и щелочными металлами
- 24. О каком элементе идет речь? Хранят обычно в керосине, и бегает он по воде, В природе,
- 26. Скачать презентацию



















 Презентация на тему Личные местоимения Глагол to be
Презентация на тему Личные местоимения Глагол to be Файлы и файловые системы
Файлы и файловые системы Программа курса «Технологияразработки мультимедиа проектов»
Программа курса «Технологияразработки мультимедиа проектов» Отзывчивость, доброе расположение к людям, стремление делать все хорошее, положительное, полезное, совокупность правил приличий
Отзывчивость, доброе расположение к людям, стремление делать все хорошее, положительное, полезное, совокупность правил приличий Стресс: причины и методы преодоления
Стресс: причины и методы преодоления Группа компаний Стройкомплект
Группа компаний Стройкомплект Якутия
Якутия Презентация на тему Употребление односоставных и двусоставных предложений в речи
Презентация на тему Употребление односоставных и двусоставных предложений в речи  Присвячено Анні Ахматовій
Присвячено Анні Ахматовій Методы творческого поиска альтернативных вариантов
Методы творческого поиска альтернативных вариантов  36736
36736 Василий Суриков
Василий Суриков Бутерброды в переводе с немецкого - хлеб с маслом
Бутерброды в переводе с немецкого - хлеб с маслом Превентивная защита от возгорания на транспортных средствах
Превентивная защита от возгорания на транспортных средствах Модульное обучение на уроках русского языка
Модульное обучение на уроках русского языка Видеоролики в instagram
Видеоролики в instagram Презентация на тему О – Ё после шипящих в корнях слов
Презентация на тему О – Ё после шипящих в корнях слов Мастер-класс «Изготовление сладкой Ёлочки»
Мастер-класс «Изготовление сладкой Ёлочки» Профилактика ВИЧ и СПИД
Профилактика ВИЧ и СПИД Отчёт по учебной практике
Отчёт по учебной практике Механическое движение. Система отсчёта
Механическое движение. Система отсчёта Chinese cuisine
Chinese cuisine Феофан Грек, Андрей Рублев
Феофан Грек, Андрей Рублев видеоконференцсвязь
видеоконференцсвязь MS Word программасында жата сурет
MS Word программасында жата сурет Менеджмент: кризис доверия VS доверие в условиях кризиса27.11.08. Круглый стол. Совместный проект ИМИСП & TRANSEARCH при поддержке «Деловой
Менеджмент: кризис доверия VS доверие в условиях кризиса27.11.08. Круглый стол. Совместный проект ИМИСП & TRANSEARCH при поддержке «Деловой  Быт россиян в 18 веке
Быт россиян в 18 веке Коррида
Коррида