Характеристика химического элемента – неметалла на основании его положения в Периодической системе химических элементов
Содержание
- 2. 1. Характеристика неметалла на примере азота Положение N в Периодической системе и строение его атома а)
- 3. 1. Характеристика неметалла на примере азота б) Состав атома P+ = 7 (порядковый номер) ē =
- 4. 1. Характеристика неметалла на примере азота в) строение атома N: Число энергетических уровней = номеру периода
- 5. 1. Характеристика неметалла на примере азота У атома азота на внешнем электронном слое находится 5 электронов,
- 6. 1. Характеристика неметалла на примере азота Электроотрицательность – способность атомов химических элементов оттягивать к себе электроны
- 7. 1. Характеристика неметалла на примере азота
- 8. 2. Сравнение свойств атома азота со свойствами атомов – соседей по группе и периоду R АТ
- 9. 3. Простое вещество азот – N2 – неметалл N2 - к.н.п, газ. Неметаллические свойства простого вещества
- 10. 4. Высший оксид – N2O5 Кислотный. Взаимодействует с Основаниями Основными оксидами водой
- 11. 4. Высший оксид – N2O5 N2O5 + 2NaOH = 2NaNO3 + H2O – р.обмена N2O5 +
- 12. 5. Высший гидроксид - HNO3 - кислота Взаимодействует с Основаниями Основными оксидами Солями металлами
- 13. 5. Высший гидроксид - HNO3 - кислота 2HNO3+Cu(OH)2 = Cu(NO3)2 + 2H2O – р.обмена, 2HNO3 +
- 14. 6. NH3 - летучее водородное соединение Аммиак
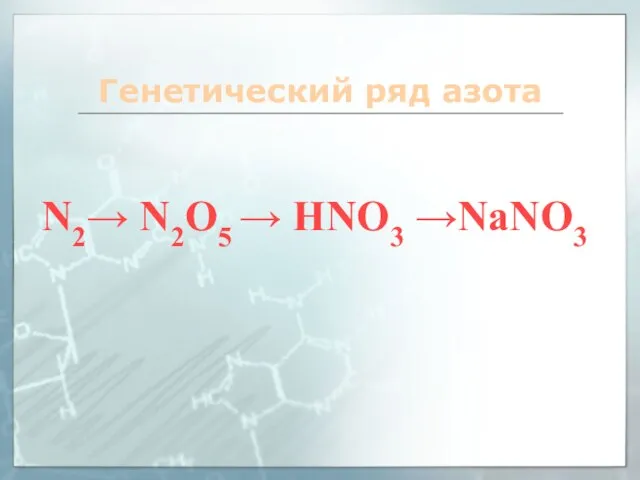
- 15. Генетический ряд азота N2→ N2O5 → HNO3 →NaNO3
- 16. Закрепление знаний . Тестирование 1. Заряд ядра атома азота равен числу а) протонов б)электронов во внешнем
- 17. 2. В ряду химических элементов B→C→N а)усиливаются металлические свойства б)ослабевают восстановительные свойства в)уменьшается электроотрицательность атомов г)уменьшается
- 18. 3. Значения высшей и низшей степеней окисления азота соответственно равны а) +5 и -3 б) +4
- 19. 4. С образованием катионов водорода и анионов кислотного остатка диссоциирует а)оксид кремния (IV) б) оксид меди
- 21. Скачать презентацию

















 Процессы карьеры и социализации. Технология самоорганизации
Процессы карьеры и социализации. Технология самоорганизации Babilonul (Poarta Zeilor)
Babilonul (Poarta Zeilor) Кролики и зайцы
Кролики и зайцы Семинар для специалистов по проведению инструктажа и обеспечению лабораторных работ на экзаменах по физике и химии в 2022 году
Семинар для специалистов по проведению инструктажа и обеспечению лабораторных работ на экзаменах по физике и химии в 2022 году Сочи – зимняя игра, Олимпийская пора
Сочи – зимняя игра, Олимпийская пора Понятие о космосе. Исследование космоса
Понятие о космосе. Исследование космоса Меры социальной поддержки, предоставляемых на территории Курганской области
Меры социальной поддержки, предоставляемых на территории Курганской области Creative agency. Интерактивная встреча по рекламе и PR
Creative agency. Интерактивная встреча по рекламе и PR Аниме. Любимые персонажи
Аниме. Любимые персонажи Воскресение Христово (Пасха)
Воскресение Христово (Пасха) Детское христианское собрание
Детское христианское собрание Австралия и Океания.
Австралия и Океания. Открытие республиканского проекта
Открытие республиканского проекта Online стратегии для бизнеса
Online стратегии для бизнеса Скульптура. Проверочная работа
Скульптура. Проверочная работа Игрушка Полкан
Игрушка Полкан Что растёт на клумбе?
Что растёт на клумбе? Органы дыхания и газообмен
Органы дыхания и газообмен Тест Мюнстерберга на восприятие и внимание.
Тест Мюнстерберга на восприятие и внимание. Особенности контрактов на комплектное оборудование Гудимова К. С., Мельник Д.А. гр. МЭ091
Особенности контрактов на комплектное оборудование Гудимова К. С., Мельник Д.А. гр. МЭ091 Русская культура в произведениях русских классиков. Самовар
Русская культура в произведениях русских классиков. Самовар DeVita Ritm mini - цифровое устройство оздоровления
DeVita Ritm mini - цифровое устройство оздоровления Игрушки из носочков своими руками №5
Игрушки из носочков своими руками №5 Буква Я - показатель мягкости согласного
Буква Я - показатель мягкости согласного Требование по размещению рекламных материалов в шинных центрах
Требование по размещению рекламных материалов в шинных центрах Анализ микробиоты кишечника и экспресс-диагностика острых кишечных инфекций методом ПЦР
Анализ микробиоты кишечника и экспресс-диагностика острых кишечных инфекций методом ПЦР Обеспечение исков иностранных граждан, права и обязанности ин лиц
Обеспечение исков иностранных граждан, права и обязанности ин лиц Базовые категории управления
Базовые категории управления