Слайд 2Вспомним,
что такое кислотные оксиды?
Кислотные оксиды – это солеобразующие оксиды неметаллов, например:

+4
SO2 – оксид серы (IV)
+6
SO3 – оксид серы (VI)
+5
P2O5 – оксид фосфора (V)
Слайд 3Кислотные оксиды реагируют:
1. Со щелочами. В результате реакции образуются соль и вода.

Эта реакция служит доказательством кислотного характера оксида.
SO3 + 2NaOH → Na2SO4 + H2O
сульфат натрия вода
CO2 + Ca(OH)2 → CaCO3↓ + H2O
карбонат кальция вода
Слайд 4Запишите уравнения самостоятельно, назовите продукты реакции
SO2 + KOH →
P2O5 + LiOH →
SO3

+ Ba(OH)2 →
CO2 + NaOH →
Слайд 5Проверь себя:
SO2 + 2KOH → K2SO3 + H2O
сульфит калия вода
P2O5 +

6LiOH → 2Li3PO4 + 3H2O
фосфат лития вода
SO3 + Ba(OH)2 → BaSO4↓+ H2O
сульфат бария
CO2 + 2NaOH → Nа2CO3 + H2O
карбонат натрия
Слайд 6Кислотные оксиды реагируют:
2. С водой. При этом образуется кислота. Исключением является SiO2.Он

с водой не реагирует, а кремниевую кислоту получают косвенным путем.
SO3 + H2O → H2SO4
серная кислота
P2O5 + 3H2O → 2H3PO4
фосфорная кислота
Слайд 7Чтобы не ошибиться в составлении формулы соли вспомните, что …
кислотному оксиду SO2

соответствует H2SO3
кислотному оксиду SO3 соответствует H2SO4
кислотному оксиду CO2 соответствует H2CO3
кислотному оксиду P2O5 соответствует H3PO4
кислотному оксиду SiO2 соответствует H2SiO3
кислотному оксиду N2O5 соответствует HNO3
Слайд 8Кислотные оксиды реагируют:
3. С основными оксидами. При этом образуется соль.
CO2 + CaO

→ CaCO3
карбонат кальция
SO3 + K2O → K2SO4
сульфат калия
Слайд 9Запишите уравнения самостоятельно, назовите продукты реакции
CaO + CO2 →
Li2O + CO2 →
BaO

+ SO2 →
Na2O + SO3 →
K2O + P2O5 →
Слайд 10Проверь себя:
CaO + CO2 → CaCO3 - карбонат кальция
Li2O + CO2 →

Li2CO3 - карбонат лития
BaO + SO2 → BaSO3- сульфит бария
Na2O + SO3 → Na2SO4 – сульфат натрия
3K2O + P2O5 →2K3PO4 – фосфат калия
Слайд 11Кислотные оксиды реагируют:
4. Менее летучие кислотные оксиды вытесняют более летучие кислотные оксиды

из их солей.
сплавление
Na2CO3 + SiO2 → Na2SiO3 + CO2↑
Слайд 12Кислотные оксиды реагируют:
5. Кислотный оксид, содержащий элемент, способный повысить степень окисления, может

реагировать с кислородом.
+4 +6
2SO2 + O2 → 2SO3
Слайд 13Выполни тест
для закрепления темы
1. Большинство кислотных оксидов реагирует:
1. только с водой

2. только с кислотами
3. со щелочами и кислотами
4. с водой и щелочами
2. Укажите номер кислотного оксида:
1.K2O 3. H2SO3
2. P2O5 4. BaO
Слайд 14Выполни тест
для закрепления темы
3. С оксидом углерода (IV) взаимодействует:
1. P2O5 3.

HCl
2. Na2SO4 4. CaO
4. Оксид серы (VI) не реагирует с:
1. NaOH 3. CaO
2. H2O 4. CO2
Слайд 15Выполни тест
для закрепления темы
5. Оксид фосфора (V) не реагирует с:
1. H2O

3. NaOH
2. CaO 4. SO3
6. Укажите оксиды, взаимодействующие между собой:
1.Li2O и CaO 3. SO3 и Na2O
2. CO2 и SiO2 4. BaO и MgO














 Изображения изделий и их обозначения при выполнении графических конструкторских документов
Изображения изделий и их обозначения при выполнении графических конструкторских документов Использование функций
Использование функций Математические задачи от русских, советских и зарубежных писателей
Математические задачи от русских, советских и зарубежных писателей Каникулы в международном детском лагере
Каникулы в международном детском лагере Язык есть исповедь народа
Язык есть исповедь народа Работа по стимулированию юридических лиц и индивидуальных предпринимателей к трудоустройству безработных
Работа по стимулированию юридических лиц и индивидуальных предпринимателей к трудоустройству безработных Физико-географическое районирование Северной Евразии
Физико-географическое районирование Северной Евразии  Узоры “тетёрки ” на печенье
Узоры “тетёрки ” на печенье Презентация на тему Постоянные магниты
Презентация на тему Постоянные магниты Весенний фестиваль для учащихся
Весенний фестиваль для учащихся 23 февраля. Поздравляем!
23 февраля. Поздравляем! Российский государственный университет нефти и газа имени И.М.Губкина Кафедра машин и оборудования нефтяной и газовой промышленн
Российский государственный университет нефти и газа имени И.М.Губкина Кафедра машин и оборудования нефтяной и газовой промышленн Звук и свет в лирике И. Анненского
Звук и свет в лирике И. Анненского Книжка-раскраска
Книжка-раскраска Взаимодействие научного руководителя со студентами через личный кабинет с использование сервиса Антиплагиат
Взаимодействие научного руководителя со студентами через личный кабинет с использование сервиса Антиплагиат Зачем живые организмы запасают питательные вещества?
Зачем живые организмы запасают питательные вещества? Особенности приема 2020 (колледж). Дистанционная подача документов
Особенности приема 2020 (колледж). Дистанционная подача документов Ресурсный Центр «Кристина»
Ресурсный Центр «Кристина» Проверка правильности кирпичной кладки
Проверка правильности кирпичной кладки Смешанное обучение – blended learning
Смешанное обучение – blended learning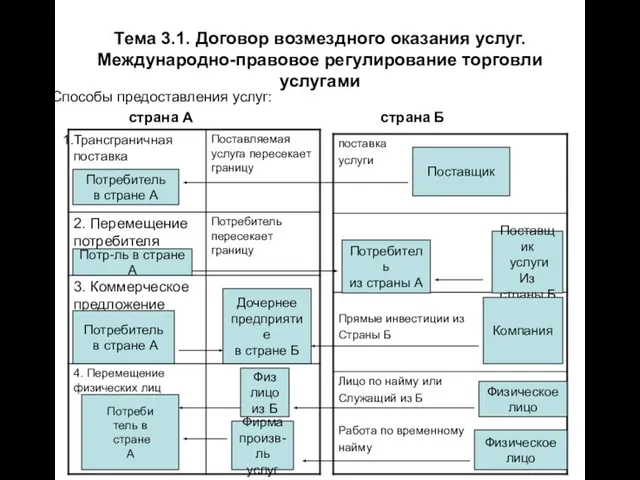 Тема 3.1. Договор возмездного оказания услуг. Международно-правовое регулирование торговли услугами Способы предоставления услуг
Тема 3.1. Договор возмездного оказания услуг. Международно-правовое регулирование торговли услугами Способы предоставления услуг Конвенция о правах ребенка
Конвенция о правах ребенка Богомолова Роза Александровна
Богомолова Роза Александровна Renault Assistance. Служба маркетинга запасных частей и послепродажного обслуживания
Renault Assistance. Служба маркетинга запасных частей и послепродажного обслуживания Принцип действия жидкокристаллических дисплеев
Принцип действия жидкокристаллических дисплеев Правила работы с обучающей презентацией
Правила работы с обучающей презентацией плакат
плакат ОП по Гагинскому району МО МВД России Большеболдинский: история, сегодняшнее состояние и перспективы развития
ОП по Гагинскому району МО МВД России Большеболдинский: история, сегодняшнее состояние и перспективы развития