Слайд 2
40Zr – [Kr]4d25s2
72Hf – [Xe,4f14]5d26s2
Устойчивая степень окисления (IV) в типичных соединениях
![40Zr – [Kr]4d25s2 72Hf – [Xe,4f14]5d26s2 Устойчивая степень окисления (IV) в типичных](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/428495/slide-1.jpg)
MO2, MF4, MCl4, M(SO4)2·4H2O.
Существуют также неустойчивые степени окисления II и III: ZrF2, ZrCl2, ZrCl3. Соединений гафния со степенью окисления II и III известно очень мало.
Слайд 3Zr и Hf не образуют в водных растворах нитратов, сульфатов, карбонатов и

фосфатов из-за необратимого гидролиза этих солей и высокой склонности Zr и Hf к образованию одно и полиядерных комплексов с этими анионами, например [Hf(SO4)3]2-.
Нитраты, сульфаты и др. получают либо в безводных средах, либо при сплавлении с реагентами, служащими источниками данных анионов:
ZrCl4 + 4N2O5 = Zr(NO3)4 + 4NO2Cl.
Слайд 5 Вследствие больших размеров атомов вокруг них может разместиться больше лигандов, чем
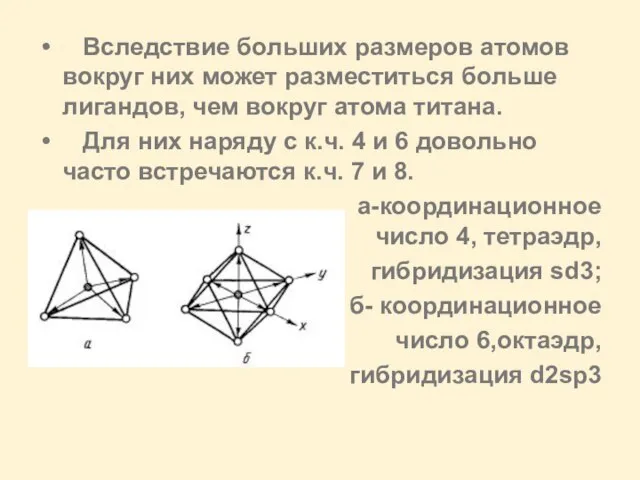
вокруг атома титана.
Для них наряду с к.ч. 4 и 6 довольно часто встречаются к.ч. 7 и 8.
а-координационное число 4, тетраэдр,
гибридизация sd3;
б- координационное
число 6,октаэдр,
гибридизация d2sp3
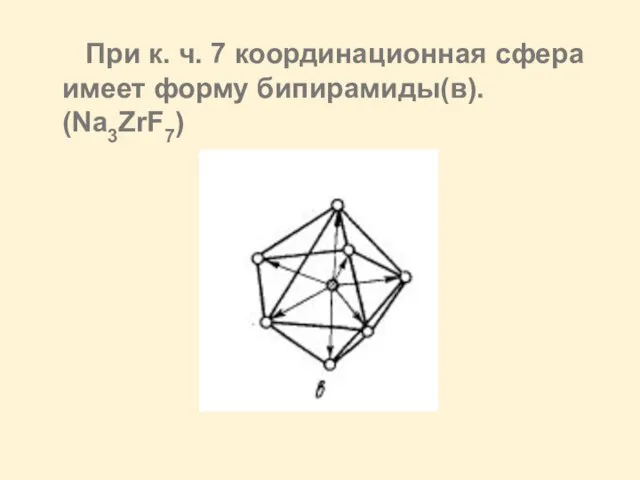
Слайд 6 При к. ч. 7 координационная сфера имеет форму бипирамиды(в). (Na3ZrF7)
Слайд 7 При к.ч. 8 координационная сфера может представлять собой куб(г), тригональный додекаэдр(д)
![При к.ч. 8 координационная сфера может представлять собой куб(г), тригональный додекаэдр(д) (Li6[BeF4][ZrF8]) или квадратную антипризму(е) (Cu3[Zr2F14]·18H2O)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/428495/slide-6.jpg)
(Li6[BeF4][ZrF8]) или квадратную антипризму(е) (Cu3[Zr2F14]·18H2O)
Слайд 8История открытия
Цирконий открыт в
1789 г. Свое название
он получил по
минералу циркону,
исследуя

который,
М. Клапрот выделил
оксид, названный
им цирконовой землей.
Слайд 9Гафний открыт в 1923г.
Д. Костер и Г. Хевеши.
Назван гафнием в
честь

города, где было
сделано открытие
(Hafnia — латинское
название Копенгагена).
Слайд 10Минералы
Цирконий в природе представлен минералом бадделеитом ZrO2 и цирконом ZrSiO4.
Гафний собственных минералов

не образует, но присутствует как примесь во всех минералах циркония.
Слайд 11Получение
HfSiO4 + ZrSiO4 + C = HfC + ZrC + SiO (t=1800

oC)
HfC + ZrC + Cl2 = HfCl4 + ZrCl4 +CCl4 (t=500 oC)
Металлические цирконий и гафний в виде губчатой массы
получают восстановлением и инертной среде тетрахлоридов
или комплексных фторидов:
K2[MeF6](ж) + 4Na(ж) = Me(к) + 2KF + 4NaF(ж)
Металлы особой чистоты получают при помощи иодидного
рафинирования:
Me + 2I2(г) ↔ MeI4(г) ;t1
MeI4(г) ↔ Me +2I2(г) ;t2
t1>t2
Реакция протекает в вакууме (0,01 Па), до 200 ОС образуется
MeI4, выше 200 – Me и I2.
Слайд 12Разделение
Цирконий и гафний разделяют, используя минимальные различия в свойствах соединений этих

элементов. Промышленное применение пока нашли два метода:
экстракционный, основанный на разной растворимости соединений циркония и гафния в метилизобутилкетоне или трибутилфосфате, и
метод дробной кристаллизации комплексных фторидов, основанный на различной растворимости K2[HfF6] и K2[ZrF6] в воде.
Слайд 13Физико-химические свойства
Цирконий и гафний, как и вес переходные: элементы,— металлы. Cуществуют в

двух полиморфных модификациях:
при низкой температуре их решетка гексагональная плотноупакованная (к.ч. 12; α-модификация),
при высокой— объемно-центрированная и кубическая (к.ч. 8; β-модификация).
Слайд 14Химические свойства
MeN
N2 t>900 oC
H2[MeF6] H2[Me(SO4)3]
HF(р) H2SO4(кип)
Hal2, t O2, t>600oC
MeHal4 Zr,
![Химические свойства MeN N2 t>900 oC H2[MeF6] H2[Me(SO4)3] HF(р) H2SO4(кип) Hal2, t](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/428495/slide-13.jpg)
Hf MeO(2±х)
H2O(г) H2O(г)
t<800oC t>800 oC
P, S, B, C
t>800 oC
MeO2 + MeH MeO2 + H2
MeS2, MeC, MeB, MeP
Слайд 15Соединения с кислородом
Оксиды
C кислородом образуют нестехиометрические оксиды состава MeO(2±х). Это белые
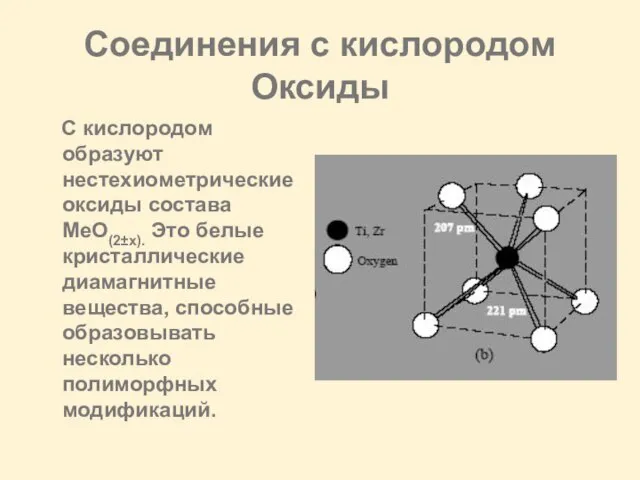
кристаллические диамагнитные вещества, способные образовывать несколько полиморфных модификаций.
Слайд 16Гидроксиды.
Гидроксиды у рассматриваемых элементов неизвестны. При добавлении оснований к растворам соединений
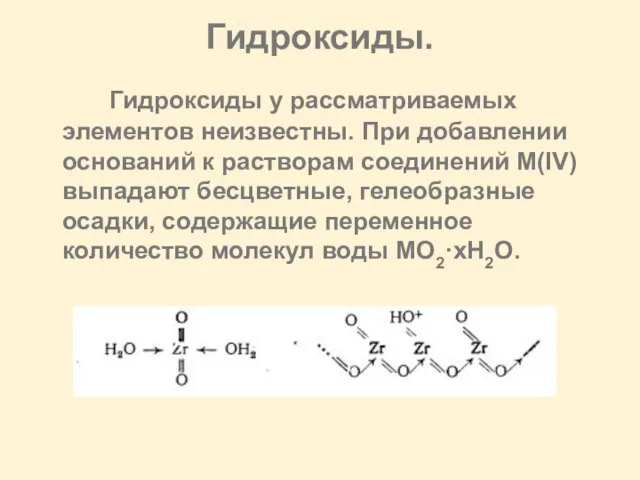
М(IV) выпадают бесцветные, гелеобразные осадки, содержащие переменное количество молекул воды MO2·xH2O.
Слайд 17 Свежеосажденные гидратированные диоксиды – химически активные соединения:
ZrO2·xH2O +4KOH(ж) = (K4,Zr)O4 +

(x+2)H2O
Прокаленные диоксиды -тугоплавкие, химически инертные вещества. Возможны только реакции:
ZrO2 + 6HF = H2[ZrF6] + 2H2O
ZrO2 + 2K2S2O7(ж) = K2[Zr(SO4)2O] + K2SO4 + SO3(г)
Слайд 18Пероксиды
При взаимодействии щелочного раствора H2O2 с солями Zr или свежеосаждённым ZrO2·xH2O, образуются
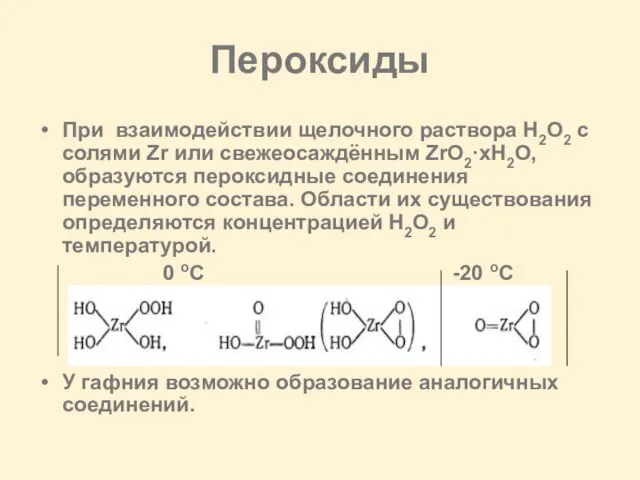
пероксидные соединения переменного состава. Области их существования определяются концентрацией H2O2 и температурой.
0 oC -20 oC
У гафния возможно образование аналогичных соединений.
Слайд 19Галогениды
При комнатной температуре все тетрагалогениды - твердые вещества. Все галогениды с

молекулярной кристаллической решеткой подвергаются полному гидролизу, но в разной степени:
ZrCl4 + H2O = ZrCl2O + 2HCl
Оксид-дихлорид циркония(IV) кристаллизуется из водных растворов в виде тетрамера:
(ZrCl2O·8H2O)4 ≡ [Zr4(H2O)16(OH)8]Cl8·12H2O
Слайд 20Низшие галогениды
Низшие галогениды – тёмноокрашенные кристаллические вещества. При взаимодействии с

водой быстро окисляются и гидролизуются. Менее летучи, чем тетрагалогениды.
Получаются восстановлением соответствующих тетрагалогенидов в вакууме или атмосфере инертного газа:
3MeCl4 + Zr ↔ 4MeCl3
Слайд 21Химия растворов
Цирконий и гафний практически никогда в соединениях не присутствуют в виде

одноатомных ионов
Не образуют типичных ионных связей.
Их соединения имеют преимущественно неионный характер и в большинстве случаев являются комплексными.
В случае циркония и гафния те типы ионов и молекул, которые имеются в газовой фазе или в растворе, не обязательно существуют в твердом состоянии.
Слайд 22 При гидролизе солей Zr и Hf возникают
такие равновесия:
Me[(H2O)x]4+ + H2O
![При гидролизе солей Zr и Hf возникают такие равновесия: Me[(H2O)x]4+ + H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/428495/slide-21.jpg)
↔ [Me(OH)(H2O)x-1]3+ +
H3О+ и т.д.
Цирконий и гафний в водных растворах H2SO4 находятся в виде комплексных анионов [Zr(SO4)3O] n 4n-, [Zr(SO4)3OH] n 3n- и
др., которые в присутствии
сульфатов щелочных
металлов могут быть
выделены в виде
кристаллических осадков
переменного состава:
M4[Zr4(SO4)4-6(OH)8-10O1-2]·xH2O
Слайд 23 Фосфаты Zr и Hf наименее растворимые из всех известных фосфатов. Растворимость
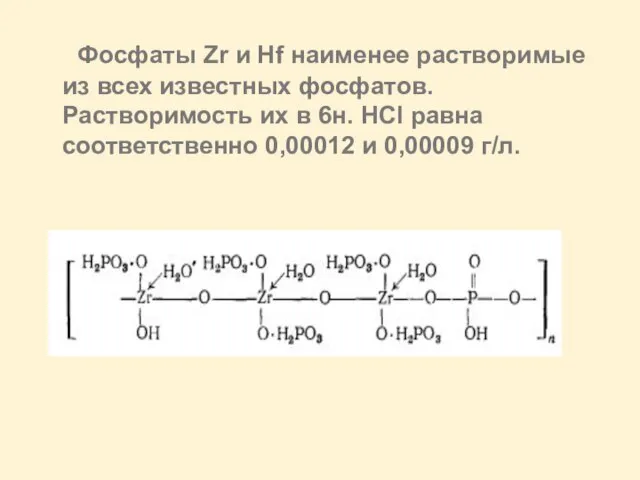
их в 6н. HCl равна соответственно 0,00012 и 0,00009 г/л.
Слайд 24Комлексные соединения
Zr и Hf образуют многочисленные ацидокомплексы и полиядерные гидроксооксоаквакомплесы.
Zr и

Hf могут быть центральными атомами как сложных катионов, так и сложных анионов.
Устойчивость ацидокомплексов с галогенидными лигандами падает от F- к I-. Известны комплексы состава K3[ZrF7], Na4[HfF8] и др.
Цирконий образует прочные оксалатные комплексы, не поддающиеся гидролизу H4[Zr(ox)3O].
Слайд 25 Анионы по их способности координироваться с атомами Zr и Hf дожы

располагаться так:
Возможность образования тех или иных комплексов увеличивается при увеличении концентрации лигандов в растворе.
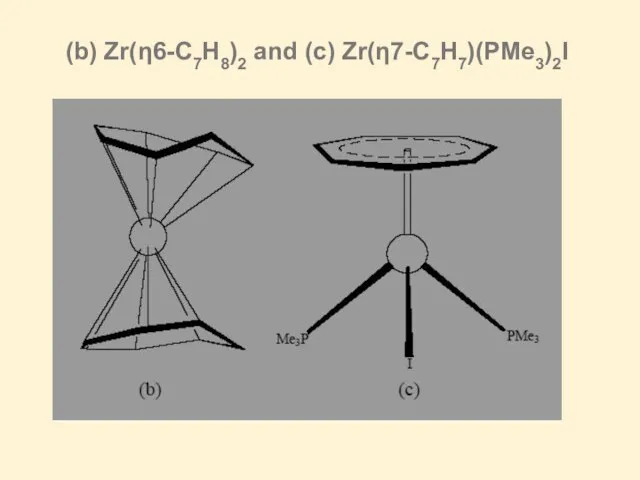
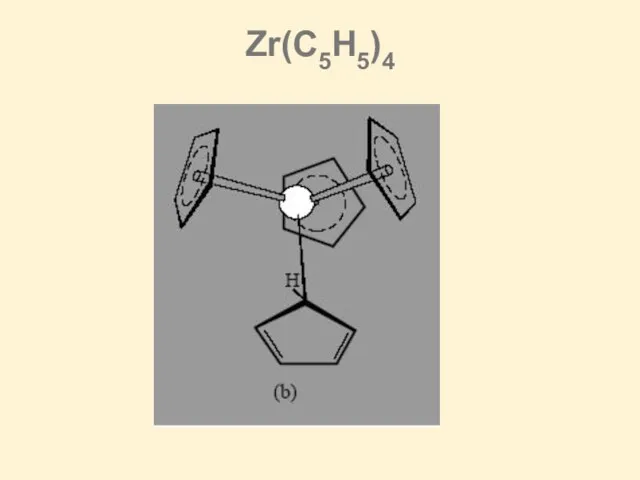
Слайд 27(b) Zr(η6-C7H8)2 and (c) Zr(η7-C7H7)(PMe3)2I
Слайд 29Токсикология.
Отравление цирконием и его соединениями проявляется болью в сердце, потливостью, головными болями.

При хронических отравлениях отмечается снижение гемоглобина в крови.
Гексафторцирконаты относят к промышленным ядам токсического действия.
Оксид и карбид гафния относят к малотоксичным соединениям.
![40Zr – [Kr]4d25s2 72Hf – [Xe,4f14]5d26s2 Устойчивая степень окисления (IV) в типичных](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/428495/slide-1.jpg)



![При к.ч. 8 координационная сфера может представлять собой куб(г), тригональный додекаэдр(д) (Li6[BeF4][ZrF8]) или квадратную антипризму(е) (Cu3[Zr2F14]·18H2O)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/428495/slide-6.jpg)






![Химические свойства MeN N2 t>900 oC H2[MeF6] H2[Me(SO4)3] HF(р) H2SO4(кип) Hal2, t](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/428495/slide-13.jpg)







![При гидролизе солей Zr и Hf возникают такие равновесия: Me[(H2O)x]4+ + H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/428495/slide-21.jpg)



![[Zr(BH4)4] Zr(C5H5)4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/428495/slide-25.jpg)


 Предложение по проведению медиакампании для номинантов «Национальной Цифровой премии» «Золотой» пакет
Предложение по проведению медиакампании для номинантов «Национальной Цифровой премии» «Золотой» пакет Сенситивные периоды человека (методика Марии Монтессори)
Сенситивные периоды человека (методика Марии Монтессори) Проект «Воспитание гражданина демократического общества» Место реализации: МОУ СОШ 33 г. Томска Срок реализации: 2008-2009 г. г. Целевая
Проект «Воспитание гражданина демократического общества» Место реализации: МОУ СОШ 33 г. Томска Срок реализации: 2008-2009 г. г. Целевая  Общие и специальные функции физической культуры
Общие и специальные функции физической культуры Стандарт организации работы общеобразовательной школы
Стандарт организации работы общеобразовательной школы Викторина "Знатоки космоса" для начальной школы
Викторина "Знатоки космоса" для начальной школы Что такое сила
Что такое сила Составители: Балдина Ирина Владимировна, заместитель директора Центра дополнительного образования для детей "Юность" г. Белгорода
Составители: Балдина Ирина Владимировна, заместитель директора Центра дополнительного образования для детей "Юность" г. Белгорода Кредит
Кредит Городские общественные пространства
Городские общественные пространства Туризм
Туризм  Презентация на тему Первые русские князья
Презентация на тему Первые русские князья ООО СэндвичПанель - Лайт. Бизнес-план
ООО СэндвичПанель - Лайт. Бизнес-план Эволюция Российского герба
Эволюция Российского герба Лукас Кранах Старший
Лукас Кранах Старший Запасы на зиму
Запасы на зиму Итоги государственного экзамена
Итоги государственного экзамена Доходная недвижимость. Инвесторский ремонт. Урок 6
Доходная недвижимость. Инвесторский ремонт. Урок 6 Два имени, две судьбы
Два имени, две судьбы Украшения ручной работы в технике фриволите
Украшения ручной работы в технике фриволите театр ноябрь
театр ноябрь What Do We Eat For Breakfast (Lunch, Dinner)?
What Do We Eat For Breakfast (Lunch, Dinner)? Город здоровья
Город здоровья Безверхий К.Ю
Безверхий К.Ю Правописание безударных гласных в корне слова
Правописание безударных гласных в корне слова Олигофрения
Олигофрения Как справиться со стрессом при пандемии
Как справиться со стрессом при пандемии Стилистические фигуры
Стилистические фигуры