Содержание
- 2. Пути образования и поддержани пула аминокислот в организме. Транспорт аминокислот в клетки. 5. Транспортные белки (транспорт
- 3. Биологические функции аминoкислoт. 1. Стpуктуpные элeменты пeптидов и белков. В состав белков входят 20 протеиногенных аминокислот,
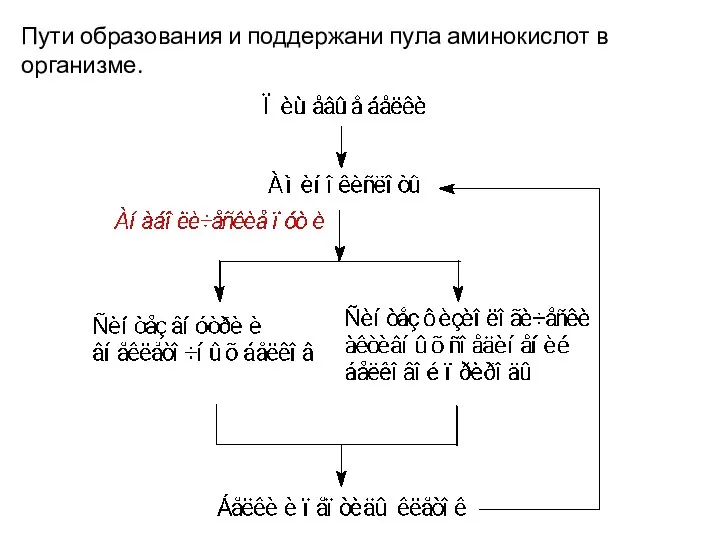
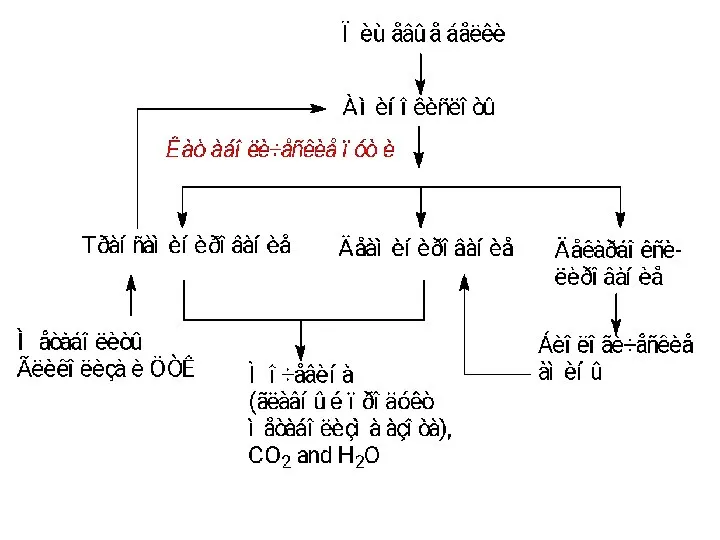
- 4. Пути образования и поддержани пула аминокислот в организме.
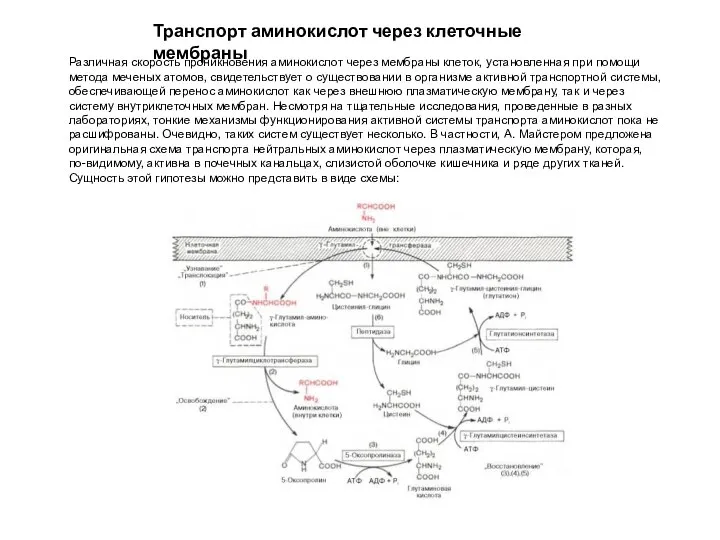
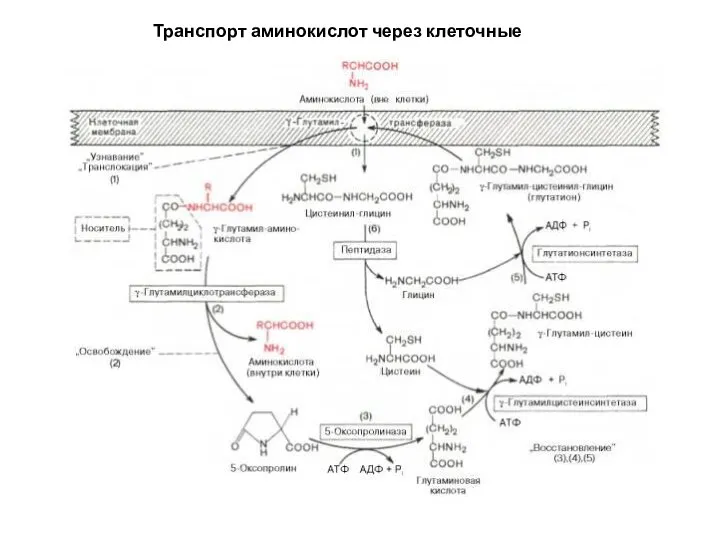
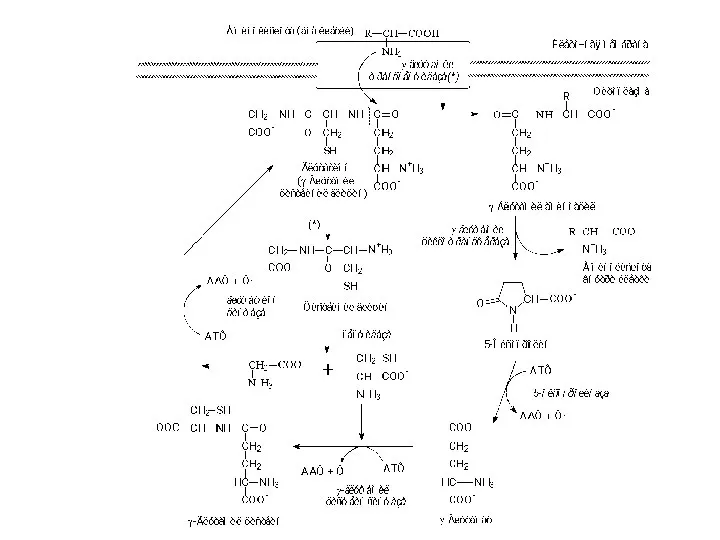
- 6. Транспорт аминокислот через клеточные мембраны Различная скорость проникновения аминокислот через мембраны клеток, установленная при помощи метода
- 7. Транспорт аминокислот через клеточные мембраны
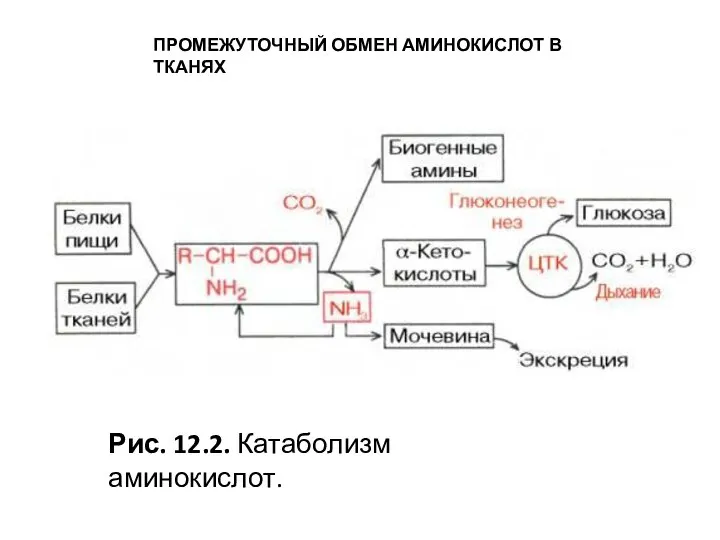
- 9. ПРОМЕЖУТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ В ТКАНЯХ Промежуточный метаболизм аминокислот белковых молекул, как и других питательных веществ в
- 10. ПРОМЕЖУТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ В ТКАНЯХ Рис. 12.2. Катаболизм аминокислот.
- 11. Общие пути обмена аминокислот Общие пути превращения аминокислот включают реакции деаминирования, трансаминирования, декарбоксилирования, биосинтеза и рацемизации.
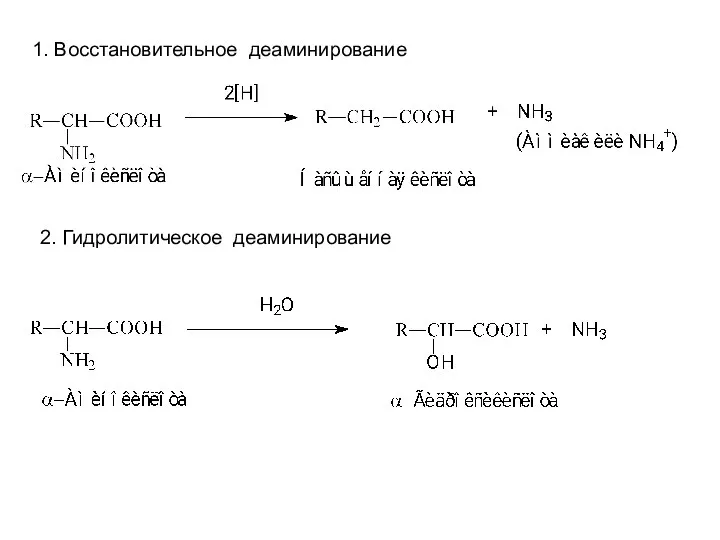
- 12. Общие пути обмена аминокислот Деаминирование аминокислот Доказано существование 4 типов деаминирования аминокислот (отщепление аминогруппы). Во всех
- 13. 1. Восстановительное деаминирование 2. Гидролитическое деаминирование
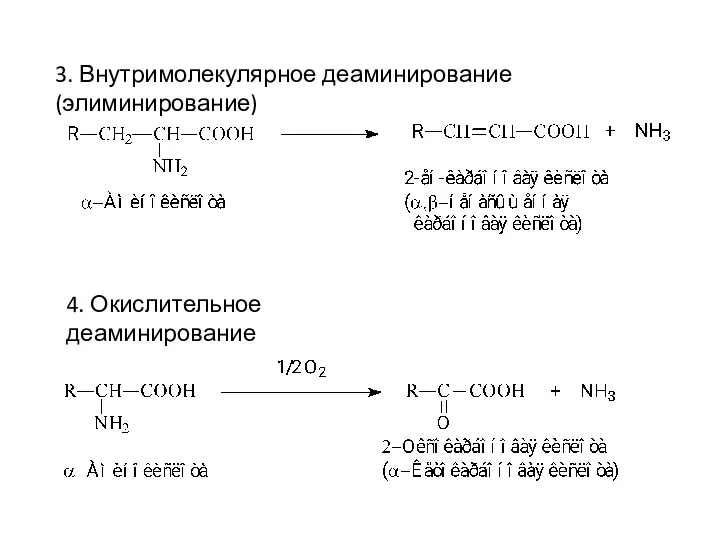
- 14. 3. Внутримолекулярное деаминирование (элиминирование) 4. Окислительное деаминирование
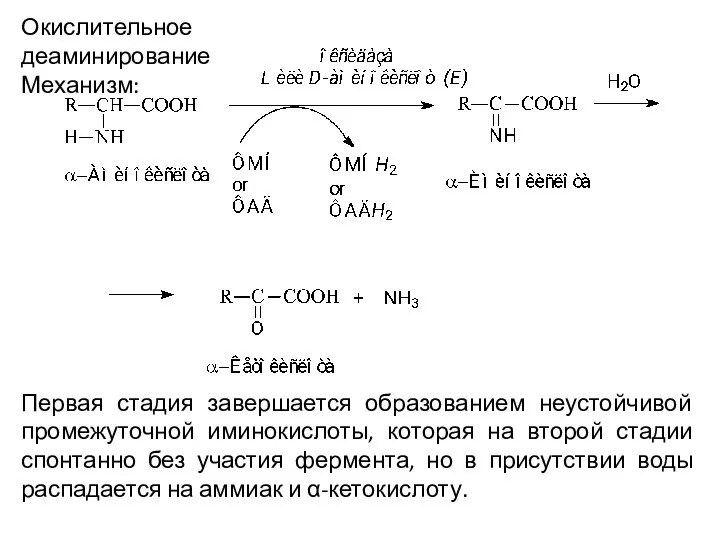
- 15. Окислительное деаминирование Механизм: Первая стадия завершается образованием неустойчивой промежуточной иминокислоты, которая на второй стадии спонтанно без
- 16. Помимо аммиака, продуктами дезаминирования являются жирные кислоты, оксикислоты и кетокислоты. Для животных тканей, растений и большинства
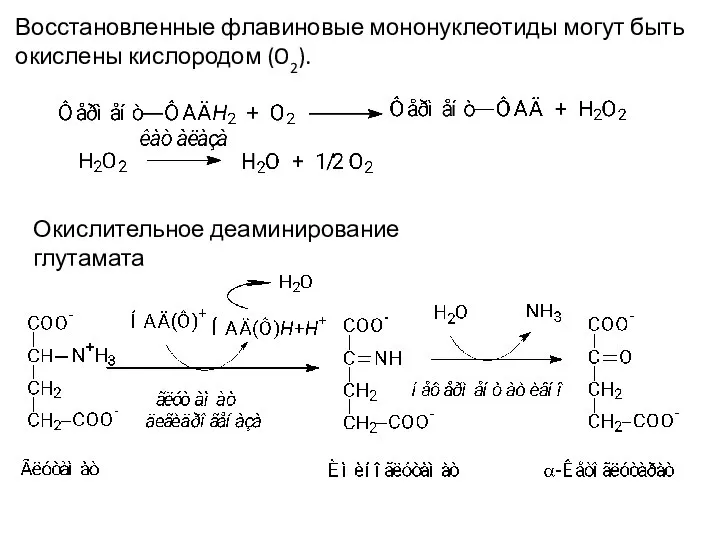
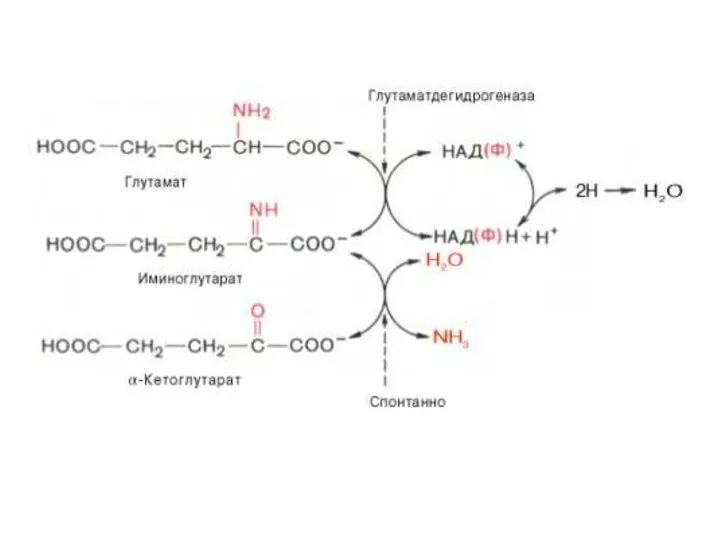
- 17. Восстановленные флавиновые мононуклеотиды могут быть окислены кислородом (O2). Окислительное деаминирование глутамата
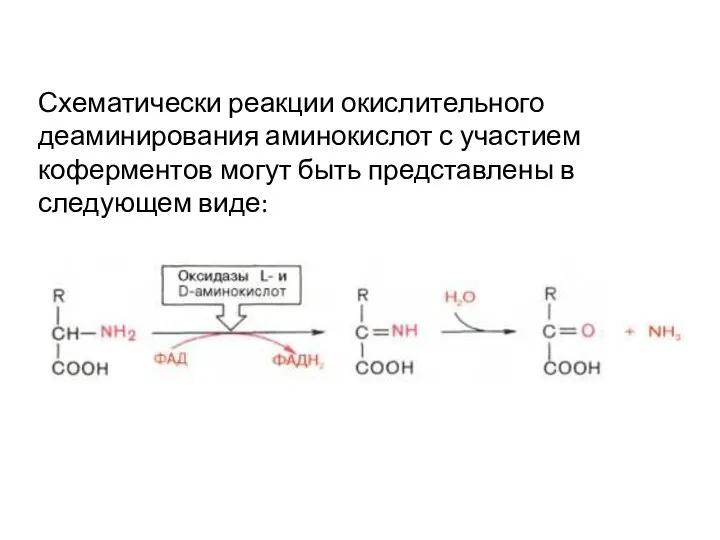
- 18. Схематически реакции окислительного деаминирования аминокислот с участием коферментов могут быть представлены в следующем виде:
- 19. Восстановленные флавин-нуклеотиды оксидаз L- и D-аминокислот могут непосредственно окисляться молекулярным кислородом. При этом образуется перекись водорода,
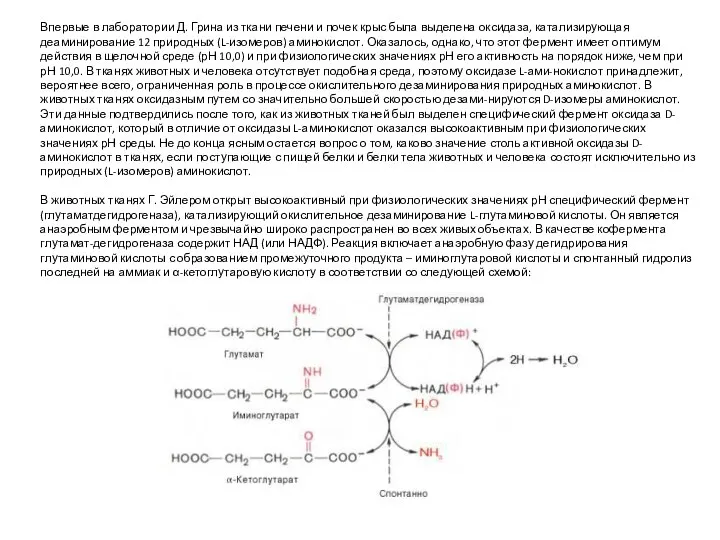
- 20. Впервые в лаборатории Д. Грина из ткани печени и почек крыс была выделена оксидаза, катализирующая деаминирование
- 22. Неокислительное деаминирование Cерина, Треонина и Цистеина.
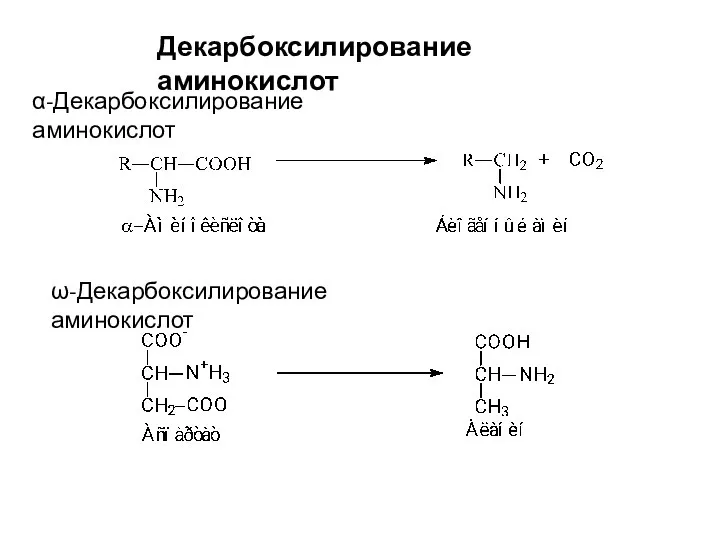
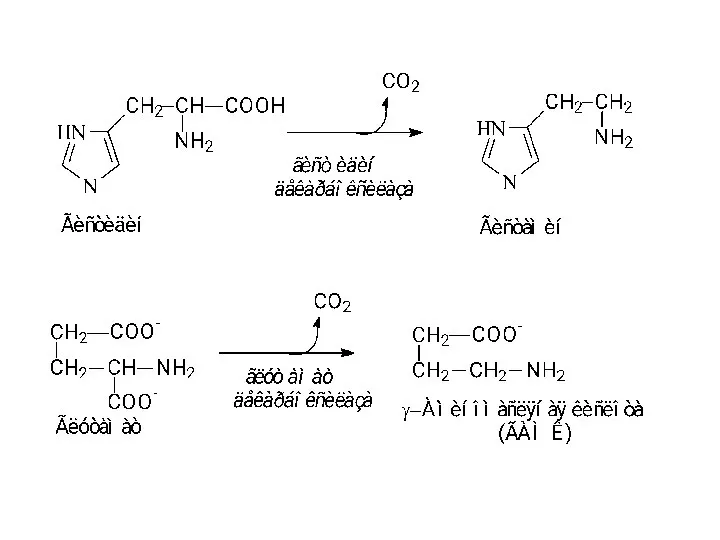
- 23. Декарбоксилирование аминокислот α-Декарбоксилирование аминокислот ω-Декарбоксилирование аминокислот
- 24. Декарбоксилирование аминокислот сопряженное с трансаминированием. Декарбоксилирование аминокислот сопряженное с конденсацией двух молекул.
- 27. Скачать презентацию









 Фотосинтез
Фотосинтез Сукцессия. Саморазвитие экосистемы
Сукцессия. Саморазвитие экосистемы Невидимые нити в осеннем лесу
Невидимые нити в осеннем лесу Брахиозавр (Плечистый Ящер)
Брахиозавр (Плечистый Ящер) Царства живой природы
Царства живой природы Способы размножения растений. Урок №24
Способы размножения растений. Урок №24 Презентация на тему ТИП ПЛОСКИЕ ЧЕРВИ
Презентация на тему ТИП ПЛОСКИЕ ЧЕРВИ  Викторина по биологии
Викторина по биологии Адаптация. Ее формы и механизмы
Адаптация. Ее формы и механизмы Тест по теме Свиньи
Тест по теме Свиньи Видообразование
Видообразование Биологияны оқыту әдістері мен әдістемелік тәсілдері
Биологияны оқыту әдістері мен әдістемелік тәсілдері Презентация на тему Медузы
Презентация на тему Медузы  Миоглобин. Тропонин. Церулоплазмин. Гаптоглобин
Миоглобин. Тропонин. Церулоплазмин. Гаптоглобин Уровни организации. Структура тела. Органы и системы органов
Уровни организации. Структура тела. Органы и системы органов Vylučovanie - močová sústava človeka
Vylučovanie - močová sústava človeka Вітамін А
Вітамін А Строение белков
Строение белков Синапсы. Классификация синапсов
Синапсы. Классификация синапсов Презентация на тему НАДКЛАСС РЫБЫ
Презентация на тему НАДКЛАСС РЫБЫ  Половая система
Половая система Высшие споровые растения, происхождение, общая характеристика. Жизненный цикл высших споровых растений
Высшие споровые растения, происхождение, общая характеристика. Жизненный цикл высших споровых растений Печеночный сосальщик. Цикл развития
Печеночный сосальщик. Цикл развития Анастомоз. Анатомия
Анастомоз. Анатомия Сравнительная шкала разрешающей способности невооруженного глаза, светового и электронного микрскопов
Сравнительная шкала разрешающей способности невооруженного глаза, светового и электронного микрскопов Альвеолярно-капиллярная мембрана
Альвеолярно-капиллярная мембрана Тип Моллюски
Тип Моллюски Развитие насекомых
Развитие насекомых