Содержание
- 2. Азотистый обмен. Общие пути. В организме человека содержится примерно 15 кг белков. Количество свободных аминокислот составляет
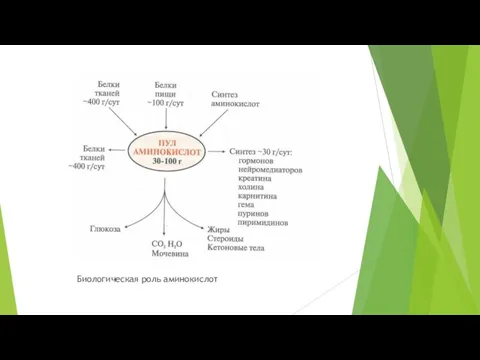
- 3. Биологическая роль аминокислот
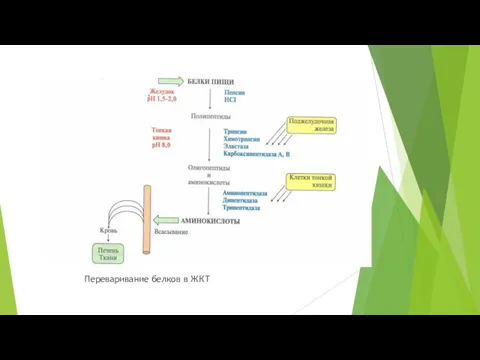
- 4. Переваривание белков в ЖКТ. Переваривание белков включает гидролиз пищевых белков до свободных аминокислот. Расщепление пептидных связей
- 5. Переваривание белков в ЖКТ
- 6. Переваривание белков в желудке. Переваривание белков в желудке происходит под действием пепсина. Профермент вырабатывается главными клетками
- 7. Переваривание белков в кишечнике Происходит при pH ~ 8,0, изменение pH происходит под действием HCO3-, поступающего
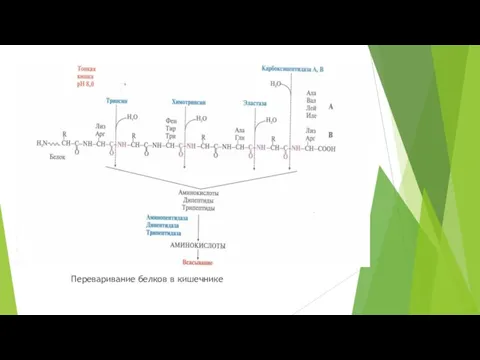
- 8. Переваривание белков в кишечнике
- 9. Трипсин синтезируется в поджелудочной железе в виде профермента трипсиногена. Превращение трипсиногена в трипсин происходит 2 путями:
- 10. Ферменты, переваривающие белки в кишечнике обладают специфичностью к определенным аминокислотам: Трипсин гидролизует пептидные связи между арг
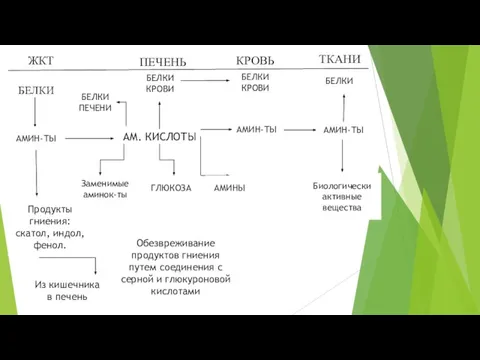
- 11. ЖКТ ТКАНИ КРОВЬ ПЕЧЕНЬ БЕЛКИ АМ. КИСЛОТЫ АМИН-ТЫ АМИНЫ ГЛЮКОЗА Заменимые аминок-ты БЕЛКИ КРОВИ АМИН-ТЫ БЕЛКИ
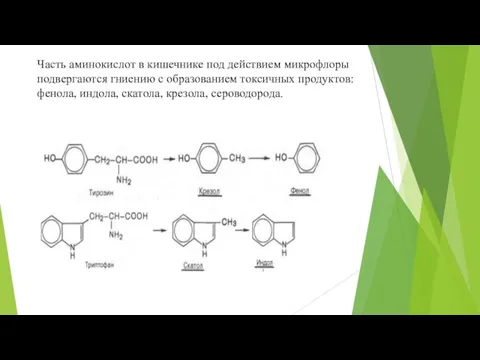
- 12. Часть аминокислот в кишечнике под действием микрофлоры подвергаются гниению с образованием токсичных продуктов: фенола, индола, скатола,
- 13. Общие пути обмена аминокислот Пути распада аминокислот до конечных продуктов можно разделить на три основные группы:
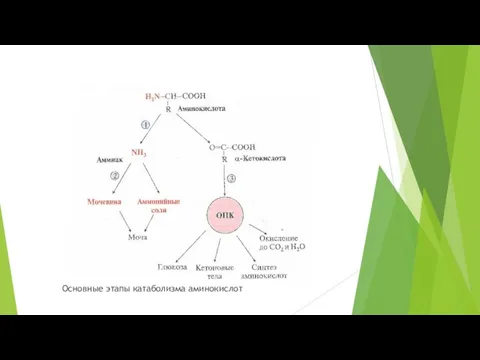
- 14. Основные этапы катаболизма аминокислот
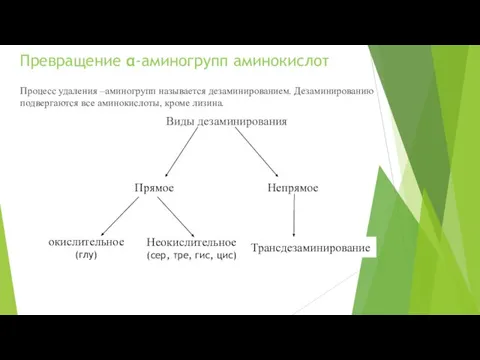
- 15. Превращение α-аминогрупп аминокислот Процесс удаления –аминогрупп называется дезаминированием. Дезаминированию подвергаются все аминокислоты, кроме лизина. Виды дезаминирования
- 16. Виды дезаминирования 1. Окислительное дезаминирование (прямое, характерное для глу) происходит в митохондриях многих тканей, а наиболее
- 17. 2. Прямое неокислительное дезаминирование характерно для серина, треонина, цистеина и гистидина. Серин и треонин дезаминируются с
- 18. Гистидин дезаминируется внутримолекулярным способом Цистеин дезаминируется с выделением H2S c использованием воды.
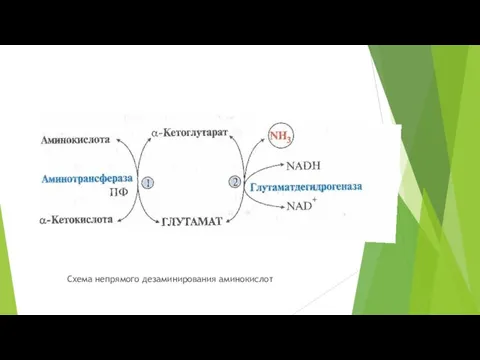
- 19. Большинство аминокислот в клетках непрямому дезаминированию, которое включает 2 стадии: Трансаминирование с α-кетоглутаратом, образование в цитозоле
- 20. Схема непрямого дезаминирования аминокислот
- 21. Аминотрансферазы, катализирующие реакцию трансаминирования обладают субстратной специфичностью. Наиболее важными являются АСТ и АЛТ. АЛТ катализирует реакцию
- 22. В результате трансаминирования образуется глутаминовая кислота. Затем глутаминовая кислота подвергается окислительному дезаминированию:
- 23. Клиническое значение определения активности аминотрансфераз В сыворотке крови здоровых людей активность аминотрансфераз ниже, чем в органах.
- 24. Декарбоксилирование аминокислот. Процесс отщепления карбоксильной группы в виде СО2 называется декарбоксилированием и приводит к образованию биогенных
- 25. При декарбоксилировании Три, Гис, Фен, Глу образуются биогенные амины: Серотонин обладает сосудосуживающим действием, участвует в регуляции
- 26. Недостаточность дофамина в черной субстанции мозга приводит к болезни Паркинсона. При этом снижена активность ДОФАдекарбоксилазы, тирозингидроксилазы.
- 27. Гистамин обладает сосудорасширяющим действием. Много образуется в области воспаления, участвует в развитии аллергических реакций. ГАМК является
- 28. Орнитин, декарбоксилируясь, дает диамин путресцин (1,4-диаминобутан): При декарбоксилировании лизина образуется кадаверин (1,5-диаминопентан):
- 29. Превращение углеродного скелета аминокислот Катаболизм всех аминокислот сводится к образованию 6 веществ, вступающих в общий путь
- 31. Скачать презентацию




















 Осень в жизни птиц
Осень в жизни птиц Строение цветка
Строение цветка Конформация циклогексана - С6
Конформация циклогексана - С6 Обобщающий урок Строение и многообразие покрытосеменных растений
Обобщающий урок Строение и многообразие покрытосеменных растений Квіти. Тварини
Квіти. Тварини Общие закономерности жизни. Явления и закономерности жизни на клеточном уровне
Общие закономерности жизни. Явления и закономерности жизни на клеточном уровне Эмбриологические доказательства эволюции
Эмбриологические доказательства эволюции Строение тканей человека
Строение тканей человека Переваривание и всасывание белков. Продукты белкового обмена
Переваривание и всасывание белков. Продукты белкового обмена Грибы. Строение грибов
Грибы. Строение грибов Берегите птиц
Берегите птиц Ценные породы рыб
Ценные породы рыб Этапы развития человека
Этапы развития человека Витамины
Витамины Бионаноцеллюлоза. Уникальній продукт в практике мировой косметологии
Бионаноцеллюлоза. Уникальній продукт в практике мировой косметологии Индивидуальное развитие растений
Индивидуальное развитие растений Анатомия человека. Головной мозг
Анатомия человека. Головной мозг Лиственные деревья России
Лиственные деревья России Биологическое действие радиации. Закон радиоактивного распада. Термоядерные реакции
Биологическое действие радиации. Закон радиоактивного распада. Термоядерные реакции Отдел слизевики
Отдел слизевики Путешествие в мире Биологии
Путешествие в мире Биологии Насекомые
Насекомые Основные признаки животных организмов
Основные признаки животных организмов Красная книга - это сигнал бедствия
Красная книга - это сигнал бедствия Пищеварительная система (демонстрационный материал)
Пищеварительная система (демонстрационный материал) Строение плесневого гриба мукора
Строение плесневого гриба мукора Шляпочные грибы
Шляпочные грибы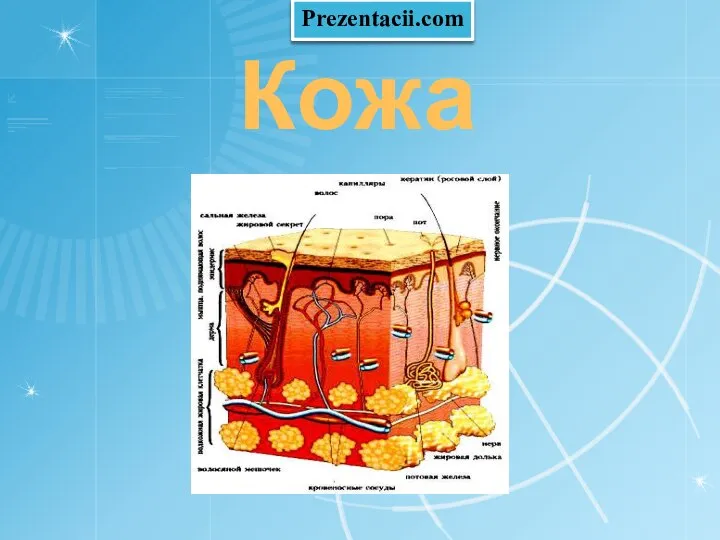 Кожа человека
Кожа человека