Содержание
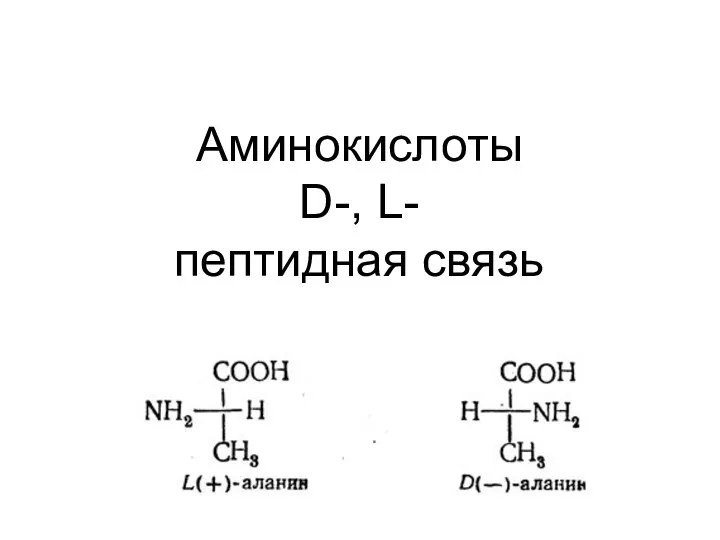
- 2. Аминокислоты D-, L- пептидная связь
- 3. Белки – высокомолекулярные природные соединения (биополимеры), состоящие из остатков аминокислот, которые соединены пептидной связью.
- 4. Функции белков 1) Структурная– определяет структуру тела, входят в состав различных биологических мембран. Эта функция является
- 5. Функции белков 6) Сократительная – обеспечивает сокращение мышцы, перистальтику и т.п. 7) Регуляторная – белки играют
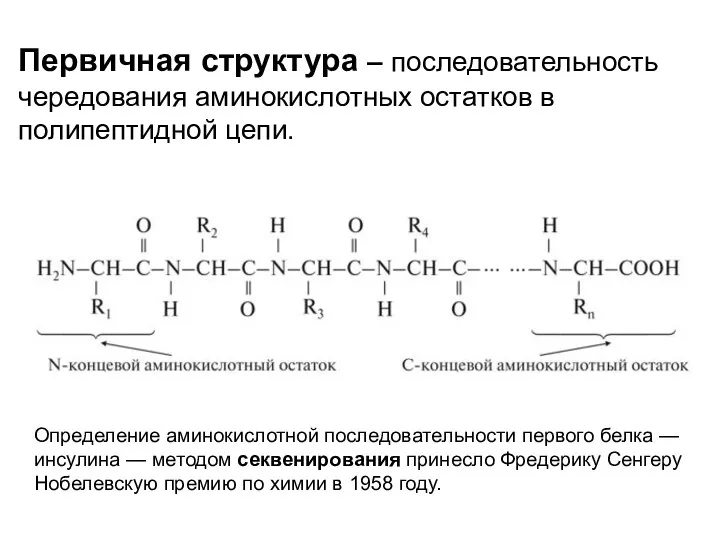
- 6. Первичная структура – последовательность чередования аминокислотных остатков в полипептидной цепи. Определение аминокислотной последовательности первого белка —
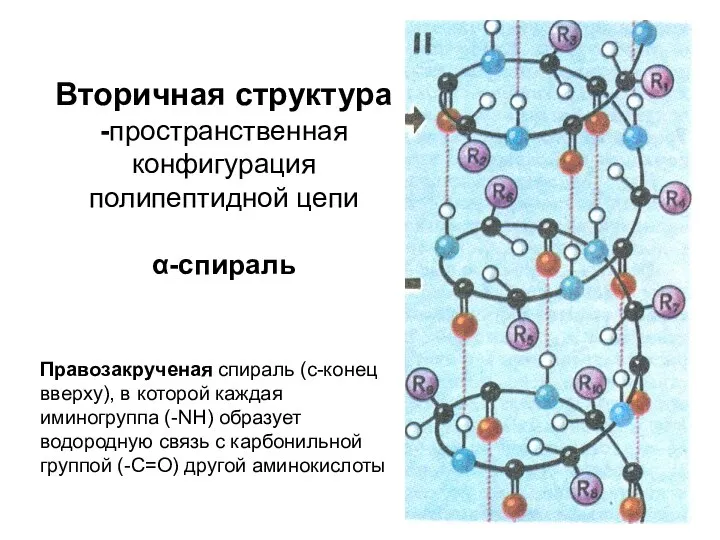
- 8. Вторичная структура -пространственная конфигурация полипептидной цепи α-спираль Правозакрученая спираль (с-конец вверху), в которой каждая иминогруппа (-NH)
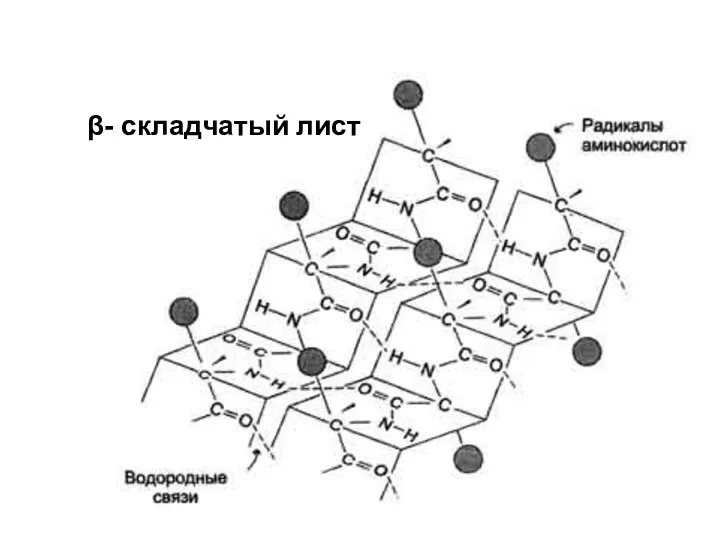
- 9. β- складчатый лист
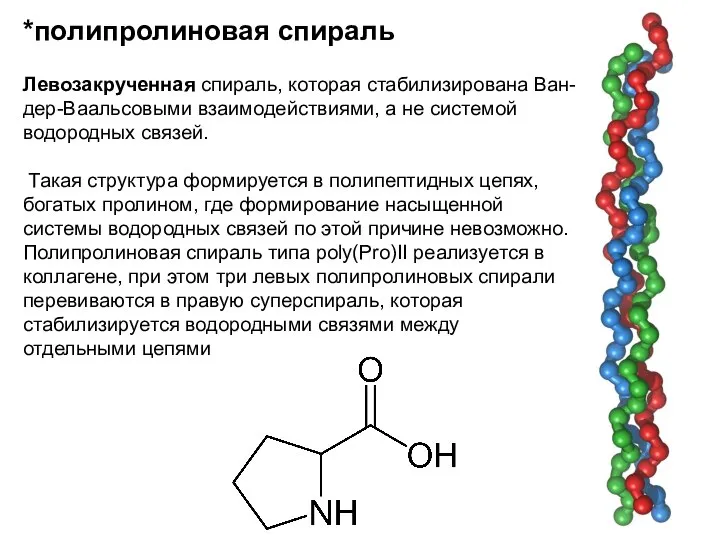
- 10. *полипролиновая спираль Левозакрученная спираль, которая стабилизирована Ван-дер-Ваальсовыми взаимодействиями, а не системой водородных связей. Такая структура формируется
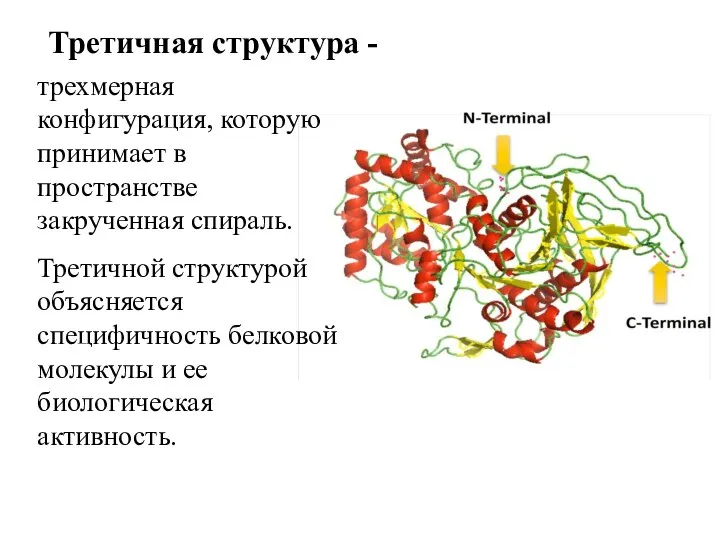
- 11. Третичная структура - трехмерная конфигурация, которую принимает в пространстве закрученная спираль. Третичной структурой объясняется специфичность белковой
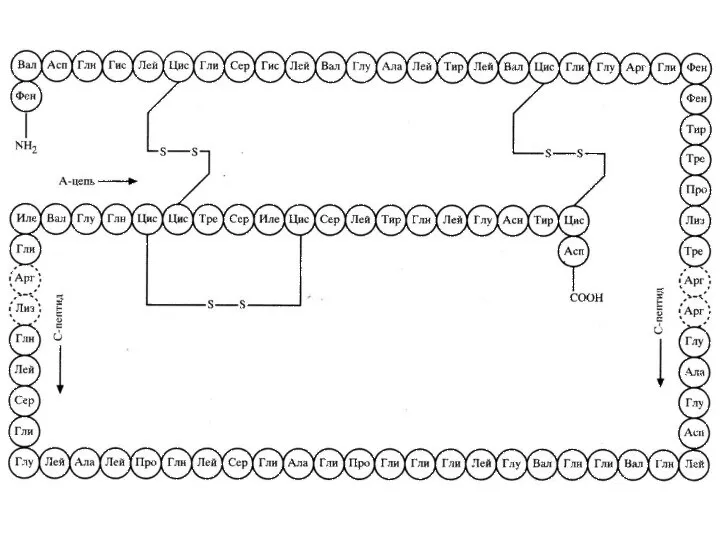
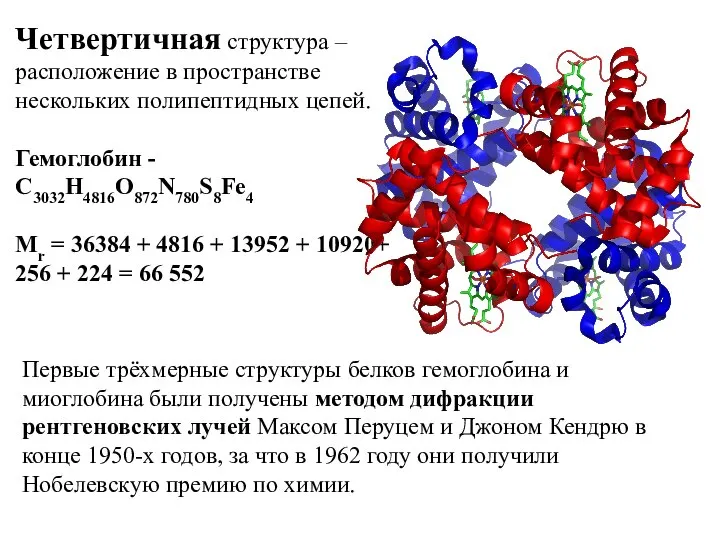
- 12. Четвертичная структура – расположение в пространстве нескольких полипептидных цепей. Гемоглобин - С3032H4816O872N780S8Fe4 Mr = 36384 +
- 13. Дифракция рентгеновских лучей Узкий пучок рентгеновских лучей был направлен на кристалл, за которым была расположена фотопластинка.
- 14. Рентгенограмма кристалла белка
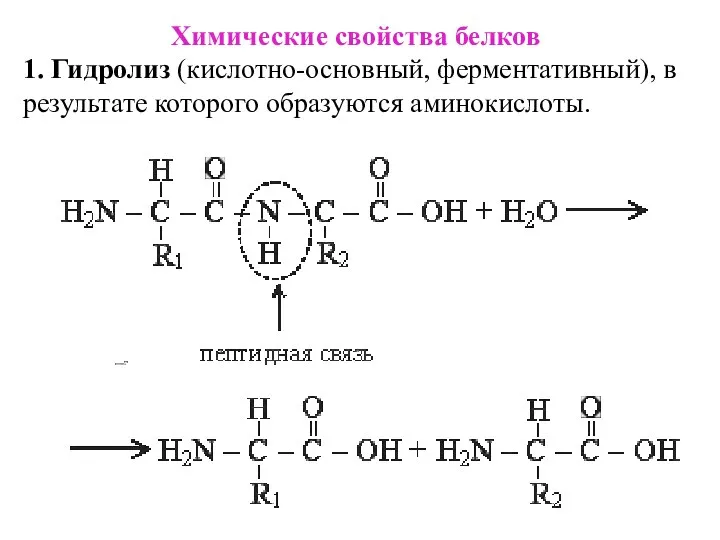
- 15. Химические свойства белков 1. Гидролиз (кислотно-основный, ферментативный), в результате которого образуются аминокислоты.
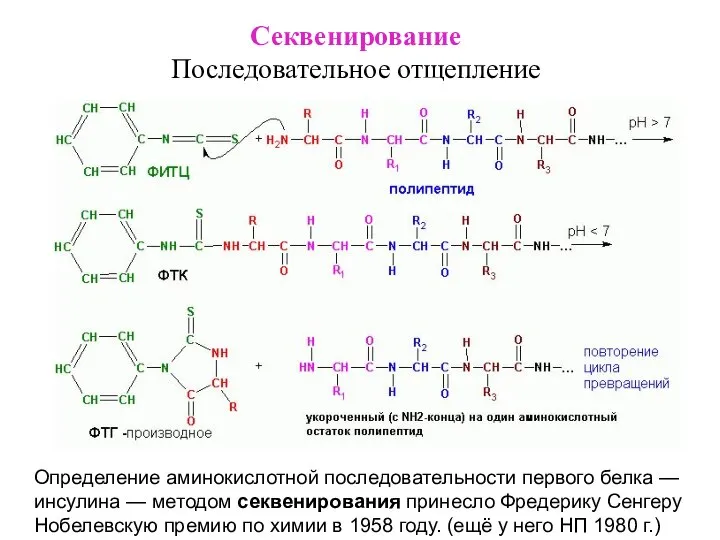
- 16. Секвенирование Последовательное отщепление Определение аминокислотной последовательности первого белка — инсулина — методом секвенирования принесло Фредерику Сенгеру
- 17. Mr белка яйца = 36 000 Денатурированный белок теряет свои биологические свойства. 2. Денатурация – нарушение
- 18. 3. Цветные качественные реакции белков а) Биуретовая реакция– взаимодействие слабощелочных растворов белков с раствором сульфата меди
- 20. Скачать презентацию







 Гаметофиты и спорофиты
Гаметофиты и спорофиты Cilvēka endokrīnā sistēma
Cilvēka endokrīnā sistēma Витамины
Витамины Репарацияның биологиялық маңызы
Репарацияның биологиялық маңызы Павловский парк
Павловский парк Биология
Биология Презентация на тему Отряд Насекомоядные млекопитающие
Презентация на тему Отряд Насекомоядные млекопитающие  По темам «Общий обзор организма» и «Координация и регуляция»
По темам «Общий обзор организма» и «Координация и регуляция» Презентация на тему ЯДЫ В ПРОДУКТАХ ПИТАНИЯ
Презентация на тему ЯДЫ В ПРОДУКТАХ ПИТАНИЯ  Учет зимующих птиц Сибири
Учет зимующих птиц Сибири Презентация на тему ПРИЧУДЫ ПАРАЗИТИЗМА
Презентация на тему ПРИЧУДЫ ПАРАЗИТИЗМА  Генетические основы селекции. Лекция 13
Генетические основы селекции. Лекция 13 Терминология и символика, используемая в генетике
Терминология и символика, используемая в генетике Природа. Встреча с природой
Природа. Встреча с природой Порода собак чихуахуа
Порода собак чихуахуа Метаболизм. Энергообмен
Метаболизм. Энергообмен Подводный мир Черного моря
Подводный мир Черного моря Значение и строение кожных покровов. Функции эпидермиса, дермы и гиподермы
Значение и строение кожных покровов. Функции эпидермиса, дермы и гиподермы Биоформы в художественном конструировании
Биоформы в художественном конструировании Ткани. Биология 8 класс
Ткани. Биология 8 класс Тип кольчатые черви
Тип кольчатые черви Породы кошек с приплюснутой мордой
Породы кошек с приплюснутой мордой Большая панда
Большая панда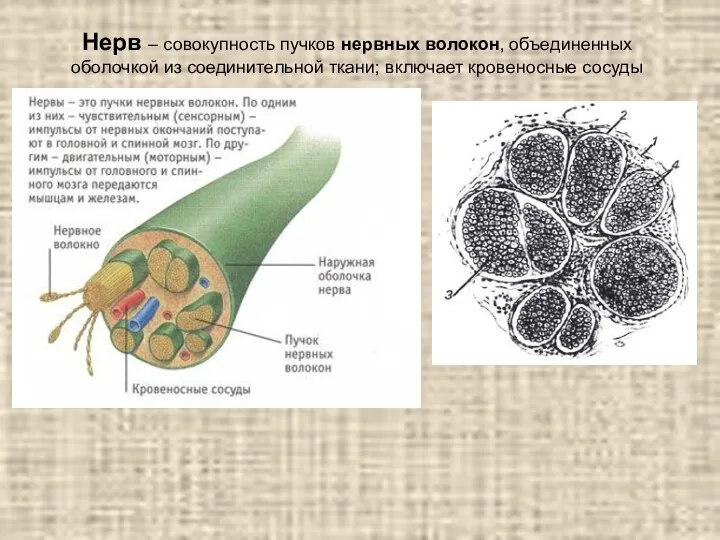 Нерв
Нерв Цитология – наука о клетке
Цитология – наука о клетке Садовые цветы
Садовые цветы Тип Плоские черви
Тип Плоские черви Морфофункциональная характеристика вегетативной нервной системы
Морфофункциональная характеристика вегетативной нервной системы