Слайд 2План
План:
1)Введение;
2)Синтез белка;
а)транскрипция
б)трансляция
в)посттрансляционные изменения
3)Заключение;
4)Список использованной литературы.

Слайд 3Введение
Введение
Белки́ (протеи́ны, полипепти́ды]) — высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых
![Введение Введение Белки́ (протеи́ны, полипепти́ды]) — высокомолекулярные органические вещества, состоящие из альфа-аминокислот,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/949646/slide-2.jpg)
в цепочку пептидной связью. В Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы)
Ферме́нты или энзи́мы — обычно достаточно сложные молекулы белка, рибозимы или их комплексы, ускоряющие химические реакции в живых системах. Каждый фермент, свернутый в определённую структуру, ускоряет соответствующую химическую реакцию: реагенты в такой реакции называются субстратами, а получающиеся вещества — продуктами.
Слайд 7Синтез белка — сложный многоступенчатый процесс, представляющий цепь синтетических реакций, протекающих по

принципу матричного синтеза.
Транскрипция представляет собой синтез молекулы РНК на молекуле ДНК. То есть ДНК служит матрицей для синтеза РНК.
Транскрипция катализируется рядом ферментов, наиболее важный РНК-полимераза.
РНК-полимераза движется по двойной цепи ДНК, разъединяет цепочки и на одной из них по принципу комплементарности строит молекулу РНК из плавающих в ядре нуклеотидов. Таким образом, РНК по-сути идентична участку другой цепи ДНК (на которой не происходит синтез), так как цепи молекулы ДНК также комплементарны друг другу. Только в РНК тимин заменен на урацил.
Синтез нуклеиновых кислот происходит в направлении от 5'-конца молекул к их 3'-концу. При этом комплементарные цепи всегда антипараллельны (направлены в разные стороны). Поэтому сама РНК синтезируется в направлении 5'→3', но по цепи ДНК движется в ее направлении 3'→5'.
Слайд 8Участок ДНК, на котором происходит транскрипция (транскриптон, оперон), состоит из трех частей:
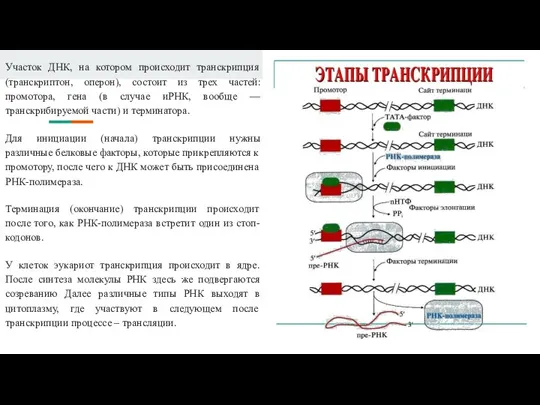
промотора, гена (в случае иРНК, вообще — транскрибируемой части) и терминатора.
Для инициации (начала) транскрипции нужны различные белковые факторы, которые прикрепляются к промотору, после чего к ДНК может быть присоединена РНК-полимераза.
Терминация (окончание) транскрипции происходит после того, как РНК-полимераза встретит один из стоп-кодонов.
У клеток эукариот транскрипция происходит в ядре. После синтеза молекулы РНК здесь же подвергаются созреванию Далее различные типы РНК выходят в цитоплазму, где участвуют в следующем после транскрипции процессе – трансляции.
Слайд 9Трансляция (англ. translation – перевод) – это биосинтез белка на матрице мРНК.
После
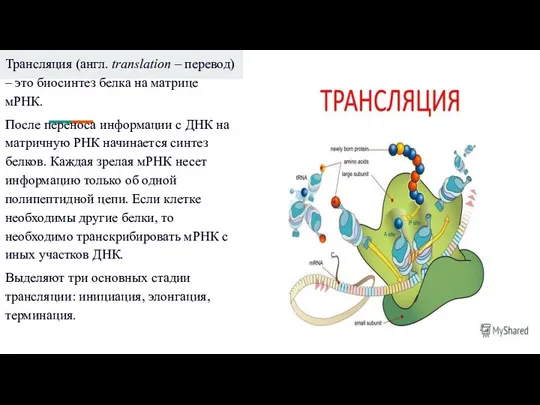
переноса информации с ДНК на матричную РНК начинается синтез белков. Каждая зрелая мРНК несет информацию только об одной полипептидной цепи. Если клетке необходимы другие белки, то необходимо транскрибировать мРНК с иных участков ДНК.
Выделяют три основных стадии трансляции: инициация, элонгация, терминация.
Слайд 10Для инициации необходимы мРНК, ГТФ, малая и большая субъединицы рибосомы, три белковых

фактора инициации ,метионин и тРНК для метионина.
После формирования тройные комплексы объединяются с большой субъединицей рибосомы. В этом процессе активно участвуют белковые факторы инициации, источником энергии служит ГТФ. После сборки комплекса инициирующая метионил-тРНК связывается с первым кодоном АУГ матричной РНК и располагается в П-центре (пептидильный центр) большой субъединицы. А-центр (аминоацильный центр) остается свободным, он будет задействован на стадии элонгации для связывания аминоацил-тРНК.
Слайд 11Элонгация
Для этой стадии необходимы все 20 аминокислот, Элонгация представляет собой циклический процесс.

Первый цикл (и следующие циклы) элонгации включает три шага:
Присоединение аминоацил-тРНК к кодону мРНК, аминокислота при этом встраивается в А-центр рибосомы. Источником энергии служит ГТФ.
Фермент пептидилтрансфераза осуществляет перенос метионина с метионил-тРНК (в П-центре) на вторую аминоацил-тРНК (в А-центре) с образованием пептидной связи между метионином и второй аминокислотой. При этом уже активированная СООН-группа метионина связывается со свободной NH2-группой второй аминокислоты..
Слайд 123 Фермент транслоказа перемещает мРНК относительно рибосомы таким образом, что первый кодон
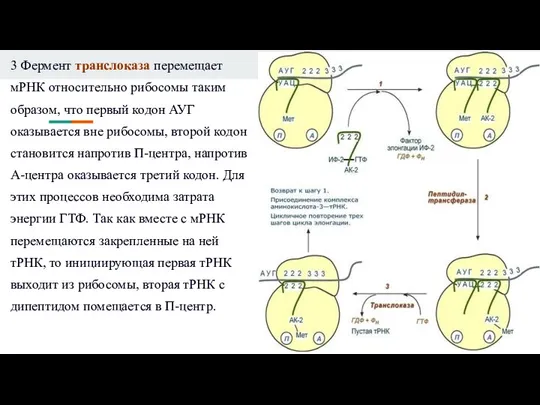
АУГ оказывается вне рибосомы, второй кодон становится напротив П-центра, напротив А-центра оказывается третий кодон. Для этих процессов необходима затрата энергии ГТФ. Так как вместе с мРНК перемещаются закрепленные на ней тРНК, то инициирующая первая тРНК выходит из рибосомы, вторая тРНК с дипептидом помещается в П-центр.
Слайд 13Терминация
Синтез белка продолжается до тех пор, пока рибосома не достигнет на мРНК

особых терминирующих кодонов – стоп-кодонов УАА, УАГ, УГА. Данные триплеты не кодируют ни одной из аминокислот, их также называют нонсенс-кодоны. При вхождении этих кодонов внутрь рибосомы происходит активация белковых факторов терминации, которые последовательно катализируют:
Гидролитическое отщепление полипептида от конечной тРНК.
Отделение от П-центра последней, уже пустой, тРНК.
Диссоциацию рибосомы.
Источником энергии для завершения трансляции является ГТФ
Слайд 14После завершения трансляции большая часть белков подвергается дальнейшим химическим модификациям, которые называются

посттрансляционными модификациями. Известно более двухсот вариантов посттрансляционных модификаций белков.Посттрансляционные модификации могут регулировать продолжительность существования белков в клетке, их ферментативную активность и взаимодействия с другими белками. В ряде случаев посттрансляционные модификации являются обязательным этапом созревания белка, в противном случае он оказывается функционально неактивным. К примеру, при созревании инсулина и некоторых других гормонов необходим ограниченный протеолиз полипептидной цепи, а при созревании белков плазматической мембраны — гликозилирование.
Слайд 15Посттрансляционные модификации могут быть как широко распространёнными, так и редкими, вплоть до

уникальных. Примером универсальной модификации служит убиквитинирование (присоединение к белку цепи из нескольких молекул короткого белка убиквитина), которое служит сигналом к расщеплению этого белка протеасомой. Другой распространённой модификацией является гликозилирование — считается, что около половины белков человека гликозилировано. К редким модификациям относят тирозинирование/детирозинирование и полиглицилирование тубулина.
Один и тот же белок может подвергаться многочисленным модификациям. Так, гистоны (белки, входящие в состав хроматина у эукариот) в разных условиях могут подвергаться более чем 150 различным модификациям.
Слайд 16Посттрансляционные модификации делят на:
модификации главной цепи;
отщепление N-концевого остатка метионина;
ограниченный протеолиз — удаление

фрагмента белка, которое может происходить с концов или, в отдельных случаях, в середине молекулы;
присоединение различных химических групп к свободным амино- и карбоксильной группам ;
модификации боковых цепей аминокислот;
присоединение или отщепление небольших химических групп
присоединение липидов и углеводородов;
изменение стандартных аминокислотных остатков на нестандартные
образование дисульфидных мостиков между остатками цистеина;
присоединение небольших белков
Слайд 17Заключение
Белки играют в питании человека чрезвычайно важную роль, так как они являются

главной составной частью клеток всех органов и тканей организма. С белками тесно связаны все жизненные процессы: обмен веществ, сократимость, раздражимость, способность к росту, размножению и даже к высшей форме движения материи — мышлению. Связывая значительные количества воды, белки образуют плотные коллоидные структуры, характерные для нашего тела.
Одновременно в организме человека происходят миллионы различных химических взаимодействий. Все эти реакции протекают при температуре, близкой к 37 °C, и малых колебаниях кислотности. В таких условиях химические реакции должны были бы длиться очень долго, а многие из них вообще не должны были бы происходить. Однако в организме все реакции обмена веществ протекают быстро, и многие из них длятся миллионные доли секунды . Это происходит благодаря участию в реакциях обмена веществ ферментов.

![Введение Введение Белки́ (протеи́ны, полипепти́ды]) — высокомолекулярные органические вещества, состоящие из альфа-аминокислот,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/949646/slide-2.jpg)













 Характеристика царства Животные. 5 класс
Характеристика царства Животные. 5 класс Презентация на тему Покровы тела
Презентация на тему Покровы тела  Элементарные факторы эволюции
Элементарные факторы эволюции Витамины. Обобщение знаний
Витамины. Обобщение знаний Строение и многообразие покрытосеменных растений
Строение и многообразие покрытосеменных растений Строение растительной и животной клетки. Прокариоты и эукариоты
Строение растительной и животной клетки. Прокариоты и эукариоты Презентация на тему Познавательные процессы (8 класс)
Презентация на тему Познавательные процессы (8 класс)  Организм - единое целое
Организм - единое целое Отъемно-доливной метод культивирования. Тубулярная культура. Хемостатный процесс непрерывного культивирования микроорганизмов
Отъемно-доливной метод культивирования. Тубулярная культура. Хемостатный процесс непрерывного культивирования микроорганизмов Слайды
Слайды Производство микроорганизмов
Производство микроорганизмов Строение семян. Изучение строения семян однодольных растений
Строение семян. Изучение строения семян однодольных растений Членистоногие обитающие в Республике Крым
Членистоногие обитающие в Республике Крым Видоизменённые подземные побеги. Урок - исследование в 6 классе
Видоизменённые подземные побеги. Урок - исследование в 6 классе Внешнее и внутреннее строение корня
Внешнее и внутреннее строение корня Холестерин. Функции холестерина
Холестерин. Функции холестерина Вода та її велике значення в нашому житті
Вода та її велике значення в нашому житті Круглые черви
Круглые черви Строение сердца и кровеносных сосудов
Строение сердца и кровеносных сосудов Строение тела человека. 2 класс
Строение тела человека. 2 класс Отряды динозавров
Отряды динозавров Железы внутренней секреции
Железы внутренней секреции Водоросли
Водоросли Презентация_Способы_добывания_пищи_животными_
Презентация_Способы_добывания_пищи_животными_ Кожа - пограничник организма
Кожа - пограничник организма Организация и проведение лабораторных работ на уроках биологии
Организация и проведение лабораторных работ на уроках биологии Витамин Q (убихинон)
Витамин Q (убихинон) Внешнее строение моллюсков
Внешнее строение моллюсков