Слайд 2Мышечная ткань
На долю мышц приходится 40-50% от массы тела (у взрослого).
Процентное содержание

мышечной ткани с возрастом увеличивается (у новорожденных приблизительно 22% от массы тела).
Функция: выполнение механической работы + генератор тепла.
Слайд 3Белки мышечной ткани
Более 50% приходится на долю сократительных белков. Важнейшие из них

актин и миозин.
Высокое содержание коллагена. Это фибриллярный белок, обладающий высокой прочностью и эластичностью. Входит в состав оболочки мышечных волокон, связок, сухожилий.
Белки – ферменты.
Миоглобин. Это основные группы белков!
Слайд 4Мышечные волокна
Мышечные волокна могут существенно различаться по размерам. Толщина составляет 0,1-0,2 мм;

длина варьирует от нескольких мм до 10 и более см.
Увеличение объема мышечной ткани под влиянием систематической тренировки происходит за счет увеличения толщины мышечных волокон, а не их числа.
Слайд 5Строение миофибрилл
Тонкие нити – миофибриллы состоят из двух типов еще более тонких

нитей – миофиламентов:
- более толстые состоят из белка миозина, более тонкие – из белка актина.
На миозиновых нитях имеются отросточки, расположенные шестью продольными рядами.
Слайд 7Строение миофибрилл
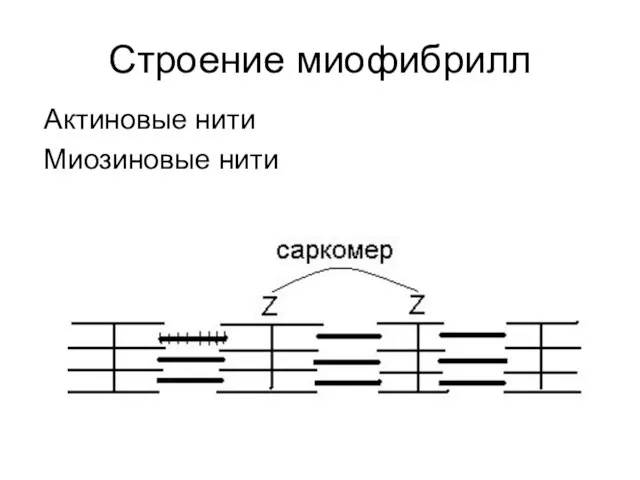
Актиновые нити
Миозиновые нити
Слайд 8Строение миофибрилл 2
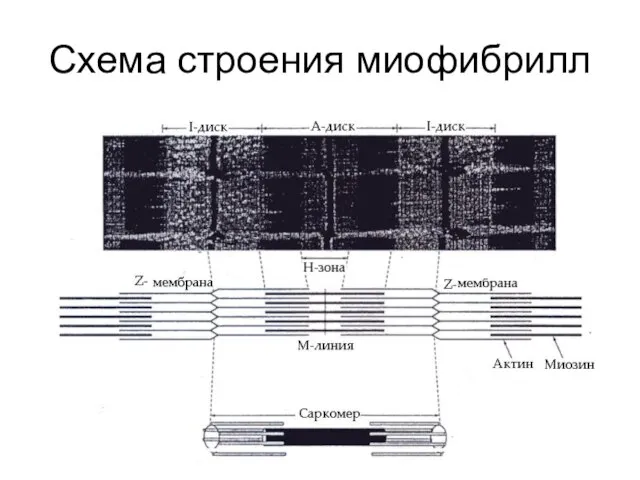
Актиновые нити соединены между собой мембраной – линией Z.
Расстояние

между двумя линиями Z называется саркомером.
Каждая миозиновая нить окружена шестью актиновыми, которые расположены напротив продольных рядов отростков миозиновых нитей.
Слайд 9Механизм мышечного сокращения
При мышечном сокращении укорачивается длина саркомеров.
Длина актиновых и миозиновых нитей

практически не меняется.
Саркомер укорачивается за счет взаимного перемещения актиновых и миозиновых нитей.
Слайд 10Укорочение саркомера
Взаимное перемещение актиновых и миозиновых нитей обеспечивается колебательными движениями отросточков на

миозиновых нитях.
При этом они «цепляются» за активные центры на актиновых нитях и меняют свой наклон, перемещая эти нити.
Однократное такое движение отростков по всей длине мышечного волокна обеспечит незначительное его укорочение. Полное сокращение – многократные повторные движения.
Слайд 11Строение миофибрилл и двигательные характеристики
Многие двигательные характеристики мышц четко связаны с особенностями

строения миофибрилл.
Например: зависимость развиваемого усилия от степени укорочения мышцы и от скорости сокращения (чем выше скорость сокращения – тем меньшее усилие может развить мышца).
Слайд 12Расход АТФ
АТФ – непосредственный источник энергии.
АТФ АДФ + Н3РО4 + энергия
При

мышечном сокращении АТФ расходуется на работу отростков миозиновых нитей, на перемещение ионов натрия и кальция (работу натриевого и кольциевого насосов).
Содержание АТФ в мышечном волокне составляет 0,4-0,5%. Этого количества АТФ хватит на 2-3 секунды напряженной работы мышцы.
Но мышца не может потратить всю АТФ. Уже при концентрации 0,15-0,2% она может перестать отвечать на поступающие импульсы.










 Витамины
Витамины Aпомиксис. Типы апомиксиса. Гаметофитный апомиксис. Апоспория
Aпомиксис. Типы апомиксиса. Гаметофитный апомиксис. Апоспория клетка 9 класс
клетка 9 класс Строение и физиологические функции кожного покрова пушных зверей
Строение и физиологические функции кожного покрова пушных зверей Из опыта ландшафтного волонтерства
Из опыта ландшафтного волонтерства Кровоносна система
Кровоносна система Фауна змей хребта Нараттюбе
Фауна змей хребта Нараттюбе Основы цитологии
Основы цитологии Движение крови по сосудам
Движение крови по сосудам Человек — сложнейшая загадка для науки и самого себя
Человек — сложнейшая загадка для науки и самого себя Функциональная анатомия, развитие и аномалии развития дыхательной системы
Функциональная анатомия, развитие и аномалии развития дыхательной системы Клеточное строение листа
Клеточное строение листа Крахмал растений
Крахмал растений Корень
Корень Крахмал и его свойства
Крахмал и его свойства Класс Птицы
Класс Птицы Физические законы в биологии
Физические законы в биологии Возможности ПЦР-анализа в профилактике заболеваний пчелы. Итоги анкеты по зимовке 2016 - 2017 года
Возможности ПЦР-анализа в профилактике заболеваний пчелы. Итоги анкеты по зимовке 2016 - 2017 года Презентация на тему Почва Земли
Презентация на тему Почва Земли  dmSb1yUjR9RFBuG9N32l4Q
dmSb1yUjR9RFBuG9N32l4Q Весна - пробуждение природы
Весна - пробуждение природы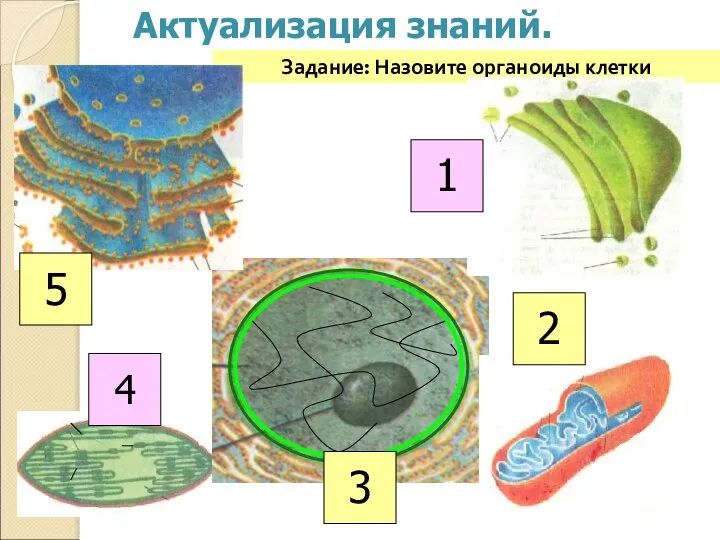 Назовите органоиды клетки
Назовите органоиды клетки В мире цветов
В мире цветов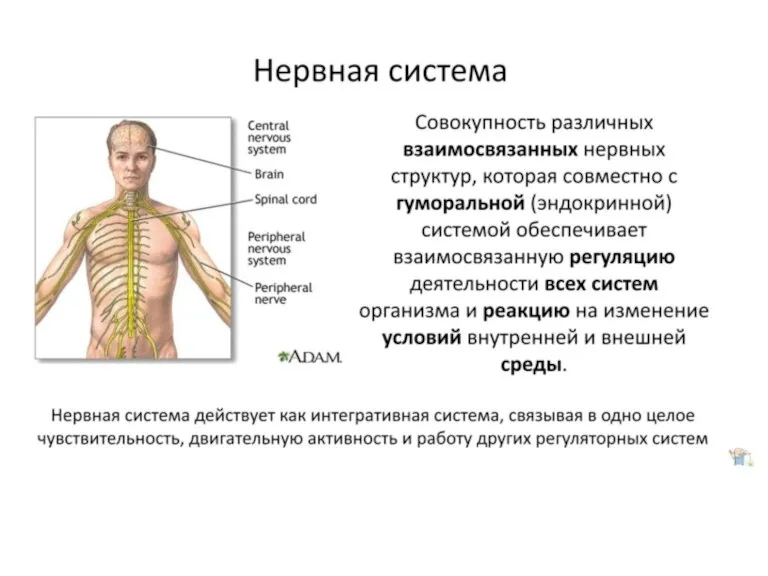 Нервная система человека
Нервная система человека 5dc9ea4996b8de47
5dc9ea4996b8de47 Биосфера
Биосфера Пищеварительная система человека
Пищеварительная система человека Красильные растения
Красильные растения