Слайд 2Рисунок 9.1 Большой Т-антиген в клетках, трансформированных SV40.
Антитела, которые связывают большой
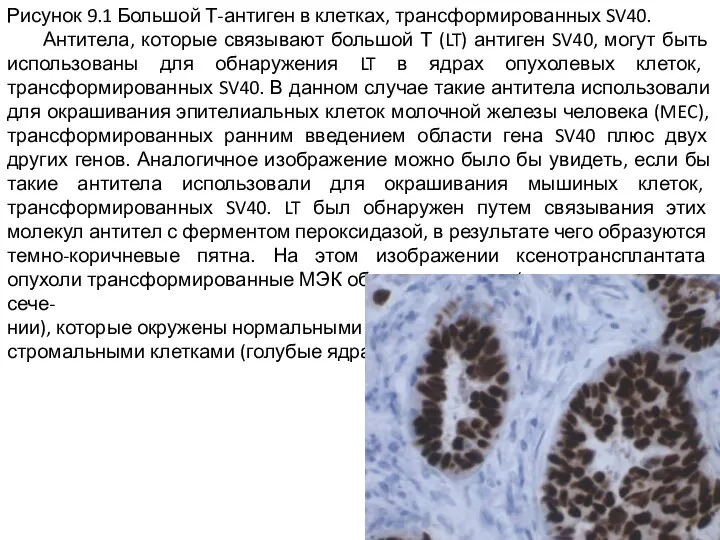
Т (LT) антиген SV40, могут быть использованы для обнаружения LT в ядрах опухолевых клеток, трансформированных SV40. В данном случае такие антитела использовали для окрашивания эпителиальных клеток молочной железы человека (MEC), трансформированных ранним введением области гена SV40 плюс двух других генов. Аналогичное изображение можно было бы увидеть, если бы такие антитела использовали для окрашивания мышиных клеток, трансформированных SV40. LT был обнаружен путем связывания этих молекул антител с ферментом пероксидазой, в результате чего образуются темно-коричневые пятна. На этом изображении ксенотрансплантата опухоли трансформированные МЭК образуют протоки (видно в поперечном сече-
нии), которые окружены нормальными
стромальными клетками (голубые ядра).
Слайд 3Рисунок 9.3 Влияние p53 на трансформацию клеток
кДНК, кодирующая онкоген ras была
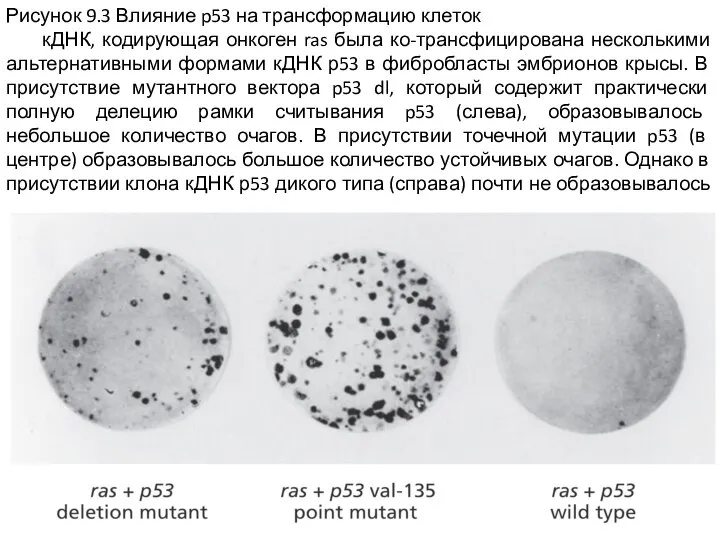
ко-трансфицирована несколькими альтернативными формами кДНК р53 в фибробласты эмбрионов крысы. В присутствие мутантного вектора p53 dl, который содержит практически полную делецию рамки считывания p53 (слева), образовывалось небольшое количество очагов. В присутствии точечной мутации p53 (в центре) образовывалось большое количество устойчивых очагов. Однако в присутствии клона кДНК р53 дикого типа (справа) почти не образовывалось очагов.
Слайд 4Рис. 9.4. Частота мутантных аллелей p53 в геномах опухолевых клеток человека
Как
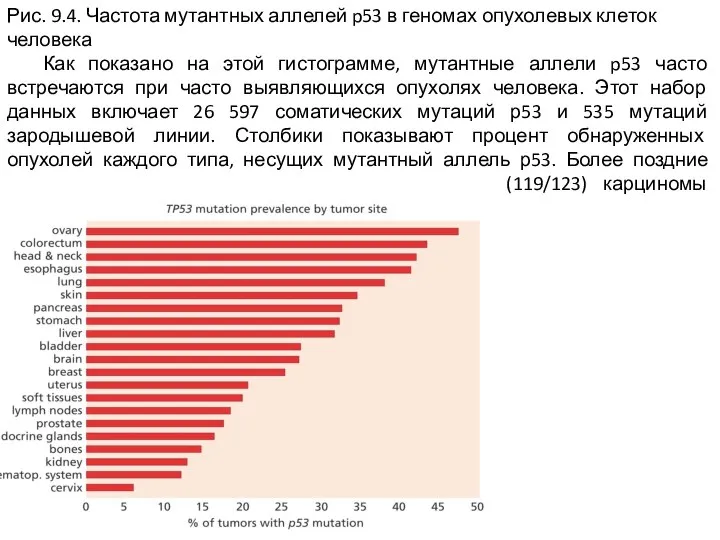
показано на этой гистограмме, мутантные аллели p53 часто встречаются при часто выявляющихся опухолях человека. Этот набор данных включает 26 597 соматических мутаций р53 и 535 мутаций зародышевой линии. Столбики показывают процент обнаруженных опухолей каждого типа, несущих мутантный аллель р53. Более поздние исследования показывают, что практически все (119/123) карциномы яичников несут мутантные аллели р53.
Слайд 5Рисунок 9.5. Влияние мутантных аллелей p53 на зародышевую линию мыши.
Этот график
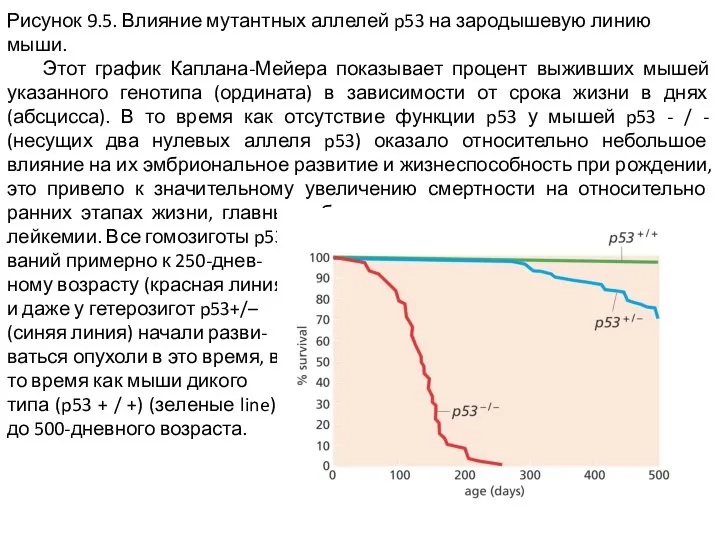
Каплана-Мейера показывает процент выживших мышей указанного генотипа (ордината) в зависимости от срока жизни в днях (абсцисса). В то время как отсутствие функции p53 у мышей p53 - / - (несущих два нулевых аллеля p53) оказало относительно небольшое влияние на их эмбриональное развитие и жизнеспособность при рождении, это привело к значительному увеличению смертности на относительно ранних этапах жизни, главным образом в результате развития сарком и лейкемии. Все гомозиготы p53 - / - умерли от злокачественных новообразо-
ваний примерно к 250-днев-
ному возрасту (красная линия),
и даже у гетерозигот p53+/–
(синяя линия) начали разви-
ваться опухоли в это время, в
то время как мыши дикого
типа (p53 + / +) (зеленые line) практически не показывали смертности почти до 500-дневного возраста.
Слайд 6Рисунок 9.6 Природа мутаций p53
(A) Как указано на этих круговых диаграммах,
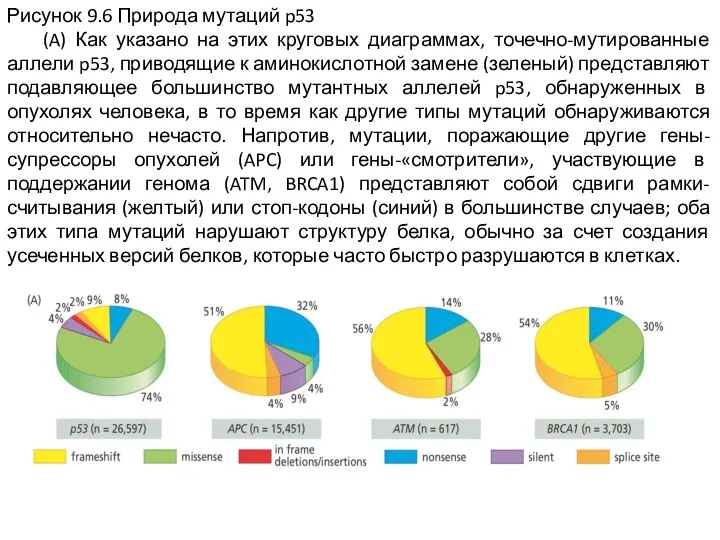
точечно-мутированные аллели p53, приводящие к аминокислотной замене (зеленый) представляют подавляющее большинство мутантных аллелей p53, обнаруженных в опухолях человека, в то время как другие типы мутаций обнаруживаются относительно нечасто. Напротив, мутации, поражающие другие гены-супрессоры опухолей (APC) или гены-«смотрители», участвующие в поддержании генома (ATM, BRCA1) представляют собой сдвиги рамки-считывания (желтый) или стоп-кодоны (синий) в большинстве случаев; оба этих типа мутаций нарушают структуру белка, обычно за счет создания усеченных версий белков, которые часто быстро разрушаются в клетках.
Слайд 7 (B) Места в рамке считывания p53 точечных мутаций, вызывающих аминокислотные замены отмечены
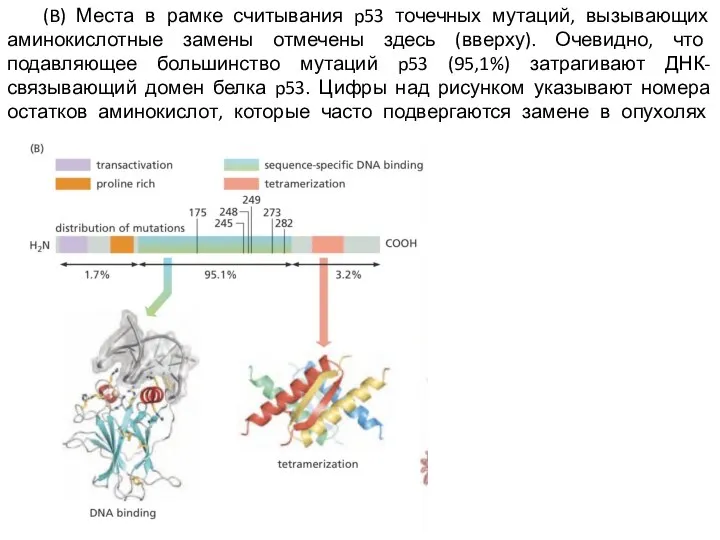
здесь (вверху). Очевидно, что подавляющее большинство мутаций p53 (95,1%) затрагивают ДНК-связывающий домен белка p53. Цифры над рисунком указывают номера остатков аминокислот, которые часто подвергаются замене в опухолях человека.
Слайд 8 (C) Общая структура тетрамера р53, связанного с ДНК, показана здесь. Четыре ДНК-связывающих
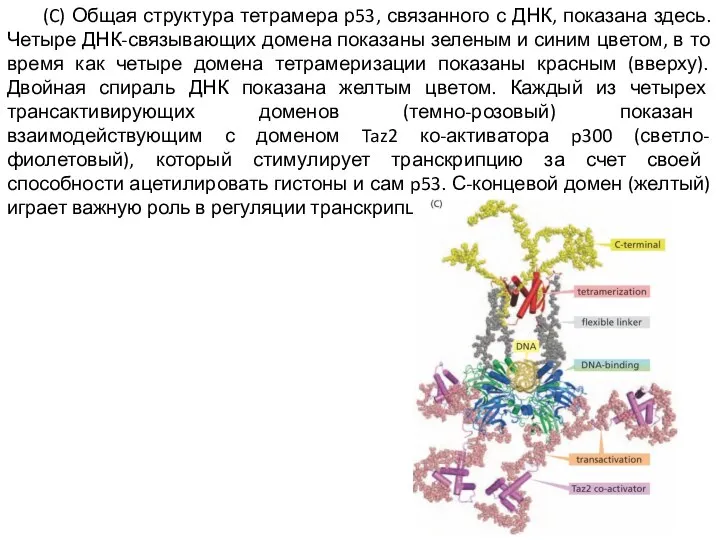
домена показаны зеленым и синим цветом, в то время как четыре домена тетрамеризации показаны красным (вверху). Двойная спираль ДНК показана желтым цветом. Каждый из четырех трансактивирующих доменов (темно-розовый) показан взаимодействующим с доменом Taz2 ко-активатора p300 (светло-фиолетовый), который стимулирует транскрипцию за счет своей способности ацетилировать гистоны и сам p53. С-концевой домен (желтый) играет важную роль в регуляции транскрипции.
Слайд 9Рисунок 9.7. Структура и функция p53
(A) В клетках, несущих единственный мутантный
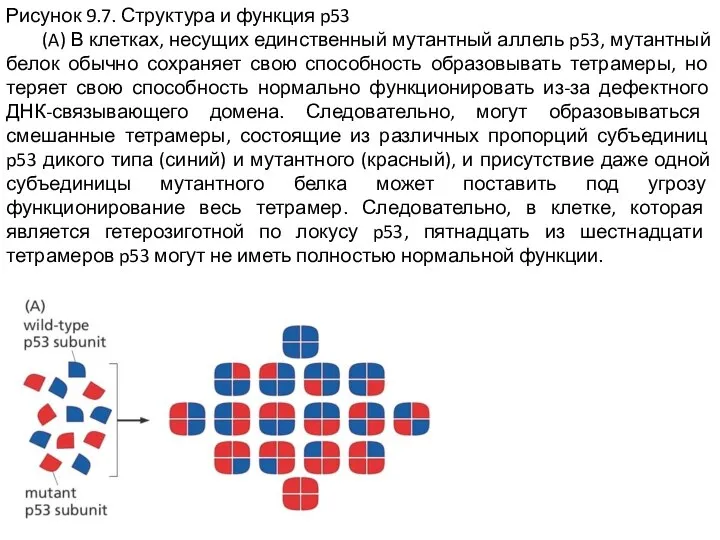
аллель p53, мутантный белок обычно сохраняет свою способность образовывать тетрамеры, но теряет свою способность нормально функционировать из-за дефектного ДНК-связывающего домена. Следовательно, могут образовываться смешанные тетрамеры, состоящие из различных пропорций субъединиц p53 дикого типа (синий) и мутантного (красный), и присутствие даже одной субъединицы мутантного белка может поставить под угрозу функционирование весь тетрамер. Следовательно, в клетке, которая является гетерозиготной по локусу p53, пятнадцать из шестнадцати тетрамеров p53 могут не иметь полностью нормальной функции.
Слайд 10 (B) Возможно, наиболее прямая демонстрация доминантно-негативного режима действия p53 произошла от «вбивания»
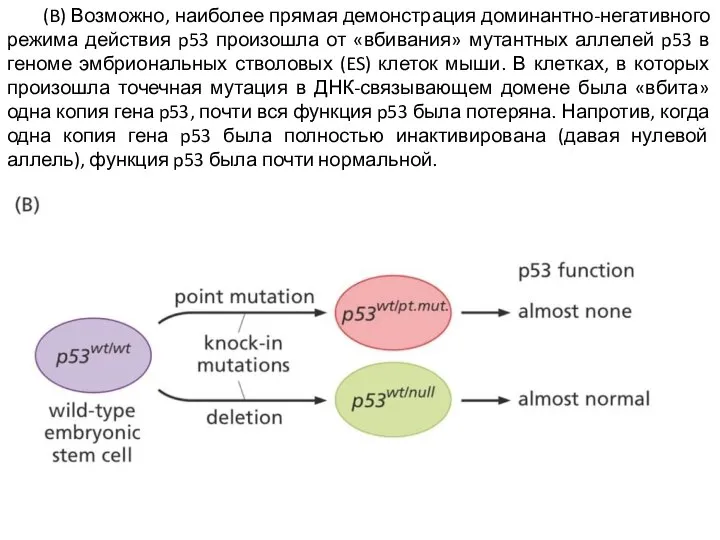
мутантных аллелей p53 в геноме эмбриональных стволовых (ES) клеток мыши. В клетках, в которых произошла точечная мутация в ДНК-связывающем домене была «вбита» одна копия гена p53, почти вся функция p53 была потеряна. Напротив, когда одна копия гена p53 была полностью инактивирована (давая нулевой аллель), функция p53 была почти нормальной.
Слайд 11Рисунок 9.8. Сигналы, активирующие р53, и последующие эффекты р53.
Исследования функции p53
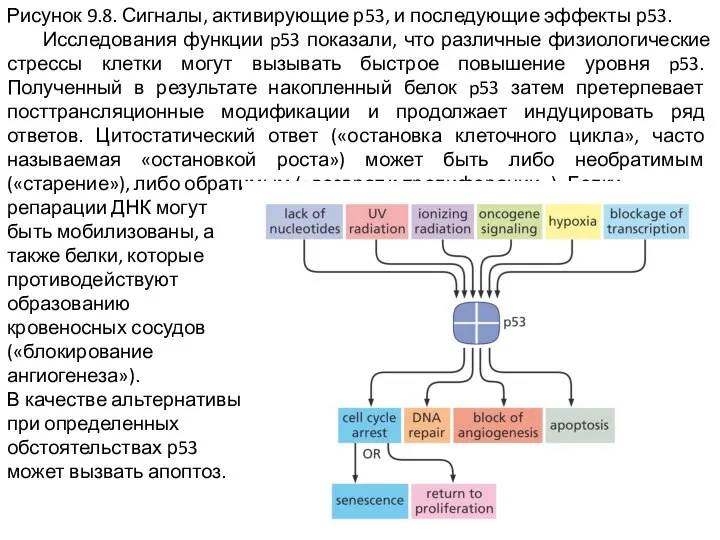
показали, что различные физиологические стрессы клетки могут вызывать быстрое повышение уровня p53. Полученный в результате накопленный белок p53 затем претерпевает посттрансляционные модификации и продолжает индуцировать ряд ответов. Цитостатический ответ («остановка клеточного цикла», часто называемая «остановкой роста») может быть либо необратимым («старение»), либо обратимым («возврат к пролиферации»). Белки
репарации ДНК могут
быть мобилизованы, а
также белки, которые
противодействуют
образованию
кровеносных сосудов
(«блокирование
ангиогенеза»).
В качестве альтернативы
при определенных
обстоятельствах р53
может вызвать апоптоз.
Слайд 12Рисунок 9.10. Контроль уровней p53 с помощью Mdm2.
После того, как концентрации
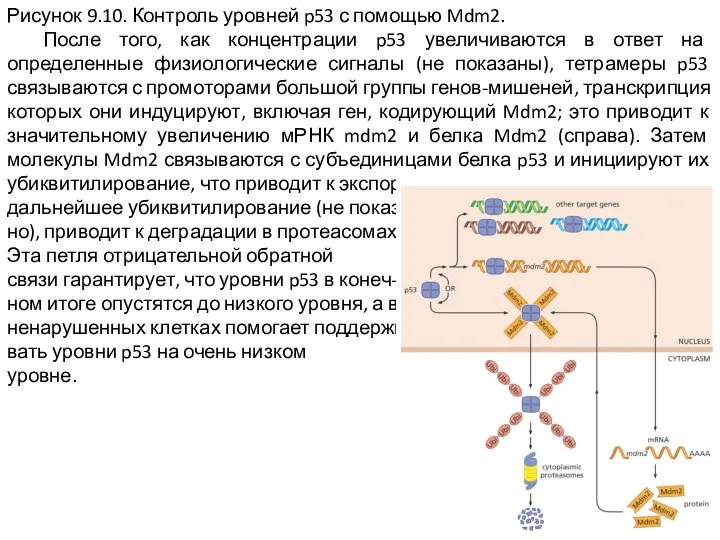
p53 увеличиваются в ответ на определенные физиологические сигналы (не показаны), тетрамеры p53 связываются с промоторами большой группы генов-мишеней, транскрипция которых они индуцируют, включая ген, кодирующий Mdm2; это приводит к значительному увеличению мРНК mdm2 и белка Mdm2 (справа). Затем молекулы Mdm2 связываются с субъединицами белка p53 и инициируют их убиквитилирование, что приводит к экспорту в цитоплазму, а
дальнейшее убиквитилирование (не показа-
но), приводит к деградации в протеасомах.
Эта петля отрицательной обратной
связи гарантирует, что уровни p53 в конеч-
ном итоге опустятся до низкого уровня, а в
ненарушенных клетках помогает поддержи-
вать уровни p53 на очень низком
уровне.
Слайд 13Рисунок 9.15. Контроль
апоптоза с помощью ARF
(A) Белок p14ARF чело-
века, называемый
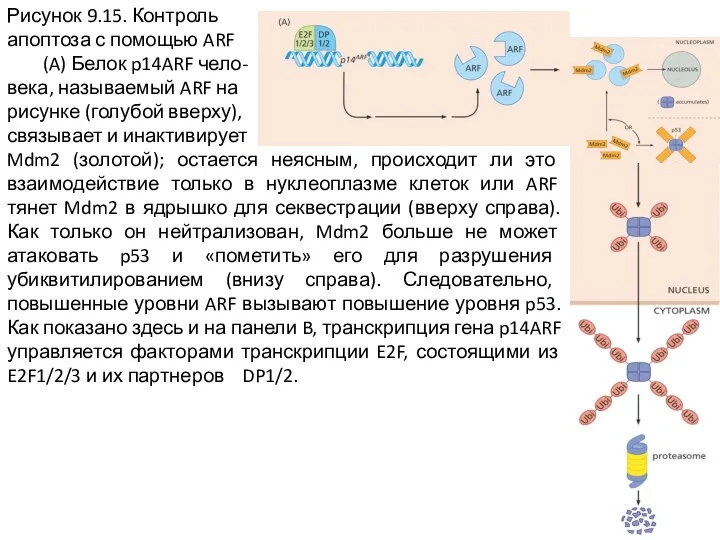
ARF на
рисунке (голубой вверху),
связывает и инактивирует
Mdm2 (золотой); остается неясным, происходит ли это взаимодействие только в нуклеоплазме клеток или ARF тянет Mdm2 в ядрышко для секвестрации (вверху справа). Как только он нейтрализован, Mdm2 больше не может атаковать p53 и «пометить» его для разрушения убиквитилированием (внизу справа). Следовательно, повышенные уровни ARF вызывают повышение уровня p53. Как показано здесь и на панели B, транскрипция гена p14ARF управляется факторами транскрипции E2F, состоящими из E2F1/2/3 и их партнеров DP1/2.
Слайд 14 (B) Различные онкогенные сигналы способствуют апоптозу благодаря их способности индуцировать активность E2F,
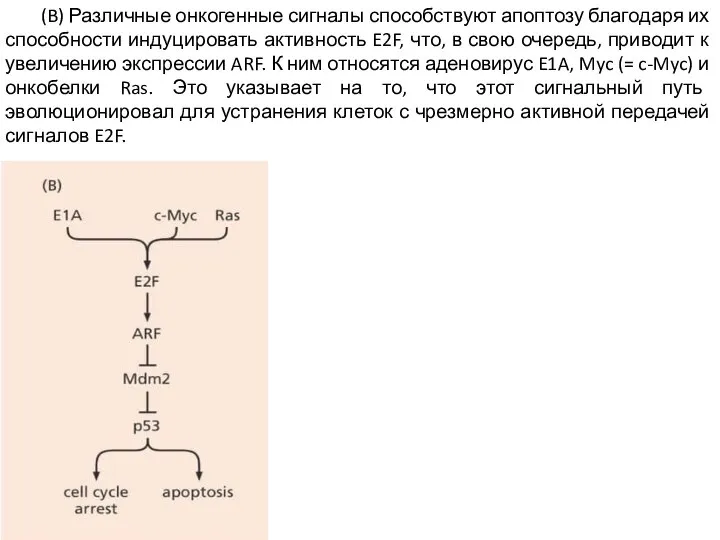
что, в свою очередь, приводит к увеличению экспрессии ARF. К ним относятся аденовирус E1A, Myc (= c-Myc) и онкобелки Ras. Это указывает на то, что этот сигнальный путь эволюционировал для устранения клеток с чрезмерно активной передачей сигналов E2F.
Слайд 15 (C) Одна копия гена, кодирующего p19ARF, была инактивирована в зародышевой линии мыши
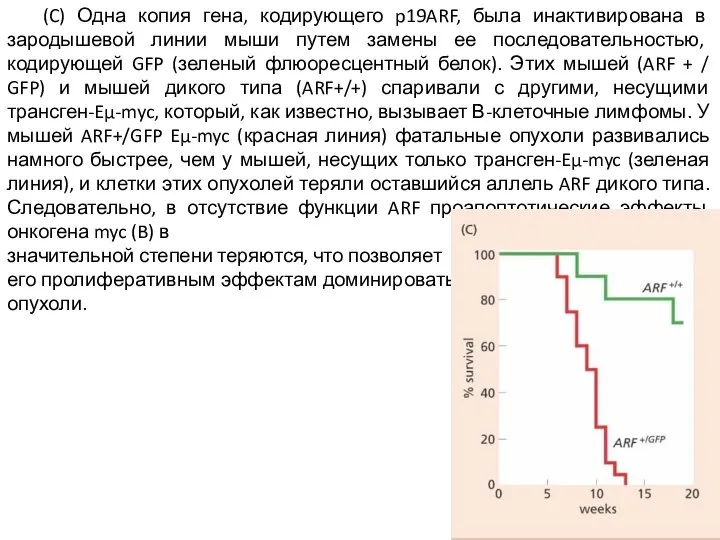
путем замены ее последовательностью, кодирующей GFP (зеленый флюоресцентный белок). Этих мышей (ARF + / GFP) и мышей дикого типа (ARF+/+) спаривали с другими, несущими трансген-Eμ-myc, который, как известно, вызывает В-клеточные лимфомы. У мышей ARF+/GFP Eμ-myc (красная линия) фатальные опухоли развивались намного быстрее, чем у мышей, несущих только трансген-Eμ-myc (зеленая линия), и клетки этих опухолей теряли оставшийся аллель ARF дикого типа. Следовательно, в отсутствие функции ARF проапоптотические эффекты онкогена myc (B) в
значительной степени теряются, что позволяет
его пролиферативным эффектам доминировать и управлять образованием опухоли.
Слайд 16Рис. 9.21. Семейная предрасположенность к раку, обусловленная мутантными аллелями зародышевой линии р53.
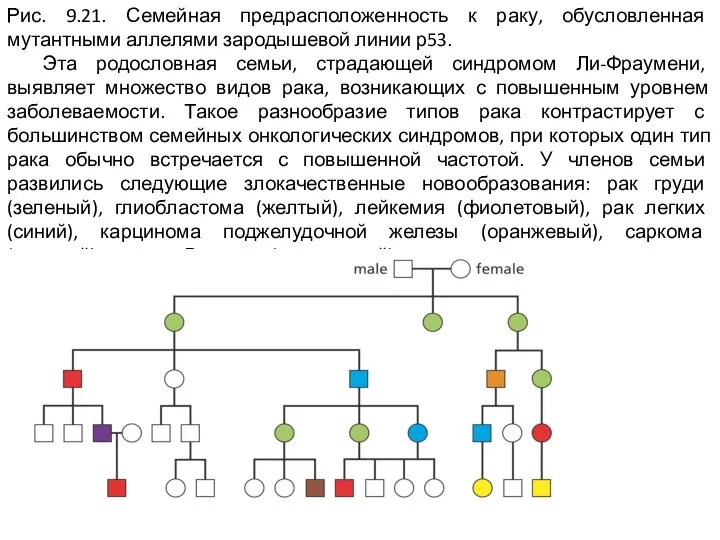
Эта родословная семьи, страдающей синдромом Ли-Фраумени, выявляет множество видов рака, возникающих с повышенным уровнем заболеваемости. Такое разнообразие типов рака контрастирует с большинством семейных онкологических синдромов, при которых один тип рака обычно встречается с повышенной частотой. У членов семьи развились следующие злокачественные новообразования: рак груди (зеленый), глиобластома (желтый), лейкемия (фиолетовый), рак легких (синий), карцинома поджелудочной железы (оранжевый), саркома (красный), опухоль Вильмса (коричневый).
Слайд 17Рисунок 9.31 Структура и функции ингибитора апоптоза IAP (ингибиторы апоптоза) путем связывания
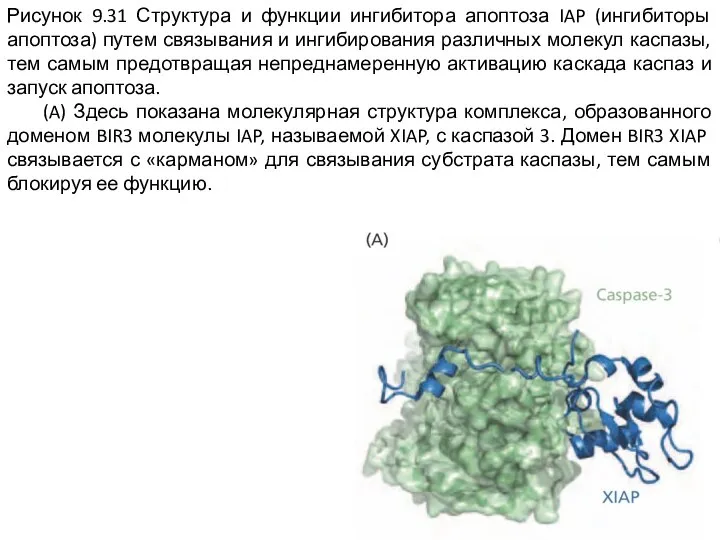
и ингибирования различных молекул каспазы, тем самым предотвращая непреднамеренную активацию каскада каспаз и запуск апоптоза.
(A) Здесь показана молекулярная структура комплекса, образованного доменом BIR3 молекулы IAP, называемой XIAP, с каспазой 3. Домен BIR3 XIAP связывается с «карманом» для связывания субстрата каспазы, тем самым блокируя ее функцию.
Слайд 18 (B) Молекула Smac/DIABLO предотвращает блокировку действия каспазы несколькими молекулами IAP, тем самым
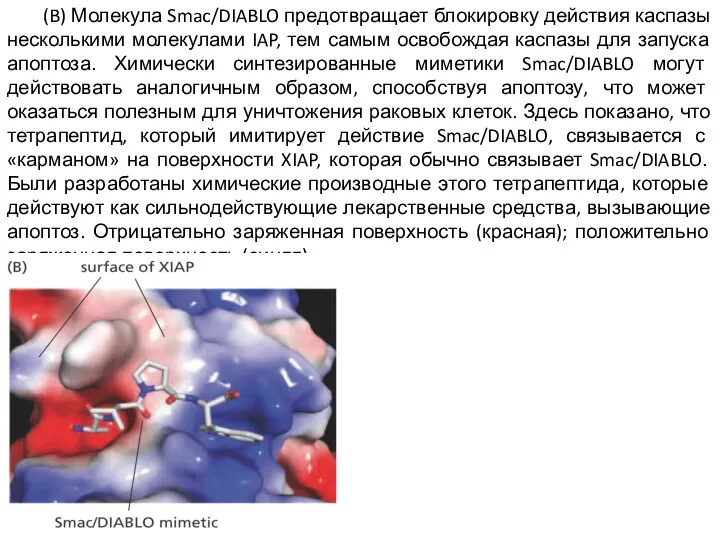
освобождая каспазы для запуска апоптоза. Химически синтезированные миметики Smac/DIABLO могут действовать аналогичным образом, способствуя апоптозу, что может оказаться полезным для уничтожения раковых клеток. Здесь показано, что тетрапептид, который имитирует действие Smac/DIABLO, связывается с «карманом» на поверхности XIAP, которая обычно связывает Smac/DIABLO. Были разработаны химические производные этого тетрапептида, которые действуют как сильнодействующие лекарственные средства, вызывающие апоптоз. Отрицательно заряженная поверхность (красная); положительно заряженная поверхность (синяя).

















 Допинг и его виды
Допинг и его виды Натуральное волокно
Натуральное волокно Слуховой анализатор
Слуховой анализатор Презентация на тему Верблюд - царь домашних животных
Презентация на тему Верблюд - царь домашних животных  Кулик-сорока. Скопа
Кулик-сорока. Скопа Строение и функции головного мозга
Строение и функции головного мозга Коневодство. Искусственный отбор
Коневодство. Искусственный отбор Лекція 5 Медбіологія
Лекція 5 Медбіологія Класс Млекопитающие или Звери
Класс Млекопитающие или Звери Витамины
Витамины Глубины океана
Глубины океана Полезные комнатные растения
Полезные комнатные растения Размножение (репродукция) человека
Размножение (репродукция) человека Витамины
Витамины Кровеносная система
Кровеносная система Нахлебничество (эпиойкия) и примеры
Нахлебничество (эпиойкия) и примеры Котики – часть нашей жизни
Котики – часть нашей жизни Презентация на тему Человек как биологический вид
Презентация на тему Человек как биологический вид  Фелинология, кинология
Фелинология, кинология Медуница лекарственная
Медуница лекарственная Ядро клетки
Ядро клетки Презентация на тему Формы размножения организмов
Презентация на тему Формы размножения организмов  Кошки - наши друзья
Кошки - наши друзья Органоиды клетки. Лизосома
Органоиды клетки. Лизосома Классификация и строение микроорганизмов
Классификация и строение микроорганизмов Физиология слуха и равновесия
Физиология слуха и равновесия Презентация на тему Подтип Позвоночные. Рыбы – водные позвоночные животные
Презентация на тему Подтип Позвоночные. Рыбы – водные позвоночные животные  Тип споровики
Тип споровики