Содержание
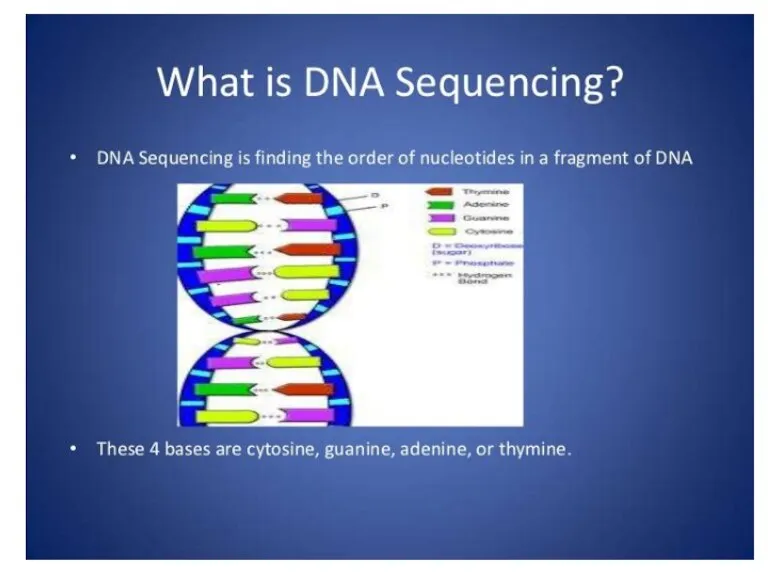
- 2. Биополимерлердің бірінші реттілігін анықтайтын әдісте секвенирлеу деген арнайы термин қолданылады. Белгілі ДНК молекуласындағы нуклеотидтердің санын мен
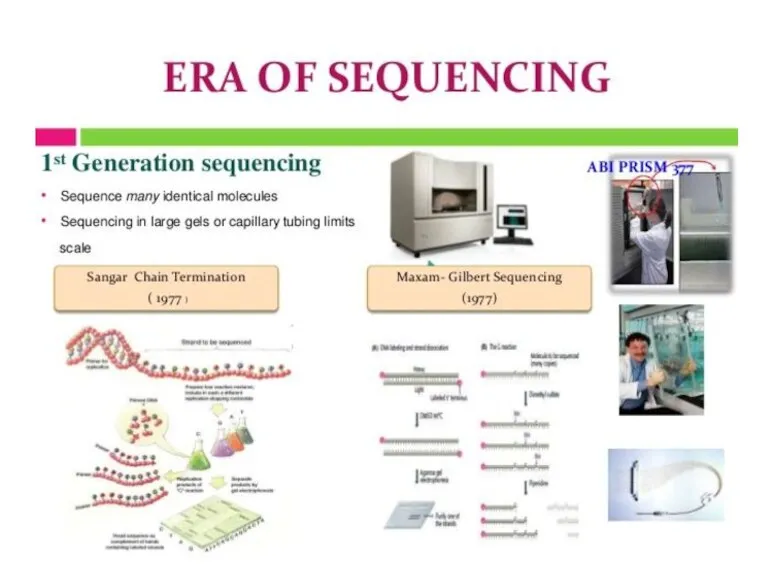
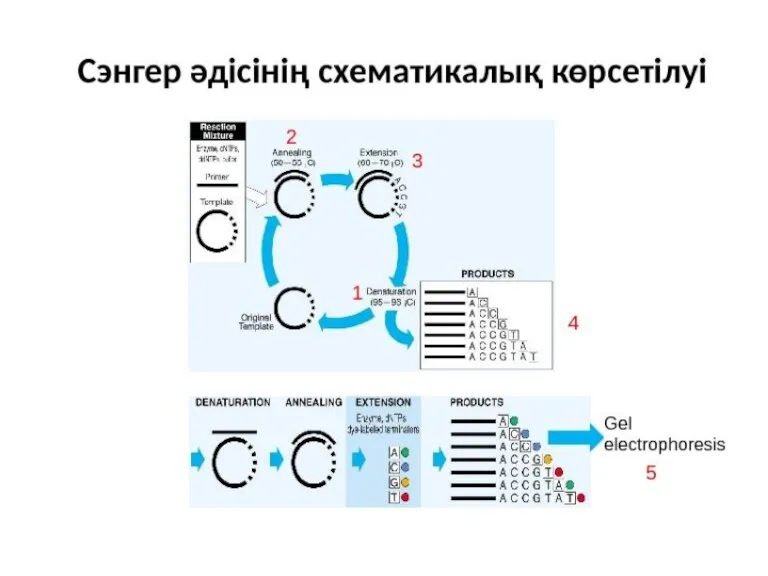
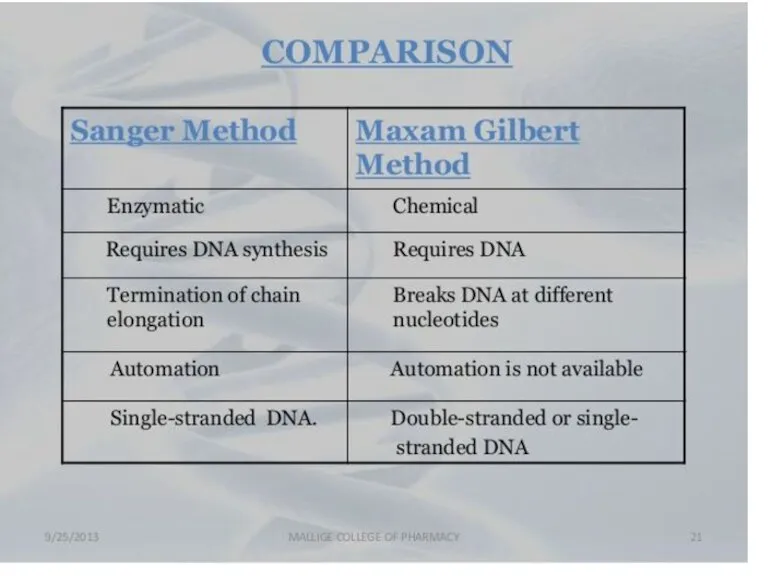
- 10. Сэнгер әдісі: «терминатор» әдісі. 4 кезең: Денатурация Синтез Терминация Электрофорез
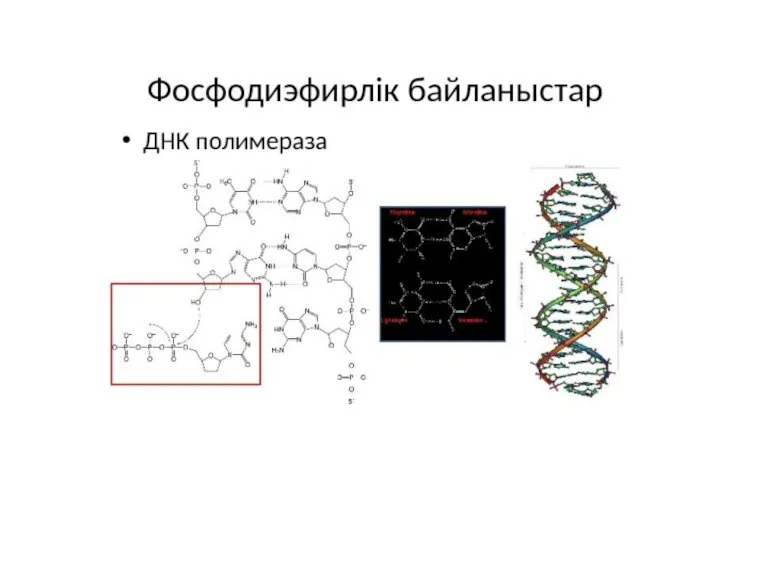
- 11. Сэнгер әдісі: «терминатор» әдісі.
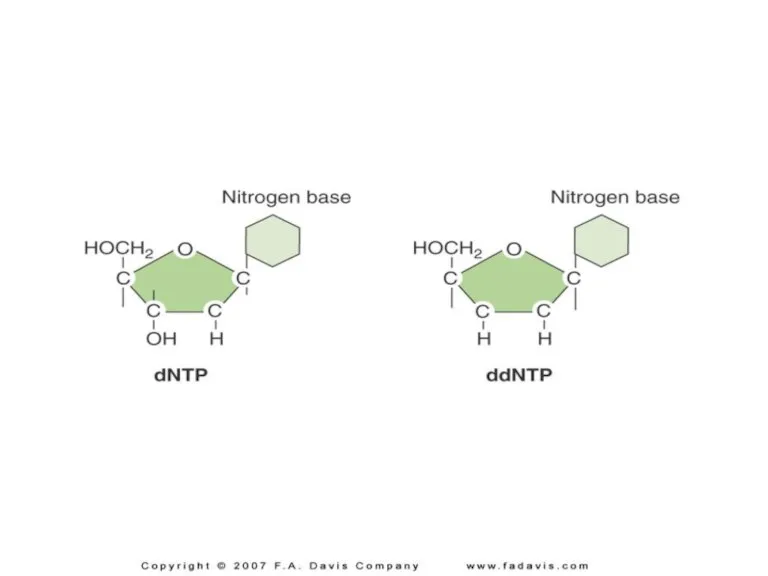
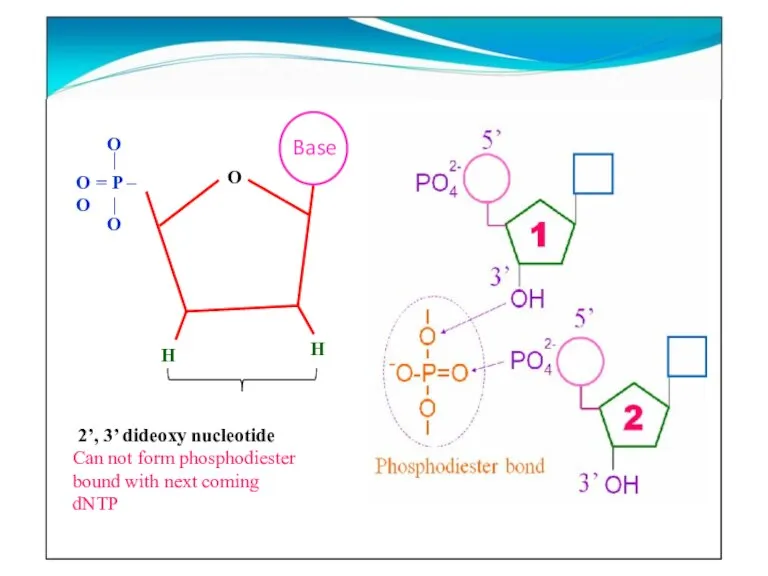
- 15. O H H O = P – O O O 2’, 3’ dideoxy nucleotide Can not
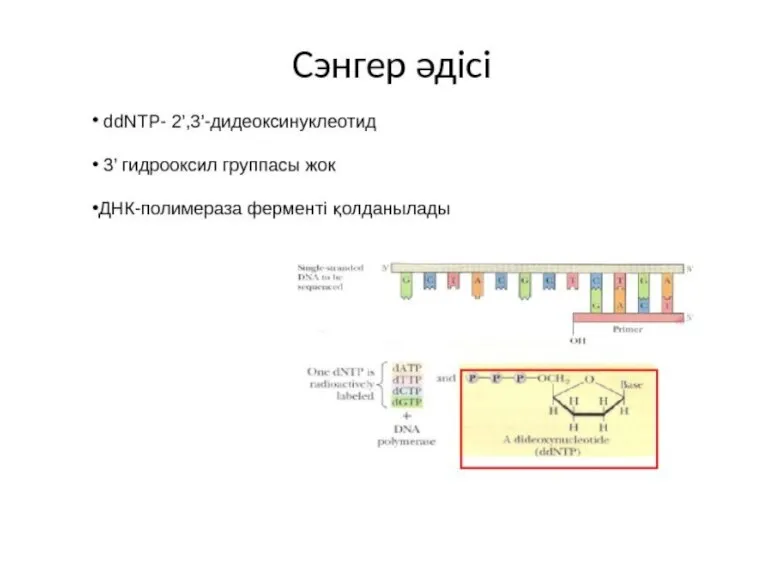
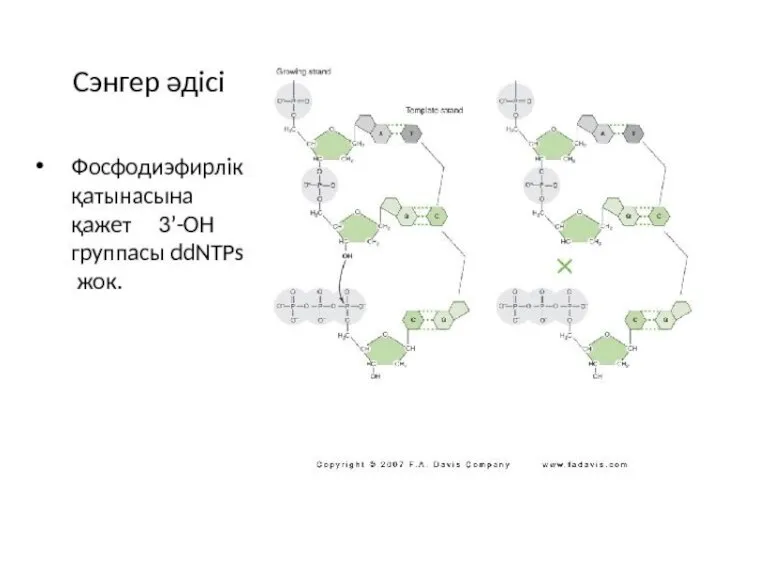
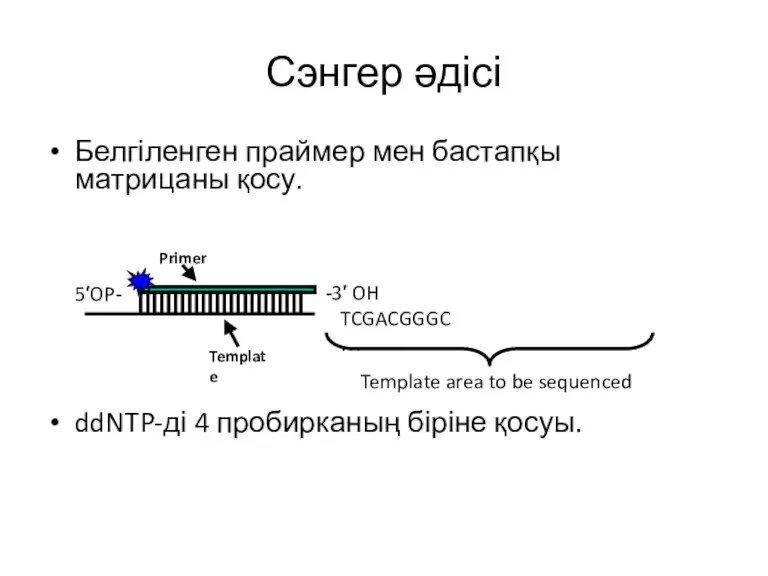
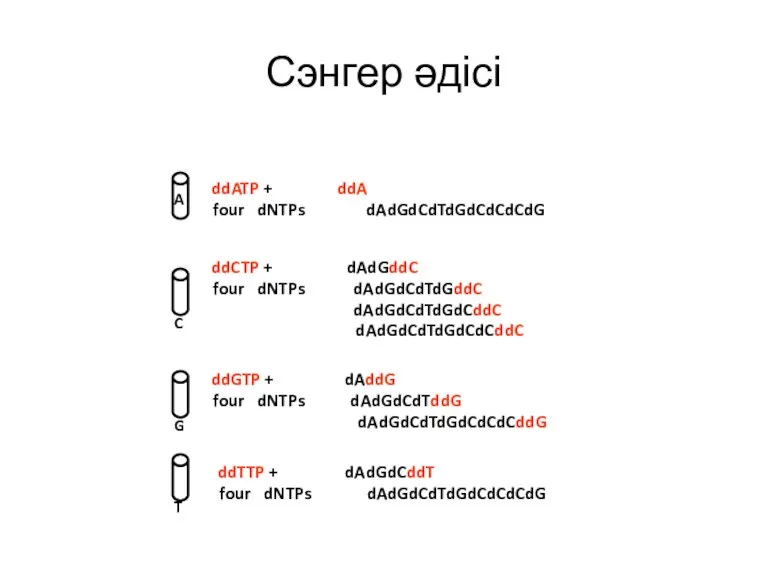
- 16. Сэнгер әдісі Белгіленген праймер мен бастапқы матрицаны қосу. ddNTP-ді 4 пробирканың біріне қосуы.
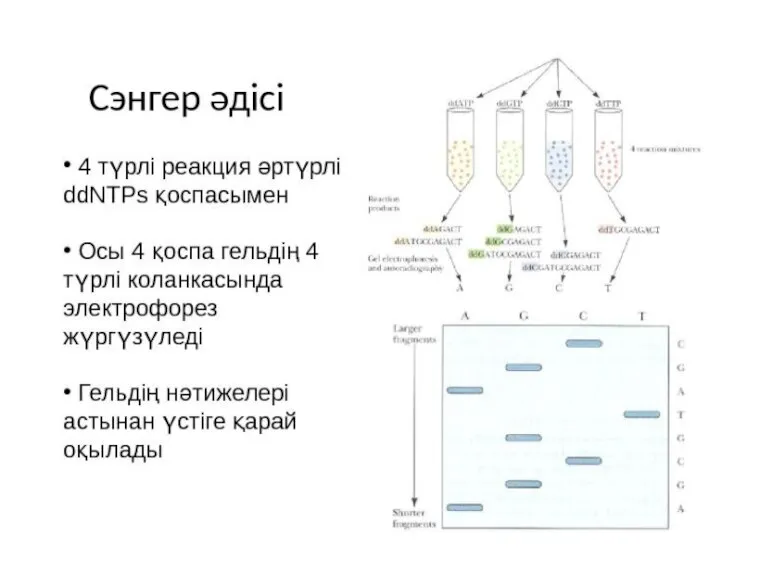
- 17. A C G T Сэнгер әдісі
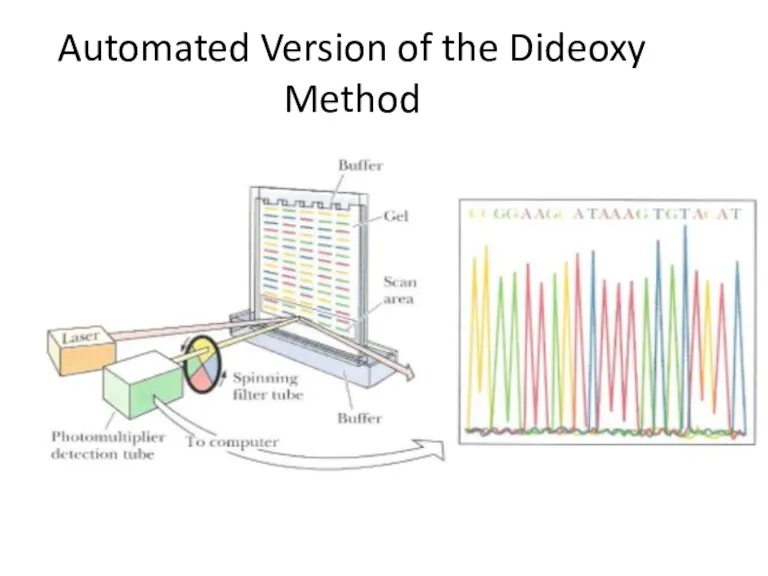
- 20. Automated Version of the Dideoxy Method
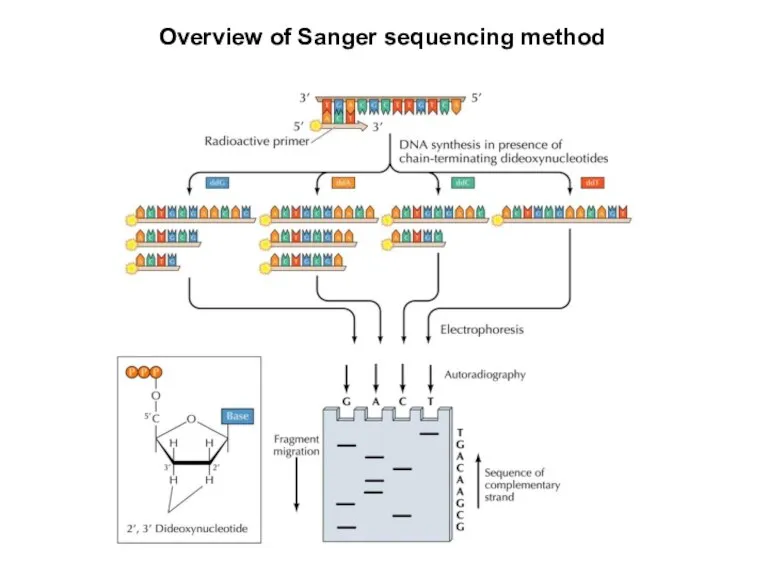
- 22. Overview of Sanger sequencing method
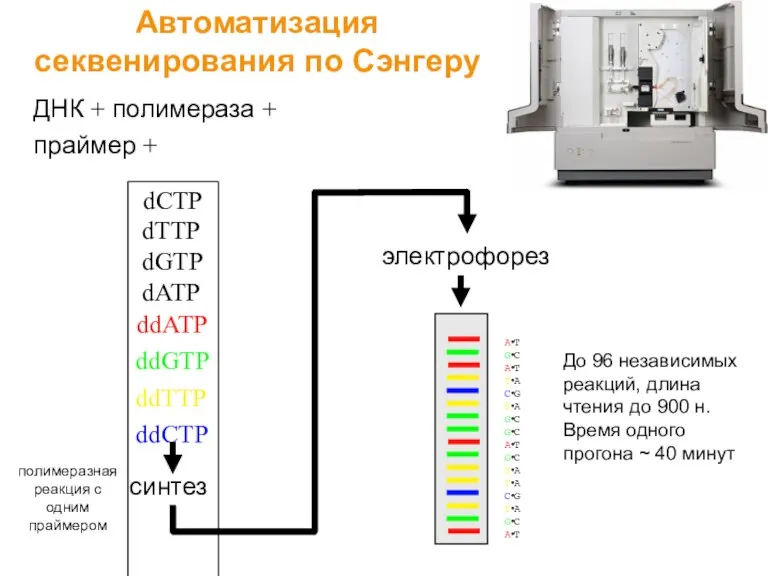
- 23. ДНК + полимераза + праймер + dCTP dTTP dGTP dATP ddATP ddGTP ddTTP ddCTP полимеразная реакция
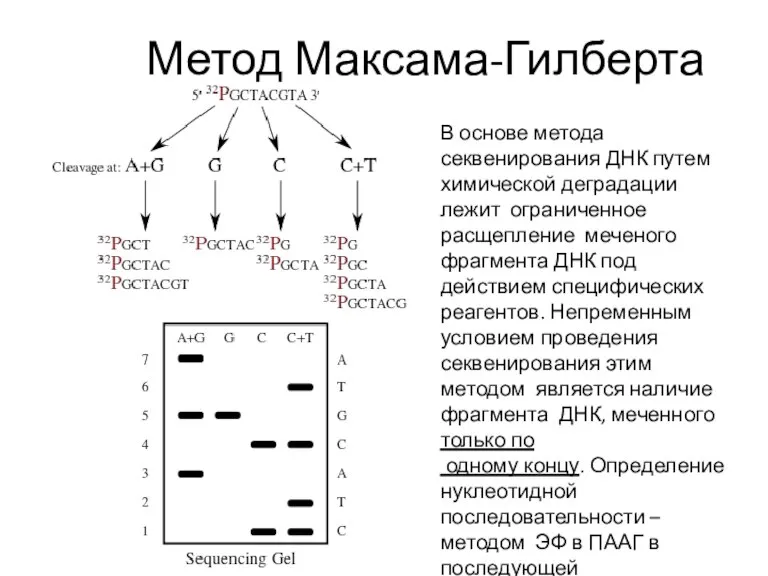
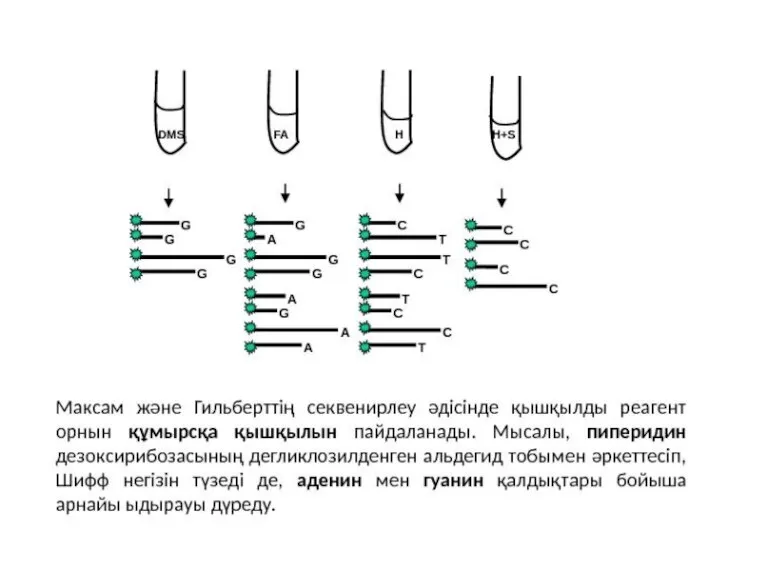
- 27. Метод Максама-Гилберта В основе метода секвенирования ДНК путем химической деградации лежит ограниченное расщепление меченого фрагмента ДНК
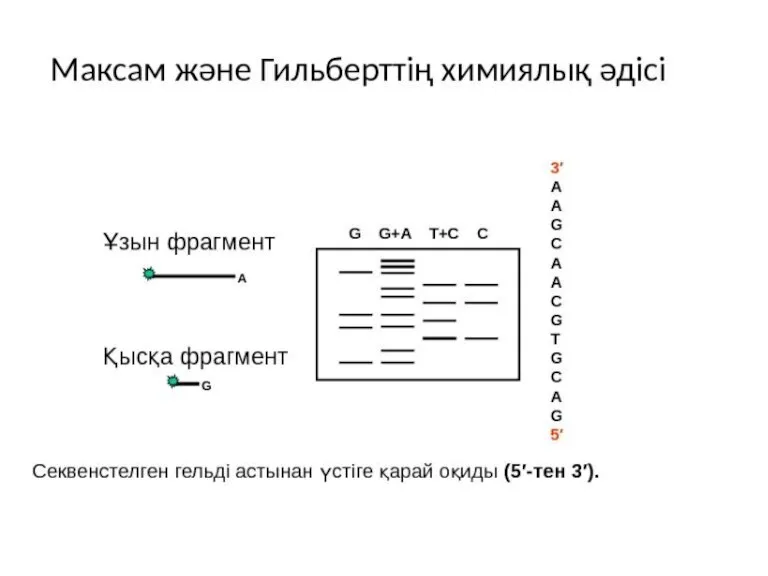
- 30. Стадии Двухцепочечный фрагмент, подлежащий секвенированию, изолирован и радиоактивно помечен на 5’-концах 32P. 2. Затем фрагмент разрезают
- 34. 9. The labeled fragments in the gel are visualized by autoradiography. 10. The sequence is read
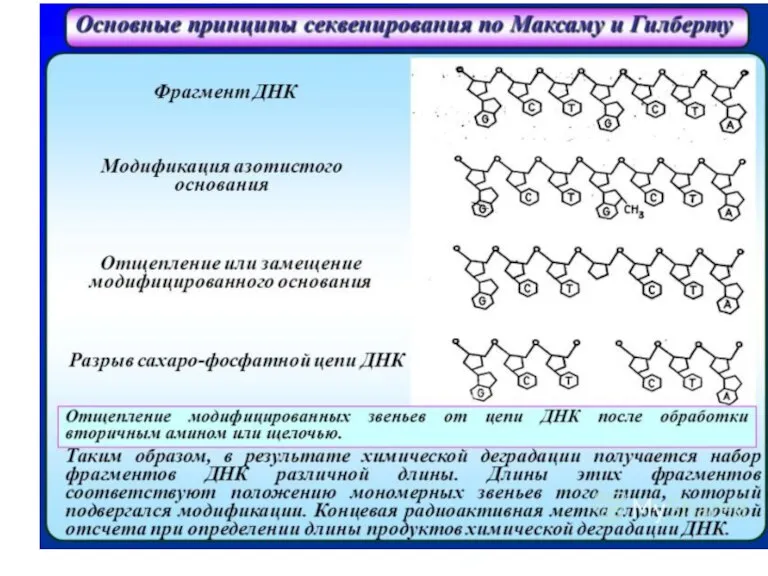
- 35. Химическая модификация азотистых основание заключается в: Депуринизации (A+G) с использованием муравьиной кислоты Метилировании гуанина с использованием
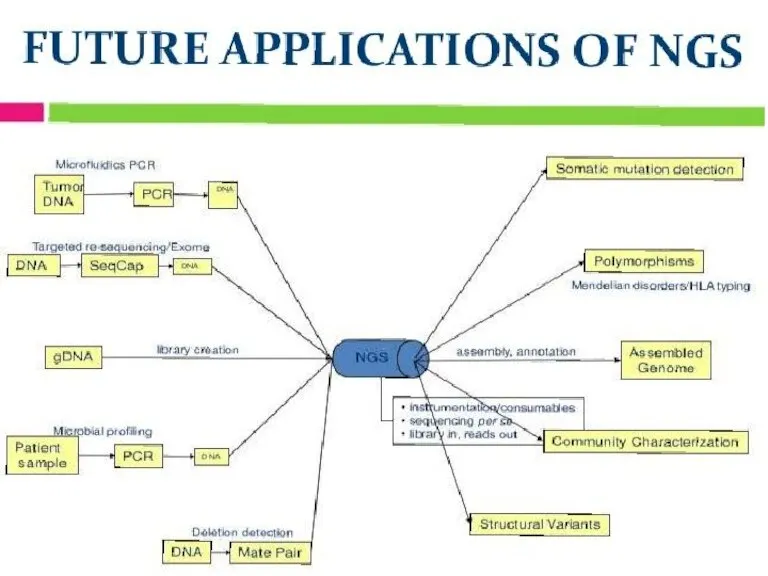
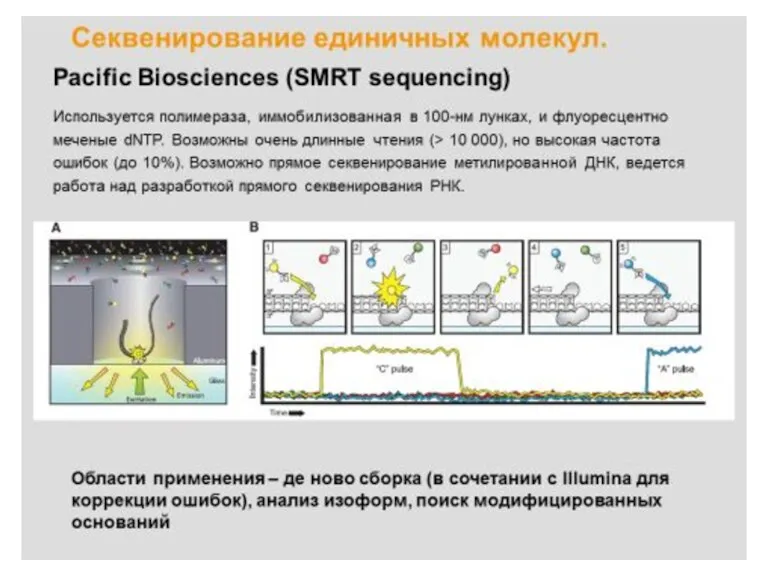
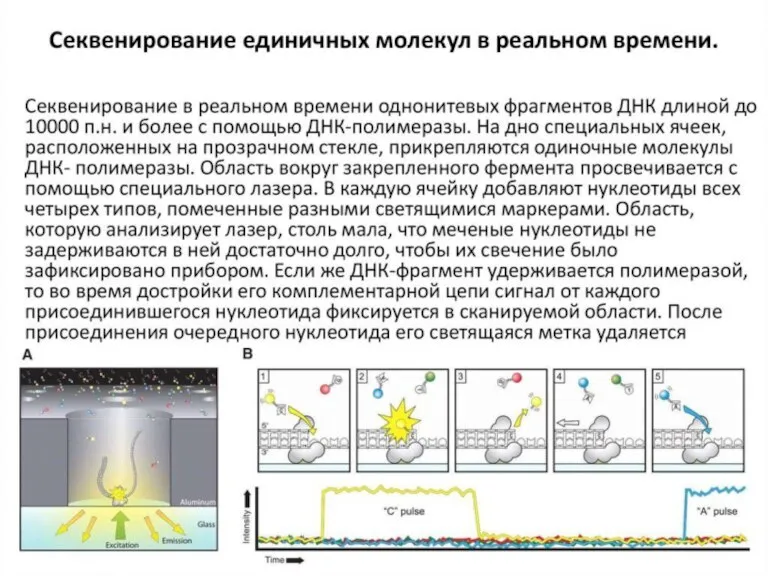
- 37. (Next generation sequencing), NGS
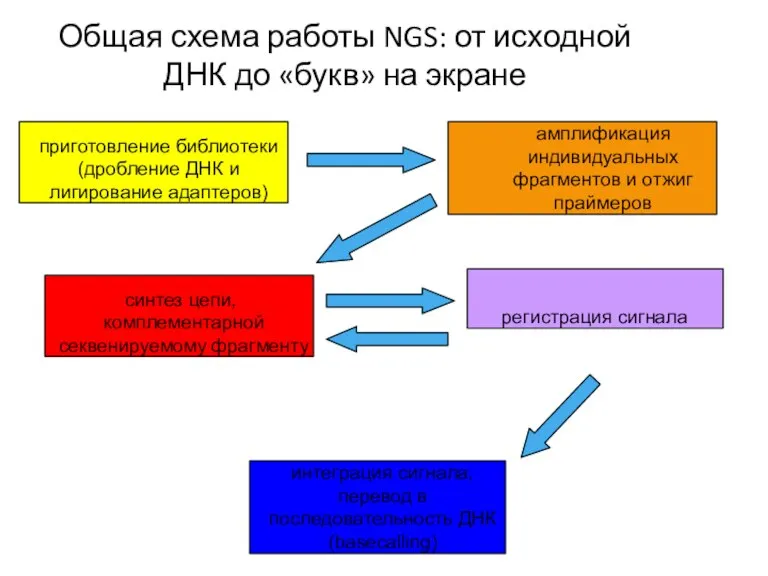
- 41. Общая схема работы NGS: от исходной ДНК до «букв» на экране приготовление библиотеки (дробление ДНК и
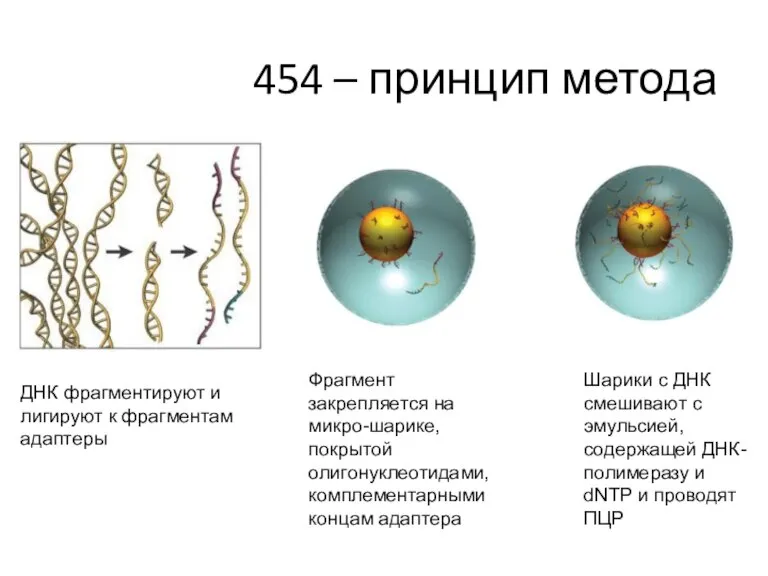
- 46. 454 – принцип метода ДНК фрагментируют и лигируют к фрагментам адаптеры Фрагмент закрепляется на микро-шарике, покрытой
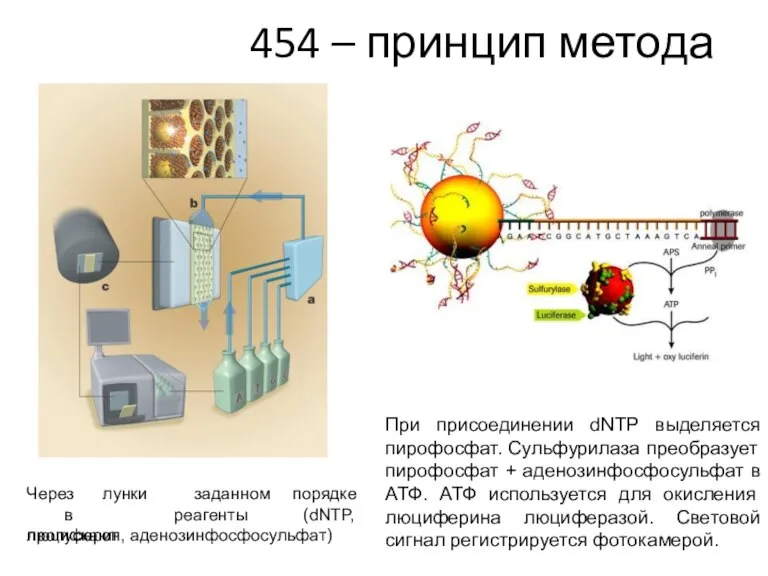
- 47. 454 – принцип метода Носитель – плашка с множеством (> 1 000 000) лунок В лунки
- 48. 454 – принцип метода Через лунки в пропускают заданном реагенты порядке (dNTP, люциферин, аденозинфосфосульфат) При присоединении
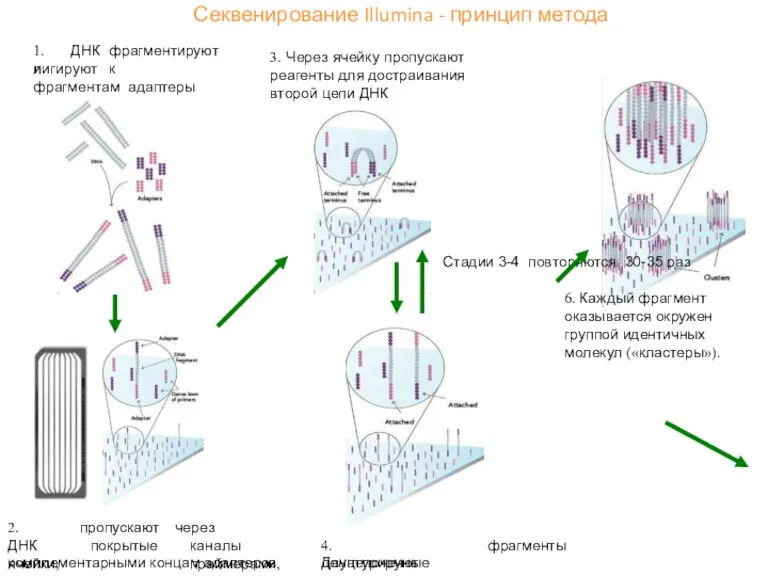
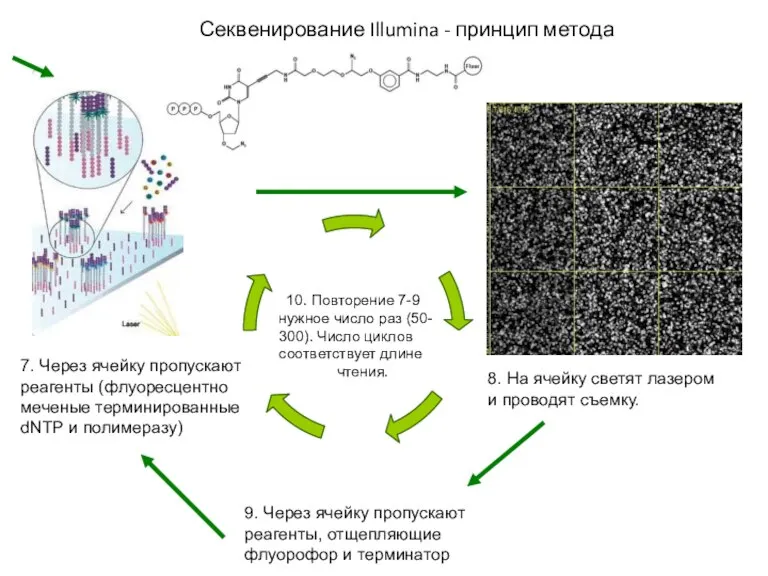
- 49. Секвенирование Illumina - принцип метода 1. ДНК фрагментируют и лигируют к фрагментам адаптеры 2. ДНК ячейки,
- 50. Секвенирование Illumina - принцип метода 7. Через ячейку пропускают реагенты (флуоресцентно меченые терминированные dNTP и полимеразу)
- 51. Преимущества: •высокая точность •универсальность •доступность ПО для обработки и анализа результатов •наименьшая цена получаемых данных (в
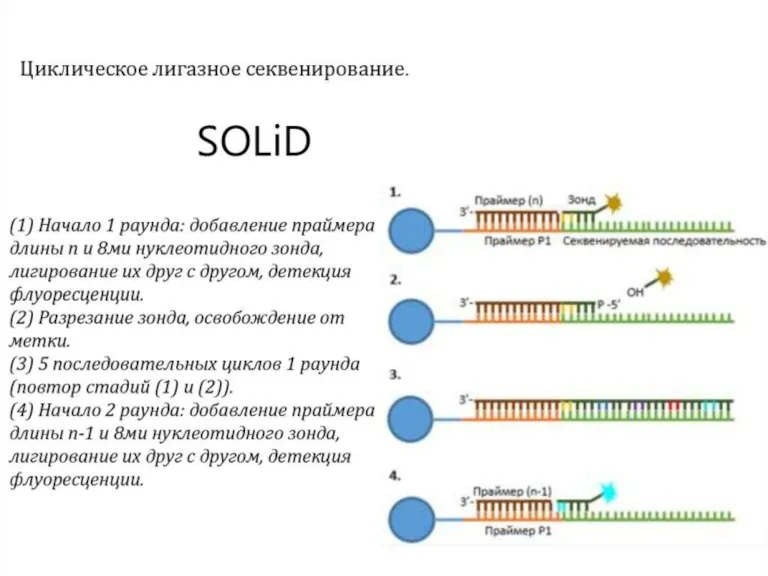
- 52. Секвенирование путем лигирования (SOLiD) Преимущества: высокая точность возможность использовать часть дорожек на ячейке Недостатки очень короткие
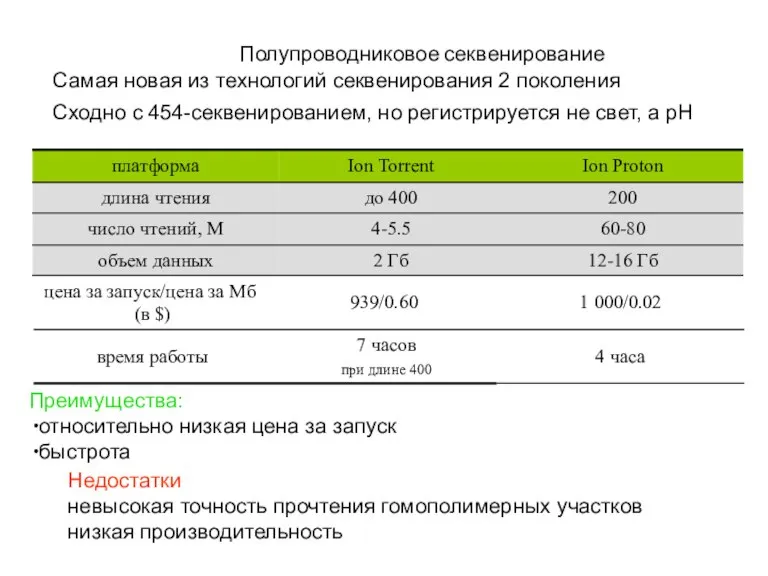
- 55. Полупроводниковое секвенирование Самая новая из технологий cеквенирования 2 поколения Сходно с 454-секвенированием, но регистрируется не свет,
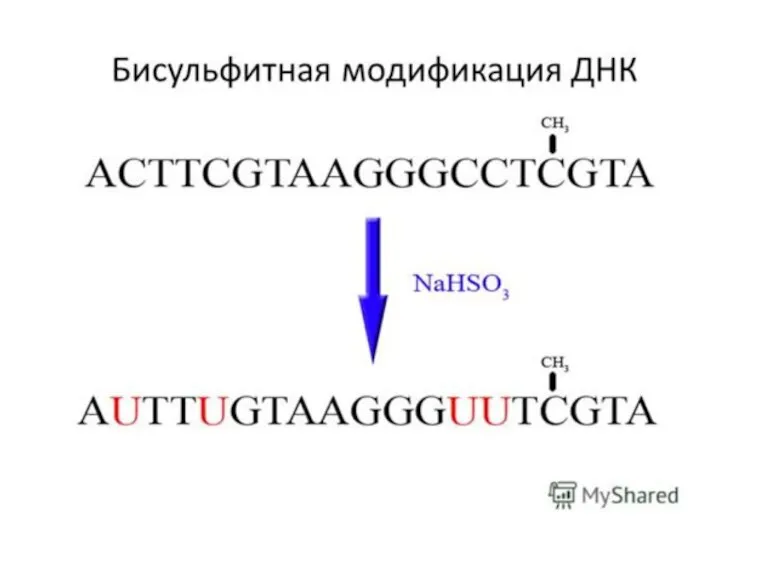
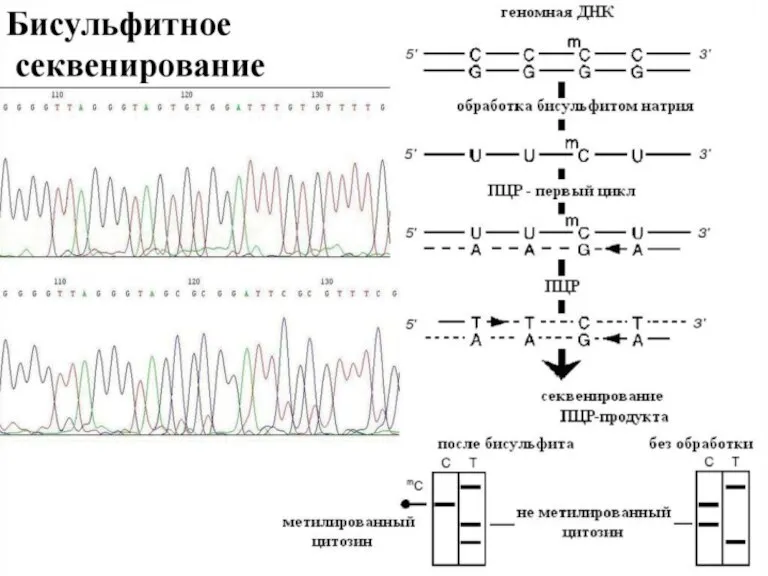
- 56. Бисульфитті секвенирлеу Бисульфитті секвенирлеу - бисульфитпен өңдеу арқылы ДНҚ метилдеу паттернасын зерттеуге бағытталған әдістер тобының жалпы
- 57. Бисульфит цитозинді урацилға айналдыра отырып, бір тізбекті ДНҚ-ға әсер етеді. Егер осы цитозин метилденген болса, яғни
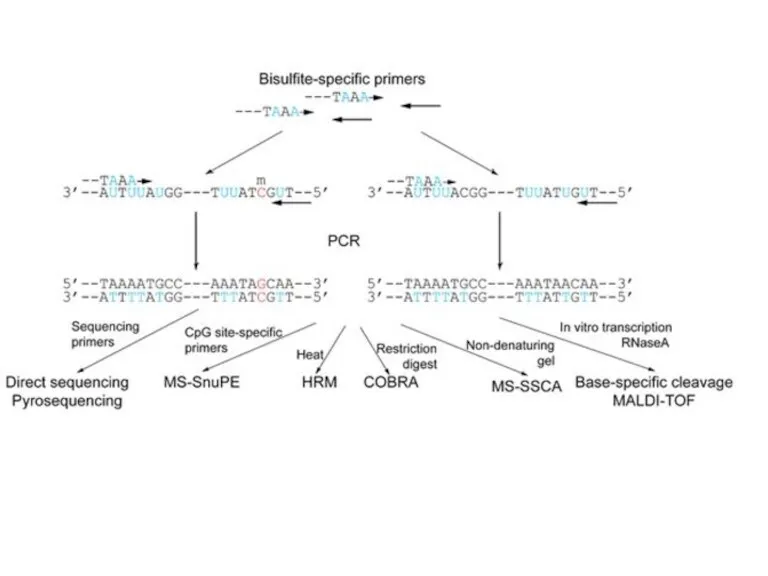
- 59. Бисульфитті секвенирлеудің бірінші әдісі 1992 жылы сипатталған. Метилдеу паттернін анықтау үшін ПЦР қолданылды, ол үшін праймерлер
- 62. Бисульфитті секвенирлеу әдістері бірқатар шектеулерге ие. Сүтқоректілерде ДНҚ 5-гидроксиметилцитозин модификациясы кең таралған. Бисульфитпен өңдеу кезінде 5-гидроксиметилцитозин
- 67. Скачать презентацию































 Полярный медведь
Полярный медведь Ботаника С1
Ботаника С1 Изменчивость
Изменчивость Царство Бактерии
Царство Бактерии Эмбриология. Половые клетки. Оплодотворение. Дробление
Эмбриология. Половые клетки. Оплодотворение. Дробление Весна в мире насекомых
Весна в мире насекомых Презентация на тему Физические явления в живых организмах
Презентация на тему Физические явления в живых организмах  Половое и бесполое размножение
Половое и бесполое размножение Взаимодействие популяций разных видов. Взаимоотношения особей внутри популяции
Взаимодействие популяций разных видов. Взаимоотношения особей внутри популяции Органы чувств. Регуляция деятельности организма
Органы чувств. Регуляция деятельности организма Designer baby
Designer baby Каланхоэ
Каланхоэ Викторина Лесная газета
Викторина Лесная газета Кровь. Тест
Кровь. Тест Кобчик – птица 2021 года
Кобчик – птица 2021 года Синичкин день
Синичкин день Грибы. Блок 1
Грибы. Блок 1 Соединительная ткань
Соединительная ткань Изменчивость. Наследственная изменчивость
Изменчивость. Наследственная изменчивость Надежная защита организма
Надежная защита организма Грибы
Грибы Потребность в сне
Потребность в сне Зелёная морская черепах
Зелёная морская черепах Ферменты − биологические катализаторы. 11 класс
Ферменты − биологические катализаторы. 11 класс Антропологический состав населения мира
Антропологический состав населения мира Презентация на тему Леса России
Презентация на тему Леса России  Опыт с пекинской капустой или как растения пьют воду
Опыт с пекинской капустой или как растения пьют воду Клеточный цикл. Митоз. Наблюдение митоза в клетках кончика корешка лука на готовых микропрепаратах
Клеточный цикл. Митоз. Наблюдение митоза в клетках кончика корешка лука на готовых микропрепаратах