Слайд 2Камышева К.С. Основы микробиологии и иммунологии Уч. пособие. «Феникс», 2015 с. 74-80

Слайд 3Микробиологическое исследование — это выделение чистых культур микроорганизмов, культивирование и изучение их

свойств.
Чистыми называются культуры, состоящие из микроорганизмов одного вида.
Слайд 4Они нужны при диагностике инфекционных болезней, для определения видовой и типовой принадлежности

микробов, в исследовательской работе, для получения продуктов жизнедеятельности микробов (токсинов, антибиотиков, вакцин и т. п.).
Слайд 5Для культивирования микроорганизмов (выращивание в искусственных условиях in vitro) необходимы особые субстраты

— питательные среды.
На средах микроорганизмы осуществляют все жизненные процессы (питаются, дышат, размножаются и т. д.), поэтому их еще называют «средами для культивирования».
Питательные среды являются основой микробиологической работы, и их качество нередко определяет результаты всего исследования. Среды должны создавать оптимальные (наилучшие) условия для жизнедеятельности микробов.
Слайд 6Требования, предъявляемые к средам
Среды должны соответствовать следующим условиям:
1) быть питательными, т. е.

содержать в легко усвояемом виде все вещества, необходимые для удовлетворения пищевых и энергетических потребностей.
Ими являются источники органогенов и минеральных (неорганических) веществ, включая микроэлементы.
Слайд 7Минеральные вещества не только входят в структуру клетки и активизируют ферменты, но

и определяют физико-химические свойства сред (осмотическое давление, рН и др.).
При культивировании ряда микроорганизмов в среды вносят факторы роста — витамины, некоторые аминокислоты, которые клетка не может синтезировать (ауксотрофы).
Слайд 8Внимание! Микроорганизмы, как все живые существа, нуждаются в большом количестве воды.
2) иметь

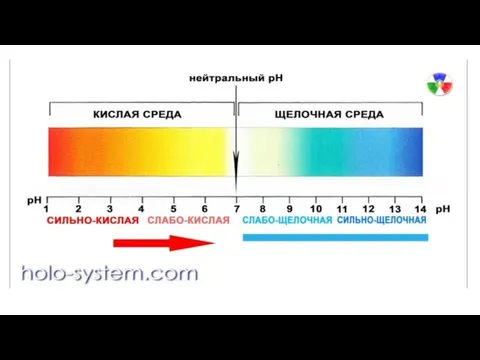
оптимальную концентрацию водородных ионов — рН, так как только при оптимальной реакции среды, влияющей на проницаемость оболочки, микроорганизмы могут усваивать питательные вещества.
Для большинства патогенных бактерий оптимальна слабощелочная среда (рН 7,2—7,4).
Исключение составляют холерный вибрион — его оптимум находится в щелочной зоне (рН 8,5—9,0) и возбудитель туберкулеза, нуждающийся в слабокислой реакции (рН 6,2—6,8).
Слайд 10Чтобы во время роста микроорганизмов кислые или щелочные продукты их жизнедеятельности не

изменили рН, среды должны обладать буферностью, т. е. содержать вещества, нейтрализующие продукты обмена;
3) быть изотоничными для микробной клетки, т. е. осмотическое давление в среде должно быть таким же, как внутри клетки. Для большинства микроорганизмов оптимальна среда, соответствующая 0,5% раствору натрия хлорида;
Слайд 114) быть стерильными, так как посторонние микробы препятствуют росту изучаемого микроба, определению

его свойств и изменяют свойства среды (состав, рН и др.);
5) плотные среды должны быть влажными и иметь оптимальную для микроорганизмов консистенцию;
Слайд 126) обладать определенным окислительно-восстановительным потенциалом, т. е. соотношением веществ, отдающих и принимающих

электроны, выражаемым индексом RH2.
Этот потенциал показывает насыщение среды кислородом. Для одних микроорганизмов нужен высокий потенциал, для других — низкий.
Например, анаэробы размножаются при RH2 не выше 5, а аэробы — при RH2 не ниже 10. Окислительно-восстановительный потенциал большинства сред удовлетворяет требованиям к нему аэробов и факультативных анаэробов;
Слайд 137) быть по возможности унифицированным, т. е. содержать постоянные количества отдельных ингредиентов.

Так, среды для культивирования большинства патогенных бактерий должны содержать 0,8—1,2 гл аминного азота NH2, т. е. суммарного азота аминогрупп аминокислот и низших полипептидов; 2,5—3,0 гл общего азота N; 0,5% хлоридов в пересчете на натрия хлорид; 1% пептона.
Слайд 14Пептон (англ. Peptone) — препарат, полученный из молока и мяса животных под действием протеолитических ферментов (если используется трипсин,

то такой пептон называется триптон).
На начальных стадиях процесса переваривания белков под действием ферментов, например, пепсина образуются крупные белковые фрагменты, которые и называются пептонами. Кроме коротких пептидов, обычно пептоны содержат жиры, металлы, соли, витамины и много других органических и минеральных веществ.
Пептоны широко используются для создания питательной среды для выращивания бактерий и грибов.
Слайд 15Желательно, чтобы среды были прозрачными — удобнее следить за ростом культур, легче
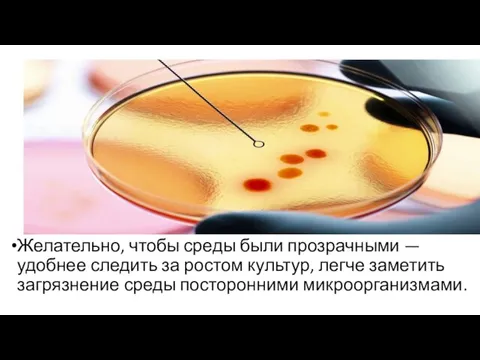
заметить загрязнение среды посторонними микроорганизмами.
Слайд 16Классификация сред
Потребность в питательных веществах и свойствах среды у разных видов микроорганизмов

неодинакова.
Это исключает возможность создания универсальной среды. Кроме того, на выбор той или иной среды влияют цели исследования.
В настоящее время предложено огромное количество сред, в основу классификации которых положены следующие признаки.
Слайд 171. Исходные компоненты. По исходным компонентам различают натуральные и синтетические среды. Натуральные

среды готовят из продуктов животного и растительного происхождения.
В настоящее время разработаны среды, в которых ценные пищевые продукты (мясо и др.) заменены непищевыми: костной и рыбной мукой, кормовыми дрожжами, сгустками крови и др.
Несмотря на то, что состав питательных сред из натуральных продуктов очень сложен и меняется в зависимости от исходного сырья, эти среды нашли широкое применение.
Слайд 18Синтетические среды готовят из определенных химически чистых органических и неорганических соединений, взятых

в точно указанных концентрациях и растворенных в дважды дистиллированной воде.
Важное преимущество этих сред в том, что состав их постоянен (известно, сколько и какие вещества в них входят), поэтому эти среды легко воспроизводимы.
Слайд 202. Консистенция (степень плотности). Среды бывают жидкие, плотные и полужидкие. Плотные и

полужидкие среды готовят из жидких веществ, к которым для получения среды нужной консистенции прибавляют обычно агар-агар или желатин.
Слайд 23Агар-агар — полисахарид, получаемый из определенных сортов морских водорослей. Он не является

для микроорганизмов питательным веществом и служит только для уплотнения среды. В воде агар плавится при 80— 100°С, застывает при 40—45°С.
Слайд 24Желатин — белок животного происхождения. При 25— 30°С желатиновые среды плавятся, поэтому

культуры на них обычно выращивают при комнатной температуре.
Плотность этих сред при рН ниже 6,0 и выше 7,0 уменьшается, и они плохо застывают. Некоторые микроорганизмы используют желатин как питательное вещество — при их росте среда разжижается.
Кроме того, в качестве плотных сред применяют свернутую сыворотку крови, свернутые яйца, картофель, среды с селикагелем.
Слайд 253. Состав. Среды делят на простые и сложные. К первым относят мясопептонный

бульон (МПБ), мясопептонный агар (МПА), бульон и агар Хоттингера, питательный желатин и пептонную воду.
Сложные среды готовят, прибавляя к простым средам кровь, сыворотку, углеводы и другие вещества, необходимые для размножения того или иного микроорганизма.
Слайд 264. Назначение:
а) основные (общеупотребительные) среды служат для культивирования большинства патогенных микробов.

Это вышеупомянутые МПА, МПБ, бульон и агар Хоттингера, пептонная вода;
Слайд 27б) специальные среды служат для выделения и выращивания микроорганизмов, не растущих на

простых средах.
Например, для культивирования стрептококка к средам прибавляют сахар, для пневмо- и менингококков — сыворотку крови, для возбудителя коклюша — кровь;
Слайд 29в) элективные (избирательные) среды служат для выделения определенного вида микробов, росту которых

они благоприятствуют, задерживая или подавляя рост сопутствующих микроорганизмов. Так, соли желчных кислот, подавляя рост кишечной палочки, делают среду элективной для возбудителя брюшного тифа.
Среды становятся элективными при добавлении к ним определенных антибиотиков, солей, изменении рН.
Слайд 32Жидкие элективные среды называют средами накопления.
Примером такой среды служит пептонная вода

с рН 8,0. При таком рН на ней активно размножается холерный вибрион, а другие микроорганизмы не растут;
Слайд 33г) дифференциально-диагностические среды позволяют отличить (дифференцировать) один вид микробов от другого по

ферментативной активности, например среды Гисса с углеводами и индикатором.
При росте микроорганизмов, расщепляющих углеводы, изменяется цвет среды;
Слайд 38д) консервирующие среды предназначены для первичного посева и транспортировки исследуемого материала; в

них предотвращается отмирание патогенных микроорганизмов и подавляется развитие сапрофитов. Пример такой среды — глицериновая смесь, используемая для сбора испражнений при исследованиях, проводимых с целью обнаружения ряда кишечных бактерий.
Слайд 39Методы посевов
Важным этапом бактериологического исследования является посев. В зависимости от цели исследования,

характера посевного материала и среды используют разные методы посева. Все они включают обязательную цель: оградить поссев от посторонних микробов. Поэтому работать следует быстро, но без резких движений, усиливающих колебание воздуха. Во время посевов нельзя разговаривать. Посев лучше делать в боксе (при работе с заразным материалом необходимо выполнять правила личной безопасности).
Слайд 40Этапы выделения чистой культуры:
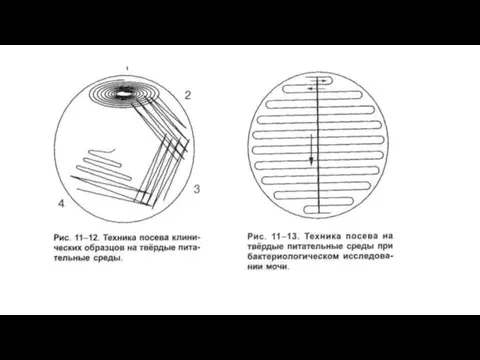
1-й день — получение изолированных колоний. Каплю исследуемого материала

петлей, пипеткой или стеклянной палочкой наносят на поверхность агара в чашке Петри.
Шпателем втирают материал в поверхность среды; не прожигая и не перевертывая шпателя, производят посев на 2-й, а тем на 3-й чашке. При таком посеве на 1-ю чашку приходится много материала и соответственно много микробов, на 2-ю меньше и на 3-ю еще меньше.
Можно получить изолированные колонии при посеве петлей. Для этого исследуемый материал эмульгируют в бульоне или изотоническом растворе натрия хлорида.
Слайд 432-й день — изучают рост микробов на чашках. В 1-й чашке обычно

бывает сплошной рост — выделить изолированную колонию не удастся. На поверхности агара во 2-й и 3-й чашке вырастают изолированные колонии.
Их изучают невооруженным глазом, с помощью лупы, при малом увеличении микроскопа и иногда в стереоскопическом микроскопе.
Нужную колонию отмечают со стороны дна чашки и пересевают на скошенный агар.
Посевы ставят в термостат. (Пересевать можно только изолированные колонии.)
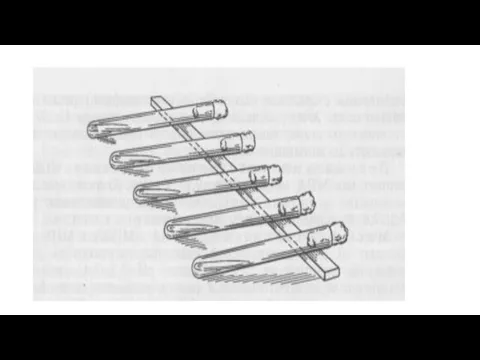
Слайд 493-й день — изучают характер роста на скошенном агаре. Делают мазок, окрашивают

его и, убедившись в том, что культура чистая, приступают к ее изучению.
На этом выделение чистой культуры заканчивается. Выделенная из определенного источника и изученная культура называется «штаммом».
Слайд 50При выделении чистой культуры из крови (гемокультуры) ее предварительно «подращивают» в жидкой

среде: 10—15 мл стерильно взятой крови засевают в 100—150 мл жидкой среды. Так поступают потому, что в крови обычно мало микробов. Соотношение засеваемой крови и питательной среды 1 : 10 не случайно — так достигается разведение крови (неразведенная кровь губительно действует на микроорганизмы).
Колбы с посевом ставят в термостат.
Через сутки (иногда через большее время, в зависимости от выделяемой культуры) из содержимого колб делают высевы на чашки для получения изолированных колоний. При необходимости повторяют высевы с интервалом в 2—3 дня.
Слайд 51При выделении чистой культуры из мочи, промывных вод желудка и других жидкостей

их предварительно центрифугируют в асептических условиях и засевают осадок. Дальнейшее выделение чистой культуры производят обычным способом.
Слайд 52Для выделения чистой культуры широко применяют элективные среды. В ряде методов для

получения чистых культур используют биологические особенности выделяемого микроба.
Например, при выделении спорообразующих бактерий посевы 10 мин прогревают при 80°С, убивая этим вегетативные формы.
При выделении возбудителя туберкулеза, устойчивого к кислотам и щелочам, с помощью этих веществ посевной материал освобождают от сопутствующей! флоры.
Для выделения пневмококка и палочки чумы исследуемый материал вводят белым мышам — в их организме высокочувствительном к данным возбудителям, эти микробы размножаются быстрее других.
Слайд 53В научно-исследовательской работе, особенно при генетических исследованиях, необходимо получать культуры заведомо из

одной клетки. Такая культура называется «клон»].
Для ее получения чаще всего пользуются микроманипулятором — прибором, снабженным инструментами (иглами] пипетками) микроскопических размеров.
С помощью держателя под контролем микроскопа их вводят в препарат «Bисячая капля», извлекают нужную клетку (одну) и переносят ее в питательную среду.
Слайд 54Изучение выделенных культур
Изучение морфологии, подвижности, тинкториальных свойств, характера роста на средах (культуральные

свойства);ферментативной активности и ряда других особенностей выделенного микроба позволяет установить его таксономическое положение, т. е. классифицировать микроорганизм: определить его род, вид, тип, подтип, разновидность.
Это называется «идентификацией». Идентификация микроорганизмов очень важна при диагностике инфекций, установлена источников и путей ее передачи и в ряде других научно-аналитических исследований.
Слайд 55Культуральные свойства
Различные виды микроорганизмов по-разному растут на средах. Эти различия служат для

их дифференциации. Одни хорошо растут на простых средах, другие — требовательны и растут только на специальных.
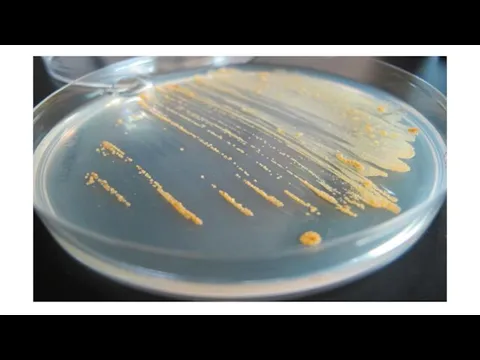
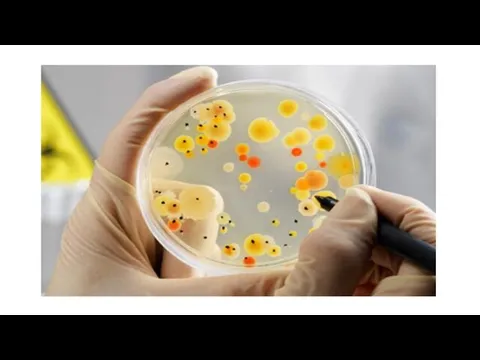
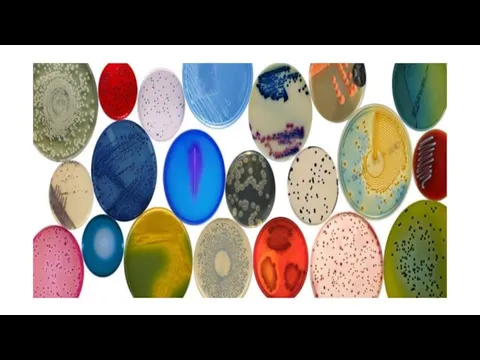
Микроорганизмы могут давать обильный (пышный) рост, умеренный или скудный. Культуры могут быть бесцветными, сероватыми, серо-голубыми. Культуры микроорганизмов, образующих пигмент, имеют разнообразную окраску: белую, желтую или золотистую у стафилококка, красную — у чудесной палочки, сине-зеленую — у сине-зеленой палочки, пигмент которой, растворимый в воде, окрашивает не только колонии, но и среду.
Слайд 58На плотных средах микроорганизмы в зависимости от количества посевного материала образуют или

сплошной налет («газон»), или изолированные колонии.
Культуры бывают грубые и нежные, прозрачные и непрозрачные, с поверхностью матовой, блестящей, гладкой, шероховатой, сухой, бугристой.
Колонии могут быть крупные (4—5 мм в диаметре и больше), средние (2—4 мм), мелкие (1—2 мм) и карликовые (меньше 1 мм).
Слайд 59Они различаются по форме, расположению на поверхности среды (выпуклые, плоские, куполообразные, вдавленные,

круглые, розеткообразные), форме краев (ровные, волнистые, изрезанные).
Слайд 61В жидких средах микроорганизмы могут образовывать равномерную муть, давать осадок (зернистый, пылевидный,

хлопьевидный) или пленку (нежную, грубую, морщинистую).
На полужидких средах при посеве уколом подвижные микробы вызывают помутнение толщи среды, неподвижные — растут только по «уколу», оставляя остальную среду прозрачной.
При изучении формы колоний учитывают характер её поверхности: матовый, блестящий, гладкий или шероховатый
Слайд 63Культуральные свойства определяют, изучая характер роста культуры простым глазом, с помощью лупы,

под малым увеличением микроскопа или пользуясь стереоскопическим микроскопом.
Величину и форму колоний, форму краев и прозрачность изучают в проходящем свете, рассматривая чашки со стороны дна. В отраженном свете (со стороны крышки) определяют характер поверхности, окраску. Консистенцию определяют прикосновением петли.
Слайд 64Морфологические свойства
Изучение морфологии микробов тоже служит для их дифференциации.
Морфологию изучают в окрашенных

препаратах. Устанавливают форму и величину клеток, их расположение в препарате, наличие спор, капсул, жгутиков.
В окрашенных препаратах определяют отношение микробов к краскам (тинкториальные свойства) — хорошо или плохо воспринимают краски, как относится к дифференциальным окраскам (в какой цвет окрашивается по Граму, Цилю—Нильсену и др.).
Слайд 65В большинстве случаев изучение особенностей роста для первичной идентификации возбудителей проводят на

колониях, выросших в течение 18-24ч. Характер роста бактерий на различных средах может дать много полезной информации.
На практике используют сравнительно небольшой набор критериев.
Слайд 66В жидких средах обычно учитывают характер поверхностного (образование плёнки) или придонного роста

(вид осадка) и общее помутнение среды.
На твёрдых средах бактерии формируют колонии — изолированные структуры, образующиеся в результате роста и накопления бактерий. Колонии возникают как следствие роста и размножения одной или нескольких клеток.
Таким образом, пересев из колонии в дальнейшем дает возможность оперировать с чистой культурой возбудителя.
Слайд 67Рост бактерий на плотных средах имеет больше характерных особенностей:
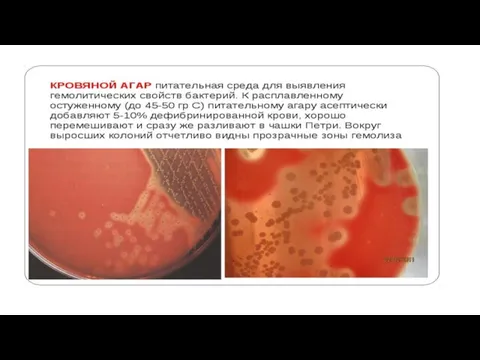
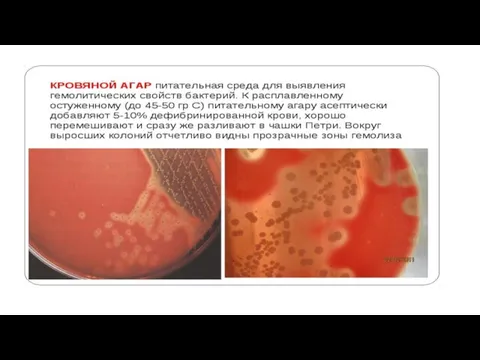
. Гемолиз Некоторые бактерии

выделяют гемолизины — вещества, разрушающие эритроциты. На КА их колонии окружают зоны просветления.
Образование гемолизинов (и соответственно — размеры зон гемолиза) может быть вариабельным, и для адекватного определения гемолитической активности следует просматривать чашки с посевами против источника света. Активность гемолизинов может проявляться в полном или неполном разрушении эритроцитов.
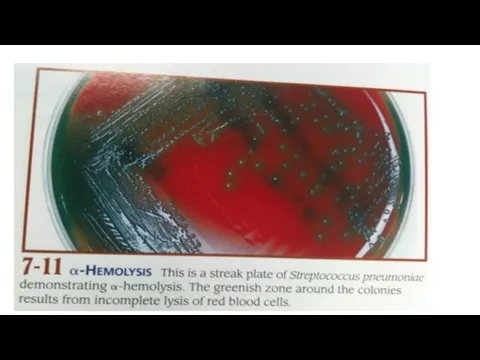
Слайд 70альфа-Гемолиз
Разрушение эритроцитов может быть неполным, с сохранением клеточной стромы. Подобный феномен называют

а-гемолиз. Просветление среды вокруг колоний обычно незначительно, позднее среда вокруг колоний может приобретать зеленоватую окраску.
Подобный рост характерен для пневмококка, а также для группы так называемых зеленящих стрептококков.
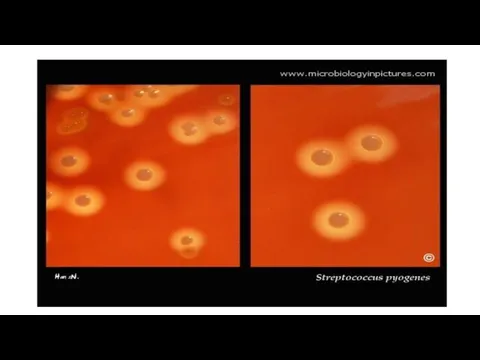
Слайд 72бета-Гемолиз Гораздо большая группа бактерий вызывает полное разрушение эритроцитов, или бета-гемолиз. Их

колонии окружены прозрачными зонами различного размера.
Например, Streptococcus pyogenes и Staphylococcus aureus образуют большие зоны гемолиза, a Listeria monocytogenes или Streptococcus agalactiae — небольшие, диффузные зоны. Для определения гемолитической активности не следует применять шоколадный агар (ША, так как образующиеся зоны а- или бета-гемолиза не имеют характерных особенностей и вызывают одинаковое позеленение среды.
Слайд 74
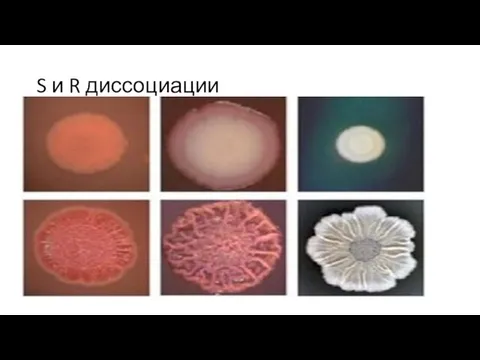
Диссоциации колоний Размеры и формы колоний часто могут изменяться. Подобные изменения известны

как диссоциации.
Наиболее часто обнаруживают S-диссоциации и R-диссоциации. S-колонии круглые, гладкие и выпуклые, с ровными краями и блестящей поверхностью.
R-колонии — неправильной формы, шероховатые, с зубчатыми краями.
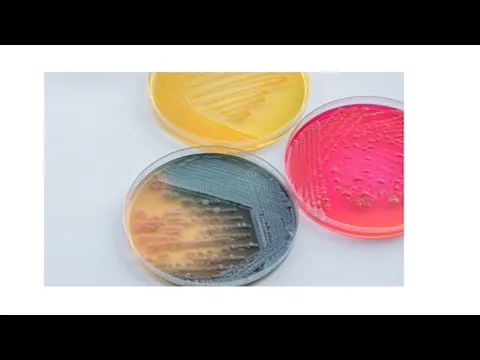
Слайд 76Цвет колоний При просмотре посевов также обращают внимание на цвет колоний. Чаще

они бесцветные, белые, голубоватые, жёлтые или бежевые; реже — красные, фиолетовые, зелёные или чёрные.
Иногда колонии ирризируют, то есть переливаются всеми цветами радуги [от греч. iris, радуга].
Окрашивание возникает в результате способности бактерий к пигментообразованию.
Слайд 77На специальных дифференцирующих средах, включающих специальные ингредиенты или красители, колонии могут приобретать

разнообразную окраску (черную, синюю и др.) за счёт включения красителей либо их восстановления из бесцветной формы.
В данном случае их окраска не связана с образованием каких-либо пигментов.
Полезную информацию могут дать консистенция колоний бактерий и особенности роста колоний бактерий на среде. Обычно эту информацию можно получить при прикосновении к колониям петлёй. Колонии могут легко сниматься со среды, врастать в неё или вызывать её коррозию (образуя трещины и неровности).
Слайд 78Консистенция колоний может быть твёрдой или мягкой. Мягкие колонии бактерий — маслянистые

или сливкообразные; могут быть слизистыми (прилипают к петле) или вязкими (тянущимися за петлёй). Твёрдые колонии бактерий — сухие, восковидные, волокнистые или крошковатые; могут быть хрупкими и ломаться при прикосновении петлёй.
Слайд 79Запах колоний бактерий Запах колоний бактерий — менее важный признак колоний, поскольку

вызываемые им ассоциации носят субъективный характер.
В частности, культуры синегнойной палочки имеют запах карамели, культуры листерий — молочной сыворотки, протеев — гнилостный запах, нокардий — све-жевскопанной земли.
Слайд 80Биохимические методы идентификации бактерий.
Способность к ферментации углеводов у бактерий.
Способность к ферментации

углеводов у бактерий оценивают по изменению окраски среды вследствие образования органических кислот (соответственно, происходит уменьшение рН), вызывающих изменение окраски индикатора.
Слайд 81Пёстрый ряд при диагностике бактерий.
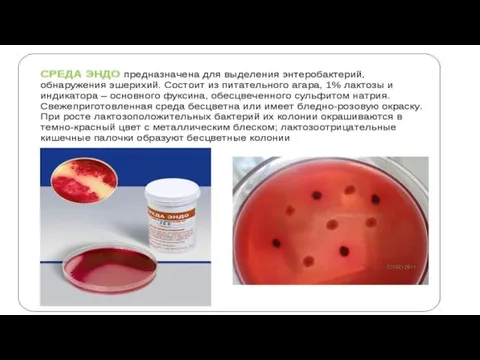
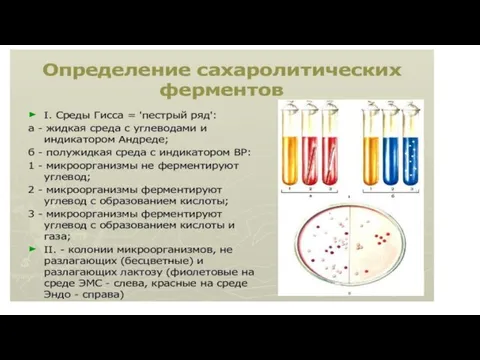
Для определения сахаролитической активности применяют среды Хисса;

в их состав входят 1% пептонная вода (или МПБ), индикатор Андраде и один из углеводов. При расщеплении углевода происходит изменение цвета среды с жёлтого на красный. Поскольку бактерии различают по способности ферментировать те или иные углеводы, то ряды пробирок приобретают пёстрый вид. Поэтому этот набор сред и называют «пёстрый» (или цветной) ряд.
Слайд 83 Стеклянные поплавки при диагностике ферментации углеводов у бактерий. Для определения способности

микроорганизмов ферментировать углеводы с образованием кислоты и газа в сосуды со средами вносят стеклянные поплавки (запаянные с одного конца короткие трубочки), всплывающие после наполнения их газом.
Слайд 84Расщепление белков бактериями Некоторые бактерии проявляют протеолитическую активность, выделяя протеазы, катализирующие расщепление

белков.
Наличие протеолитических ферментов из группы коллагеназ определяют при посеве уколом в МПЖ.
При положительном результате наблюдают его разжижение в виде воронки либо послойно сверху вниз.
Способность к расщеплению белков и аминокислот также можно оценивать по изменению окраски среды, так как образующиеся продукты — аммиак, индол и сероводород — сдвигают рН в щелочную сторону, вызывая изменение окраски индикатора.
Слайд 85Образование аммиака бактериями. Для определения способности к образованию NH3 проводят посев в

МПБ, и между его поверхностью и пробкой закрепляют полоску лакмусовой бумаги. При положительном результате бумажка синеет.
Слайд 86Образование индола и H2S. Обычно для определения способности к образованию индола и

сероводорода также проводят посев в МПБ, между его поверхностью и пробкой закрепляют бумажки: в первом случае пропитанные раствором щавелевой кислоты (при образовании индола бумажка краснеет), во втором — раствором ацетата свинца (при образовании H2S бумажка чернеет).
Также используют специальные среды, содержащие индикаторы (например, среда Клиглера), либо их вносят непосредственно в среду после регистрации видимого роста бактерий
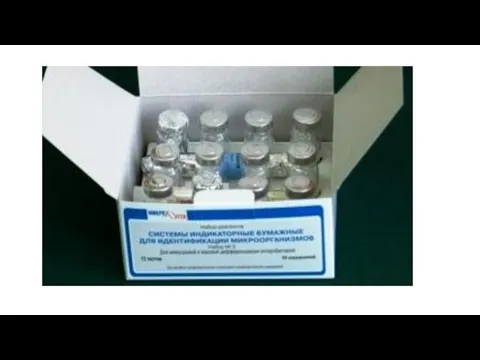
Слайд 88Индикаторные бумажки для идентификации бактерий Для изучений биохимической активности бактерий широко применяют

системы индикаторных бумажек или наборы мультимикротестов.
Система индикаторных бумажек (СИБ) — набор дисков, пропитанных различными субстратами.
Их можно непосредственно вносить в пробирки со взвесью бактерий либо предварительно поместить в лунки пластиковых планшетов, куда будут внесены исследуемые бактерии.
Слайд 91 Наборы мультимикротестов — пластиковые планшеты, в лунки которых помещены различные субстраты

и индикаторы.
В лунки вносят различные разведения бактерий и инкубируют при 37 °С.
На практике используют тесты RapID NH для идентификации нейссерий и гемофиллов, RapID E для энтеробактерий и др., позволяющие получить результаты не позднее 4-8 ч.
Слайд 93Так, на практике применяют наборы Minitek Enterobacteriaceae III и Minitek Neisseria для

дифференциальной диагностики энтеробактерий {четырнадцать субстратов) и нейссерий (четыре субстрата), позволяющие получить результаты через 4 ч инкубации при 37С.











































































 Пингвины
Пингвины Пространственное распределение наземных позвоночных
Пространственное распределение наземных позвоночных Нейронные сети в современном мире
Нейронные сети в современном мире Кокетльові господарочки
Кокетльові господарочки Орган вкуса
Орган вкуса Строение и значение кожи
Строение и значение кожи Рефлексы. Условные рефлексы И. П. Павлова в школе
Рефлексы. Условные рефлексы И. П. Павлова в школе Изучение автоматизированной системы управления воздушным режимом
Изучение автоматизированной системы управления воздушным режимом Сон и его профилактика
Сон и его профилактика Мочевыделительная система. Мужская и женская половая система
Мочевыделительная система. Мужская и женская половая система Уголок природы - осень
Уголок природы - осень Месторасположение эндокринных, экзокринных и смешанных желез
Месторасположение эндокринных, экзокринных и смешанных желез Біосферний заповідник Асканія-Нова
Біосферний заповідник Асканія-Нова Класс Пресмыкающиеся (Рептилии)
Класс Пресмыкающиеся (Рептилии) Сон. Сновидение
Сон. Сновидение БЕЛКИ И НУКЛЕИНОВЫЕ КИСЛОТЫ
БЕЛКИ И НУКЛЕИНОВЫЕ КИСЛОТЫ Презентация на тему "Лимфатическая система" - презентации по Биологии
Презентация на тему "Лимфатическая система" - презентации по Биологии Жу́кова Мари́я 1(Зевакина), 1804 г.- 26 апреля 1855г. Русская писательница
Жу́кова Мари́я 1(Зевакина), 1804 г.- 26 апреля 1855г. Русская писательница Молекулы и болезни
Молекулы и болезни Строение кожи
Строение кожи Царство Грибы. Часть 2
Царство Грибы. Часть 2 Пластический обмен. Фотосинтез. Хемосинтез
Пластический обмен. Фотосинтез. Хемосинтез Гормоны. Классификация гормонов
Гормоны. Классификация гормонов Опорно - двигательная система. Урок № 2.3. Скелет конечностей
Опорно - двигательная система. Урок № 2.3. Скелет конечностей Мутуализм
Мутуализм Умови життя на планеті Земля
Умови життя на планеті Земля Водоросли
Водоросли Пищеварительная система
Пищеварительная система