Содержание
- 2. Электрические свойства клетки Искусственные мембраны представляют собой только липидный бислой и не содержат белков (рис. 1-36
- 3. Рассмотрим теперь реальную мембрану клетки, представленную на рис. 1-36 Б1. Такая мембрана содержит липидный бислой, в
- 4. В части (А) представлены модель искусственной мембраны (А1) и ее эквивалентная электрическая схема (А2), состоящая из
- 5. Сопротивление мембраны клетки Для изучения мембран клеток применяются законы, используемые для описания элементов линейных цепей и
- 6. Величина, обратная сопротивлению (1/Rin), характеризует способность мембраны проводить ток. Это соотношение называется проводимостью (Gin). Уменьшение сопротивления
- 7. Такая величина типична, например, для нервных клеток моллюсков. В зависимости от геометрии клетки и свойств мембраны
- 8. Эта величина также типична для тел нервных клеток моллюсков. У большинства других животных мембраны клеточных тел
- 9. Емкость мембраны Стимулируя клетку небольшими импульсами электрического тока, можно изучить еще одно свойство мембраны. Если даже
- 10. где ∆Vm - изменение мембранного потенциала, производимое током IR. Протекание тока через емкость можно рассчитать следующим
- 11. Рис. 1-37. Сопротивление и емкость мембраны. А - эквивалентная электрическая схема для участка мембраны, включающая только
- 12. Постоянная времени мембраны Постоянная времени мембраны (τm) - это время, необходимое для того, чтобы импульс постоянного
- 13. Постоянная длины мембраны Постоянная длины мембраны (λ) - это расстояние от точки в нейроне, где при
- 14. Рис. 1-38. Определение постоянных времени и длины. А - постоянная времени. На панели А1 изображена схема
- 15. Потенциал покоя и его механизмы Потенциал покоя клетки определяется работой Na+/K+-АТФазы и выходом ионов K+ по
- 16. Потенциалы клетки, возникающие при деполяризации ее мембраны, и принцип искусственного смещения потенциала Помимо потенциала покоя (рис.
- 17. Пассивный электротонический потенциал Пассивный электротонический потенциал можно зарегистрировать с помощью одного внутриклеточного микроэлектрода, если через второй
- 18. Таким образом, для общего тока, текущего в покое через мембрану, получаем: Емкостной компонент мембраны Сm обусловлен
- 19. Рис. 1-41. Пассивный электротонический потенциал
- 20. Механизм пассивного электротонического потенциала Пассивный электротонический потенциал определяется только емкостными и резистивными свойствами мембраны клетки, но
- 21. Рис. 1-42. Влияние различных прямоугольных импульсов электрического тока на форму пассивного электротонического потенциала
- 22. Метод фиксации тока Были предложены три способа использования микроэлектродов, дошедшие до настоящих дней в той или
- 23. Рис. 1-43. Принципы регистрации внутриклеточных потенциалов и внутриклеточной поляризации
- 24. Локальный ответ При увеличении силы раздражителя в виде электрического тока появляются признаки так называемого локального ответа
- 25. Рис. 1-44. Локальный ответ нервного волокна. А - форма пассивного электротонического потенциала и локального ответа. Б
- 26. Потенциал действия Если электровозбудимую клетку или нервное волокно подвергнуть действию электрического раздражителя пороговой величины, то возникает
- 27. Типы биоэлектрической активности нервных клеток Рассмотрим типы биоэлектрической активности на примере нервных клеток (рис. 1-45), поскольку
- 28. Рис. 1-45. Потенциал действия и типы биоэлектрической активности на примере нервных клеток
- 29. Действие электрического тока К числу основных раздражителей клеток принадлежит электрический ток. Введем обозначения: Em используется только
- 30. На рисунке 1-46 А1 показан прямоугольный импульс электрического тока положительной полярности, вызывающий смещение Em до величины
- 31. Рис. 1-46. Влияние внутриклеточной поляризации на биоэлектрическую активность клеток. А - соотношения между исходным уровнем потенциала
- 32. Механизм потенциала действия пороговой величине раздражающего электрического стимула возникает потенциал действия, состоящий из фаз деполяризации и
- 33. Фазовые изменения возбудимости В процессе потенциала действия возбудимость любой клетки меняется, что определяется механизмами, лежащими в
- 34. Рис. 1-48. Фазовые изменения возбудимости (синие кривые) и их связь с потенциалами действия (зеленые кривые) трех
- 35. Методы фиксации потенциала На рисунке 1-49 представлены основные схемы фиксации потенциала у аксона и клеток, применяя
- 36. Рис. 1-49. Принципы фиксации потенциала у аксона и клеток. А - схема регистрации ионного тока у
- 37. Patch-clamp Расцвет исследований мембран клеток наступил с созданием метода patch-clamp. Этот метод позволяет регистрировать на изолированных
- 38. Конфигурация whole-cell позволяет сформировать другую конфигурацию - outside-out patch. Оттягивание пипетки от клетки заставляет мембрану растягиваться
- 39. Сравнение методов На рисунке 1-51 показаны микроэлектрод (рис. 1-51 А1) и patch-пипетка (рис. 1-51 Б1) и
- 40. Рис. 1-51. Сравнение методов регистрации с помощью обычного микроэлектрода (А) и с помощью patch- пипетки (Б)
- 41. Ионные токи Результат применения метода фиксации потенциала представлен на рис. 1-52 А. На мембране поддерживается определенный
- 42. Рис. 1-52. Ионные токи, зарегистрированные методом фиксации потенциала. А - ток, протекающий через мембрану (синяя кривая)
- 43. Регистрация ионных токов методом фиксации потенциала На рисунке 1-53 А представлен принцип регистрации тока при фиксации
- 44. Рис. 1-53. Двухэлектродный метод фиксации потенциала. А - схема опыта. Б - регистрируемые токи на фоне
- 45. Na+- и К+- проводимость Зная величину калиевого и натриевого тока, нетрудно оценить проводимость мембраны для каждого
- 46. Рис. 1-54. Натриевая и калиевая проводимости и теоретическая реконструкция потенциала действия. А - изменения во времени
- 47. Токи при разных ступеньках потенциала Рассмотрим ответ мембраны клетки на ступенчатое смещение мембранного потенциала относительно поддерживаемого
- 48. Рис. 1-55. Фиксация потенциала на гигантском аксоне кальмара. А - смещения мембранного потенциала во времени относительно
- 49. Основные блокаторы Na+- и К+-токов ТТХ и ТЭА Эксперименты с заменой ионов и полученные результаты требовали
- 50. Рис. 1-56. Избирательное блокирование натриевых и калиевых каналов с помощью тетродотоксина и тетраэтиламмония. В первой части
- 51. Nа+-токи Рассмотрим Na+-токи, зарегистрированные методом voltage-clamp. На рисунке 1-57 А продемонстрированы Na+-токи, зарегистрированные у ряда электровозбудимых
- 52. Рис. 1-57. Na+-токи, зарегистрированные в конфигурации whole-cell у электровозбудимых клеток при различных величинахсмещения мембранного потенциалаотносительно поддерживаемогопотенциала.
- 53. Активация и инактивация Na+-токов Корректное описание инактивации входящих токов представляет определенные сложности, поскольку этот процесс развивается
- 54. На рисунке 1-58 показаны принципы исследования активации и инактивации тока. На панели А данного рисунка представлены
- 55. Рис. 1-58. Принципы регистрации и анализа активации и инактивации тока
- 56. Na+-каналы В настоящее время известно 9 типов Na+-каналов. Рисунок 1-59 А демонстрирует одиночные Na+- каналы, зарегистрированные
- 57. Рис. 1-59. Na+-ток через одиночный Na+-канал в мышечной клетке мыши. А - Регистрация методом patch-clamp в
- 58. Параметры Na+-тока Микроскопические механизмы, то есть механизмы на уровне токов, текущих через одиночные каналы, лежащие в
- 59. Рис. 1-60. Параметры Na+-тока, протекающего через целую клетку и через одиночные ионные каналы
- 60. Места связывания токсинов у Na+-канала Большое количество биологических токсинов оказывают свой токсический эффект, модифицируя свойства Na+-каналов.
- 61. Рис. 1-61. Места связывания токсинов с различными доменами и сегментами потенциалуправляемых натриевых каналов, посредством которых реализуется
- 62. Центр связывания 1 у Na+-канала Первые два (рис. 1-62 А) естественно встречающихся токсина, вероятно, лучше всего
- 63. Рис. 1-62. Блокаторы участка связывания 1 тетродотоксин, сакситоксин и μ-конотоксин, блокирующие проводимость ионов. А - химическая
- 64. Центр связывания 2 у Na+-канала Представители группы липидорастворимых соединений могут получить доступ к определенному центру связывания
- 65. Рис. 1-63. Блокаторы участка связывания 2 - батрахотоксин, вератридин, граянотоксин и аконитин, - эффект которых определяется
- 66. Центр связывания 3 у Na+-канала Участок связывания 3 взаимодействует с полипептидами α-токсина скорпиона и токсинов морских
- 67. Рис. 1-64. Участок 3 связывает α-токсины скорпиона и токсины морских анемон, которые замедляют или блокируют инактивацию.
- 68. Центр связывания местных анестетиков у Na+-канала Местные анестетики (рис. 1-65) типа лидокаина и прокаина вызывают эффект,
- 69. Рис. 1-65. Структура местных анестетиков, для которых обнаружен специфический участок связывания Рис. 1-66. Структура пиретроидов и
- 70. Рис. 1-67. Схема связывания токсинов с различными участками потенциал-управляемого Na+-канала
- 71. Са2+-ток и его характеристики На рисунке 1-68 представлен типичный wholecell Ca2+-ток (ICa-L), определяемый наличием CaV1- каналов,
- 72. Принципы исследования активации и инактивации на примере I Ca,T тока показаны на панелях В, Г, Д,
- 73. Рис. 1-68. Типичный whole-cell Са2+-ток (ICa-L), зарегистрированный от изолированного кардиомиоцита желудочков мыши, мембрана которого имеет СаV1-каналы.
- 74. Са2+-каналы L-типа и N-каналы На рисунке 1-69 А1 показана оригинальная регистрация тока, текущего через одиночный канал
- 75. Рис. 1-69. Биофизические свойства CaV1-канала и CaV2.2-канала. А - биофизические свойства CaV1-канала с L-типом Ca2+-тока, зарегистрированного
- 76. Са2+-каналы R-типа и T-типа На рисунке 1-70 А1 в качестве примера показана оригинальная регистрация тока одиночного
- 77. Рис. 1-70. Биофизические свойства Сау2.3-канала и Сау3.2-канала. А - биофизические свойства CaV2.3-канала с R-типом Ca2+-тока, зарегистрированного
- 78. Блокаторы и активаторы Са2+-каналов Фармакология трех семейств кальциевых каналов хорошо изучена. Каналы СаV1 служат молекулярной мишенью
- 79. Рис. 1-71. Фармакологические соединения, мишенью которых служат Са2+-каналы
- 80. Изменение Са2+-токов под действием Са2+ агонистов и антагонистов На рисунке 1-72 продемонстрированы примеры действия фармакологических препаратов
- 81. Рис. 1-72. Примеры действия фармакологических препаратов на типичный whole-cell Са2+-ток (1Са,L), зарегистрированный от изолированного кардиомиоцита желудочков
- 82. Модель Ca2+-поры Модели двухмерной топографической карты поры с использованием предполагаемых «холмов» и «ям» химической потенциальной энергии,
- 83. Рис. 1-73. Модели Са2+-канала, объясняющие его проницаемость и структуру поры. А - теория скоростей реакции описывает
- 84. К+-токи и каналы Калиевые каналы представляют собой наиболее обширное семейство ионных каналов (К+-каналов), генерирующих разнообразные калиевые
- 85. Рис. 1-74. Примеры оригинальной регистрации whole-cell К+-тока, вольтамперной характеристики whole-cell К+-тока и активности одиночного канала
- 86. Характеристики К+-токов Разлагая на компоненты ионные токи можно вычленить входящий Na+-ток и выходящий К+-ток, представив их
- 87. Рис. 1-75. Общая характеристика потенциалуправляемых K+-каналов и K+-токов. Описание в тексте
- 88. К+-каналы задержанного выпрямления Обсудим некоторые данные, характеризующие работу первого типа потенциалуправляемых К+-каналов - К+-каналов задержанного выпрямления
- 89. Рис. 1-76. Потенциалуправляемые К+-каналы (KV), относящиеся к типу К+-каналов задержанного выпрямления (delayed outward rectifier К"-channels -
- 90. Кir-каналы Класс трансмембранных белков с двумя сегментами включает 2S белки, образующие inward rectifiers channels (Kir), которые
- 91. Са2+-активируемые К+-каналы Еще один тип К+-каналов - так называемые Са2+-активируемые К+-каналы. Примером такого канала может служить,
- 92. Рис. 1-78. Са2+-активируемые K+-каналы (KCa)
- 93. Канал утечки - K2P Каналы утечки представляют собой особую группу ионных каналов. Это одни из немногих
- 94. Рис. 1-79. К+-каналы с двумя петлями в домене (two-P K+-channels - К2Р)
- 95. Потенциалы действия и токи, их формирующие Рис. 1-80. Связь одиночного потенциала действия с основными ионными токами
- 96. В - связь потенциала действия клетки рабочего миокарда с ионными токами. В1 - форма потенциала действия
- 97. Механосенситивные потенциалы На рисунке 1-81 А показана непрерывная регистрация биоэлектрической активности изолированного кардиомиоцита левого желудочка мыши
- 98. Рис. 1-81. Индуцированные механическим растяжением клетки потенциалы кардиомиоцитов. А - влияние растяжения изолированного кардиомиоцита левого желудочка
- 99. Механосенситивные токи На рисунке 1-82 А показаны оригинальные кривые, полученные методом patch-clamp в конфигурации whole-cell на
- 101. Скачать презентацию
Слайд 2Электрические свойства клетки
Искусственные мембраны представляют собой только липидный бислой и не содержат
Электрические свойства клетки
Искусственные мембраны представляют собой только липидный бислой и не содержат

Простейший конденсатор представляет собой две обкладки, находящиеся на небольшом расстоянии друг от друга. Когда его подсоединяют к источнику постоянного тока, то одна его обкладка заряжается положительно, а другая - отрицательно. Емкость такого конденсатора зависит от площади обкладок (чем меньше площадь, тем меньше емкость) и от расстояния между ними (чем меньше расстояние, тем больше емкость). Напряжение V на зажимах элемента емкости и ток I, проходящий через элемент, связаны между собой соотношением:
Удельная емкость искусственных липидных мембран Мюллера и Мюллера-Рудина (С) равна около 0,4-1 μF/cm2. (Эта величина близка и для мембран клеток, поскольку и их емкость обусловлена исключительно липидным бислоем.)
Вместе с тем искусственный липидный бислой обладает крайне высоким сопротивлением (R), величина которого лежит в диапазоне 106-109 Ωхcm2 (поскольку жир, по существу, служит изолятором), что на несколько порядков выше сопротивления биологической мембраны
(Rm), величина которой около 103 Ωхcm2. Как было отмечено, столь высокое сопротивление липидного бислоя можно понизить добавлением белков (электрическое сопротивление которых значительно меньше электрического сопротивления липидов) или соединений, образующих ионные каналы.
В электротехнике напряжение V, приложенное к элементу активного сопротивления R, и ток I, проходящий через него, связаны между собой линейным соотношением, которое представляет собой запись закона Ома:
Слайд 3Рассмотрим теперь реальную мембрану клетки, представленную на рис. 1-36 Б1. Такая мембрана
Рассмотрим теперь реальную мембрану клетки, представленную на рис. 1-36 Б1. Такая мембрана

Это и различные рецепторные белки, и белки ионных каналов, через которые ионыдвижутся пассивно, и, наконец, белки, ответственные за активный перенос ионов (например, показанная на рисунке Na+/K+-АТФаза).
Такую мембрану можно представить в виде эквивалентной электрической схемы (рис. 1-36 Б2), включающей емкостной компонент мембраны (Сm) и резистивный компонент (Rm). Емкостной компонент (Сm) реальной мембраны клетки обусловлен исключительно ее липидным бислоем, а резистивный компонент (Rm) белками, встроенными в липидный бислой, и, прежде всего, белками, образующими ионные каналы. Но в эту эквивалентную электрическую схему введена еще и батарея (Em), формирующая разность потенциалов относительно мембраны.
Ее роль выполняет специфический белок мембраны - Na+/K+-АТФаза, создающая разность потенциалов относительно мембраны клетки.
Слайд 4В части (А) представлены модель искусственной мембраны (А1) и ее эквивалентная электрическая
В части (А) представлены модель искусственной мембраны (А1) и ее эквивалентная электрическая
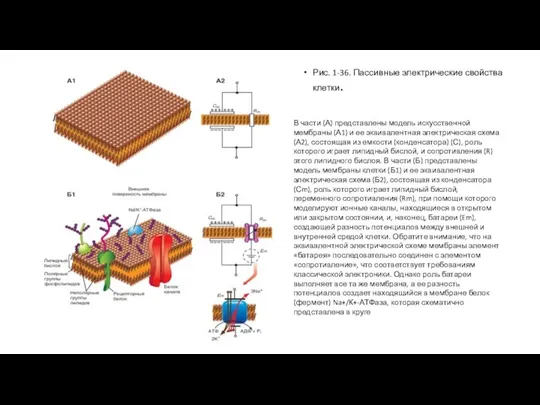
Рис. 1-36. Пассивные электрические свойства клетки.
Слайд 5Сопротивление мембраны клетки
Для изучения мембран клеток применяются законы, используемые для описания элементов
Сопротивление мембраны клетки
Для изучения мембран клеток применяются законы, используемые для описания элементов

Одно из этих пассивных электрических свойств- отношение изменения мембранного потенциала (DVm) к току I, текущему через мембрану (рис. 1-37 А).
Это отношение называется сопротивлением мембраны (R) и измеряется в Омах. Сопротивление характеризует способность мембраны препятствовать протеканию тока. Поскольку ток течет не только через нее, но и через внутреннюю и наружную среды, а геометрия клетки часто неизвестна, суммарное сопротивление, преодолеваемое током, называется входным сопротивлением (Rinput или, сокращенно, - Rin). Закон Ома, описывающий соотношение между током, напряжением и сопротивлением в электрических цепях, полностью применим и к биологическим мембранам:
Слайд 6Величина, обратная сопротивлению (1/Rin), характеризует способность мембраны проводить ток. Это соотношение называется
Величина, обратная сопротивлению (1/Rin), характеризует способность мембраны проводить ток. Это соотношение называется

Рассмотрим идеализированное тело нейрона без аксонов и дендритов (рис. 1-39 Б).
Если с помощью внутриклеточного электрода пропускать ток силой 0,1 нА (1 нА = 10-9 А) наружу, то он равномерно протекает через всю поверхность клеточной мембраны (за счет эквипотенциальности поверхности шара идеализированной клетки). В результате деполяризационный сдвиг потенциала на 10 мВ, зарегистрированный в соседней точке внутри клетки, указывает на то, что в этой точке клетка (мембрана и аксоплазма) имеет сопротивление 100 MОм (1 MОм = 106 Ом):
Слайд 7Такая величина типична, например, для нервных клеток моллюсков. В зависимости от геометрии
Такая величина типична, например, для нервных клеток моллюсков. В зависимости от геометрии

от 105 до 108 Ом; чем меньше клетка, тем выше ее входное сопротивление (при одинаковых свойствах мембраны). Сопротивление мембраны можно изобразить соединенным последовательно с батареей, создающей мембранный потенциал Em.
Поскольку при измерении Rin размеры и форма нейрона не учитываются, этот параметр не подходит для сравнения свойств мембраны у клеток различной величины и формы. Вместо этого применяют стандартизированный параметр - удельное сопротивление мембраны (Rm), соответствующее поперечному сопротивлению 1 см2 мембраны.
Таким образом, удельное сопротивление мембраны определяется двумя факторами:
• сопротивлением мембраны, являющимся мерой проводящих свойств мембраны, т.е. ее проницаемости для ионов;
• общей площадью поверхности мембраны.
Для клетки, имеющей входное сопротивление 100 MОм и радиус 100 мкм (площадь поверхности 1,26х10-3 или приблизительно 10-3 см2), получим:
Слайд 8Эта величина также типична для тел нервных клеток моллюсков. У большинства других
Эта величина также типична для тел нервных клеток моллюсков. У большинства других

Однако в экспериментальной работе площадь поверхности клетки измерить крайне сложно, поэтому в исследованиях для нормирования используют емкость мембраны, так как она пропорциональна площади поверхности клетки.
Для сферической клетки без дендритов с радиусом r и поверхностью 4πr2 величина Rm определяется по формуле:
Кроме сопротивления мембраны Rm (Омхсм2), или иначе удельного сопротивления мембраны, используют следующие параметры:
Сопротивление мембраны на единицу длины волокна rm (Омхсм), равное Rm/πd, где d - диаметр волокна.
Сопротивление цитоплазмы (rin) на единицу длины для тока, текущего вдоль аксона, равное Rin/πr2. Для клетки с Rin, равным 50 Омхсм, и радиусом аксона 50 мкм, rin равно 6,3х105 Ом/см.
Кроме того, используют внеклеточное сопротивление rout (Ом/см) на единицу длины для тока, текущего вдоль аксона.
Слайд 9Емкость мембраны
Стимулируя клетку небольшими импульсами электрического тока, можно изучить еще одно свойство
Емкость мембраны
Стимулируя клетку небольшими импульсами электрического тока, можно изучить еще одно свойство

Мембрана работает как емкость, потому что внутриклеточная и внеклеточная среды представляют собой электролиты, которые являются хорошими проводниками, тогда как имеющая высокое сопротивление мембрана служит хорошим изолятором. Благодаря своим емкостным свойствам клетки могут накапливать (или разделять) заряды. Например, если импульс постоянного электрического тока вызовет изменение мембранного потенциала, то на внутренней и наружной поверхностях мембраны возникнет заряд, пропорциональный DVm. . Входная емкость мембраны (Cin) будет определяться как отношение заряда q (Кл), возникшего на каждой стороне мембраны, к изменению мембранного потенциала:
Емкость клетки прямо пропорциональна площади поверхности мембраны (большая площадь внешнего и внутреннего жидких проводников позволяет мембране удержать больший заряд) и обратно пропорциональна ее толщине (увеличение толщины мембраны уменьшает взаимодействие зарядов, находящихся на каждой из
проводящих поверхностей). Поскольку толщина всех клеточных мембран примерно одинакова (7,5 нм), емкость мембраны (Cm) зависит, главным образом, от площади поверхности и рассчитывается на 1 см2 поверхности мембраны. Мембранный потенциал клетки равен заряду мембраны, деленному на ее емкость (Vm=q/Cm). Емкость измеряется в фарадах: 1 Ф=1 Кл (6,24х1018 электронов) на 1 В.
Если бы мы пропустили прямоугольный импульс электрического тока только через сопротивление мембраны, он вызвал бы прямоугольный скачок напряжения. Но поскольку мембрана работает так же как и емкость, а та удерживает заряды, проходящему через мембрану току требуется некоторое время, чтобы изменить потенциал на мембране. Поскольку емкость и сопротивление мембраны соединены параллельно, напряжение на них будет одно и то же, так что в каждый данный момент емкость мембраны будет нести заряд, пропорциональный мембранному потенциалу. Для того чтобы импульс электрического тока смог полностью изменить мембранный потенциал до нового значения (определяемого силой тока и сопротивлением мембраны), ток сначала должен изменить заряд на емкости мембраны и сдвинуть его до уровня, соответствующего новому мембранному потенциалу. Таким образом, ток, подаваемый в клетку, сначала должен войти в емкость и выйти из нее, изменив ее заряд. По мере того как мембранный потенциал постепенно приближается к своему новому значению, все меньшая доля тока проходит через емкость и все большая доля начинает проходить через сопротивление. Когда емкость зарядится до конца, весь ток будет течь через сопротивление.
Таким образом, когда на мембрану подается импульс электрического тока, он идет по двум путям. Сначала ток протекает по емкости мембраны, изменяя заряд на ней. Этот компонент тока называется емкостным током (IC). По мере заряда емкости снижаются емкостная составляющая тока и основная часть оставшегося тока, та, которая шла через сопротивление. Этот второй компонент называется током сопротивления (IR), или ионным током (в клетках, где электричество переносится только ионами). Эти токи схематически представлены на рис. 1-37 А, В.
Итак, если мы подаем на мембрану ток, то протекание его через Rm описывается законом Ома:
Слайд 10где ∆Vm - изменение мембранного потенциала, производимое током IR.
Протекание тока через емкость
где ∆Vm - изменение мембранного потенциала, производимое током IR.
Протекание тока через емкость

величиной емкости Cm и скоростью изменения напряжения (dVm/dt):
Таким образом, общий ток через мембрану будет равен:
Временной ход IR можно оценить по записи мембранного потенциала, так как ∆Vm=lRm. Поскольку IR+IC=Im, ток через емкость (IC) можно получить, вычитая из Im величину IR.
Слайд 11Рис. 1-37. Сопротивление и емкость мембраны.
А - эквивалентная электрическая схема для участка
Рис. 1-37. Сопротивление и емкость мембраны.
А - эквивалентная электрическая схема для участка

Б - идеализированное тело клетки с эквипотенциальной поверхностью (например, нейрона без аксона и дендритов) при исследовании внутриклеточных потенциалов. Согласно классической схеме в клетку введен один микроэлектрод, регистрирующий ее потенциал, и второй микроэлектрод, соединенный с генератором прямоугольных импульсов электрического тока, используемый для смещения потенциала клетки в сторону деполяризации или гиперполяризации.
В - эквивалентная электрическая схема для участка мембраны.
(1) Если приложен прямоугольный импульс электрического тока Im (красная кривая), создающий небольшой (пассивный электротонический) потенциал ∆vm , то этот ток разлагается на резистивную (синяя кривая) и емкостную (голубая кривая) составляющие. Разностью im и irявляется ic.
(2) Цепь содержит батарею em, создающую потенциал покоя, соединенную последовательно с сопротивлением rm и параллельно с емкостью Cm. Эквивалентная электрическая схема моделирует небольшой участок мембраны. На схеме показано, как часть тока проходит через сопротивление (ir) и называется ионным током; другая часть течет к емкости и от емкости и называется емкостным током (IC)
Слайд 12Постоянная времени мембраны
Постоянная времени мембраны (τm) - это время, необходимое для того,
Постоянная времени мембраны
Постоянная времени мембраны (τm) - это время, необходимое для того,

В фазе подъема (рис. 1-38 А2, А3) изменение потенциала Vm во времени при подаче импульса электрического тока описывается уравнением:
где I - величина ступеньки тока, пропускаемого через мембрану; IRm - конечное значение мембранного потенциала, обусловленного импульсом электрического тока. При t = τ = RmCm имеем:
Постоянную времени мембраны (τ = RmCm) можно измерить непосредственно по записям напряжения (см. рис. 1-38 А2, А3). В приведенном примере для нейрона моллюска с Rm= 100 000 Омхсм2 типичное значение τm будет равно 100 мс. Для различных клеток значения τm варьируются от одной до нескольких сотен миллисекунд. У сферической клетки без аксона и дендритов постоянную времени можно представить как:
Таким образом, измерение τm важно также для оценки Cm. Пусть τm равно 100 мс, a Rm - 100 000 Омхсм2, тогда емкость Cm будет равна 1 мФ/см2:
Слайд 13Постоянная длины мембраны
Постоянная длины мембраны (λ) - это расстояние от точки в
Постоянная длины мембраны
Постоянная длины мембраны (λ) - это расстояние от точки в

Изменения потенциала в различных точках аксона можно измерить с помощью введения регистрирующих электродов (V1, V2, V3, V4) на различных расстояниях вдоль аксона (рис. 1-38 Б1). Пусть аксон имеет большой диаметр, сравнимый с размером клеточного тела. Тогда постоянная длины (в сантиметрах) будет определяться формулой:
где Rm - удельное сопротивление мембраны; rin - удельное сопротивление аксоплазмы; d - диаметр аксона. Мы приводим лишь конечную формулу, поскольку в основе ее вывода лежат те же принципы, что и для постоянной времени.
Постоянная длины мембраны - это расстояние, на которое вдоль аксона электротонически распространяются подпороговые сигналы. Если нейрон имеет сопротивление Rm= 100 000 Омхсм2 и rin= 50 Омхсм2, постоянная длины при диаметре аксона 20 мкм равна 1 см. Но для аксонов малого диаметра d постоянная длины может быть значительно меньше и достигать 0,1 см.
Слайд 14Рис. 1-38. Определение постоянных времени и длины.
А - постоянная времени. На панели
Рис. 1-38. Определение постоянных времени и длины.
А - постоянная времени. На панели
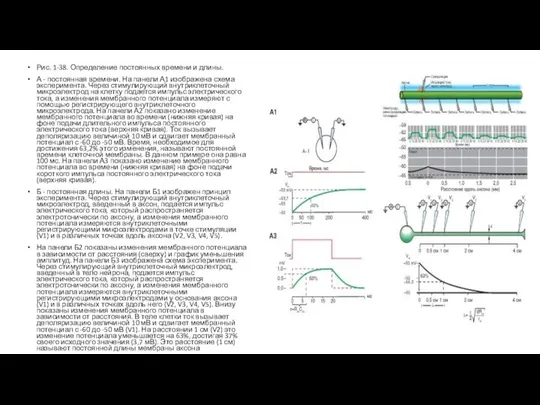
Б - постоянная длины. На панели Б1 изображен принцип эксперимента. Через стимулирующий внутриклеточный микроэлектрод, введенный в аксон, подается импульс электрического тока, который распространяется электротонически по аксону, а изменения мембранного потенциала измеряются внутриклеточными регистрирующими микроэлектродами в точке стимуляции (V1) и в различных точках вдоль аксона (V2, V3, V4, V5).
На панели Б2 показаны изменения мембранного потенциала в зависимости от расстояния (сверху) и график уменьшения амплитуд. На панели Б3 изображена схема эксперимента. Через стимулирующий внутриклеточный микроэлектрод, введенный в тело нейрона, подается импульс электрического тока, который распространяется электротонически по аксону, а изменения мембранного потенциала измеряются внутриклеточными регистрирующими микроэлектродами у основания аксона (V1) и в различных точках вдоль него (V2, V3, V4, V5). Внизу показаны изменения мембранного потенциала в зависимости от расстояния. В теле клетки ток вызывает деполяризацию величиной 10 мВ и сдвигает мембранный потенциал с -60 до -50 мВ (V1). На расстоянии 1 см (V2) это изменение потенциала уменьшается на 63%, достигая 37% своего исходного значения (3,7 мВ). Это расстояние (1 см) называют постоянной длины мембраны аксона
Слайд 15Потенциал покоя и его механизмы
Потенциал покоя клетки определяется работой Na+/K+-АТФазы и выходом
Потенциал покоя и его механизмы
Потенциал покоя клетки определяется работой Na+/K+-АТФазы и выходом

ионов Na+. При этом работа Na+/K+-АТФазы удерживает внутри клетки концентрацию Na+ на низком, а концентрацию K+ на высоком уровнях. Имеющуюся в клетке трансмембранную разность потенциалов можно зарегистрировать.
Если микроэлектрод, подключенный к предварительному усилителю, показанному на рис. 1-39 Б, подключить к измерительной схеме и ввести в физиологичский раствор, где расположены ткань или клетки, при этом замкнуть цепь через индифферентный электрод, то при сбалансированном усилителе и компенсации физико-химических свойств микроэлектрода на экране осциллографа мы будем регистрировать линию (рис. 1-39 В), соответствующую измерительному нулю, равному нулю при закороченных входах усилителя. Теперь если подвести при помощи микроманипулятора микроэлектрод вплотную к мембране клетки и проколоть ее, то на экране осциллографа можно зарегистрировать падение нулевого потенциала и разность потенциалов между внутренней и наружной средами клетки, величина которой для разных клеток лежит в диапазоне от -40 до -80 мВ. Именно эта разность, представленная на рис. 1-39 В, служит потенциалом покоя клетки.
Рис. 1-39. Потенциал покоя клетки и принцип его регистрации.
А - структуры мембраны, формирующие потенциал покоя. На панели А представлена мембрана клетки, канал утечки, Nа+-канал, К+-канал и -АТФаза, которая выкачивает ионы Na+ из клетки против его электрохимического градиента, одновременно вводя ионы K+ в клетку также против его электрохимического градиента. Каналы утечки, через которые осуществляется очень незначительный вход ионов Na+ в клетку и превышающий его в 100 раз выход ионов К+ из клетки. За счет каналов утечки и работы Na+/K+-АТФазы возникает негативный внутриклеточный потенциал мембраны клетки - потенциала покоя. Б - измерительная схема. В - потенциал покоя
Слайд 16Потенциалы клетки, возникающие при деполяризации ее мембраны, и принцип искусственного смещения потенциала
Помимо
Потенциалы клетки, возникающие при деполяризации ее мембраны, и принцип искусственного смещения потенциала
Помимо

Однако, чтобы зарегистрировать эти потенциалы, необходимо искусственное смещение потенциала покоя клетки. Возможность внутриклеточной поляризации мембраны, включающей деполяризацию и гиперполяризацию, крайне необходима для изучения свойств мембраны. Искусственное смещение мембранного потенциала дает возможность не только изучать пассивные электрические характеристики клеток, но и исследовать межклеточные взаимодействия, осуществляемые непосредственно через высокопроницаемые контакты мембран клеток. Однако возможность внутриклеточной поляризации мембран должна непременно сочетаться с возможностью одновременной регистрации биоэлектрической активности клеток и тех изменений этой активности, которые возникают вследствие приложения электрического тока.
В наиболее примитивном виде принцип внутриклеточной поляризации мембран при возможности одновременной регистрации биоэлектрической активности клеток представлен на рис. 1-40 Д. В этом случае в клетку одновременно вводят два микроэлектрода, один из которых поляризующий, а другой - регистрирующий. На экране двухлучевого осциллографа можно видеть весь процесс: на первом канале регистрируется величина поляризующего сигнала, а на втором канале - мембранный потенциал и его искусственное смещение, вызванное поляризацией мембраны. Следует помнить, что прямое подключение поляризующего микроэлектрода к генератору невозможно, для этого существуют специальные схемы.
Рис. 1-40. Изменение мембранного потенциала в зависимости от силы раздражения.
А - потенциал покоя. Б - пассивный электротонический потенциал. В - локальный ответ. Г - потенциал действия. Д - выход
Слайд 17Пассивный электротонический потенциал
Пассивный электротонический потенциал можно зарегистрировать с помощью одного внутриклеточного микроэлектрода,
Пассивный электротонический потенциал
Пассивный электротонический потенциал можно зарегистрировать с помощью одного внутриклеточного микроэлектрода,

Пассивный электротонический потенциал возникает в ответ на подпороговый импульс электрического тока, который не приводит к открытию потенциалуправляемых ионных каналов и определяется только емкостными и резистивными свойствами мембраны клетки. Емкостной компонент мембраны обусловлен исключительно липидным бислоем, а резистивный компонент - белками, образующими ионные каналы и встроенными в липидный бислой.
Липидный бислой можно уподобить конденсатору, две обкладки которого находятся на небольшом расстоянии друг от друга, и при подаче тока одна обкладка заряжается положительно, а другая - отрицательно. Ионные каналы липидного бислоя или в этом случае мембраны клетки обладают проводимостью, и, следовательно, мембрана характеризуется электрическим сопротивлением.
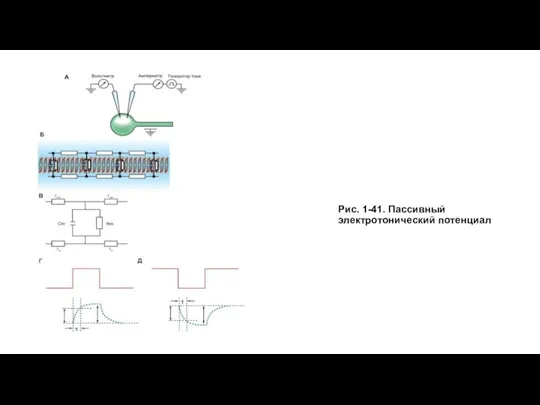
На рисунке 1-41 Б изображена эквивалентная электрическая схема мембраны клетки, а на рис. 1-41 В показана эквивалентная электрическая схема фрагмента мембраны. На подаваемый ток и изменения сопротивления и напряжения эта схема реагирует точно так же, как и сама мембрана.
Данная схема включает емкостной компонент мембраны (Сm) и резистивный компонент (Rm), а также учитывает сопротивления внешней среды rout и сопротивление цитозоля rin. Поскольку значения rout и rin малы, ими можно пренебречь, хотя это достаточно грубая аппроксимация. Кроме того, rout много меньше rin
Если на мембрану через один микроэлектрод подать подпороговый прямоугольный импульс электрического тока положительной полярности (рис. 1-41 Г - импульс красного цвета), то усилитель, подключенный ко второму микроэлектроду, зарегистрирует изменения мембранного потенциала, форма которого отличается от прямоугольника (зеленая кривая). Это и есть пассивный электротонический потенциал.
Если мы подаем на мембрану ток, то его протекание через Rm описывается законом Ома:
где Vm - потенциал на Rm.
Протекание тока через емкость можно рассчитать следующим образом:
Слайд 18Таким образом, для общего тока, текущего в покое через мембрану, получаем:
Емкостной компонент
Таким образом, для общего тока, текущего в покое через мембрану, получаем:
Емкостной компонент

где Rm Сm =τm , что называется постоянной времени (временем релаксации мембраны). Постоянная времени мембраны τ - одна из важнейших характеристик пассивного электротонического потенциала, которая отражает пассивные свойства мембраны. Последнее уравнение крайне важно, поскольку величины τm и Rm можно, в отличие от Cm, зарегистрировать экспериментально и, следовательно, таким образом рассчитать Cm. С помощью постоянной времени и Rm можно полностью описать пассивные свойства эквивалентной схемы (или мембраны).
Постоянная времени характеризует временной ход изменений мембранного потенциала, т.е. скорость, с которой он меняется при переходе от одного значения к другому. Постоянная времени мембраны - это время, необходимое для того, чтобы импульс постоянного тока зарядил емкость мембраны на 63% (см. рис. 1-41 Г).
Сходная картина возникает, если на мембрану через один микроэлектрод подать аналогичный по силе прямоугольный импульс электрического тока отрицательной полярности (рис. 1-41 Д - импульс красного цвета). В этом случае пассивный электротонический потенциал будет направлен в отрицательную область (зеленая кривая).
Слайд 19Рис. 1-41. Пассивный электротонический потенциал
Рис. 1-41. Пассивный электротонический потенциал
Слайд 20Механизм пассивного электротонического потенциала
Пассивный электротонический потенциал определяется только емкостными и резистивными свойствами
Механизм пассивного электротонического потенциала
Пассивный электротонический потенциал определяется только емкостными и резистивными свойствами

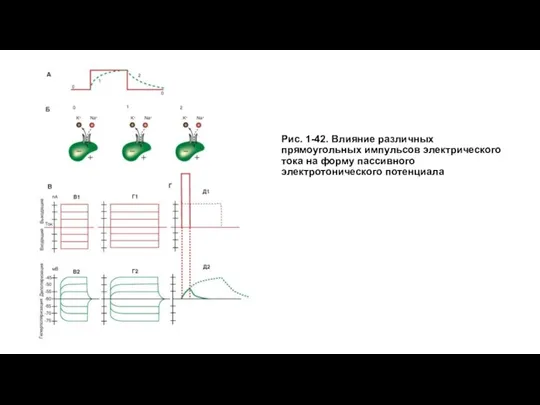
На рисунке 1-42 А показан пассивный электротонический потенциал, в котором мы искусственно выделяем отдельные фазы (0 - потенциал покоя, 1 - фаза нарастания, 2 - фаза падения), а также клетка в каждую из этих фаз. Из рисунка следует, что на фоне потенциала покоя, т.е. в фазу 0, открыты только каналы утечки, через которые ионы К+ выходят из клетки, а ионы Na+ в незначительном количестве входят в клетку. Это соотношение обычно принято как К+: Na+=100:1. При этом потенциалуправляемые Na+- каналы, обеспечивающие входящий ток, и потенциалуправляемые К+-каналы, обеспечивающие выходящий ток, закрыты (находятся в состоянии покоя). В фазу 1 и фазу 2 также открыты только каналы утечки, через которые ионы К+ выходят из клетки, а ионы Na+ в незначительном количестве входят в клетку. Соотношение K+:Na+=100:1 не меняется. При этом потенциалуправляемые Na+-каналы, обеспечивающие входящий ток, и потенциалуправляемые К+-каналы, обеспечивающие выходящий ток, также закрыты (находятся в состоянии покоя). При нарастании потенциала (фаза 1), как и при его падении (фаза 2) до уровня
потенциала покоя, не происходит никаких изменений ионных токов, поскольку, как отмечалось, пассивный электротонический потенциал определяется только емкостными и резистивными свойствами мембраны.
Характерная особенность пассивного электротонического потенциала состоит в равенстве скоростей нарастания и спада экспоненты.
Для различных клеток значения τm варьируют от одной до нескольких сотен миллисекунд, однако для одной и той же клетки эта величина равна вне зависимости от длительности и направления поляризующего импульса электрического тока. Это еще одна особенность пассивного электротонического потенциала.
Наконец, если дискретно увеличивать амплитуду поляризующего импульса электрического тока, оставаясь тем не менее в подпороговом диапазоне его силы (рис. 1-42 В1), то амплитуда каждого пассивного электротонического потенциала будет равна амплитуде импульса тока, его вызывающего. В этом проявляется строго линейная зависимость между амплитудами электрического стимула и пассивного электротонического потенциала (рис. 1-42 В2). Значительное увеличение длительности поляризующего импульса не меняет этой закономерности (рис. 1-42 Г1, Г2). Ранее мы обсуждали, что как только емкость зарядится до потенциала, равного подаваемому на нее, емкостной ток прекратится. Таким образом, она не препятствует изменениям потенциала, а только замедляет его нарастание и падение.
Наклеткуможноподатьпрямоугольныйимпульс электрического тока сверхпороговой амплитуды, т.е. величиной в несколько вольт или даже в несколько десятков вольт, без ущерба для данной клетки, если длительность этого импульса будет меньше значения τm для данной клетки. В этом случае емкость мембраны не успевает полностью зарядиться и, следовательно, клетка не набирает столь большой потенциал (рис. 1-42 Д1, Д2).
Наконец, последняя особенность пассивного электротонического потенциала заключается в том, что в волокне, например аксоне, он распространяется с затуханием, характеризующим постоянную длину мембраны λ, т.е. расстояние вдоль аксона, на котором напряжение, приложенное в одной точке нейрона, потеряет 63% (1-1/e) своей первоначальной величины.
Слайд 21Рис. 1-42. Влияние различных прямоугольных импульсов электрического тока на форму пассивного электротонического
Рис. 1-42. Влияние различных прямоугольных импульсов электрического тока на форму пассивного электротонического
Слайд 22Метод фиксации тока
Были предложены три способа использования микроэлектродов, дошедшие до настоящих дней
Метод фиксации тока
Были предложены три способа использования микроэлектродов, дошедшие до настоящих дней

Стеклянная микропипетка становится микроэлектродом после заполнения ее сквозного продольного канала электролитом и образования контакта электролита с электронно-измерительной схемой. Контакт электролита и микроэлектрода может быть двух типов и зависит от того, какой биологический объект изучается. Первый тип - так называемая жесткая фиксация микроэлектрода - применяется для внутриклеточных исследований неподвижных тканей или клеток, например клеток нервной системы.
Второй тип - так называемый плавающий микроэлектрод - применяется для внутриклеточных исследований сокращающейся ткани, например, миокарда.
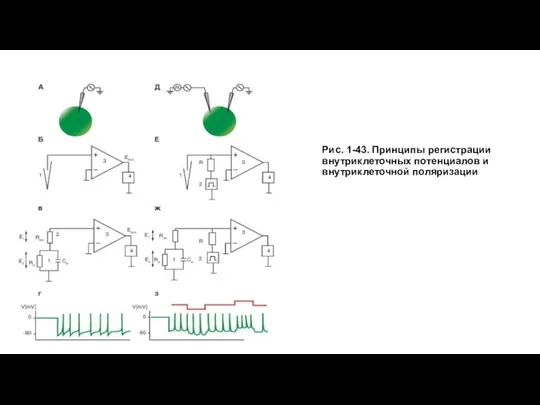
Для регистрации внутриклеточного потенциала мембраны применяют крайне простую измерительную аппаратуру, представляющую собой усилитель на основе микросхемы, имеющей высокое входное сопротивление, на несколько порядков превышающее сопротивление мембраны клетки, включенный в режиме повторителя, и микроэлектрод (рис. 1-43 А, Б). В этом случае мы будем иметь дело со следующей эквивалентной измерительной схемой (рис. 1-43 В), а регистрируемый внутриклеточный сигнал будет иметь вид, показанный на рис. 1-43 Г.
Если же нам надо внутриклеточно поляризовать клетку, то в наиболее примитивном виде принцип внутриклеточной поляризаций мембран при возможности одновременной регистраций биоэлектрической активности клеток представлен на рис. 1-43 Д. В этом случае в клетку вводят одновременно два микроэлектрода, один из которых поляризующий, а другой - регистрирующий. На экране двухлучевого осциллографа можно будет видеть процесс (рис. 1-43 З), когда на верхнем первом канале регистрируется величина поляризующего сигнала, а на нижнем втором канале - мембранный потенциал и его искусственное смещение, вызванное поляризацией мембраны. Следует помнить, что прямое подключение поляризующего микроэлектрода к генератору, как это условно показано на рисунке, невозможно. Для этого существуют специальные схемы.
Вместе с тем даже при технически грамотном подходе использование двух микроэлектродов для введения в одну клетку - задача весьма сложная, даже если работа выполняется на гигантских нейронах беспозвоночных. Если же необходимо изучать межклеточное, например электротоническое, взаимодействие двух нейронов, то в препарат необходимо ввести четыре микроэлектрода (по два в каждую клетку), что практически невыполнимо. В то же время при изучении мелких клеток ввести два микроэлектрода в одну клетку просто невозможно. В этом случае необходимо, чтобы один микроэлектрод выполнял роль и регистрирующего, и поляризующего. Для этой цели была разработана схема, получившая название схемы фиксации тока в цепи измерений или current clamp схемы.
Метод current clamp представляет наибольший интерес, поэтому мы остановимся на нем подробно. Такая схема представлена на рис. 1-43 Е. Сопротивление R должно быть достаточно высоко и в 20-50 раз превышать входное сопротивление клетки. Сопротивление Rдолжно быть также достаточно высоким, чтобы при подаче импульса стимуляции ток не зависел от сопротивления микроэлектрода. Для этого оно должно в 20-50 раз превышать сопротивление микроэлектрода. Обычно требуемая величина R лежит в диапазоне от 109 до 1010 Ом. Эти резисторы достаточно редки. Кроме того, они требуют специального обращения, так как любое повреждение центрального цветного кольца, пыль или отпечатки пальцев на поверхности и прочее существенно уменьшают их величину. Что же достигается этим принципом? Поскольку сопротивление R значительно превышает входное сопротивление клетки и сопротивления микроэлектрода, ток в цепи измерений будет определяться максимальным сопротивлением - сопротивление R - и не будет зависеть от изменений сопротивлений клетки и микроэлектрода, т.е. ток в цепи измерений будет равен const, и мы можем, внутриклеточно поляризуя клетку, измерять ее мембранный потенциал.
В этом случае мы будем иметь дело со следующей эквивалентной измерительной схемой (рис. 1-43 Ж), а регистрируемый внутриклеточный сигнал будет иметь вид, показанный на рис. 1-43 З.
Слайд 23Рис. 1-43. Принципы регистрации внутриклеточных потенциалов и внутриклеточной поляризации
Рис. 1-43. Принципы регистрации внутриклеточных потенциалов и внутриклеточной поляризации
Слайд 24Локальный ответ
При увеличении силы раздражителя в виде электрического тока появляются признаки так
Локальный ответ
При увеличении силы раздражителя в виде электрического тока появляются признаки так

Если дискретно увеличивать амплитуду поляризующего импульса электрического тока, оставаясь, однако, в подпороговом диапазоне, то амплитуда каждого пассивного электротонического потенциала будет пропорциональна амплитуде импульса тока, его вызывающего. В этом проявляется строго линейная зависимость между амплитудами электрического стимула и пассивного электротонического потенциала (рис. 1-44 Б, кривые 1 и 2). Однако при более сильной деполяризации появляются первые признаки локального ответа, заключающиеся в изменении формы пассивного электротонического потенциала и появлении самостоятельно развивающегося пика относительно небольшой амплитуды, по форме напоминающего S-образ- ную кривую. Первые признаки локального ответа возникают при действии стимулов, составляющих приблизительно 75% пороговой величины (рис. 1-44 Б, кривые 3-5). По мере дальнейшего усиления раздражающего тока амплитуда локального ответа увеличивается и может не только достигать критического потенциала, но и превышать его.
Таким образом, как было отмечено, можно условно говорить, что сам локальный ответ включает две фазы: фазу пассивного электротонического потенциала, при которой не происходит изменений потенциалуправляемых ионных токов через мембрану, и стадию собственно локального ответа. В последнем случае в механизме деполяризации мембраны существенную роль играют также изменения ионного транспорта, которые и приводят к самостоятельному изменению потенциала, проявляющегося в форме локального ответа. Сам локальный ответ обусловлен повышением Na+-проницаемости мембраны через потенциалуправляемые Na+-каналы, обеспечивающие входящий ток, вызывающий фазу деполяризации. Однако при подпороговом стимуле такое повышение проницаемости недостаточно велико для того, чтобы вызвать процесс регенеративной деполяризации мембраны, поскольку открывается лишь небольшая часть потенциалуправляемых Na+-каналов. Именно поэтому начавшаяся деполяризация не развивается в потенциал действия, а уравновешивается увеличением К+-проводимости вследствие открытия опять-таки небольшого, но достаточного количества потенциалуправляемых К+-каналов. Далее за счет превалирующего выхода из клетки ионов К+ потенциал возвращается на уровень потенциала покоя.
Поскольку локальный ответ обусловлен открытием потенциалуправляемых Na+- и К+-каналов, то можно сказать, что он сходен с потенциалом действия. Однако эти две формы ответа имеют существенные различия. В отличие от потенциала действия локальный ответ не имеет четкого порога возникновения; он не подчиняется закону «все или ничего» - с увеличением силы раздражителя амплитуда локального ответа растет. Любое, даже незначительное, изменение потенциала клетки изменяет количество открытых Na+- и К+-каналов. Появление же характерного S-образного ответа означает только, что величина локального ответа превышает величину пассивного электротонического потенциала. При этом не следует забывать, что кинетика открывания быстрых потенциалуправляемых Na+-каналов и медленных К+-каналов различна. Именно поэтому при достижении определенного уровня деполяризации (порог генерации потенциала действия) и соответственно количества открытых Na+-каналов, ток через К+-каналы не «успевает» уравновесить Na+-ток, что приводит к дальнейшей деполяризации и открыванию большего количества Na+-каналов, т.е. возникает потенциал действия.
В естественных условиях организма локальный ответ представляет собой электрофизиологическое выражение местного возбуждения.
Слайд 25Рис. 1-44. Локальный ответ нервного волокна.
А - форма пассивного электротонического потенциала и
Рис. 1-44. Локальный ответ нервного волокна.
А - форма пассивного электротонического потенциала и

Кривые 1 и 2 представляют собой пассивный электротонический потенциал, вызываемый увеличивающимися по амплитуде деполяризующими импульсами электрического тока.
На кривых 3, 4 и 5 к пассивному электротоническому потенциалу присоединяется деполяризация в форме локального ответа.
При пороговой силе тока локальный ответ перерастает в потенциал действия б.
Ступеньки деполяризующих импульсов электрического тока отмечены красным цветом.
В - механизм возникновения локального ответа
Слайд 26Потенциал действия
Если электровозбудимую клетку или нервное волокно подвергнуть действию электрического раздражителя пороговой
Потенциал действия
Если электровозбудимую клетку или нервное волокно подвергнуть действию электрического раздражителя пороговой

На рисунке 1-45 А продемонстрирован потенциал действия и его фазы. Он начинается в результате смещения потенциала покоя (например, от -90 мВ) прямоугольным импульсом электрического тока до уровня критического потенциала (разного для разных типов клеток). После чего в результате изменения ионных токов меняется и сам потенциал клетки, быстро нарастая в положительную область и доходя до 0 мВ. Обычно эту фазу называют фазой деполяризации. Потенциал действия продолжает возрастать, пересекая 0 мВ и достигая значений, лежащих около +35 мВ (точнее, разных значений для разных типов клеток). По достижении пика величина потенциала падает в отрицательную область, вновь достигая 0 мВ. Превышение потенциала действия над нулевой линией называется овершутом. Далее потенциал действия пересекает 0 мВ и достигает значений потенциала покоя. Эту фазу обычно называют фазой реполяризации.
В процессе реполяризации потенциал действия может возвращаться на уровень потенциала покоя по двум разным ионным механизмам (рис. 1-45 Б). Первый механизм приводит к тому, что от уровня критического потенциала реполяризация медленно и плавно переходит в потенциал покоя. Это следовая деполяризация (фиолетовая кривая). При втором механизме реполяризация достигает величины потенциала покоя и продолжается дальше в более отрицательную область, после чего возвращается к уровню потенциала покоя. Это следовая гиперполяризация (красная кривая).
Слайд 27Типы биоэлектрической активности нервных клеток
Рассмотрим типы биоэлектрической активности на примере нервных клеток
Типы биоэлектрической активности нервных клеток
Рассмотрим типы биоэлектрической активности на примере нервных клеток

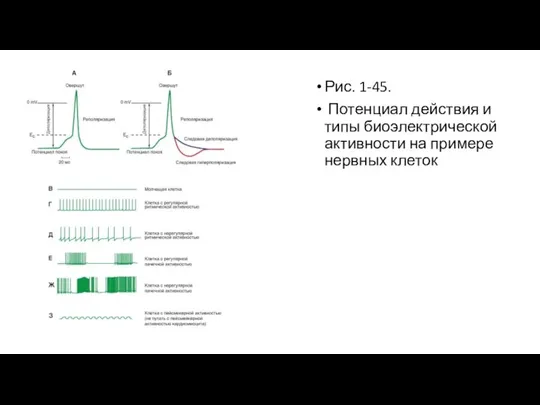
тканей изложены в соответствующих разделах. Часто потенциал действия возникает на фоне потенциала покоя под влиянием искусственной внутриклеточной деполяризации. Такой потенциал действия возникает у клеток с неменяющимся потенциалом покоя и, следовательно, такие клетки самостоятельно не генерируют потенциалы действия. Их называют «молчащими» (рис. 1-45 В). Это первый тип биоэлектрической активности нейронов.
Ко второму типу биоэлектрической активности клеток относятся нейроны, способные самостоятельно генерировать потенциалы действия. Механизмы этой генерации мы рассмотрим далее, а сейчас обратимся исключительно к феноменологической стороне вопроса. К этому типу относят клетки, генерирующие регулярную ритмическую активность (рис. 1-45 Г), нерегулярную ритмическую активность (рис. 1-45 Д), и регулярную пачечную (несколько потенциалов действия - «пачка», после чего наблюдается короткий период покоя) активность. При этом количество потенциалов действия в пачке и межпачечные интервалы одинаковые (рис. 1-45 Е). Наконец, это клетки, генерирующие нерегулярную пачечную активность. При этом количество потенциалов действия в пачке, частота их возникновения и межпачечные интервалы разные (рис. 1-45 Д).
К третьему типу биоэлектрической активности клеток относятся нейроны, способные самостоятельно генерировать флуктуации потенциала покоя, не достигающие критического потенциала (рис. 1-45 Ж). Обычно эти флуктуации бывают синусоидальной или пилообразной формы. Только редкие осцилляции могут достигнуть порога и вызвать генерацию одиночных потенциалов действия. Этот тип потенциалов называется пейсмекерным. К сожалению, как в отечественной, так и в зарубежной литературе этот термин несет две смысловые нагрузки. Во-первых, пейсмекерными называют клетки, генерирующие истинный пейсмекерный потенциал, показанный на рис. 1-45 З. Во-вторых, так называют клетки, способные к самостоятельной генерации потенциалов действия. В таком смысле этот термин особенно прижился в терминологии по электрофизиологии сердца, с чем читателю придется столкнуться далее.
Слайд 28Рис. 1-45.
Потенциал действия и типы биоэлектрической активности на примере нервных клеток
Рис. 1-45.
Потенциал действия и типы биоэлектрической активности на примере нервных клеток
Слайд 29Действие электрического тока
К числу основных раздражителей клеток принадлежит электрический ток.
Введем обозначения: Em
Действие электрического тока
К числу основных раздражителей клеток принадлежит электрический ток.
Введем обозначения: Em

Если на мембрану клетки воздействовать импульсами электрического тока либо положительной, либо отрицательной полярности, то это воздействие вызовет смещение Em соответственно либо в положительную область (деполяризация мембраны), либо в отрицательную область (гиперполяризация мембраны). На рисунке 1-46 А показано влияние прямоугольных импульсов электрического тока различной силы и полярности на Em. Условие возникновения потенциала действия - критический потенциал Ес. Электрическое раздражение вызывает быстрое смещение мембранного потенциала до уровня Ес, при котором происходит активация потенциалуправляемых Na+-каналов, что и приводит к возбуждению мембраны в виде потенциала действия.
Величины Em, Ес и ∆Vm можно связать следующим выражением:
Слайд 30На рисунке 1-46 А1 показан прямоугольный импульс электрического тока положительной полярности, вызывающий
На рисунке 1-46 А1 показан прямоугольный импульс электрического тока положительной полярности, вызывающий

Далее показан (рис. 1-46 А2) прямоугольный импульс электрического тока положительной полярности, причем первая ступень, смещаяEm в более положительную область, не вызывает смещение мембранного потенциала до величины Ec, поэтому на фоне первой ступени потенциал действия не возникает. Но в таком случае величина порогового потенциала будет меньше, чем ∆Vm, 1 и равна ∆Vm,2. Вторая ступень вызывает смещение мембранного потенциала до величины Ec, что и приводит к возникновению потенциала действия.
На рисунке 1-46 А3 также показан прямоугольный импульс электрического тока, но его первая ступень имеет отрицательную полярность, а вторая ступень - положительную полярность. Первая ступень смещает Em в отрицательную область. На фоне этой первой ступени потенциал действия не возникает, и тогда величина порогового потенциала будет больше, чем ∆Vm, 1, и равна ∆Vm,3. Вторая ступень вызывает смещение мембранного потенциала до величины Ec, что и приводит к возникновению потенциала действия.
Большинство нервных клеток отвечает на деполяризацию ритмическими разрядами потенциалов действия, и наоборот, аппликация постоянного гиперполяризующего электрического тока ингибирует возникновение потенциалов действия.
Рассмотрим сначала влияние деполяризующего тока, продемонстрированное на рис. 1-46 Б1. Как было показано выше, клетка отвечает генерацией потенциала действия на пороговый импульс раздражающего тока. Почему же на длительный деполяризующий импульс электрического тока возникает только один потенциал действия (см. рис. 1-46 Б1)? Дело в том, что порог для возникновения повторного ответа выше, чем для генерации одиночного потенциала действия. Основа механизма этого процесса в том, что после окончания первого потенциала действия сопротивление мембраны обычно снижено за счет высокой проводимости для ионов К+, поэтому раздражающий ток из порогового превращается в подпороговый. Кроме того, продолжающаяся деполяризация препятствует полному устранению инактивации Na+-каналов. Если эти изменения небольшие, они могут быть скомпенсированы увеличением силы тока раздражающего импульса (рис. 1-46 Б2), что приведет к появлению нескольких потенциалов действия. Еще большее повышение силы тока приведет к генерации ритмической активности (рис. 1-46 Б3). Дальнейшее дискретное увеличение силы деполяризующего тока до определенного предела приведет к учащению ритмического разряда и увеличению числа импульсов в нем (не показано). Однако при дальнейшем увеличении силы деполяризующего тока разряд потенциалов действия укорачивается и уменьшается по амплитуде (рис. 1-46 Б4 и 5) вплоть до полного прекращения генерации потенциалов действия (рис. 1-46 Б6). Причиной этого является инактивация Na+-каналов.
Влияние длительного гипероляризующего тока, продемонстрированное на рис. 1-46 В обычно рассматривают применительно к нейронам, обладающим спонтанной активностью. Увеличение гиперполяризации клетки (рис. 1-46 В1-3) приводит к уменьшению частоты спайковой активности и увеличению амплитуды потенциалов действия за счет удаления от величины критического потенциала вплоть до полного прекращения генерации этих потенциалов (рис. 1-46 В4).
Слайд 31Рис. 1-46. Влияние внутриклеточной поляризации на биоэлектрическую активность клеток.
А - соотношения между
Рис. 1-46. Влияние внутриклеточной поляризации на биоэлектрическую активность клеток.
А - соотношения между

при деполяризации (А2) и при гиперполяризации (A3).
Б - влияние искусственной долго длящейся деполяризации различной силы на биоэлектрическую активность нервной клетки.
В - влияние искусственной долго длящейся гиперполяризации различной силы
Слайд 32Механизм потенциала действия
пороговой величине раздражающего электрического стимула возникает потенциал действия, состоящий
Механизм потенциала действия пороговой величине раздражающего электрического стимула возникает потенциал действия, состоящий
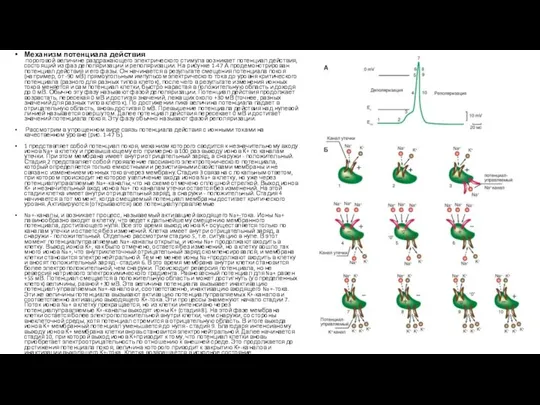
Рассмотрим в упрощенном виде связь потенциала действия с ионными токами на качественном уровне (рис. 1-47 Б).
1 представляет собой потенциал покоя, механизм которого сводится к незначительному входу ионов Na+ в клетку и превышающему его примерно в 100 раз выходу ионов К+ по каналам утечки. При этом мембрана имеет внутри отрицательный заряд, а снаружи - положительный. Стадия 2 представляет собой проявление пассивного электротонического потенциала, который определяется только емкостными и резистивными свойствами мембраны и не связан с изменением ионных токов через мембрану.Стадия 3 связана с локальным ответом, при котором происходит некоторое увеличение входа ионов Na+ в клетку, но уже через потенциалуправляемые Na+-каналы, что на схеме отмечено сплошной стрелкой. Выход ионов К+ и незначительный вход ионов Na+ по каналам утечки остается без изменений. На этой стадии клетка имеет внутри отрицательный заряд, а снаружи - положительный. Стадия 4 начинается в тот момент, когда смещаемый потенциал мембраны достигает критического уровня. Активируются (открываются) все потенциалуправляемые
Na+-каналы, и возникает процесс, называемый активацией входящего Na+-тока. Ионы Na+ лавинообразно входят в клетку, что ведет к дальнейшему смещению мембранного потенциала, достигающего нуля. Все это время выход ионов К+ осуществляется только по каналам утечки и остается без изменений. Клетка имеет внутри отрицательный заряд, а снаружи - положительный. Отдельно рассмотрим стадию 5, т.е. ситуацию в нуле. В этот момент потенциалуправляемые Na+-каналы открыты, и ионы Na+ продолжают входить в клетку. Выход ионов К+, как было отмечено, остается без изменений, но в клетку вошло так много ионов Na+, что внутриклеточный отрицательный заряд скомпенсировался, и мембрана клетки становится электронейтральной. Тем не менее ионы Na+продолжают входить в клетку и вносят положительный заряд - стадия 6. В это время мембрана внутри клетки становится более электроположительной, чем снаружи. Происходит реверсия потенциала, но не реверсия натриевого электрохимического градиента. Равновесный потенциал для Na+ равен +55 мВ. Потенциал смещается в положительную область и может достигнуть (у определенных клеток) величины, равной +30 мВ. Эта величина потенциала вызывает инактивацию потенциал-управляемых Na+-каналов и, соответственно, инактивацию входящего Na+-тока. Эти же величины потенциала вызывают активацию потенциалуправляемых К+-каналов и соответственно активацию выходящего К+-тока. Эти процессы знаменуют начало стадии 7. Поток ионов Na+ в клетку прекращается, но из клетки интенсивно через потенциалуправляемые К+-каналы выходят ионы К+ (стадия 8). На этой фазе мембрана клетки остается более электроположительной внутри клетки, чем снаружи, со стороны внеклеточной среды, хотя потенциал стремится в отрицательную область. В итоге выхода ионов К+ мембранный потенциал уменьшается до нуля - стадия 9. Благодаря интенсивному выходу ионов К+ мембрана клетки вновь становится электронейтральной. Далее начинается стадия 10, при которой выход ионов К+приводит к тому, что потенциал клетки вновь приобретает электроотрицательность по отношению к внешней среде. Это продолжается до достижения потенциала покоя, величина которого приводит к закрытию К+-каналов и инактивации выходящего К+-тока. Клетка возвращается в исходное состояние.
Рис. 1-47. Потенциал действия нервной клетки, его главные фазы и механизм. Ес - критический потенциал
Слайд 33Фазовые изменения возбудимости
В процессе потенциала действия возбудимость любой клетки меняется, что определяется
Фазовые изменения возбудимости
В процессе потенциала действия возбудимость любой клетки меняется, что определяется

На рисунке 1-48 А в верхней части представлен потенциал, подобный потенциалу действия, а в нижней части синхронно показаны фазовые изменения возбудимости. Чтобы понять, как меняется возбудимость в разные фазы потенциала действия, удобно использовать тестовый импульс электрического тока прямоугольной формы и амплитудой, лежащей в диапазоне от величины потенциала покоя до критического потенциала. Если такой импульс подать на клетку на фоне потенциала покоя, ответом будет полноценный потенциал действия. Следовательно, на уровне потенциала покоя мембрана клетки имеет нормальную возбудимость (принятую условно за 100%). Далее, чтобы возбудить клетку на уровне фазы пассивного электротонического потенциала, необходим прямоугольный импульс меньшей амплитуды, а на уровне фазы локального ответа - еще меньшей амплитуды. Следовательно, синхронно с этими двумя фазами потенциала действия возбудимость станет увеличиваться. Затем начинается фаза деполяризации потенциала действия, в основе которой лежит открытие всех потенциалуправляемых Na+-каналов. В этот период, именно из-за активации всех потенциалуправляемых Na+-каналов, клетку невозможно вторично возбудить. То есть возбудимость сразу же падает до 0%, и начинается поддерживаемая фаза абсолютной рефрактерности. Эта фаза длится до того момента, пока фаза реполяризации потенциала действия не пересечет нулевую линию.
Чем ближе реполяризация потенциала действия подходит к уровню потенциала покоя, тем проще вторично вызвать процесс возбуждения мембраны клетки. Все это время мембрана клетка находится в фазе относительной рефрактерности. Наконец, реполяризация пересекает потенциал покоя. Если в этой точке подать тестовый импульс, ответом будет полноценный потенциал действия. Следовательно, при возврате к уровню потенциала покоя возбудимость станет вновь нормальной и равной 100%.
Далее для вызова процесса возбуждения на фоне нарастающей следовой гиперполяризации необходимы все большие и большие по амплитуде электрические импульсы. Следовательно, при нарастании следовой гиперполяризации возбудимость будет уменьшаться. При возврате следовой гиперполяризации к уровню потенциала покоя амплитуда импульсов, необходимых для возбуждения мембраны клетки, будет уменьшаться, пока не достигнет исходной в точке пересечения следовой гиперполяризации с уровнем потенциала покоя. Следовательно, возбудимость станет возрастать, пока не достигнет исходной величины в этой же точке.
Для того чтобы вызвать процесс возбуждения в фазу следовой деполяризации потенциала действия, необходимы все меньшие и меньшие по амплитуде электрические импульсы. Следовательно, возбудимость мембраны клетки будет повышенной. При возврате следовой деполяризации к уровню потенциала покоя амплитуда импульсов, требуемых для возбуждения мембраны клетки, станет увеличиваться, пока не достигнет исходной в точке пересечения следовой деполяризации с уровнем потенциала покоя.
Сходным образом можно описать фазовые изменения возбудимости поперечно-полосатой мышечной клетки (рис. 1-48 Б) и миокардиальной клетки (рис. 1-48 В). В последнем случае фаза относительной рефрактерности начинается позже, поскольку выход из инактивации Na+-каналов начинается приблизительно с -30 мВ. Разумеется, оба этих типа потенциалов действия на рисунках представлены схематично.
Слайд 34Рис. 1-48. Фазовые изменения возбудимости (синие кривые) и их связь с потенциалами
Рис. 1-48. Фазовые изменения возбудимости (синие кривые) и их связь с потенциалами

мышечной (Б) и
миокардиальной (В).
При потенциале покоя возбудимость принята за 100%. Во время фазы абсолютной рефрактерности возбудимость принята за 0%.
Тестовый импульс электрического тока прямоугольной формы представлен красным цветом
Слайд 35Методы фиксации потенциала
На рисунке 1-49 представлены основные схемы фиксации потенциала у аксона
Методы фиксации потенциала
На рисунке 1-49 представлены основные схемы фиксации потенциала у аксона

емкостной ток становится равным нулю, если Vm задать равным константе. При этом Im становится равным I , т. е. ионный ток оказывается выведенным во внешнюю измерительную цепь.
Техническая сторона метода, позволяющего регистрировать ионный ток у аксона, представлена в виде схемы на рисунке (рис. 1-49 А). Электроды С и D связаны с входом усилителя напряжения, и соединенный с ним осциллограф регистрирует мембранный потенциал. С помощью электронной схемы с обратной связью этот потенциал можно длительное время фиксировать (или поддерживать) на любом уровне путем пропускания тока необходимой величины между электродами А и В, поэтому он называется поддерживаемым потенциалом (holding potential). При помощи генератора прямоугольных импульсов электрического тока на участке мембраны его можно смещать до некоторой новой величины и удерживать на этом уровне также с помощью электронной схемы с обратной связью. Ток, протекающий через этот участок мембраны при поддерживаемом потенциале или под влиянием приложенного напряжения, измеряют отдельным усилителем тока, также подсоединенным к осциллографу. Эту характерную для экспериментов на аксонах схему применяют и в настоящее время.
Исследования методом фиксации потенциала были выполнены на изолированных клетках различных тканей. Изолированная клетка представляет собой эквипотенциальную сферу и не требует дополнительных устройств. Для осуществления такого метода применяли электронно-измерительную схему (рис. 1-49 Б) и два микроэлектрода, введенных в одну клетку. Мембранный потенциал регистрируют микроэлектродом и подают на усилитель напряжения. С помощью электронной схемы с обратной связью его можно длительное время фиксировать (или поддерживать) на любом уровне путем пропускания тока через второй микроэлектрод, поэтому этот потенциал также называется поддерживаемым (holding potential). С помощью генератора прямоугольных импульсов электрического тока на мембране поддерживаемый потенциал можно смещать до некоторой новой величины и удерживать на этом уровне также с помощью электронной схемы с обратной связью. Ток, протекающий через этот участок мембраны при поддерживаемом потенциале или под влиянием приложенного напряжения, измеряют отдельным усилителем.
Большим шагом вперед было создание метода внутриклеточного диализа (рис. 1-49 В1). Он позволял осуществлять полную замену внутриклеточной среды в изолированных клетках. Экспериментальную камеру посредством полиэтиленовой перегородки делили на два отсека (рис. 1-49 В2). В перегородке с помощью иглы просверливали коническое отверстие, соответствующее по размерам изучаемой клетке. Стенки поры покрывали специальным составом, к которому приклеивали подведенную микропипеткой клетку. Резкое создание в нижнем отсеке отрицательного давления разрывало часть мембраны, находящуюся с этой стороны. Таким образом, с одной стороны перегородки находилась внешняя часть мембраны, а с другой - внутренняя (рис. 1-49 В1). Каждый отсек имел автономную систему перфузии и электронно-измерительную схему.
Позднее была разработана простая в изготовлении пластиковая микропипетка с отверстием нужного диаметра на вершине для внутриклеточного диализа (рис. 1-49 Г). В результате оказываются готовыми как отверстие подведения клетки, так и контур перфузии искусственного внутриклеточного раствора: перфузирующий клетку изнутри раствор подается в одно колено микропипетки, а выводится в другое. Присасывание к клетке осуществляется благодаря отрицательному гидростатическому давлению в пипетке по отношению к среде, в которой находятся клетки. Позднее для исследований клеток стали применять упрощенную схему (рис. 1-49 Д).
Слайд 36Рис. 1-49. Принципы фиксации потенциала у аксона и клеток.
А - схема регистрации
Рис. 1-49. Принципы фиксации потенциала у аксона и клеток.
А - схема регистрации
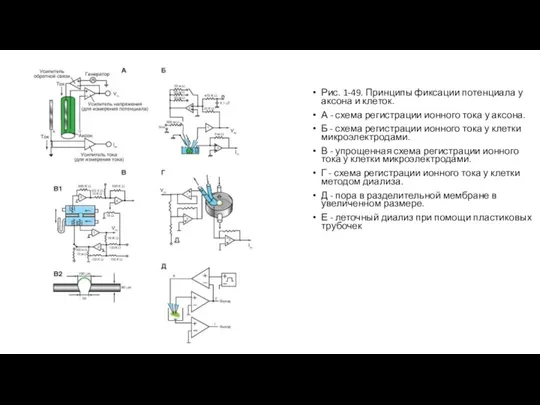
Б - схема регистрации ионного тока у клетки микроэлектродами.
В - упрощенная схема регистрации ионного тока у клетки микроэлектродами.
Г - схема регистрации ионного тока у клетки методом диализа.
Д - пора в разделительной мембране в увеличенном размере.
Е - леточный диализ при помощи пластиковых трубочек
Слайд 37Patch-clamp
Расцвет исследований мембран клеток наступил с созданием метода patch-clamp. Этот метод позволяет
Patch-clamp
Расцвет исследований мембран клеток наступил с созданием метода patch-clamp. Этот метод позволяет

На рисунке 1-50 показаны различные конфигурации patch-clamp по отношению к клетке или фрагменту ее мембраны. Сначала пипетку подводят вплотную к мембране изолированной клетки (рис. 1-50 А) и получают конфигурацию low resistance seal. Далее в пипетке подсасыванием создают небольшое отрицательное давление (рис. 1-50 Б). Это приводит к тому, что мембрана плотно закупоривает отверстие пипетки и формируется высокоомный контакт - конфигурация cell-attached, или иначе - переход пипетка-мембрана с сопротивлением утечки более 10 ГОм (так называемый giga seal). После нормализации давления в пипетке конфигурация cell-attachedблизка к физиологической ситуации, поскольку зона мембраны, захваченная пипеткой, с внутренней стороны контактирует с внутриклеточной жидкостью, а с внешней стороны - со стандартным внеклеточным раствором, которым заполняют patch-пипетку. Эта конфигурация, с одной стороны, позволяет регистрировать одиночные ионные каналы под пипеткой, а с другой, является промежуточной для других конфигураций. Она позволяет изучать на одиночном канале роль вторичных мессенджеров, включающихся через рецепторы плазматической мембраны.
Конфигурация cell-attached позволяет двумя путями (в зависимости от задач исследователя) сформировать конфигурацию, называемую whole-cell. В одном случае для ее получения в пипетку необходимо резко и одномоментно подать небольшое отрицательное давление, разрывающее мембрану под пипеткой и образующее низкоомный путь между внутренней средой клетки и раствором в пипетке. При этом в мембране возникает дырка, величина которой позволяет осуществлять обмен ионов и различных соединений между пипеткой и цитоплазмой (рис. 1-50 В). В другом случае низкоомный путь между внутренней средой клетки и раствором в пипетке формируется за счет влияния соединений, находящихся в пипетке и вызывающих образование в мембране пор, проницаемых для ионов, но не для молекул. Это перфоративный (perforated) patch. Эта методика позволяет исследовать ионные токи, протекающие через мембрану, идентифицировать и вычленить их.
Слайд 38Конфигурация whole-cell позволяет сформировать другую конфигурацию - outside-out patch. Оттягивание пипетки от
Конфигурация whole-cell позволяет сформировать другую конфигурацию - outside-out patch. Оттягивание пипетки от

Конфигурация cell-attached позволяет сформировать другую конфигурацию, называемую «insideout patch». К ее образованию приводит резкое отрывание пипетки от клетки (рис. 1-50 Е), причем giga seal не меняется. В этом случае на пипетке находится лишь фрагмент мембраны (patch), внутренняя сторона которой смотрит в омывающий раствор перфузионной камеры, а внешняя контактирует с содержимым пипетки (рис. 1-50 Ж). Данную конфигурацию применяют для изучения вклада соединений цитоплазмы в канальную активность.
Конфигурация cell-attached позволяет сформировать и изучать везикулу. Для ее образования пипетку плавно и медленно оттягивают от клетки (рис. 1-50 З). Оттягивание пипетки от клетки заставляет мембрану растягиваться до тех пор, пока она не отделится от клетки и не сошьется, образовав везикулу (рис. 1-50 И). При помощи дальнейшей экспозиции пипетки в воздухе можно получить конфигурациюinside-out patch
(рис. 1-50 К, Л).
Рис. 1-50. Метод patch-clamp и его конфигурации
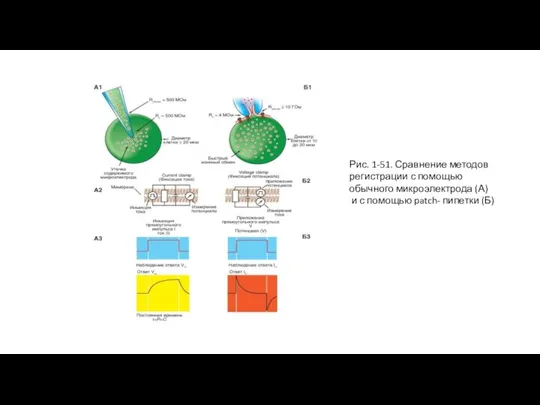
Слайд 39Сравнение методов
На рисунке 1-51 показаны микроэлектрод (рис. 1-51 А1) и patch-пипетка (рис. 1-51 Б1)
Сравнение методов
На рисунке 1-51 показаны микроэлектрод (рис. 1-51 А1) и patch-пипетка (рис. 1-51 Б1)

На рисунке показан принцип фиксации тока, или current clamp (рис. 1-51 А2), а также принцип фиксации потенциала, или voltage clamp(рис. 1-51 Б2).
Применительно к рисунку (рис. 1-51 А2) липидный бислой можно уподобить конденсатору, две обкладки которого находятся на небольшом расстоянии друг от друга, и при подаче тока одна обкладка заряжается положительно, а другая - отрицательно.
Итак, если мы подаем на мембрану ток (рис. 1-51 А3), то его протекание через Rm описывается законом Ома:
где Vm - потенциал на Rm.
Протекание тока через емкость можно рассчитать следующим образом:
Таким образом, для общего тока, текущего в покое через мембрану, получаем:
Емкостной компонент мембраны Сm обусловлен исключительно липидным бислоем, а резистивный компонент Rm - белками, образующими ионные каналы и встроенными в липидный бислой.
Если подать на мембрану прямоугольный импульс электрического тока, кривая изменения потенциала будет определяться RmxCm
Применительно к рис. 1-51 Б2 можно фиксировать потенциал и разрешить течь току.
Если внезапно менять напряжение от исходного значения до нового (в виде прямоугольного импульса; рис. 1-51 Б3), то быстро проходящий емкостной ток (Ic) течет по тому же принципу, как заряды текут на конденсатор. Ic максимален в начале прямоугольного импульса, когда заряд на конденсатор течет наиболее быстро, и затем уменьшается по экспоненте с постоянной времени RC. Если внезапно уменьшить напряжение до его исходного значения, Ic течет в противоположном направлении, по сравнению с регистрируемым в начале импульса. Таким образом, Ic появляется в виде коротких пиков в начале и в конце прямоугольного импульса. Изменение знака напряжения объясняется изменением направления тока в момент его прекращения, т.е. сначала происходит заряд, а затем разряд емкости, что связано с изменением на противоположное направление тока в цепи.
Итак, если Vm поддерживать постоянным, то Ic будет течь только очень короткое время, лишь в самый момент сдвига мембранного потенциала до нового значения. Затем этот ток прекратится, поскольку величина dVm/dt (скорость изменения мембранного потенциала) будет равна нулю. При этом мембранный ток становится простой функцией мембранной проводимости (gm) и напряжения (Vm):
Ток, который должен подаваться усилителем обратной связи для поддержания заданной величины мембранного потенциала, в точности равен общему мембранному току, протекающему при данном мембранном потенциале через участок мембраны, на котором напряжение фиксировано. Эти токи позволяют оценивать изменения общей ионной проводимости (а отсюда и специфических ионных проводимостей), вызываемые изменением мембранного потенциала.
В целом, метод был основан на том, что в известном выражении
емкостной ток становится равным нулю, если Vm задать равным константе. При этом Im становится равным Ii, т.е. ионный ток оказывается выведенным во внешнюю измерительную цепь.
Слайд 40Рис. 1-51. Сравнение методов регистрации с помощью обычного микроэлектрода (А)
и с
Рис. 1-51. Сравнение методов регистрации с помощью обычного микроэлектрода (А)
и с
Слайд 41Ионные токи
Результат применения метода фиксации потенциала представлен на рис. 1-52 А. На
Ионные токи
Результат применения метода фиксации потенциала представлен на рис. 1-52 А. На

Если мембрана резко деполяризована (рис. 1-52 Б), общий ионный ток (т.е. текущий после почти мгновенного разряда емкости) состоит из двух фаз - входящего и выходящего токов (синяя кривая). Поскольку ионный ток определяется ионами Na+ иК+ и зависит от их концентраций, то, изменяя концентрацию этих ионов, его можно разделить на компоненты. Было установлено, что если все ионы Na+, находящиеся во внешней среде, заменить на холин, который не проходит через мембрану, то входящий ток будет отсутствовать (коричневая кривая). Следовательно, он обусловлен ионами Na+. В этом случае выходящий ток приписывали ионам К+. Сначала ионы Na+ движутся по концентрационному градиенту, создавая входящий ток. Однако эта компонента быстро уменьшается и сменяется выходящим К+-током.
Слайд 42Рис. 1-52. Ионные токи, зарегистрированные методом фиксации потенциала.
А - ток, протекающий через
Рис. 1-52. Ионные токи, зарегистрированные методом фиксации потенциала.
А - ток, протекающий через
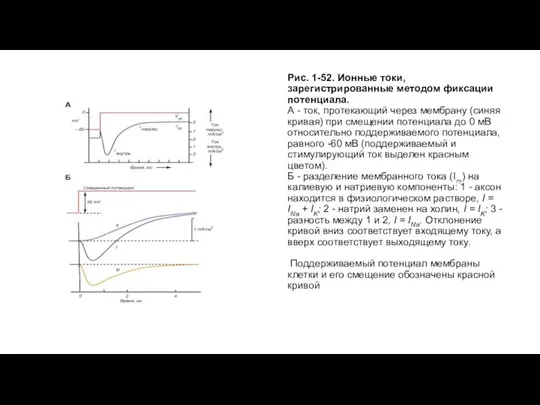
Б - разделение мембранного тока (Im) на калиевую и натриевую компоненты: 1 - аксон находится в физиологическом растворе, I = INa + IK; 2 - натрий заменен на холин, I = IK; 3 - разность между 1 и 2, I = INa. Отклонение кривой вниз соответствует входящему току, а вверх соответствует выходящему току.
Поддерживаемый потенциал мембраны клетки и его смещение обозначены красной кривой
Слайд 43Регистрация ионных токов методом фиксации потенциала
На рисунке 1-53 А представлен принцип регистрации
Регистрация ионных токов методом фиксации потенциала
На рисунке 1-53 А представлен принцип регистрации

На рисунке 1-53 Б показаны примеры регистрации при типичных экспериментах с фиксацией потенциала у ооцита, в который экспрессированы потенциалуправляемые Na+-каналы. В этих экспериментах потенциал поддерживается на уровне -80 мВ. В первой части экспериментов тестирующая ступенька длиной 10 мс смещает потенциал от -80 до -120 мВ и вновь возвращает его к -80 мВ. В этом случае регистрируют только короткие емкостные пики в начале и в конце прямоугольного импульса. В промежутке между емкостными
пиками, т.е. на фоне самой ступеньки, не регистрируются никакие другие токи. Во второй части экспериментов тестирующая ступенька длиной 10 мс смещает потенциал от -80 мВ до -40 мВ и вновь возвращает его к -80 мВ. В этом случае в промежутке между емкостными пиками, т.е. на фоне самой ступеньки, регистрируется входящий ток. Этот ионный ток, протекающий через экспрессированные в ооцит потенциалуправляемые №+-каналы. Часто этот ток называют макроскопическим, поскольку он протекает через большую популяцию каналов в целой клетке.
Для понимания механизма удобно рассмотреть электрическую модель аксона. На рисунке 1-53 В сопротивление r представляет собой сопротивление осевого электрода, связывающего разные участки мембраны. Предположим, что моделируемый аксон находится в большом объеме раствора, так что наружная жидкость эквипотенциальна и на схеме может быть представлена проводником без сопротивления. На рисунке показан один элемент мембраны, а следует представить себе большое число аналогичных элементов, связанных между собой и образующих непрерывный кабель. Каждый элемент содержит емкость мембраны С, калиевую и натриевую батареи Ек и ЕNa и сопротивления RK и RNa. Сопротивление утечки Rl и батарея Еl введены для учета движения ионов, проходящих по каналам, которые не изменяются во время активности. Однако ток утечки мал, и в первом приближении его можно не принимать во внимание.
Слайд 44Рис. 1-53. Двухэлектродный метод фиксации потенциала.
А - схема опыта.
Б - регистрируемые
Рис. 1-53. Двухэлектродный метод фиксации потенциала.
А - схема опыта.
Б - регистрируемые
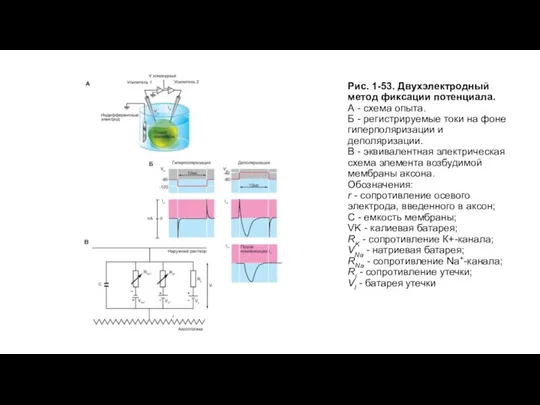
В - эквивалентная электрическая схема элемента возбудимой мембраны аксона.
Обозначения:
r - сопротивление осевого электрода, введенного в аксон;
С - емкость мембраны;
VK - калиевая батарея;
RK - сопротивление К+-канала;
VNa - натриевая батарея;
RNa - сопротивление Nа+-канала;
Rl - сопротивление утечки;
Vl - батарея утечки
Слайд 45Na+- и К+- проводимость
Зная величину калиевого и натриевого тока, нетрудно оценить проводимость
Na+- и К+- проводимость
Зная величину калиевого и натриевого тока, нетрудно оценить проводимость

Как только входящий Na+-ток хотя бы слегка превысит выходящий К+-ток, мембранный потенциал неизбежно начнет смещаться регенеративным образом в сторону ENa .
Зная величину калиевого и натриевого тока, можно оценить проводимость мембраны для каждого иона. На рисунке 1-54 А показаны изменения проводимости, вызванные быстрым смещением потенциала внутри волокна до 0 мВ относительно поддерживаемого потенциала, равного -56 мВ. Смещение мембранного потенциала до нуля эквивалентно короткому замыканию мембраны. В этом случае конденсатор С сразу разряжается, и с этого момента ток создают только ионы, проходящие по каналам, имеющим сопротивление RNa иRK.
Натриевая проводимость (gNa) в ответ на смещение мембранного потенциала относительно поддерживаемого потенциала изменяется от крайне низкой величины и быстро нарастает, а затем экспоненциально уменьшается. Это экспоненциальное уменьшение gNa может быть быстрым или медленным, что определяется длительностью ступеньки деполяризации. Если смещение потенциала относительно поддерживаемого потенциала (например, потенциала покоя) было кратковременным (как это показано красной пунктирной линией; рис. 1-54 А, красная кривая, импульс 1), и потенциал покоя был быстро восстановлен, gNa быстро возвращается к состоянию покоя (пунктирная красная кривая). Если сразу же подать второй аналогичный импульс, вызывающий смещение потенциала относительно поддерживаемого потенциала, то это также вызывает аналогичное увеличение gNa. Если же деполяризация продолжительна (рис. 1-54 А, красная кривая, импульс 2 или 3), gNa быстро увеличивается, но уменьшается более медленно (рис. 1-54 А, сплошная кривая) вследствие процесса, называемого инактивацией. В этом случае, чтобы второй импульс после инактивации натриевых каналов мог снова вызвать изменение проницаемости для натрия, мембрана в течение нескольких миллисекунд до нанесения этого импульса должна быть реполяризована. Что же касается калиевой проводимости (gK), то во всяком случае в аксоне кальмара не обнаружено инактивации, и высокая gK сохраняется все время, пока мембрана деполяризована. Так, если смещение потенциала относительно поддерживаемого потенциала было не очень длительным (рис. 1-54 А, красная кривая, импульс 2), высокая gK сохраняется до возвращения потенциала к поддерживаемому потенциалу (рис. 1-54 А, пунктирная коричневая кривая). Если же смещение потенциала относительно поддерживаемого потенциала было длительным (рис. 1-54 А, красная кривая, импульс 3), высокая gK сохраняется все время, пока мембрана деполяризована (рис. 1-54 А, сплошная коричневая кривая).
Калиевая проводимость (gK) нарастает от небольшой, но вполне определенной величины. Это изменение начинается не сразу. Кривая увеличения gK имеет S-образную форму, и проводимость выходит на постоянный уровень через 5-6 мс. Задержанный сдвиг gKдостигает максимума, и это начинает возвращать мембранный потенциал к уровню потенциала покоя (а часто сдвигает его и несколько дальше этого уровня). Кроме того, приходит в действие другой независимый механизм: деполяризация мембраны вызывает также (с задержкой) инактивацию gNa, что тоже способствует возвращению мембранного потенциала к уровню потенциала покоя.
Таким образом, деполяризация гигантского аксона кальмара запускает три процесса:
быстрое нарастание gNa;
• задержанное нарастание калиевой проводимости, которая не инактивируется (но выключается при реполяризации мембраны);
• задержанную инактивацию gNa (рис. 1-54 А, Б).
Рассчитанные значения потенциала действия (А.Л. Ходжкин и А.Ф. Хаксли) были похожи на зарегистрированный потенциал действия (рис. 1-54 В).
Слайд 46Рис. 1-54. Натриевая и калиевая проводимости и теоретическая реконструкция потенциала действия.
А -
Рис. 1-54. Натриевая и калиевая проводимости и теоретическая реконструкция потенциала действия.
А -
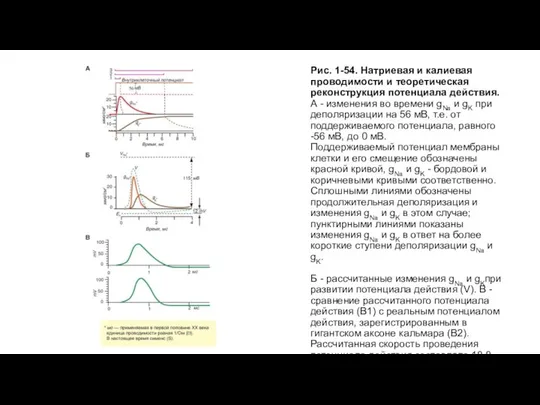
Поддерживаемый потенциал мембраны клетки и его смещение обозначены красной кривой, gNa и gK - бордовой и коричневыми кривыми соответственно. Сплошными линиями обозначены продолжительная деполяризация и изменения gNa и gK в этом случае; пунктирными линиями показаны изменения gNa и gK в ответ на более короткие ступени деполяризации gNa и gK.
Б - рассчитанные изменения gNa и gKпри развитии потенциала действия (V). В - сравнение рассчитанного потенциала действия (В1) с реальным потенциалом действия, зарегистрированным в гигантском аксоне кальмара (В2). Рассчитанная скорость проведения потенциала действия составляла 18,8 м/с, а полученная в эксперименте - 21,2 м/с
Слайд 47Токи при разных ступеньках потенциала
Рассмотрим ответ мембраны клетки на ступенчатое смещение мембранного
Токи при разных ступеньках потенциала
Рассмотрим ответ мембраны клетки на ступенчатое смещение мембранного

Входящий ток объясняется тем, что в результате увеличения gNa, вызываемого деполяризацией, ионы Na+ устремляются внутрь клетки. Исходя из увеличения gNa, этот ток прекращается при +55 мВ - потенциале равновесия Нернста для Na+ (ЕNa). При ЕNa сила, обусловленная электрическим потенциалом, равна по величине и противоположна по направлению силе, создаваемой градиентом концентрации, так что суммарного натриевого тока нет. При еще большей деполяризации первая из этих сил становится больше второй, и ионы Na+ начинают выходить из клетки наружу, тем самым изменяя направление тока. Подобным образом особенности выходящего тока определяются тем, что его носителями служат ионы К+. По мере деполяризации мембраны силы электрического поля, стремящиеся удержать К+ внутри клетки, уменьшаются, приводя ко все большему преобладанию направленных наружу сил, обусловленных градиентом концентрации К+.
Слайд 48Рис. 1-55. Фиксация потенциала на гигантском аксоне кальмара.
А - смещения мембранного потенциала
Рис. 1-55. Фиксация потенциала на гигантском аксоне кальмара.
А - смещения мембранного потенциала

Б - ток через мембрану, регистрируемый одновременно со смещением потенциала. Показаны только смещения потенциала в положительную область от уровня поддерживаемого потенциала, равного -60 мВ (например, потенциала покоя).
В - вольтамперные характеристики, полученные в результате экспериментов с фиксацией потенциала.
По оси абсцисс - смещения мембранного потенциала относительно поддерживаемого потенциала (в данном случае потенциала покоя);
по оси ординат - изменения входящего Na+-тока (фиолетовая кривая) и выходящего К+-тока (коричневая кривая)
Слайд 49Основные блокаторы Na+- и К+-токов ТТХ и ТЭА
Эксперименты с заменой ионов и
Основные блокаторы Na+- и К+-токов ТТХ и ТЭА
Эксперименты с заменой ионов и

Избирательность действия фармакологических соединений позволила установить и другие детали. Например, когда внутрь аксона вводят проназу - фермент, расщепляющий белки, - она избирательно нарушает инактивацию gNa. После обработки аксона проназой натриевый ток нарастает обычным образом, но потом не спадает: он остается большим в течение всего времени деполяризации. Первый сделанный из этого вывод заключался в том, что включение и выключение gNa - это два независимых процесса. Второй вывод основывался на следующей дополнительной информации, известной биохимикам. Проназа представляет собой комплекс из 11 ферментов. Последовательное введение каждого из них в клетку показало, что к избирательному нарушению инактивации gNa приводит только введение В-щелочной протеазы. Поскольку она селективно отщепляет аргинин от белковой цепочки, было постулировано, что инактивационные ворота Na+-канала представляют собой аргинин.
Слайд 50Рис. 1-56. Избирательное блокирование натриевых и калиевых каналов с помощью тетродотоксина и
Рис. 1-56. Избирательное блокирование натриевых и калиевых каналов с помощью тетродотоксина и

В первой части рисунка представлены наложенные друг на друга 7-9 записей, сделанных в условиях фиксации потенциала (на уровнях от 30 до 150 мВ) на одном перехвате Ранвье седалищного нерва лягушки. На записях цифрами показаны смещения мембранного потенциала от поддерживаемого потенциала (в данном случае потенциала покоя, равного около -75 мВ), кратные 15 мВ. Входящий ток направлен вниз, а выходящий вверх. Поскольку площадь мембраны перехвата, на которой фиксировали напряжение, нельзя определить точно, указана сила тока (в наноамперах), а не плотность тока.
В нижней части рисунка представлены вольтамперные характеристики измеряемых токов.
А - изменение тока во времени в опыте с обычным солевым раствором (А1) и в присутствии тетродотоксина (А2). Тетродотоксин блокирует ту часть общего мембранного тока, которая переносится ионами Na+, но не К+, т.е. входящий натриевый ток, оставляя без изменений выходящий калиевый ток (Hille, 1976).
Б - изменение тока во времени в опыте с нормальным солевым раствором (Б1) и в присутствии тетраэтиламмония (Б2). Влияние тетраэтиламмония на ток показывает, что это соединение блокирует калиевый, но не натриевый ток. (По Hille, 1976, с изменениями) В - вольтамперные характеристики гигантского аксона Myxicola, показывающие INa (белые кружечки) и IK (белые треугольники) в контрольных условиях и демонстрирующие, что тетродотоксин (1 мкМ) блокирует INa (черные кружечки), но не IK (черные треугольники).
Точки - ионные токи во время ступенек напряжения от уровня поддерживаемого потенциала до указанного уровня
Слайд 51Nа+-токи
Рассмотрим Na+-токи, зарегистрированные методом voltage-clamp. На рисунке 1-57 А продемонстрированы Na+-токи, зарегистрированные
Nа+-токи
Рассмотрим Na+-токи, зарегистрированные методом voltage-clamp. На рисунке 1-57 А продемонстрированы Na+-токи, зарегистрированные

Однако приводятся величины смещений мембранного потенциала относительно поддерживаемого потенциала, при которых входящий Na+-ток максимален, и величины, при которых максимален инвертированный Na+-ток (т.е. ток, изменивший свое направление).
Разумеется, фаза деполяризации потенциала действия лежит в том диапазоне потенциалов, при которых Na+-ток имеет входящее направление. Выходящее направление этого тока в естественных условиях не встречается, а присутствует только в условиях значительных смещений мембранного потенциала в эксперименте, что позволяет охарактеризовать проводимость каналов при всех возможных уровнях смещения потенциала.
На рисунке 1-57 Б представлена запись Na+- токов при смещении мембранного потенциала относительно величины поддерживаемого потенциала. Величина поддерживаемого потенциала Ehp равна -90 мВ. На основании результатов экспериментов по пиковым значениям и по стационарным значениям токов, представленных на рисунке 1-57 Б, были построены вольтамперные характеристики (рис. 1-57 В), типичные для Na+-токов.
Слайд 52Рис. 1-57. Na+-токи, зарегистрированные в конфигурации whole-cell у электровозбудимых клеток при различных величинахсмещения мембранного
Рис. 1-57. Na+-токи, зарегистрированные в конфигурации whole-cell у электровозбудимых клеток при различных величинахсмещения мембранного

А - Na+-токи, зарегистрированные у разных электровозбудимых клеток.
Б - Na+-токи, зарегистрированные при разных ступеньках относительно поддерживаемого потенциала. Величина поддерживаемого потенциала Eh равна -90 мВ.
Величины ступенек тестирующих
потенциалов указаны на рисунке.
В - вольтамперные характеристики, построенные по пиковым значениям (о) и по стационарным значениям (∆)Na+-токов
Слайд 53Активация и инактивация Na+-токов
Корректное описание инактивации входящих токов представляет определенные сложности, поскольку
Активация и инактивация Na+-токов
Корректное описание инактивации входящих токов представляет определенные сложности, поскольку

В этом случае измеряют уменьшение максимальной величины тока, вызванного тестирующими деполяризующими ступеньками в случае, если перед этим мембранный потенциал определенное (достаточно длинное по сравнению с длительностью инактивации) время поддерживался на сниженном уровне. Зависимость этого уменьшения от величины поддерживаемого потенциала носит S-образную форму. При этом для характеристики каналов помимо амплитуды тока (I) обычно рассматривают величину активации (Va) и величину инактивации (Vh). Если сущность постоянных времени активации и инактивации каналов достаточно понятна, то величины активации (Va) и инактивации (Vh) требуют пояснения.
Слайд 54На рисунке 1-58 показаны принципы исследования активации и инактивации тока.
На панели А
На рисунке 1-58 показаны принципы исследования активации и инактивации тока.
На панели А

где I представляет собой амплитуду тока, Imax является максимальной амплитудой тока, V - тестовый потенциал, V0,5 - потенциал полуактивации или иначе Va. На панели В рисунка представлены тестовые сигналы и steady-state инактивация тока. Мембрана клетки была на поддерживаемом потенциале в диапазоне от -110 до -45 мВ в течение 1 с, и токи выявляли при помощи деполяризующих шагов-ступенек до -40 мВ. На панели Г показана инактивационная кривая, полученная на основании уравнения Больцмана в следующей форме:
где I представляет собой амплитуду тока, Imax является максимальной амплитудой тока, V - потенциал, V0,5 - потенциал полуинактивации или иначе Vh. И в случае (Б), и в случае (Г) константа k представляет собой наклон кривой (фактор крутизны) и отражает steady-state потенциалчувствительность каналов или «диапазон» потенциалов, в котором каналы функциональны. Чем больше k, тем уже диапазон. В части рисунка (Д) кривые на панелях Б и Г объединены вместе.
Слайд 55Рис. 1-58. Принципы регистрации и анализа активации и инактивации тока
Рис. 1-58. Принципы регистрации и анализа активации и инактивации тока
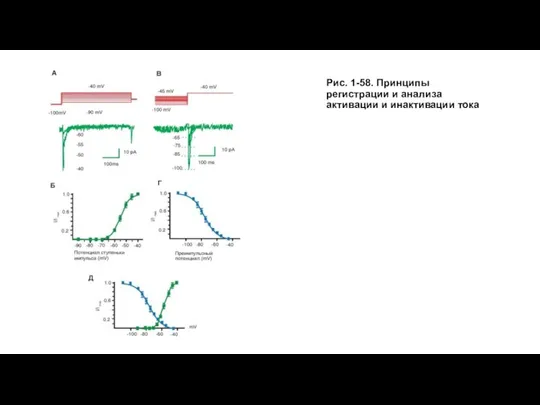
Слайд 56Na+-каналы
В настоящее время известно 9 типов Na+-каналов. Рисунок 1-59 А демонстрирует одиночные
Na+-каналы
В настоящее время известно 9 типов Na+-каналов. Рисунок 1-59 А демонстрирует одиночные

На рис. 1-59 А показано 10 регистраций одиночного натриевого канала в ответ на стимуляцию деполяризационной тестовой ступенькой потенциала (цитозольная сторона patch электроотрицательна) в одном и том же эксперименте.
Н рис. 1-59 Б показано 8 регистраций одиночного натриевого канала в ответ на стимуляцию деполяризационной тестовой ступенькой потенциала (цитозольная сторона patch электроотрицательна) в одном и том же эксперименте, выполненном методом patch-clamp(записи одного и того же канала).
Слайд 57Рис. 1-59. Na+-ток через одиночный Na+-канал в мышечной клетке мыши.
А -
Рис. 1-59. Na+-ток через одиночный Na+-канал в мышечной клетке мыши.
А -

Открытое состояние Na+-каналов представлено в виде смещения нулевой линии вниз, т.е. через канал течет входящий Na+-ток.
Б - Регистрация методомpatch-clamp в конфигурации outside-out одиночных ионных каналов при смещениях мембранного потенциала от -100 до -40 мВ
Слайд 58Параметры Na+-тока
Микроскопические механизмы, то есть механизмы на уровне токов, текущих через одиночные
Параметры Na+-тока
Микроскопические механизмы, то есть механизмы на уровне токов, текущих через одиночные

На рис. 1-60 А линия обозначает вольт-амперную зависимость идеализированного открытого натриевого канала. Т.к. мы исходим из начальной предпосылки, что канал в нашем случае будет полностью открыт все время (т.е. что проводимость каналов не будет функцией напряжения) тогда ток, текущий через них, будет линейным или «омическим».
На рис. 1-60 Б представлена кривая, которая показывает вероятность того, что натриевый канал будет находиться в открытом состоянии (вероятность открытия натриевого канала). Уравнение, приведенное во вставке в рисунок, означает
приведенную кривую, если мы вставим значения
ZNa = 6.5 и V0.5= - 50 mV.
На рис. 1-60 В параметр m описывает вероятность того, что каждая из трех частей в натриевом канале находятся в необходимом состоянии для того, что бы канал открылся. Параметр h описывает вероятность того, что инактивирующая часть натриевого канала находится в необходимом состоянии для того, что бы канал открылся (т.е. не будет инактивировать его). Таким образом, высокие значения параметра h располагают к тому, чтобы канал был в открытом состоянии. Параметры, отложенные на рисунке - это значения m и h на бесконечном промежутке времени.
На рис. 1-60 Г представлена оценка макроскопического натриевого тока посредством умножения одноканальных токов из секции А рисунка на вероятность их открытия Ро из секции Б и на количество каналов (N). В данном случае мы устанавливаем количества каналов в 100 натриевых.
Слайд 59Рис. 1-60.
Параметры Na+-тока, протекающего через целую клетку и через одиночные ионные
Рис. 1-60.
Параметры Na+-тока, протекающего через целую клетку и через одиночные ионные
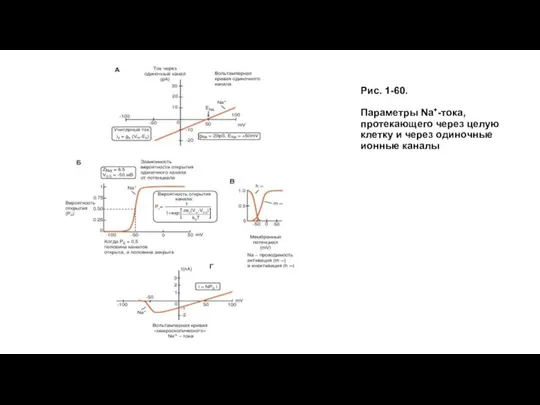
Слайд 60Места связывания токсинов у Na+-канала
Большое количество биологических токсинов оказывают свой токсический эффект,
Места связывания токсинов у Na+-канала
Большое количество биологических токсинов оказывают свой токсический эффект,

• растворимые в воде гетероциклические гуанидиновые соединения: ТТХ и сакситоксин (saxitoxin, STX);
• липидорастворимые полициклические соединения: вератридин, аконитин и батрахотоксин (batrachotoxin, BTX);
• яды, представляющие собой низкомолекулярные полипептиды, изолированные из скорпиона, морских анемон и многих других.
После появления данных об этих участках B. Hille предложил наглядную схему взаимодействия токсинов с белком канала (рис. 1-61). Эта схема и до настоящего времени позволяет читателям, не обладающим специальной молекулярно-биологической подготовкой, понять, в каком месте канала происходит взаимодействие с теми или иными токсинами.
Все фармакологические соединения, действующие на Na+-каналы, имеют места или участки связывания на α-субъединице. Были идентифицированы, по крайней мере, шесть отличающихся мест связывания для нейротоксинов и один участок связывания для местных анестетиков и сходных с ними веществ, которые представлены в таблице (рис. 1-61).
Место связывания 1 связывает непептидные блокаторы поры Na+-каналов - ТТХ, STX и пептидный блокатор поры μ-конотоксин. Рецепторные участки для этих токсинов сформированы аминокислотными остатками в петле поры и непосредственно на внеклеточной стороне петли поры с внешней стороны.
Место связывания 2 связывает семейство липидорастворимых токсинов, включающих аконитин (aconitine, AC), вератридин (veratridine, VER), BTX и граянотоксин (grayanotoxin, GTX), которые поддерживают активацию натриевых каналов. Фотоафинная маркировка и исследования мутагенеза демонстрируют трансмембранные сегменты IS6 и IVS6 в рецепторном участке для BTX.
Место связывания 3 связывает α-токсин скорпиона и токсины морских анемон, которые ингибируют инактивацию Na+-каналов, замедляя переход Na+-каналов, находящихся в активированном состоянии, к состоянию их инактивации. Эти пептидные токсины связываются в комплексном рецепторном участке, включающем петлю между сегментами S3-S4 на внешнем конце S4 сегмента в домене IV.
Место связывания 4 связывает β-токсины скорпиона, которые увеличивают активацию каналов. Рецепторный участок для β-токсина скорпиона включает петлю, соединяющую сегменты S3-S4 на внеклеточном конце сенсора напряжения сегмента S4 в домене II.
Место связывания 5 связывает комплекс полиэфирных токсинов - бреветоксинов (brevetoxin, PbTx) и CTX (ciguatoxin), которые продуцируют морские планктонные формы dinoflaggelates. В экспериментах с фотоафинной меткой было показано, что трансмембранные сегменты IS6 и IVS5 обеспечивают связывание PbTx.
Место связывания 6 связывает пиретроиды, представляющие собой аналоги природных нейротоксинов приретринов, 4,4-дихлордифенил- трихлорэтан и δ-конотоксины, которые замедляют скорость инактивации подобно α-токсину скорпиона. Местоположение нейротоксинового рецепторного участка 6 неизвестено.
Наконец, местные анестетики и вещества, родственные антиэпилептикам, и антиаритмические вещества связывают перекрывающиеся рецепторные участки, расположенные во внутренней полости поры натриевого канала. Аминокислотные остатки в сегментах S6, по крайней мере в трех из четырех доменов, вносят вклад в этот сложный комплекс рецепторного участка к соединению, при этом доминирующую роль играет IVS6-сегмент.
Слайд 61Рис. 1-61.
Места связывания токсинов с различными доменами и сегментами потенциалуправляемых натриевых
Рис. 1-61.
Места связывания токсинов с различными доменами и сегментами потенциалуправляемых натриевых
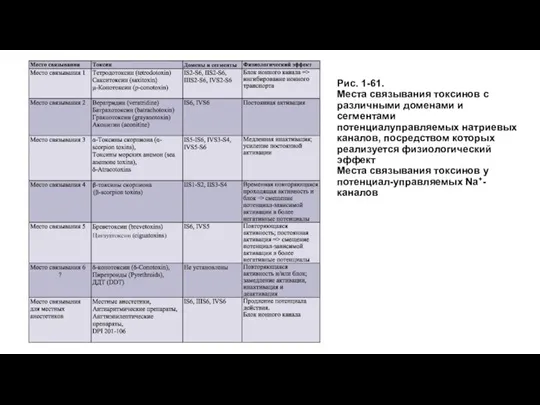
Места связывания токсинов у потенциал-управляемых Na+-каналов
Слайд 62Центр связывания 1 у Na+-канала
Первые два (рис. 1-62 А) естественно встречающихся токсина,
Центр связывания 1 у Na+-канала
Первые два (рис. 1-62 А) естественно встречающихся токсина,

STX, подобно TTX, относится к блокаторам активации Na+-каналов и известен так же, как паралитический яд моллюска (PSP: paralytic shellfish poison). Этот токсин, найденный в некоторых моллюсках, членистоногих, иглокожих и некоторых других морских животных, заглатывающих протистов (простейших одноклеточных организмов), главным образом Dinoflagellata - одноклеточный организм в морском планктоне, который содержит яд. Кроме того, STX представляет собой продукт некоторых пресноводных Cyanobacteria. Этим способом фильтрующие корм ракушки, рыбы или моллюски становятся ядовитыми и могут вызвать паралитическое ракушечно-рыбное отравление при потреблении пищи домашними животными и человеком.
TTX и STX, возможно, наиболее специфичные токсины для Na+-каналов. В большинстве случаев связывание быстро обратимо (секунды и минуты) и высокоафинно. Их равновесная константа диссоциации Kd лежит в диапазоне 1-10 нМ для изоформ скелетной мышцы или нервных клеток, а для менее чувствительных сердечных Na+- каналов - в диапазоне нескольких мкМ. Два гуанидиновых токсина и их структурные аналоги оказались ценными инструментами как для исследования формы и структуры внешнего устья, так и для моделирования TTX- и STX-связываю- щего участка. Изучение связывания с STX предполагает, что также β1-субъединица участвует в формировании TTX/STX связывающего участка. На рисунке 1-62 показано ингибирующее действие TTX на Na+-ток.
Слайд 63Рис. 1-62. Блокаторы участка связывания 1 тетродотоксин, сакситоксин и μ-конотоксин, блокирующие проводимость
Рис. 1-62. Блокаторы участка связывания 1 тетродотоксин, сакситоксин и μ-конотоксин, блокирующие проводимость
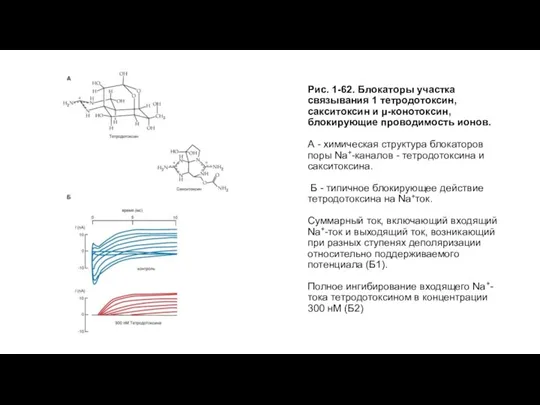
А - химическая структура блокаторов поры Na+-каналов - тетродотоксина и сакситоксина.
Б - типичное блокирующее действие тетродотоксина на Na+ток.
Суммарный ток, включающий входящий Na+-ток и выходящий ток, возникающий при разных ступенях деполяризации относительно поддерживаемого потенциала (Б1).
Полное ингибирование входящего Na+-тока тетродотоксином в концентрации 300 нМ (Б2)
Слайд 64Центр связывания 2 у Na+-канала
Представители группы липидорастворимых соединений могут получить доступ к
Центр связывания 2 у Na+-канала
Представители группы липидорастворимых соединений могут получить доступ к

Прежде всего, рассмотрим феноменологическую сторону нейротоксического действия BTX, VER, AC и GTX на мембраны клеток в виде первых наиболее простых экспериментов, выполненных с использованием этих соединений.
BTX можно рассматривать как полный агонист, так как при воздействии он вызывает одновременное изменение всех основных свойств Na+-каналов. Кроме двух выше упомянутых эффектов, BTX ухудшает проводимость одиночных каналов и их селективность для ионов.
На рисунке 1-63 Б1 показано развитие во времени Na+-токов, текущих через Na+-каналы в клетках гибридной линии нейробластома-глиома, перфузируемых стандартным раствором, а затем (рис. 1-63 Б2) продемонстрированы Na+-токи, текущие через Na+-каналы в условиях перфузии клетки раствором, содержащим BTX в концентрации 5х10-6 М. Очевидно отсутствие фазы инактивации тока.
Далее показано (рис. 1-63 В) смещение влево примерно на 50 мВ активационной кривой под действием BTX в концентрации 5х10-6 М. Это смещение было меньше в клетках миокарда новорожденных крысят (приблизительно на 30 мВ).
На рисунке 1-63 Г представлены вольтамперные характеристики перехвата Ранвье, причем в первом случае перехват Ранвье находился в стандартном перфузионном растворе, а во втором случае - в растворе, содержащем BTX. Одна кривая построена по пиковым значениям интактного Na+-тока, а другая представляет собой вольтамперную кривую для модифицированных (треугольники) и интактных (кружочки) каналов.
Слайд 65Рис. 1-63. Блокаторы участка связывания 2 - батрахотоксин, вератридин, граянотоксин и аконитин,
Рис. 1-63. Блокаторы участка связывания 2 - батрахотоксин, вератридин, граянотоксин и аконитин,

А - химическая структура токсинов, повышающих активацию натриевых каналов, - аконитина, вератридина, батрахотоксина и граянотоксина.
Б - влияние батрахотоксина на Na+^оки у клеток нейробластомы.
Б1 - Na+-токи, текущие через Na+-каналы в клетках нейробластомы, перфузируемых стандартным раствором. Поддерживаемый потенциал Ehp = -100 мВ. Тестируемые ступеньки деполяризации от Ehp до -45, -40, -35, -20, +15 мВ.
Б2 - Na+-токи, текущие через Na+-каналы в клетках нейробластомы, перфузируемых стандартным раствором, содержащим батрахотоксин в концентрации 5х10-6 М через 30 мин после начала перфузии. Поддерживаемый потенциал Ehp = -110 мВ. Тестируемые ступеньки деполяризации от Ehp до -90, -85, -75, -65, -40, -35, -25 мВ. (Примечание: при экспериментах использовали гибридную линию нейробластомы-глиомы NG 108-15.)
В - влияние батрахотоксина в концентрации 5х10-6М через 30 мин на активационную кривую у клеток нейробластомы. Черные кружечки - контроль, белые кружечки - влияние соединения.
Г - вольтамперные характеристики, полученные для перехвата Ранвье, находящегося в стандартном перфузионном растворе (Г1). Вольтамперные характеристики, полученные для перехвата Ранвье, находящегося в стандартном перфузионном растворе, содержащем 2х10-5 М батрахотоксина (Г2).
В обоих случаях кривые построены по пиковым (кружочки) и стационарным (треугольники) значениям мембранных токов. Изменение тока утечки демонстрирует прямая линия
Слайд 66Центр связывания 3 у Na+-канала
Участок связывания 3 взаимодействует с полипептидами α-токсина скорпиона
Центр связывания 3 у Na+-канала
Участок связывания 3 взаимодействует с полипептидами α-токсина скорпиона

Фармакологические свойства токсинов морских анемон (или актиний) хорошо изучены. Это полипептиды с молекулярной массой от 3 до 300 кДа, изолированные из щупальца морской анемоны. Токсины, изолированные из представителей родов Anthopleura (anthopleurin:Ap-A или Ap-B) и Anemonia (ATX I, II или V), представлены относительно большими белками, классифицируемыми как токсины типа I морской анемоны. Для проявления их действия на Na+-каналы они должны быть апплицированы с внеклеточной стороны. Как было обсуждено выше, согласно современным представлениям о структуре Na+-каналов домены, которые, как известно, связаны с инактивацией, в основном расположены внутриклеточно. Тот факт, что токсины морской анемоны модифицируют инактивацию, хотя они действуют с внеклеточной стороны, делает их перспективными для использования в качестве зондов при исследовании Na+-каналов.
На рисунке 1-64 А продемонстрирован потенциал действия перехвата Ранвье миелинизированного нерва лягушки в стандартном перфузионном растворе (рис. 1-64 А1) и после применения скорпиона (Leiurus quinquestriatus) в концентрации 1 мкг/мл (рис. 1-64 А2).
Далее показан (рис. 1-64 Б) Na+-ток перехвата Ранвье до (Б1) и после (Б2) применения α-токсина скорпиона (Leiurus quinquestriatus).Наблюдается резкое замедление натриевой инактивации.
α-Токсины скорпиона вырабатываются североафриканскими скорпионами, относящимися к родам Androctonus, Buthus и Leiurus. α-Токсин V скорпиона, изолированный из яда Leiurus quinquestriatus, взаимодействует с нейротоксиновым рецепторным участком 3 у Na+-канала. Это связывание сильно зависит от потенциала и замедляет или блокирует инактивацию Na+-канала. α-Токсины скорпиона также аллостерически усиливают постоянную активацию теми нейротоксинами, которые связываются с участком 2, как, например, BTX. Структура нескольких токсинов из яда соответствующего скорпиона была определена методом рентгено-структурного анализа.
Слайд 67Рис. 1-64. Участок 3 связывает α-токсины скорпиона и токсины морских анемон, которые замедляют
Рис. 1-64. Участок 3 связывает α-токсины скорпиона и токсины морских анемон, которые замедляют
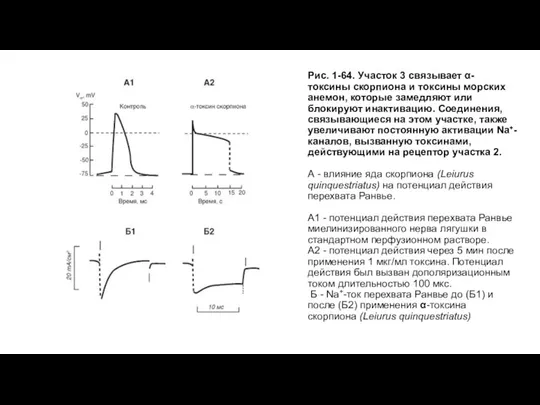
А - влияние яда скорпиона (Leiurus quinquestriatus) на потенциал действия перехвата Ранвье.
А1 - потенциал действия перехвата Ранвье миелинизированного нерва лягушки в стандартном перфузионном растворе.
А2 - потенциал действия через 5 мин после применения 1 мкг/мл токсина. Потенциал действия был вызван дополяризационным током длительностью 100 мкс.
Б - Na+-ток перехвата Ранвье до (Б1) и после (Б2) применения α-токсина скорпиона (Leiurus quinquestriatus)
Слайд 68Центр связывания местных анестетиков у Na+-канала
Местные анестетики (рис. 1-65) типа лидокаина и
Центр связывания местных анестетиков у Na+-канала
Местные анестетики (рис. 1-65) типа лидокаина и

Были многочисленные попытки охарактеризовать участок связывания местных анестетиков. В результате нескольких исследований было показано наличие дозозависимого эффекта при связывании VER и BTX и местных анестетиков, что предлагает аллостерическое взаимодействие этих двух участков связывания. Вне участка связывания 2 нет взаимодействия местных анестетиков с местами связывания нейротоксинов на других участках рецептора. Например, местный анестетик PD85,639 не конкурирует за связывание с антиконвульсионными препаратами фенитоином и карбамазепином, связывающихся в Na+-каналах из синаптосом и синаптических мембран. Недавно опубликованные результаты показывают, что существует гидрофобный участок связывания, который отличается от участка связывания 2, но аллостерически с ним связанный. В нескольких исследованиях было показано предпочтительное взаимодействие соединений с Na+-каналом, находящимся в инактивированном состоянии. В противоположность этим результатам недавно были получены данные, что местный анестетик лидокаин не конкурирует с быстрой инактивацией. Результаты этих экспериментов свидетельствуют, что блокирующий эффект местных анестетиков не является результатом процесса медленного восстановления от быстрой инактивации и не вовлекает увеличение быстро инактивирующихся каналов, как это описано в других работах. Эти данные представляет новую модель, фокусирующуюся на процессах активации, как более уместных для механизма действия местных анестетиков.
Многие данные о мутациях поддерживают модель с отдельным участком связывания для QX-314. Подобные результаты получены и на скелетной мышце. Однако необходимо отметить, что направленные мутации аминокислот в других трех сегментах S6 в доменах DI-DIII, которые могут взаимодействовать с другими трансмембранными сегментами, до сих пор не были выполнены. Так как эти четыре домена канала, как полагают, должны располагаться вокруг поры канала, вероятно, что другие сегменты S6 могут также внести вклад в формирование рецептора для местных анестетиков. Аминокислотные остатки в петлях поры, которые формируют селективный фильтр, - также хорошие кандидаты для будущих экспериментов для определения мишени местного обезболивающего действия.
Слайд 69Рис. 1-65. Структура местных анестетиков, для которых обнаружен специфический участок связывания
Рис. 1-66.
Рис. 1-65. Структура местных анестетиков, для которых обнаружен специфический участок связывания
Рис. 1-66.
Слайд 70Рис. 1-67. Схема связывания токсинов с различными участками потенциал-управляемого Na+-канала
Рис. 1-67. Схема связывания токсинов с различными участками потенциал-управляемого Na+-канала
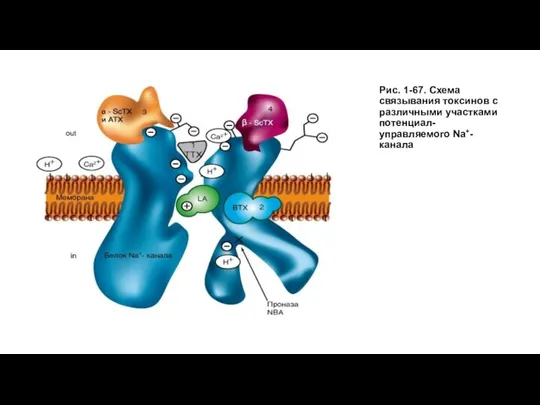
Слайд 71Са2+-ток и его характеристики
На рисунке 1-68 представлен типичный wholecell Ca2+-ток (ICa-L), определяемый
Са2+-ток и его характеристики
На рисунке 1-68 представлен типичный wholecell Ca2+-ток (ICa-L), определяемый

Корректное описание инактивации Ca2+-токов представляет определенные сложности, поскольку этот процесс развивается во времени параллельно с развитием выходящих K+-токов. Именно поэтому регистрируемый спад Ca2+-тока может быть не истинным, а определяться наложением на Ca2+-ток одновременно развивающихся выходящих K+-токов. Для предотвращения подобных ошибок необходимо тщательно блокировать K+-токи. Их наличие в наиболее простой форме можно определить по амплитуде Ca2+-тока в конце достаточно длинного по времени стимула. В этом случае она будет слегка превышать «нулевую» линию (Y0 >0). Следует отметить, что превышение «нулевой» линии в конце стимула может также отражать очень медленную (константа времени значительно больше длительности стимула) инактивацию исследуемого Са2+-тока, поэтому, чтобы избежать возможных ошибок, сложный динамический процесс инактивации сводят к стационарной (steady-state) инактивации.
В этом случае измеряют уменьшение максимальной величины тока, вызванного тестирующими деполяризующими ступеньками, в случае, если перед этим мембранный потенциал определенное время (достаточно продолжительное по сравнению с длительностью инактивации) поддерживался на сниженном уровне. Зависимость этого уменьшения от величины поддерживаемого потенциала носит S-образную форму. При этом для характеристики Ca2+-кана-
лов помимо амплитуды кальциевого тока (ICa) обычно рассматриваются величина активации (Va) и величина инактивации (Vh). Если сущность постоянных времени активации и инактивации Ca2+-каналов достаточно понятна, то величины активации (Va)и инактивации(Vh) требуют пояснения.
Слайд 72Принципы исследования активации и инактивации на примере I Ca,T тока показаны на
Принципы исследования активации и инактивации на примере I Ca,T тока показаны на

где I представляет собой амплитуду тока, Imax - максимальная амплитуда тока, V- тестовый потенциал, V0,5 - потенциал полуактивации или иначе Va. На панели Д представлены тестовые сигналы и steady-state инактивация ICa,T. Мембрана клетки была на поддерживаемом потенциале в диапазоне от -110 до -45 мВ в течение 1 с и Ca2+-токи определяли при помощи деполяризующих шагов-ступенек до -40 мВ. На панели Е показана инактивационная кривая, полученная на основании уравнения Больцмана в следующей форме:
где I представляет собой амплитуду тока, Imax - максимальная амплитуда тока, V - потенциал, V0,5 - потенциал полуинактивации или иначе Vh. И в случае, представленном на панели Г, и в случае, продемонстрированном на панели Е константа к, представляет собой наклон кривой (фактор крутизны) и отражает steady-state потенциал-чувствительность каналов или «диапазон» потенциалов, в котором каналы функциональны. Чем больше к, тем уже диапазон. В части рисунка Ж кривые на панелях Г и Е объединены вместе.
Слайд 73Рис. 1-68. Типичный whole-cell Са2+-ток (ICa-L), зарегистрированный от изолированного кардиомиоцита желудочков мыши,
Рис. 1-68. Типичный whole-cell Са2+-ток (ICa-L), зарегистрированный от изолированного кардиомиоцита желудочков мыши,
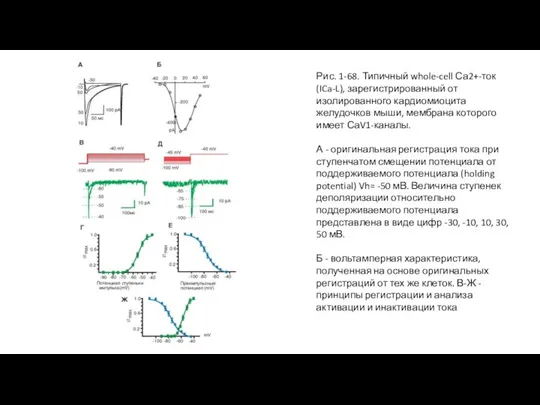
А - оригинальная регистрация тока при ступенчатом смещении потенциала от поддерживаемого потенциала (holding potential) Vh= -50 мВ. Величина ступенек деполяризации относительно поддерживаемого потенциала представлена в виде цифр -30, -10, 10, 30, 50 мВ.
Б - вольтамперная характеристика, полученная на основе оригинальных регистраций от тех же клеток. В-Ж - принципы регистрации и анализа активации и инактивации тока
Слайд 74Са2+-каналы L-типа и N-каналы
На рисунке 1-69 А1 показана оригинальная регистрация тока, текущего
Са2+-каналы L-типа и N-каналы
На рисунке 1-69 А1 показана оригинальная регистрация тока, текущего

Показана гауссовская кривая (см. рис. 1-69 А2), позволяющая оценить среднюю амплитуду тока (событий) и погрешность аппроксимации (стандартное отклонение), т.е. для данного случая это -1,21±0,02 пА при +20 мВ. По зависимости величин зарегистрированного тока от амплитуд ступенек деполяризации (рис. 1-69 А3) можно определить проводимость одиночного канала, т.е. наклон кривой (или иначе фактор крутизны). Амплитуда тока была-1,41±0,03 и -0,97+0,02 пА при 0 и +20 мВ соответственно, а проводимость одиночного канала в приведенном случае равна 22,0+1,1 pS.
Наконец, дополнительную информацию о механизмах функционирования каналов можно получить из анализа гистограмм распределения времен жизни открытого или закрытого состояния канала (рис. 1-69 А4). Интерпретация последних обычно довольно сложная. Распределение времен жизни открытого состояния канала CaV1 при +10 мВ было аппроксимировано одной экспонентой с τ0 = 5,60 мс (см. рис. 1-69 А4). Среднее времен жизни открытого состояния канала, рассчитанное как среднее арифметическое всех данных, было равно 5,95+0,24 мс.
Далее в качестве примера показаны (рис. 1-69 Б1) оригинальнаярегистрациятокаодиночногоканала CaV2 и распределение амплитуды тока при +20 мВ (рис. 1-69 Б2). Амплитуда тока была -1,09+0,02, -0,89+0,02 и -0,73+0,02 пА при +10, +20 и +30 мВ соответственно, а проводимость одиночного канала равна 18,0+1,1 pS (рис. 1-69 Б3). Распределение времен жизни открытого состояния канала CaV2 при +20 мВ было аппроксимировано одной экспонентой с τ0 = 1,04 мс (рис. 1-69 Б4). Среднее времен жизни открытого состояния канала, рассчитанное как среднее арифметическое всех данных, было равно 1,14+0,02 мс.
Слайд 75Рис. 1-69. Биофизические свойства CaV1-канала и CaV2.2-канала.
А - биофизические свойства CaV1-канала с
Рис. 1-69. Биофизические свойства CaV1-канала и CaV2.2-канала.
А - биофизические свойства CaV1-канала с

А1 - регистрация тока одиночного канала подсемейства CaV1 (тока L-типа) на фоне ступени деполяризации, равной +10 мВ от поддерживаемого потенциала (holding potential) Vhp = -40 мВ. Раствор в patch-пипетке содержал 10 μΜ CTx-MVIIC и 5 μΜ Bay K 8644.
А2 - распределение амплитуд тока L-типа при +10 мВ.
А3 - наклон кривой - проводимость одиночного канала, рассчитанная по величине зарегистрированного тока L-типа.
А4 - гистограмма распределения времен жизни открытого состояния канала подсемейства CaV1 при +10 мВ. (Распределение времен жизни в открытом состоянии) (В пипетку добавлен активатор Bay K 8644 для всех CaV1 каналов, продуцирующих L-тока и CTx-MVIIC).
Б - биофизические свойства CaV2.2-канала N-типа Ca2+-каналов кортикальных астроцитов, зарегистрированных в cell-attached patch.
- регистрация тока одиночного канала CaV2.2-канала (тока N-типа) на фоне ступени деполяризации, равной +20 мВ от поддерживаемого потенциала (holding potential) Vhp = -80 мВ. Раствор в patch-пипетке содержал 5 μΜ нифедипина и 100 нМ SNX-482.
Б2 - распределение амплитуд тока N-типа при +20 мВ.
Б3 - наклон кривой - проводимость одиночного канала, рассчитанная по величине зарегистрированного тока N-типа.
Б4 - гистограмма распределения времен жизни открытого состояния канала CaV2.2 при +20 мВ. (Распределение времен жизни в открытом состоянии.)
Слайд 76Са2+-каналы R-типа и T-типа
На рисунке 1-70 А1 в качестве примера показана оригинальная
Са2+-каналы R-типа и T-типа
На рисунке 1-70 А1 в качестве примера показана оригинальная

На рисунке 1-70 Б1 в качестве примера показаны оригинальная регистрация тока одиночного канала CaV3.2, зарегистрированного в cell-attached patch, распределение амплитуд тока (рис. 1-70 Б2), активация (правая кривая) и инактивация (левая кривая) тока (рис. 1-70 Б3), гистограмма распределения времен жизни открытого состояния канала
(рис. 1-70 Б4).
Слайд 77Рис. 1-70. Биофизические свойства Сау2.3-канала и Сау3.2-канала.
А - биофизические свойства CaV2.3-канала с
Рис. 1-70. Биофизические свойства Сау2.3-канала и Сау3.2-канала.
А - биофизические свойства CaV2.3-канала с
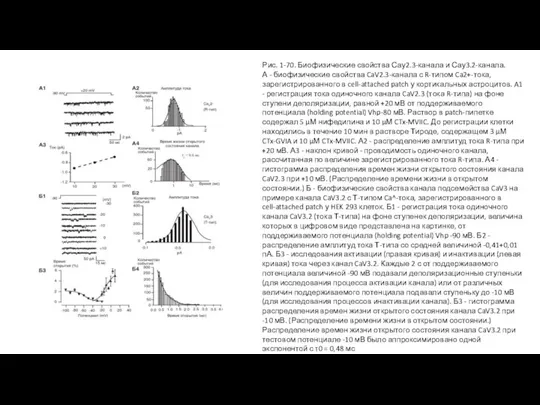
Слайд 78Блокаторы и активаторы Са2+-каналов
Фармакология трех семейств кальциевых каналов хорошо изучена. Каналы СаV1
Блокаторы и активаторы Са2+-каналов
Фармакология трех семейств кальциевых каналов хорошо изучена. Каналы СаV1

Фенилалкиламины представляют собой блокаторы внутриклеточного участка поры. Полагают, что эти вещества входят в пору из цитоплазматических участков канала и осуществляют блокаду. Их рецепторные участки образованы аминокислотными остатками в S6-сегментах в домене III и IV по аналогии с рецепторным участком для анестетиков у Na+-каналов.
Дигидропиридины могут быть активаторами или ингибиторами Са2+-каналов и полагают, что они действуют аллостерически, сдвигая моду функционирования канала в направлении открытого или закрытого состояния, скорее, чем закупоривая пору. Их рецепторный участок включает аминокислотные остатки в S6-сегментах в домене III и IV и S5-сегменте домена III. Места связывания дигидропиридинов и фенилалкиламов связаны и частично перекрываются.
Бензодиазепины, представляющие собой группу синтетических веществ (один из которых дилтиазем), связываются с рецепторным участком, который перекрывается с местом связывания фенилалкиламинов.
Семья СаV2 Са2+-каналов относительно нечувствительна к дигидропиридиновым блокаторам Са2+-каналов, но эти Са2+-каналы специфически блокируются пептидными токсинами пауков и морских улиток. СаV2.1-каналы блокируются специфически ω-агатоксин IVA яда из паутины паука. СаV2.2-каналы блокируются специфически ω-конотоксином GVIA и сопоставимы с токсинами улиток. СаV2.3-каналы блокируются специфически пептидным токсином SNX-482, выделенным из яда тарантулов. Эти пептидные токсины могут быть потенциальными блокаторами синаптической передачи, потому что их специфические эффекты реализуются через СаV2 семью Са2+-каналов.
Семья СаV,3 Са2+-каналов нечувствительна к обоим дигидропиридинам, блокирующим СаV1-каналы, и токсину паука или токсину конусной улитки, блокирующим СаV2. Специфические блокаторы СаV3-каналов пока не найдены. Органический блокатор Ca2+-каналов мибефрадил в какой то степени специфичен для СаV3 по сравнению с СаV1 Ca2+-токов (в три-пять раз). Пептид куртоксин ингибирует активационные ворота СаV3.1- и СаV3.2-каналов. Развитие более специфических и высокоафинных блокаторов СаV3 семьи Ca2+-каналов должно быть полезным для более детального анализа физиологической роли этих каналов.
Слайд 79Рис. 1-71. Фармакологические соединения, мишенью которых служат Са2+-каналы
Рис. 1-71. Фармакологические соединения, мишенью которых служат Са2+-каналы
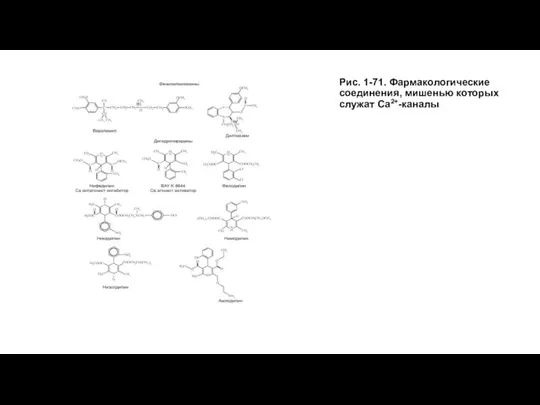
Слайд 80Изменение Са2+-токов под действием Са2+ агонистов и антагонистов
На рисунке 1-72 продемонстрированы примеры
Изменение Са2+-токов под действием Са2+ агонистов и антагонистов
На рисунке 1-72 продемонстрированы примеры

Панель Ж демонстрирует регистрацию одиночного Ca2+-канала L-типа в контрольных условиях, а панель З показывает характер изменений того же канала при добавлении 5 μΜ BAY K8644.
Слайд 81Рис. 1-72. Примеры действия фармакологических препаратов на типичный whole-cell Са2+-ток (1Са,L), зарегистрированный от изолированного
Рис. 1-72. Примеры действия фармакологических препаратов на типичный whole-cell Са2+-ток (1Са,L), зарегистрированный от изолированного

Слайд 82Модель Ca2+-поры
Модели двухмерной топографической карты поры с использованием предполагаемых «холмов» и «ям»
Модель Ca2+-поры
Модели двухмерной топографической карты поры с использованием предполагаемых «холмов» и «ям»

Если бы был только один такой участок в поре (рис. 1-73 А1), то ион, проходящий эту пору, должен был бы преодолеть энергетический барьер в 22 kT, что соответствует скорости потока ионов через Са2+-каналы меньше чем 2000 ионов в секунду, т.е. приблизительно в 1000 раз меньше, чем величины регистрируемых пикоамперных токов. Это показывает, что селективность не может быть обеспечена тем, что пора становится «липкой» для специфического иона, потому что в этом случае ион перемещается через пору слишком медленно.
Теория скоростей реакции предлагает два независимых пути для обеспечения высокого потока ионов через «липкую» пору, но оба требуют, чтобы пора могла удерживать больше одного иона Ca2+ одновременно. На рисунке 1-73 А2 продемонстрирован механизм, используемый двумя идентичными участками высокоафинного связывания. Один ион Ca2+ перебрасывается назад и вперед между ними с небольшим шансом для выхода. Поскольку в такой модели ионы не могут ни перепрыгнуть друг друга, ни войти в занятый участок связывания, один ион Ca2+ преграждает вход ионам другого сорта. Но можно предположить, что, когда два иона Ca2+ находятся в поре, они взаимодействуют, чтобы уменьшить афинность мест связывания для Ca2+. Эти более мелкие «колодцы» (стрелка 2) допускают больший поток ионов. Однако в поре обнаружен так называемый EEEE-локус, и только он может быть высокоафинным участком связывания, что противоречит представлениям о двух идентичных связывающих участках. Наличие EEEE- локуса опровергает детали модели, представленной на данном рисунке, но не ее основной принцип. Предполагается, что существуют еще два боковых низкоафинных участка с каждой стороны. Это привело к созданию модели, представленной далее (рис. 1-73 А3), на которой мелкие «колодцы» тесно примыкают с каждой стороны к одному глубокому «колодцу». В такой модели у ионов нет возможности взаимодействовать, поэтому при мультиионной оккупации поры энергетические колодцы и барьеры не изменяются. Но простое присутствие низко-афинных примыкающих участков означает, что ограничивающий скорость барьер для выхода (стрелка 2) имеет примерно такие же размеры, как в модели, где ионы имеют возможность взаимодействовать. Серия участков с уменьшающейся афинностью ускоряет поток ионов через химические потенциальные энергетические барьеры.
Пора имеет форму песочных часов (рис. 1-73 Б). Диаметр селективного фильтра равен 5,6 А, т.е. почти в 3 раза шире, чем диаметр иона Ca2+, поэтому селективность нельзя объяснить тесным совпадением диаметра иона и диаметра отверстия, что лежит в основе механизма селективности К+-каналов. Важно положение зарядов (квадратики) четырех глутаматов EEEE-локуса.
Слайд 83Рис. 1-73. Модели Са2+-канала, объясняющие его проницаемость и структуру поры.
А - теория
Рис. 1-73. Модели Са2+-канала, объясняющие его проницаемость и структуру поры.
А - теория

Стрелка 1 соответствует энергии, которая определяет Ca2+-блок для ионов другого сорта.
Стрелка 2 указывает самый высокий прыжок энергии в каждой модели, который ограничивает скорость выхода иона Ca2+ из поры.
Поток очень низок в поре с одним участком, потому что существует высокоэнергетический барьер для выхода (1); мультиионные поры представляют два различных механизма для уменьшения энергетического барьера, лимитирующего скорость потока;
(2) взаимодействия иона c ионом (ion interaction) и
(3) лестница шагов - «ступени» потенциальной энергии (stairsteps), - созданная низкоафинными участками связывания, и примыкающий селективный участок.
Б - поперечный разрез поры. Показаны узкий и короткий селективный фильтр около внешней стороны и широкая область в центре мембраны
Слайд 84К+-токи и каналы
Калиевые каналы представляют собой наиболее обширное семейство ионных каналов (К+-каналов),
К+-токи и каналы
Калиевые каналы представляют собой наиболее обширное семейство ионных каналов (К+-каналов),

Обсудим некоторые данные, характеризующие работу абстрактных К+-каналов. На рисунке 1-74 В представлена вольтамперная кривая K+-каналов, рассчитанная при помощи уравнения Гольдмана- Ходжкина-Катца. Сплошная кривая отражает K+- ток, предсказанный на основании уравнения с допущением, что мембрана хорошо проницаема для ионов K+, причем [K+]in равна 155 мМ, а [K+]out равна 4,5 мМ. Величина -95 мВ - потенциал реверсии (reversal potential: Vrev), потому что при этом потенциале направление тока меняет значение, а в самой точке, равной -95 мВ, ток равен нулю. В физике направление тока всегда такое же, как и направление перемещения положительных зарядов. Ток ионов, текущий в клетку, будет, таким образом, называться inward current, а ток ионов, текущий из клетки, - всегда outward. Пунктирная линия демонстрирует ток, который можно ожидать, если [K+]in равна [K+]out и соответствует 155 мМ.
Наконец на рис. 1-74 Г показана регистрация одиночного канала К+-канала.
Традиционно K+-токи и соответственно K+-каналы вследствие их функции были описаны и классифицированы главным образом в возбудимых клетках. Они включали классические:
• K+-каналы задержанного выпрямления (delayed outward rectifier K+-channels (currents) - IK);
• быстрые транзиторные K+-каналы выходящего тока (fast transient K+-channels (currents) - IA, или transient outward current - Ito);
• K+-каналы аномального выпрямления с током входящего направления (inward rectifier K+- channels - IK1);
• Ca2+-активируемые K+-каналы (Ca2+ dependent K+-channels - KCa);
• каналы, через которые проходит ток утечки (leak currents), определяемый преимущественно ионами K+.
Чуть больше десятилетия назад была принята первая стандартная номенклатура для генов шести трансмембранных сегментов потенциалуправляемых K+каналов, названных KV-системой. В нее прежде всего вошли:
• K+-каналы задержанного выпрямления (delayed outward rectifier K+-channels - IK);
• быстрые транзиторные K+-каналы выходящего тока (fast transient K+-channels (currents) - IA, или transient outward current - It0).
Эта номенклатура была основана на выведенных филогенетических связях. Каналы, в составе которых обнаружено более 65% идентичных аминокислотных остатков, были объединены в одно подсемейство. В отдельную группу были выделены K+-каналы аномального выпрямления с током входящего направления (inward rectifier K+-channels), которая была названа Kir.
Таким образом, принятая в настоящее время классификация делит K+-каналы на:
• потенциалуправляемые К+-каналы (KV), которые включают:
- K+-каналы задержанного выпрямления (delayed outward rectifier K+-channels - IK);
- быстрые транзиторные ^-каналы выходящего тока (fast transient K+-channels (currents) - IA, или transient outward current - Ito);
• K+-каналы аномального выпрямления с током входящего направления (inward rectifier K+-channels - Kir);
• Ca2+-активируемые K+-каналы (KCa);
• K+-каналы с двумя петлями в домене (two-P K+-channels - К2Р).
Слайд 85Рис. 1-74. Примеры оригинальной регистрации whole-cell К+-тока, вольтамперной характеристики whole-cell К+-тока и активности одиночного канала
Рис. 1-74. Примеры оригинальной регистрации whole-cell К+-тока, вольтамперной характеристики whole-cell К+-тока и активности одиночного канала
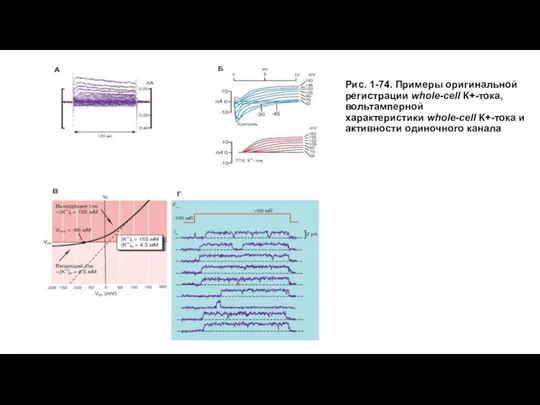
Слайд 86Характеристики К+-токов
Разлагая на компоненты ионные токи можно вычленить входящий Na+-ток и выходящий
Характеристики К+-токов
Разлагая на компоненты ионные токи можно вычленить входящий Na+-ток и выходящий

На рис. 1-75 А линия обозначает вольт-амперную зависимость идеализированного открытого калиевого канала. Т.к. мы исходим из начальной предпосылки, что канал в нашем случае будет полностью открыт все время (т.е. что проводимость каналов не будет функцией напряжения) тогда ток, текущий через них, будет линейным или «омическим».
На рис. 1-75 Б представлена кривая, которая показывает вероятность того, что калиевый канал будет находиться в открытом состоянии (вероятность открытия калиевого канала). Уравнение, приведенное во вставке в рисунок, описывает приведенную кривую, если мы вставим значения zK = 5,3 и V0.5 = - 30 mV.
На рис. 1-75 В представлен отдельно макроскопический калиевый ток.
На рис. 1-75 Г представлена оценка макроскопического калиевого тока посредством умножения одноканальных токов из секции А рисунка на вероятность их открытия Ро из секции Б и на количество каналов (N). В данном случае мы устанавливаем количества каналов в 100 калиевых.
Слайд 87Рис. 1-75. Общая характеристика потенциалуправляемых K+-каналов и K+-токов. Описание в тексте
Рис. 1-75. Общая характеристика потенциалуправляемых K+-каналов и K+-токов. Описание в тексте
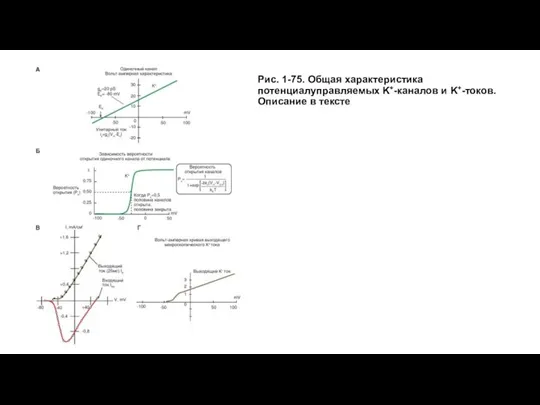
Слайд 88К+-каналы задержанного выпрямления
Обсудим некоторые данные, характеризующие работу первого типа потенциалуправляемых К+-каналов -
К+-каналы задержанного выпрямления
Обсудим некоторые данные, характеризующие работу первого типа потенциалуправляемых К+-каналов -

Транзиторные К+-каналы
Данные, характеризующие работу второго типа К+-каналов, - быстрых транзиторных K+-каналов выходящего тока (fast transient K+-channels (currents) - IA, или transient outward current - It0) представлены на рис. 1-76 Г. Показаны результаты экспериментов, позволяющие построить кривую активации этого тока и его инактивации.
Слайд 89Рис. 1-76. Потенциалуправляемые К+-каналы (KV), относящиеся к типу К+-каналов задержанного выпрямления (delayed outward
Рис. 1-76. Потенциалуправляемые К+-каналы (KV), относящиеся к типу К+-каналов задержанного выпрямления (delayed outward
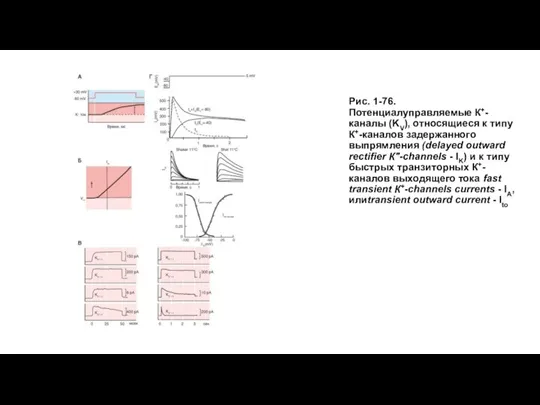
Слайд 90Кir-каналы
Класс трансмембранных белков с двумя сегментами включает 2S белки, образующие inward rectifiers channels (Kir),
Кir-каналы
Класс трансмембранных белков с двумя сегментами включает 2S белки, образующие inward rectifiers channels (Kir),
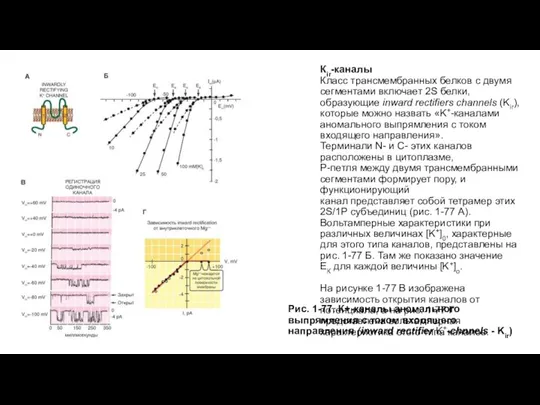
Терминали N- и C- этих каналов расположены в цитоплазме,
P-петля между двумя трансмембранными сегментами формирует пору, и функционирующий
канал представляет собой тетрамер этих 2S/1P субъединиц (рис. 1-77 А). Вольтамперные характеристики при различных величинах [K+]0, характерные для этого типа каналов, представлены на рис. 1-77 Б. Там же показано значение ЕК для каждой величины [K+]o.
На рисунке 1-77 В изображена зависимость открытия каналов от потенциала, а на рис. 1-77 Г представлена вольтамперная характеристика этого типа каналов.
Рис. 1-77. К+-каналы аномального выпрямления с током входящего направления (inward rectifier K+-chnnels - Kir)
Слайд 91Са2+-активируемые К+-каналы
Еще один тип К+-каналов - так называемые Са2+-активируемые К+-каналы. Примером такого
Са2+-активируемые К+-каналы
Еще один тип К+-каналов - так называемые Са2+-активируемые К+-каналы. Примером такого

или Slo1). Slo имеет 7S и кодирует высокопроводящий канал, Slo (0S-6S). В этом канале Р-область находится между SVI и SVII; функционирующий канал представляет собой тетрамер, но, в отличие от других каналов, Slo имеет N-терминаль, расположенную во внеклеточной среде (рис. 1-78 А).
Са2+-активируемые К+-каналы описаны достаточно давно и включают два подтипа. Одна из этих групп включает три KCa-канала с низкой проводимостью (KCa2.1, KCa2.2, и KCa2.3) и канал KCa3.1 с промежуточной проводимостью. Эти каналы непотенциалуправляемые и активируются низкими концентрациями внутриклеточного Ca2+ (<1,0 μΜ), в отличие от KCa1.1 (KCNMA1, Slo1), который активируется и потенциалом, и внутриклеточным Ca2+. Эти три KCa-канала с низкой проводимостью чувствительны к блокирующему действию апамина (100 пМ-10 нМ), что отличает их от всех других KCa-каналов. И KCa-каналы с низкой проводимостью, и каналы с промежуточной проводимостью играют важную роль во многих процессах, включающих Са2+-зависимый сигналлинг в электровозбудимых и электроневозбудимых клетках. Они не связывают свободные ионы Ca2+ непосредственно, а скорее, обнаруживают Ca2+ через кальмодулин, который постоянно связан с C-терминальным регионом. Связывание кальция с таким кальмодулином приводит к конформационным изменениям, ответственным за воротный механизм канала.
Вторая группа KCa-каналов включает KCа1.1 (Slo или Slo1), KCa4.1 (Slack или Slo2.2), KCa4.2 (Slick или Slo2.1) и KCa5.1 (Slo3). Каналы KCa1.1 изучали в клетках мозга, улитки и мышцах, и известно, что варианты альтернативного сплайсинга их мРНК ответственны за их значительные функциональные различия. В отличие от KCa2 и каналов, связывание ионов Са2+ каналом KCа1.1 не зависит от его ассоциации с кальмодулином, но полагают, что определяется, по крайней мере, тремя связывающими двухвалентные катионы участками в цитоплазматической карбоксильной области каждой субъединицы канала. Два независимых высоко чувствительных Ca2+-связывающих участка, названных «calcium bowl», сформированы отрицательно заряженными сегментами в дистальной карбоксильной терминали белка и внутри первой RCK области (RCK: Regulator of Conductance for K+), кодирующей проксимальную C-терминаль белка. Третий низкоафинный связывающий двухвалентные катионы участок также найден в первой RCK области.
Хотя три других члена этой группы, KCa4.1, 4.2, и 5.2, были включены в KCa-спецификацию, так как все они являются членами этой структурно связанной группы генов, но в отличие от KCa1.1 активирующихся внутриклеточным Ca2+, ни один из вышеупомянутых каналов, повидимому, не может быть им активирован. Эти три нечувствительные к внутриклеточному Ca2+ канала активируются иначе. KCa4.2 и KCa4.1 активируются внутриклеточными ионами Na+ и Cl-, а KCa5.1 - внутриклеточным защелачиванием (сдвигом рН в щелочную сторону).
На рисунке 1-78 Б показаны токи через одиночные Са2+-активируемые К+-каналы, Вероятность открытия каналов значительно повышается с увеличением концентрации Са2+. На рис. 1-78 В показана зависимость вероятности открытия канала от потенциала на фоне различной концентрации Са2+.
Слайд 92Рис. 1-78. Са2+-активируемые K+-каналы (KCa)
Рис. 1-78. Са2+-активируемые K+-каналы (KCa)
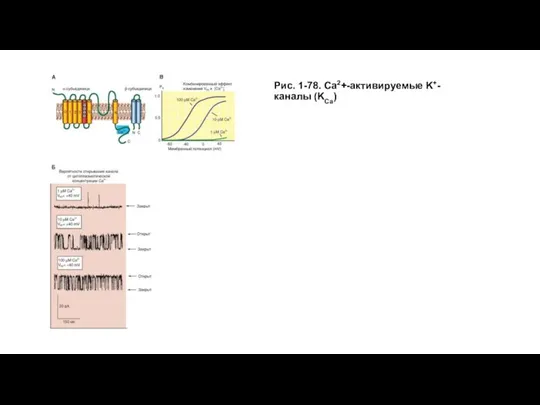
Слайд 93Канал утечки - K2P
Каналы утечки представляют собой особую группу ионных каналов. Это
Канал утечки - K2P
Каналы утечки представляют собой особую группу ионных каналов. Это

На рисунке 1-79 Б представлена классификация K2P-каналов, причем часть из них, отмеченная на рисунке, проявляет механосенситивность. Наконец, на рис. 1-79 В показаны типичные вольтамперные характеристики, имеющие выпрямление. На нем представлено изменение вольтамперных характеристик в зависимости от величины рН для канала TASK-1, принадлежащего семье K2P-каналов.
Слайд 94Рис. 1-79. К+-каналы с двумя петлями в домене (two-P K+-channels - К2Р)
Рис. 1-79. К+-каналы с двумя петлями в домене (two-P K+-channels - К2Р)
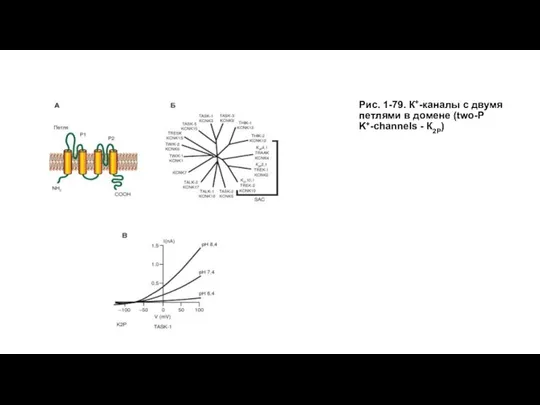
Слайд 95Потенциалы действия и токи, их формирующие
Рис. 1-80. Связь одиночного потенциала действия с
Потенциалы действия и токи, их формирующие
Рис. 1-80. Связь одиночного потенциала действия с

А - связь одиночного потенциала действия (А1) нервной клетки с ионными токами (А2).
А1 - потенциал действия. Прямыми линиями помечены равновесный натриевый и калиевый потенциалы.
А2 - две компоненты ионных токов, показанные через проводимость: входящий Na+-ток, осуществляемый через потенциалуправляемые Na+-каналы, и выходящий К+-ток, осуществляемый через потенциалуправляемые К+-каналы. На уровне критического потенциала наблюдается активация входящего Na+-тока, который инактивируется, когда мембранный потенциал достигнет положительных значений. Инактивация входящего Na+-тока происходит одновременно с активацией выходящего К+-тока. После достижения мембранного потенциала уровня потенциала покоя выходящий К+-ток инактивируется.
Б - связь потенциала действия и самопроизвольного смещения мембранного потенциала до уровня критического потенциала с некоторыми ионными токами у нервной клетки с самопроизвольной ритмической активностью.
Б1 - потенциал действия клетки с регулярной ритмической активностью.
Б2 - компоненты ионных токов, формирующих этот потенциал действия. Показаны входящий Na+-ток (INa), создающий фазу деполяризации потенциала действия, выходящий К+-ток (IK), формирующий фазу реполяризации потенциала действия и быстрый временный выходящий К+-ток (Ito). Потенциал мембраны такой клетки определяется активностью 6 токов, которые были обнаружены у клеток с ритмической активностью. Во-первых, это, разумеется, ток, генерируемый электрогенным Na+, К+-насосом мембраны, и выходящий К+-ток утечки, создающие мембранный потенциал покоя. Кроме того, это входящий Na+-ток (или в отдельных случаях входящий - Са2+-ток), формирующий фазу деполяризации потенциала действия, и так называемый выходящий К+-ток (IK), формирующий фазу реполяризации потенциала действия. Наконец, это два типа ионных токов, смещающих мембранный потенциал до уровня критического потенциала в период между потенциалами действия. Первый тип - это сильный входящий Na+-ток, текущий по другим каналам, нежели вышеописанные и формирующие фазу деполяризации потенциала действия. Именно этот ионный ток смещает мембранный потенциал в сторону деполяризации к критическому потенциалу. К другому типу относится быстрый транзиторный выходящий К+-ток (fast transient K+-current - IA, или transient outward current - Ito), инактивация которого устраняется следовой гиперполяризацией и который активируется в промежутке между двумя потенциалами действия в подпороговой области мембранного потенциала. Кроме этих шести описанных ионных токов существуют еще два: медленный Na+-ток и медленный К+-ток. Эти медленные токи приводят к самоподдерживающимся осцилляциям мембранного потенциала, лежащим в основе периодических пачечных разрядов нейронов.
Слайд 96 В - связь потенциала действия клетки рабочего миокарда с ионными токами.
В - связь потенциала действия клетки рабочего миокарда с ионными токами.
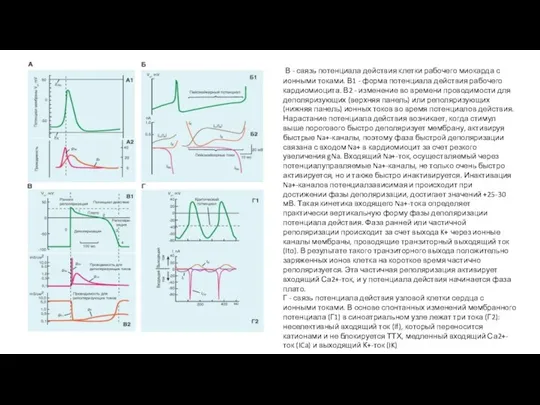
Г - связь потенциала действия узловой клетки сердца с ионными токами. В основе спонтанных изменений мембранного потенциала (Г1) в синоатриальном узле лежат три тока (Г2): неселективный входящий ток (If), который переносится катионами и не блокируется ТТХ, медленный входящий Са2+-ток (ICa) и выходящий К+-ток (IK)
Слайд 97Механосенситивные потенциалы
На рисунке 1-81 А показана непрерывная регистрация биоэлектрической активности изолированного кардиомиоцита
Механосенситивные потенциалы
На рисунке 1-81 А показана непрерывная регистрация биоэлектрической активности изолированного кардиомиоцита

В нормальном растворе Тироде с использованием patch-clamp в конфигурации whole-cell изолированные кардиомиоциты здорового желудочка морской свинки отвечают на растяжение изменением величины потенциала покоя и длительности потенциала действия. Показано, что растяжение на 2 и 4 μm не меняет величину потенциала покоя и форму потенциала действия кардиомиоцитов. Растяжение на 6 μm деполяризует покоящуюся мембрану в среднем на 3 мВ (рис. 1-81 Б1), а растяжение на 8 μm деполяризует в среднем на 6 mV (рис. 1-81 Б2). Растяжение на 8 μм удлиняют средние значения APD90 (Action potential duration - длительность амплитуды потенциала действия на уровне 90% фазы реполяризации) от 360 до 502 мс. Кроме того, растяжение на 8 μm и далее на 10 μm запускает экстрапотенциалы действия, начинающиеся от диастолической деполяризации.
Далее представлена (рис. 1-81 В) динамика развития одного экстрапотенциала действия в правом предсердии крысы, перенесшей инфаркт миокарда, при увеличении степени растяжения
(1-5)препарата. Второй потенциал возникает при достижении SID (stretch-induced depolarization - механоиндуцированная деполяризация) критического уровня деполяризации (Ec = -66,6 мВ).
Механоиндуцированные экстрасистолы и фибрилляция связаны с развитием SID, которая появляется на уровне APD90. Показано, что растяжение ткани прямо вызывает аритмию. SID, возникающая на уровне APD90, соответствует поздней фазе реполяризации, когда инактивация потенциалуправляемых Na+-каналов уже исчезла. Относительно большие различия между мембранным потенциалом, принадлежащим APD90, и равновесным потенциалом для механосенситивных токов, могут способствовать генерации развития эффективной движущей силы для токов, входящих через МСК и соответственно способствовать развитию SID. SID на уровне APD90 может деполяризовать мембрану до порога вследствие активации быстрых Na+-токов и приводить к генерации дополнительных потенциалов действия. Снятие растяжения ткани полностью устраняло эти механоиндуцированные изменения потенциала действия.
На рисунке 1-81 Д также представлена динамика развития одного экстрапотенциала действия кардиомиоцита правого предсердия крысы, перенесшей инфаркт миокарда, при увеличении степени растяжения (1-5) препарата. Второй потенциал возникает после окончания периода абсолютной рефрактерности клетки при достижении в этот период SID критического уровня деполяризации (Ec = -67,7 мВ).
Слайд 98Рис. 1-81. Индуцированные механическим растяжением клетки потенциалы кардиомиоцитов.
А - влияние растяжения изолированного
Рис. 1-81. Индуцированные механическим растяжением клетки потенциалы кардиомиоцитов.
А - влияние растяжения изолированного
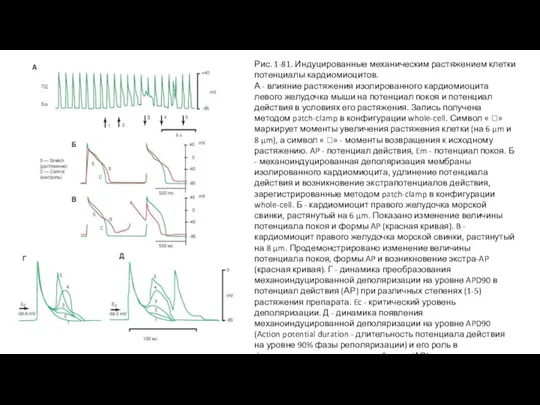
Слайд 99Механосенситивные токи
На рисунке 1-82 А показаны оригинальные кривые, полученные методом patch-clamp в
Механосенситивные токи
На рисунке 1-82 А показаны оригинальные кривые, полученные методом patch-clamp в

Далее (рис. 1-82 Б) представлен типичный пример изменения вольт-амперной кривой кардиомиоцита человека до растяжения (фиолетовые треугольники, объединенные кривой) и при его растяжении (красные треугольники, объединенные кривой). Смещение кривой в области отрицательных потенциалов свидетельствует о наличии входящего ионного тока через МСК.
На рис. 1-82 В показаны SAC клеток сердца, которые активируют его приложением давления в patch-пипетку, находящуюся в конфигурации cell-attached.
 Красная книга. Тамбовская область
Красная книга. Тамбовская область Надкласс Рыбы
Надкласс Рыбы ОГЭ биология
ОГЭ биология Антропогенез. Стадии антропогенеза
Антропогенез. Стадии антропогенеза Происхождение жизни на Земле
Происхождение жизни на Земле Презентация на тему "Класс Двустворчатые моллюски" - презентации по Биологии
Презентация на тему "Класс Двустворчатые моллюски" - презентации по Биологии Мышечная и нервная ткань животных. 5 класс
Мышечная и нервная ткань животных. 5 класс Строение стебля
Строение стебля Удивительные пауки
Удивительные пауки Норма реакции – предел изменения признака под влиянием условий среды. Часть 4-2
Норма реакции – предел изменения признака под влиянием условий среды. Часть 4-2 Так что же такое клиническое исследование?
Так что же такое клиническое исследование? Виртуальная школа Кирилла и Мефодия
Виртуальная школа Кирилла и Мефодия Иммунитет и иммунная система
Иммунитет и иммунная система Угадайте профессию человека на картинке. Специализация рептилии
Угадайте профессию человека на картинке. Специализация рептилии Клебсиеллалар. Морфологиясы
Клебсиеллалар. Морфологиясы Насекомые
Насекомые Состав,строение и рост костей
Состав,строение и рост костей Биологическое ассорти
Биологическое ассорти Обмен веществ и энергии
Обмен веществ и энергии МБОУ СОШ №1 аула тахтамукай, республики адыгея Презентация к уроку английского языка по теме: «Внешность и части тела». Автор:
МБОУ СОШ №1 аула тахтамукай, республики адыгея Презентация к уроку английского языка по теме: «Внешность и части тела». Автор:  Звіробій. Ботанічні характеристики
Звіробій. Ботанічні характеристики Класс пресмыкающиеся, особенности строения
Класс пресмыкающиеся, особенности строения Многообразие цветковых растений
Многообразие цветковых растений Звери, птицы, насекомые
Звери, птицы, насекомые Основы лазерной сканирующей конфокальной микроскопии
Основы лазерной сканирующей конфокальной микроскопии Подключичная артерия
Подключичная артерия Систематика растений
Систематика растений Энергетический обмен (катаболизм, диссимиляция)
Энергетический обмен (катаболизм, диссимиляция)