Содержание
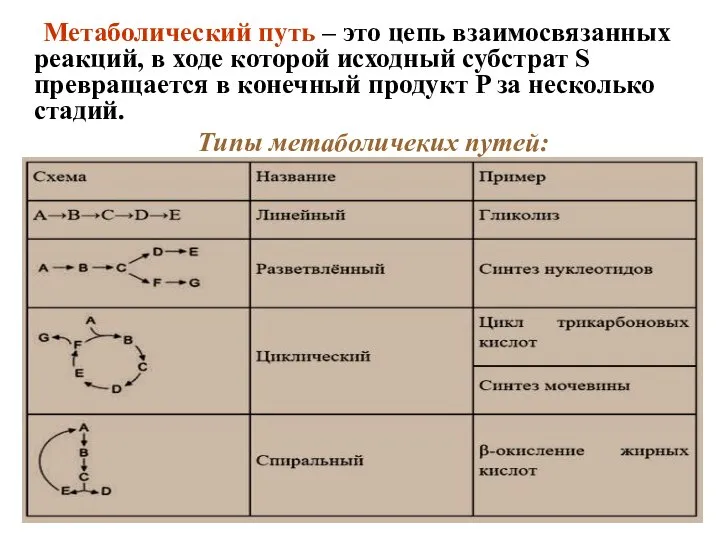
- 2. Метаболический путь – это цепь взаимосвязанных реакций, в ходе которой исходный субстрат S превращается в конечный
- 3. Регуляция скорости реакций метаболического пути осуществляется путем регуляции действия определенных ферментов, которые называются регуляторными (как правило,
- 4. Очень часто ингибитором регуляторного фермента является конечный продукт метаболического пути. Фермент, катализирующий превращение субстрата А в
- 5. Регуляция активности ферментов Основные способы регуляции активности ферментов: - аллостерическая регуляция; - регуляция с помощью белок-белковых
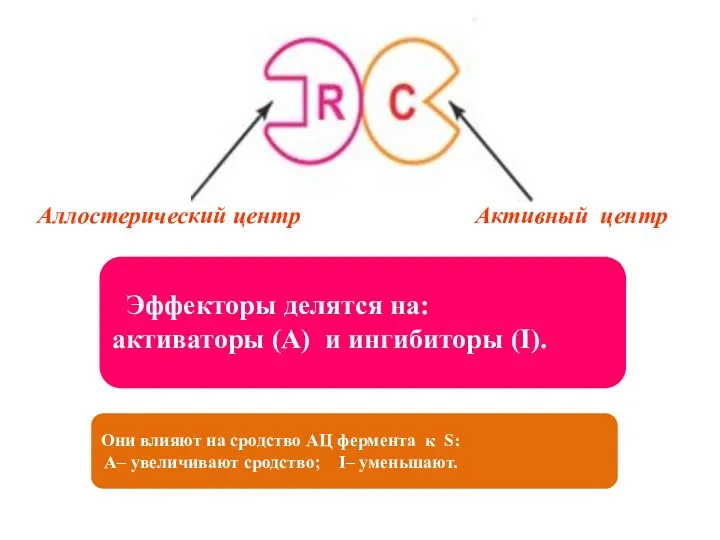
- 6. Аллостерическая регуляция Аллостерические ферменты: 1)Олигомерные белки, состоящие из 2-х или более субъединиц – регуляторной (R) и
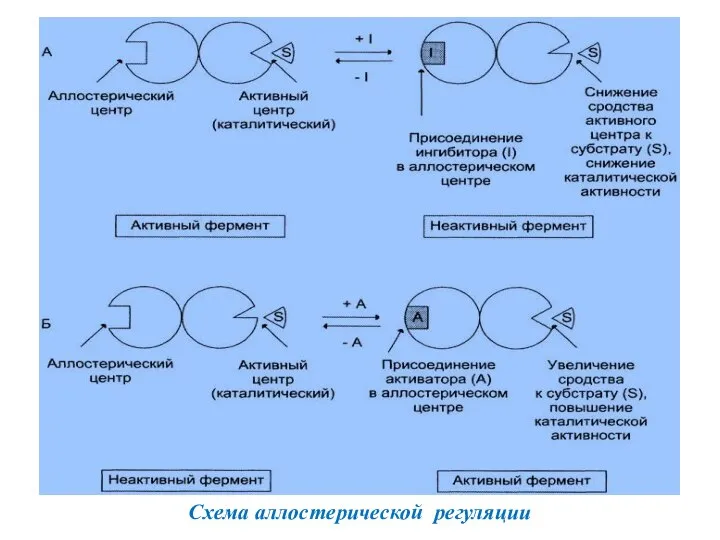
- 7. Аллостерический центр Активный центр Эффекторы делятся на: активаторы (A) и ингибиторы (I). Они влияют на сродство
- 8. Схема аллостерической регуляции
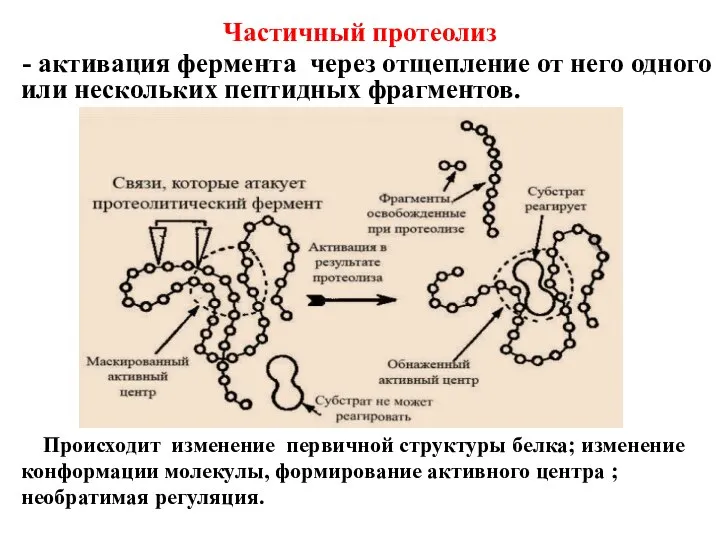
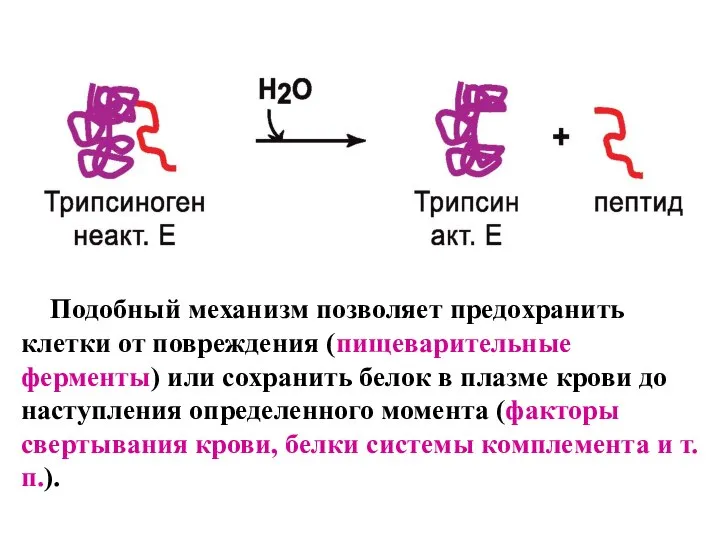
- 9. Частичный протеолиз - активация фермента через отщепление от него одного или нескольких пептидных фрагментов. Происходит изменение
- 10. Подобный механизм позволяет предохранить клетки от повреждения (пищеварительные ферменты) или сохранить белок в плазме крови до
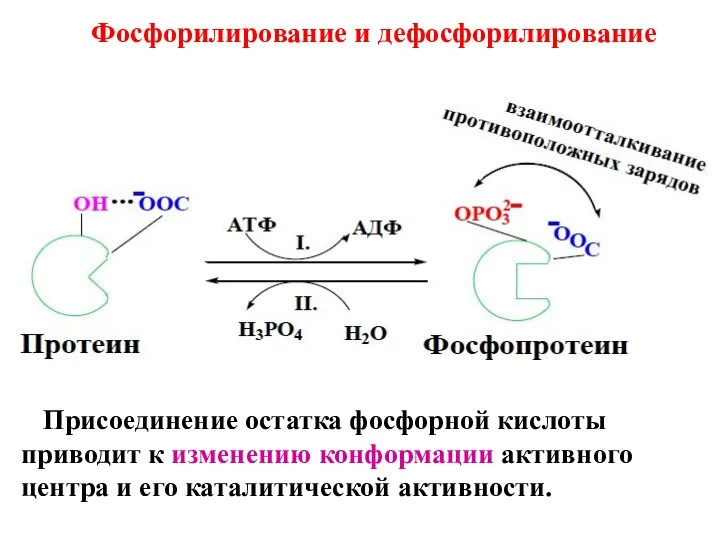
- 11. Фосфорилирование и дефосфорилирование Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической
- 12. I. Фосфорилирование – катализируют ферменты: протеинкиназы (A, C, G и др.); II. Дефосфорилирование – катализируют ферменты:
- 13. Белок-белковые взаимодействия Термин обозначает ситуацию, в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки.
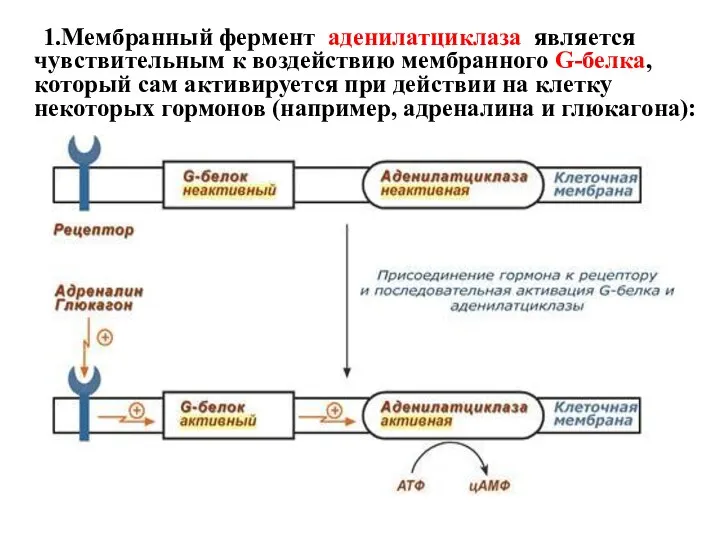
- 14. 1.Мембранный фермент аденилатциклаза является чувствительным к воздействию мембранного G-белка, который сам активируется при действии на клетку
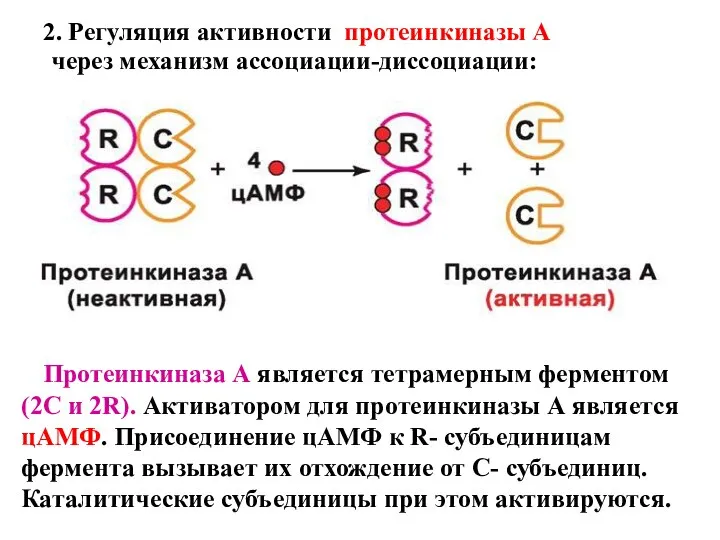
- 15. 2. Регуляция активности протеинкиназы А через механизм ассоциации-диссоциации: Протеинкиназа А является тетрамерным ферментом (2С и 2R).
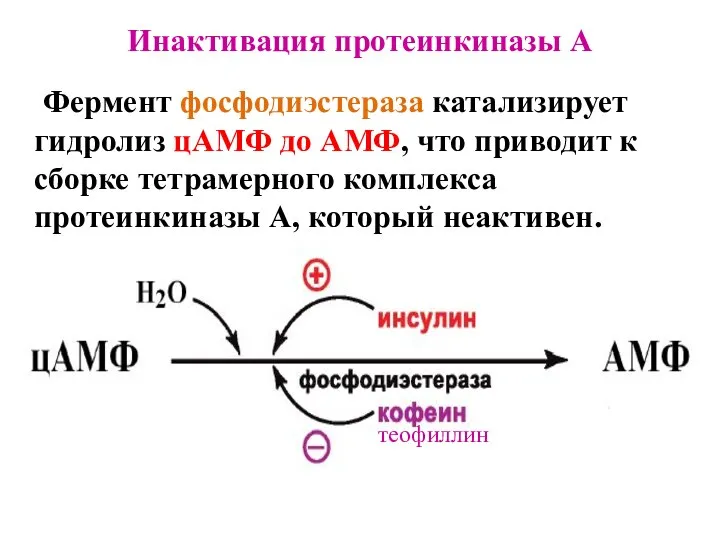
- 16. Инактивация протеинкиназы A Фермент фосфодиэстераза катализирует гидролиз цАМФ до АМФ, что приводит к сборке тетрамерного комплекса
- 17. Ингибиторы фосфодиэстеразы используются: а) при острой сердечной недостаточности как кардиотонические средства; б) для лечения бронхиальной астмы.
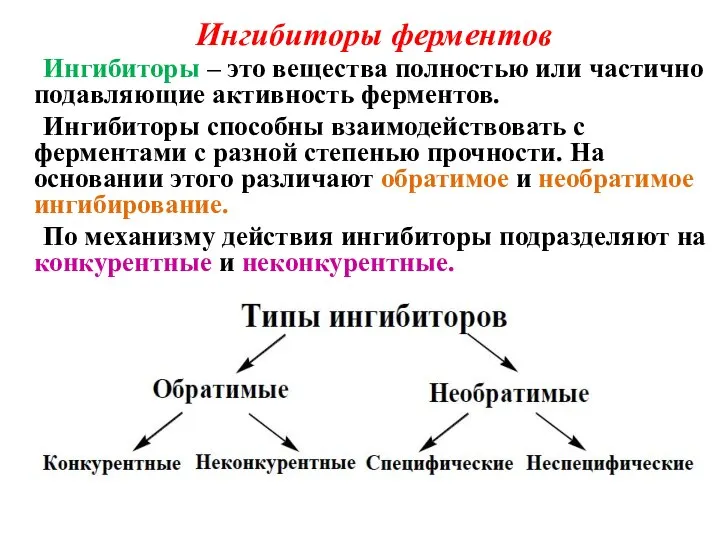
- 18. Ингибиторы ферментов Ингибиторы – это вещества полностью или частично подавляющие активность ферментов. Ингибиторы способны взаимодействовать с
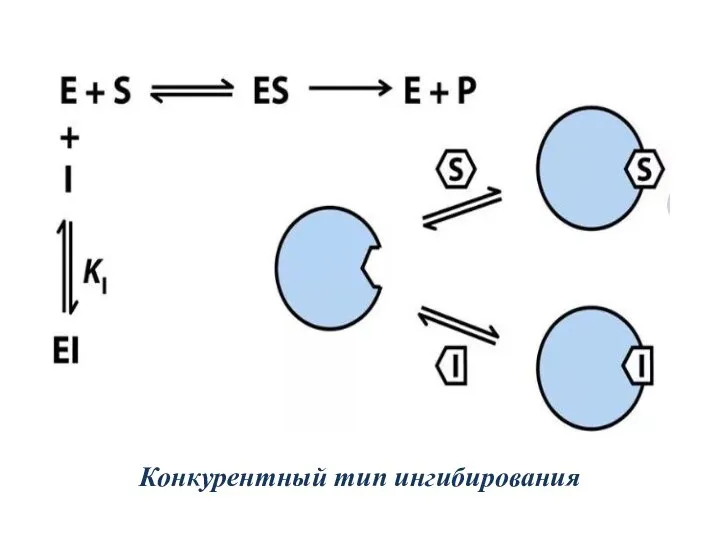
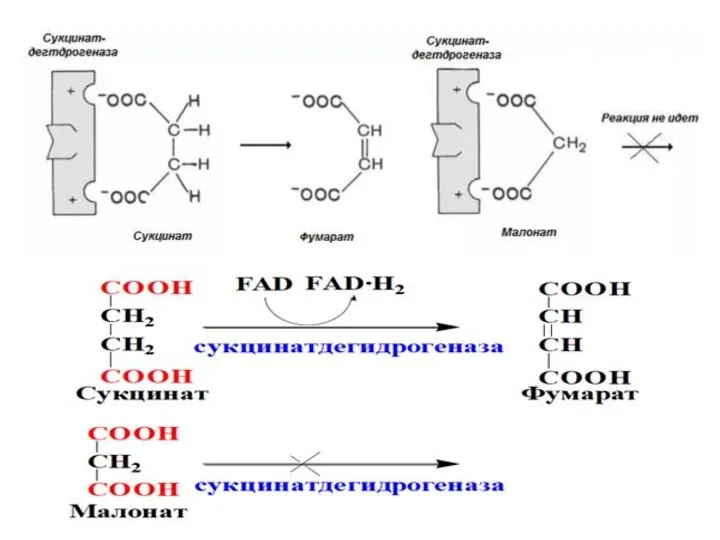
- 19. Обратимые ингибиторы присоединяются к ферменту слабыми связями и могут легко отделяться от фермента. Обратимые конкурентные ингибиторы:
- 20. Конкурентный тип ингибирования
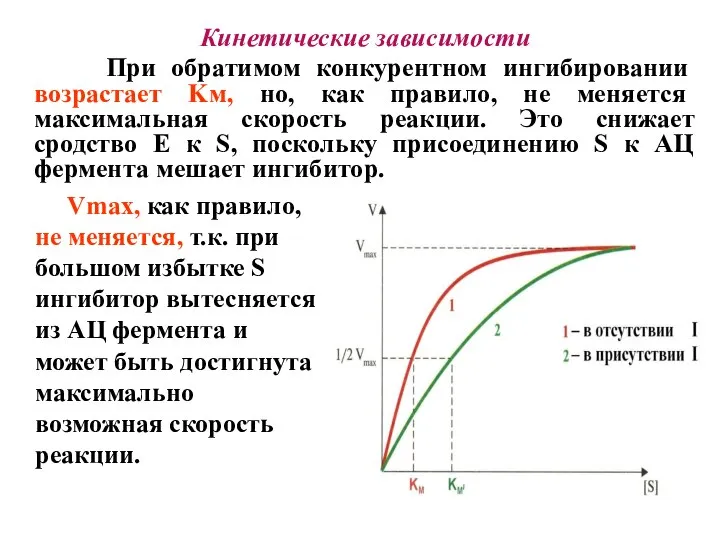
- 22. Кинетические зависимости При обратимом конкурентном ингибировании возрастает Kм, но, как правило, не меняется максимальная скорость реакции.
- 23. Лекарственные препараты как конкурентные ингибиторы Прозерин, эндрофоний, дистигмин, галантамин – ингибируют ацетилхолинэстеразу, фермент, разрушающий ацетилхолин, что
- 24. Обратимые неконкурентные ингибиторы: не являются структурными аналогами субстрата; не присоединяются к активному центру фермента; действуют на
- 25. Степень торможения активности фермента неконкурентными ингибиторами зависит от продолжительности их действия и их концентрации. При снижении
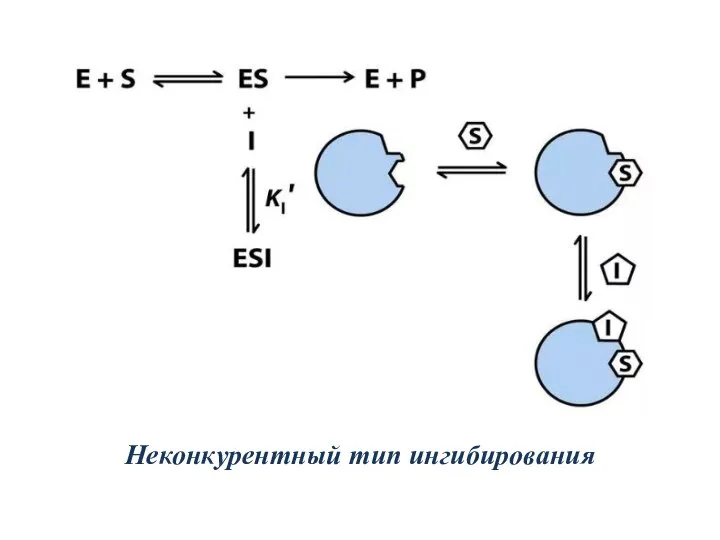
- 26. Неконкурентный тип ингибирования
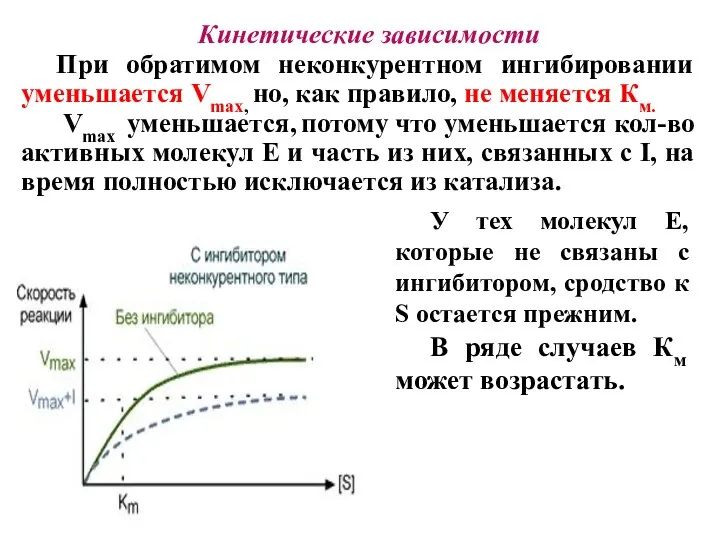
- 27. Кинетические зависимости При обратимом неконкурентном ингибировании уменьшается Vmax, но, как правило, не меняется Км. Vmax уменьшается,
- 28. Необратимые ингибиторы характеризуются тем, что связываются с молекулой фермента прочными ковалентными связями (чаще всего модификации подвергается
- 29. Необратимые специфические ингибиторы – присоединяются к строго определённой группе в области активного центра E, образуя с
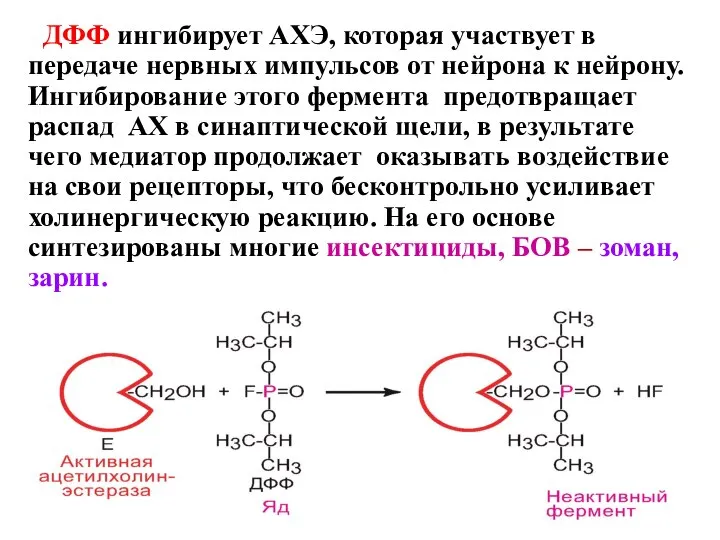
- 30. ДФФ ингибирует АХЭ, которая участвует в передаче нервных импульсов от нейрона к нейрону. Ингибирование этого фермента
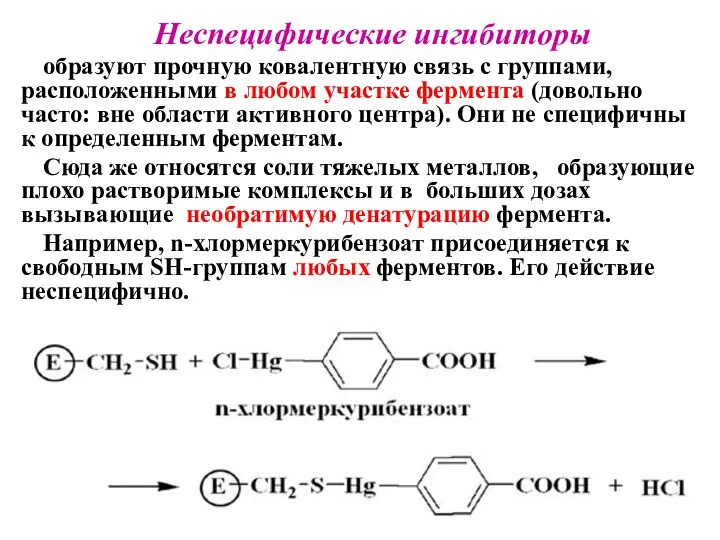
- 31. Неспецифические ингибиторы образуют прочную ковалентную связь с группами, расположенными в любом участке фермента (довольно часто: вне
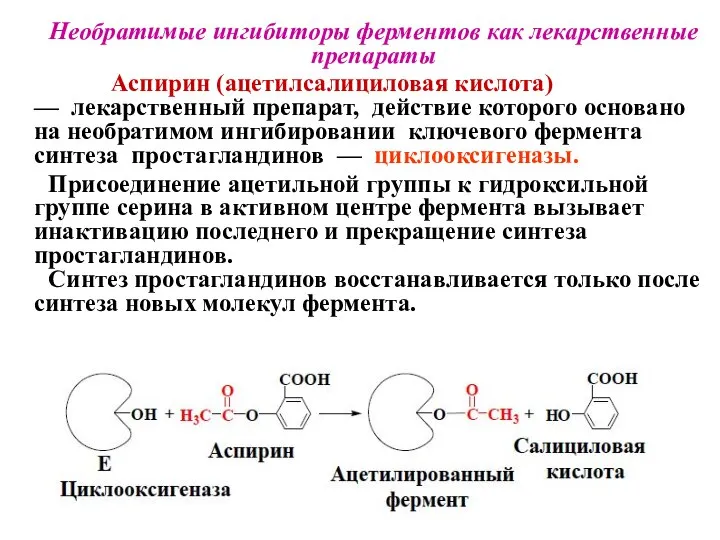
- 32. Необратимые ингибиторы ферментов как лекарственные препараты Аспирин (ацетилсалициловая кислота) — лекарственный препарат, действие которого основано на
- 33. Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий
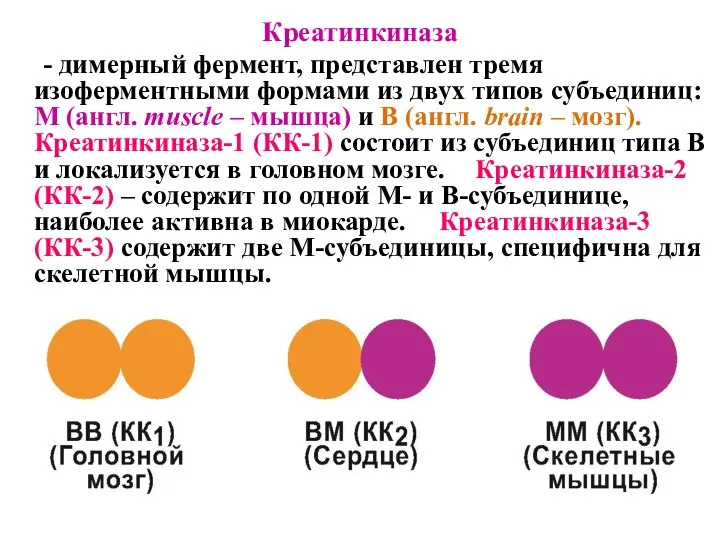
- 34. Креатинкиназа - димерный фермент, представлен тремя изоферментными формами из двух типов субъединиц: M (англ. muscle –
- 36. Скачать презентацию














 Дидактическая игра для дошкольников: Природа
Дидактическая игра для дошкольников: Природа Будова та функції кінцевого мозку
Будова та функції кінцевого мозку Основы вирусологии. Бактериофагия
Основы вирусологии. Бактериофагия «Здоровье и проблемы рационального и безопасного питания» «Здоровье и проблемы рационального и безопасного питания»
«Здоровье и проблемы рационального и безопасного питания» «Здоровье и проблемы рационального и безопасного питания» Группа веществ, не требующих особых методов изолирования. (Лекция 15)
Группа веществ, не требующих особых методов изолирования. (Лекция 15) Иммунитет. Нарушения иммунной системы человека. Вакцинация. 8 класс
Иммунитет. Нарушения иммунной системы человека. Вакцинация. 8 класс Сенсорная функция психики
Сенсорная функция психики Лабораторна робота №3. Вивчення мінливості у рослин. Побудова варіаційного ряду і варіаційної кривої
Лабораторна робота №3. Вивчення мінливості у рослин. Побудова варіаційного ряду і варіаційної кривої Схема нервной системы
Схема нервной системы Роль бактерий в природе и жизни человека
Роль бактерий в природе и жизни человека Как идет жизнь на Земле
Как идет жизнь на Земле Арахис культурный
Арахис культурный Стрессовые факторы окружающей среды
Стрессовые факторы окружающей среды Биосемантика: интерпретационные процессы в живых организмах
Биосемантика: интерпретационные процессы в живых организмах Эндокринная система
Эндокринная система Цветные секреты растений. Часть II
Цветные секреты растений. Часть II Взаимодействие генов
Взаимодействие генов Концевой мозг
Концевой мозг Розробка та аналіз біогазового комплексу, що використовує біомасу рослин
Розробка та аналіз біогазового комплексу, що використовує біомасу рослин Клещевой энцефалит
Клещевой энцефалит Презентация на тему ОТДЕЛ ПАПОРОТНИКОВИДНЫЕ
Презентация на тему ОТДЕЛ ПАПОРОТНИКОВИДНЫЕ  Миология. Мышцы плечевого пояса, плеча
Миология. Мышцы плечевого пояса, плеча Біологічні основи запліднення та розвитку організму
Біологічні основи запліднення та розвитку організму Природа человека
Природа человека Зимующие птицы
Зимующие птицы Подготовка к ГИА задания С. 9 класс
Подготовка к ГИА задания С. 9 класс Понятие о регенерации. Эволюция способности к регенерации у позвоночных. 10 класс
Понятие о регенерации. Эволюция способности к регенерации у позвоночных. 10 класс Секреты этологии. Основоположники этологии
Секреты этологии. Основоположники этологии