Слайд 2ФЕРМЕНТЫ – это биологические катализаторы белковой природы, ускоряющие все химические реакции, протекающие

в живом организме.
В организме ферменты синтезируются в активной форме и в неактивной форме.
Неактивная форма – профермент.
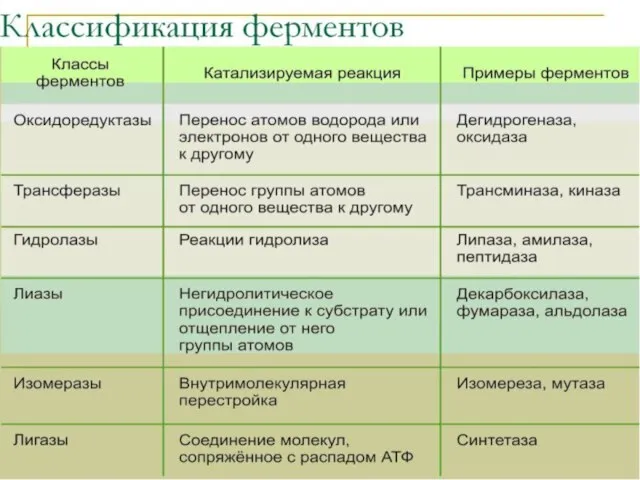
Слайд 6Классификация фермента (шифр)

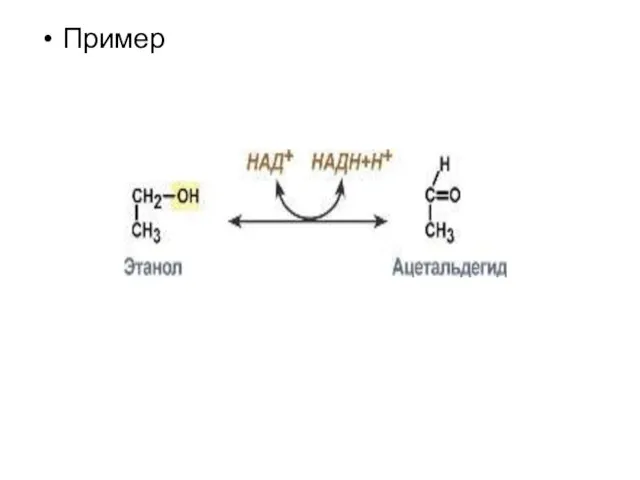
Слайд 9Оксидоредуктазы
Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса.

Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
На подподклассы деление происходит в зависимости от акцептора протонов и электронов
Слайд 11Трансферазы
Коферментами являются пиридоксальфосфат, коэнзим А, тетрагидрофолиевая кислота, метилкобаламин. Класс подразделяется на 9 подклассов в зависимости от
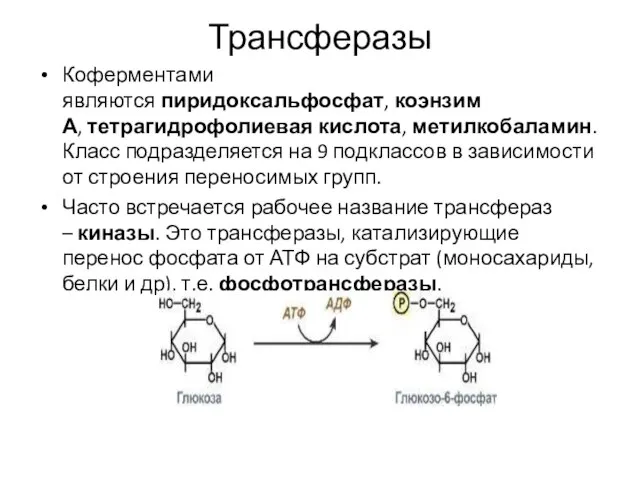
строения переносимых групп.
Часто встречается рабочее название трансфераз – киназы. Это трансферазы, катализирующие перенос фосфата от АТФ на субстрат (моносахариды, белки и др), т.е. фосфотрансферазы.
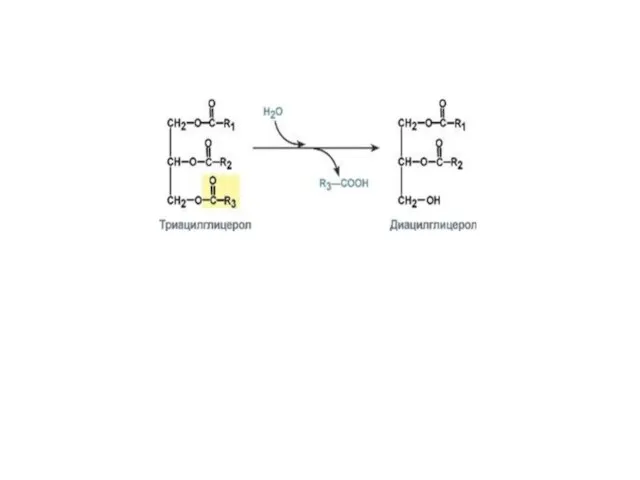
Слайд 13Гидролазы
Гидролазы – ферменты, осуществляющие разрыв внутримолекулярных связей в субстрате путем присоединения элементов

Н2О, подразделяются на 13 подклассов. Сохранены тривиальные названия, например, пепсин, трипсин. Коферменты отсутствуют.
Гидролазы широко представлены ферментами желудочно-кишечного тракта (пепсин, трипсин, липаза, амилаза и другие).
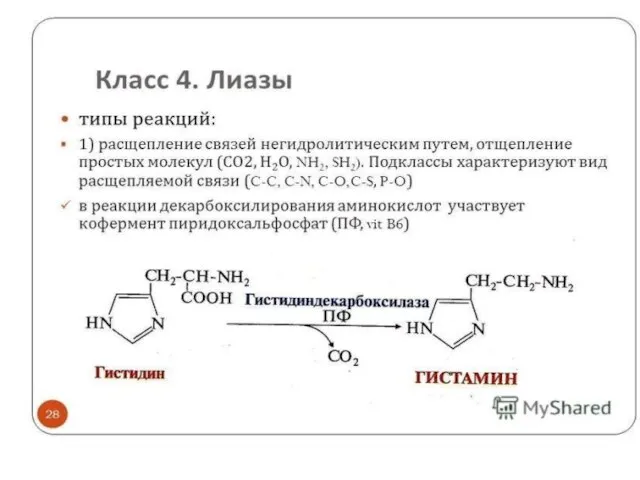
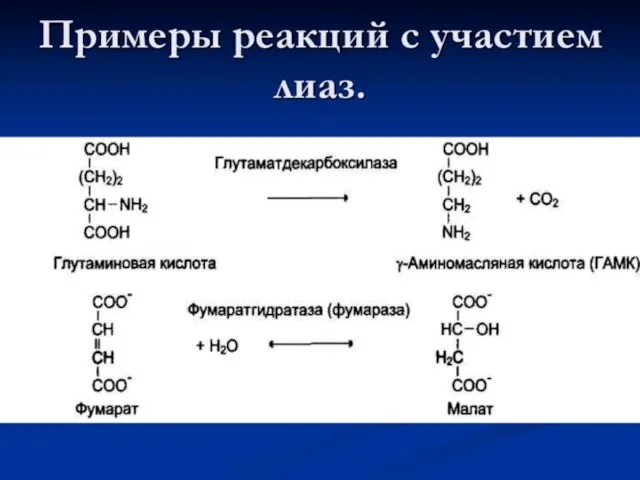
Слайд 15Лиазы
Лиазы являются сложными ферментами. Коферментами служат пиридоксальфосфат, тиаминдифосфат, участвует магний, кобальт.
Ферменты делятся на подклассы в зависимости от природы
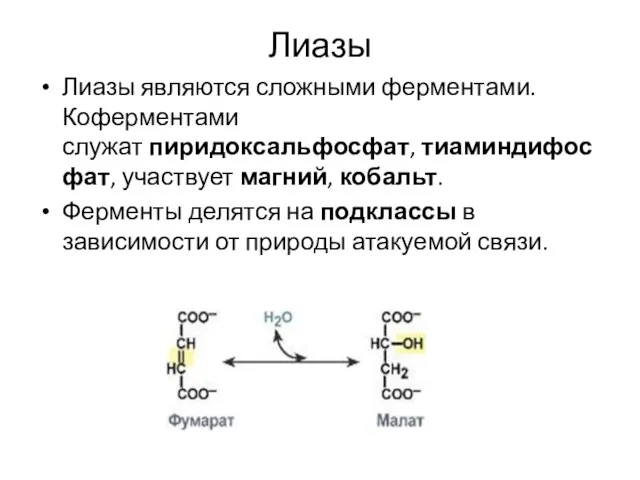
атакуемой связи.
Слайд 18Изомеразы
ферменты, катализирующие изомерные превращения в пределах одной молекулы. Изомеразы – сложные ферменты.
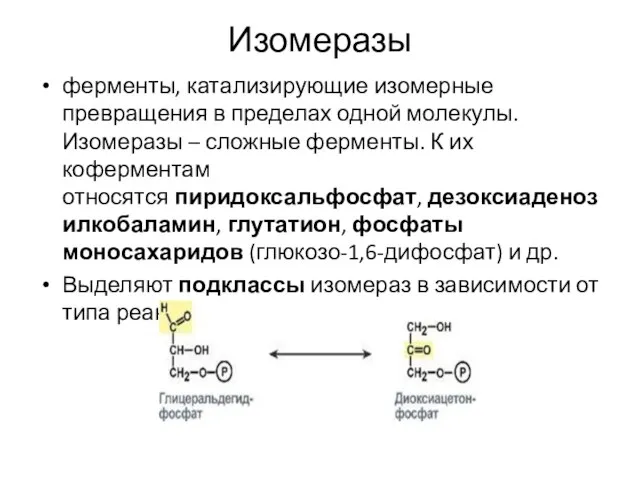
К их коферментам относятся пиридоксальфосфат, дезоксиаденозилкобаламин, глутатион, фосфаты моносахаридов (глюкозо-1,6-дифосфат) и др.
Выделяют подклассы изомераз в зависимости от типа реакции.
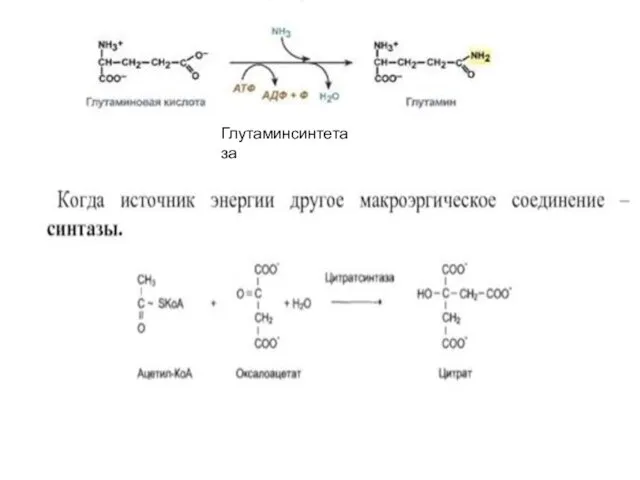
Слайд 19Лигазы
ферменты, катализирующие присоединение друг к другу двух молекул с использованием энергии высокоэнергетических
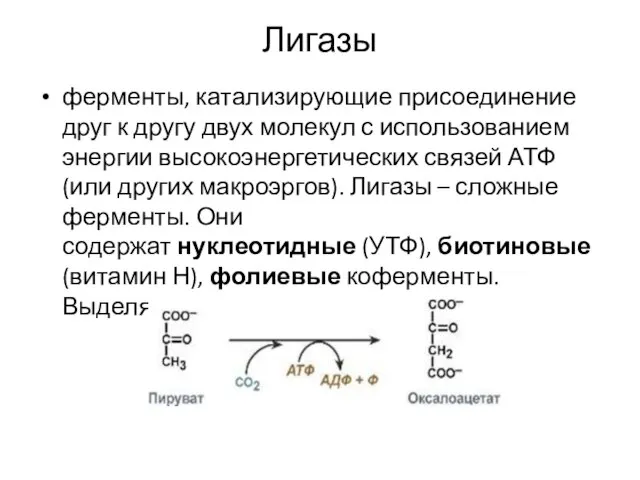
связей АТФ (или других макроэргов). Лигазы – сложные ферменты. Они содержат нуклеотидные (УТФ), биотиновые (витамин Н), фолиевые коферменты. Выделяют 6 подклассов.
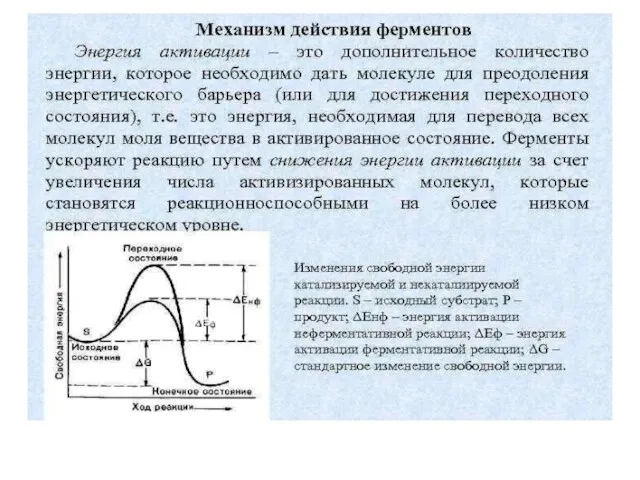
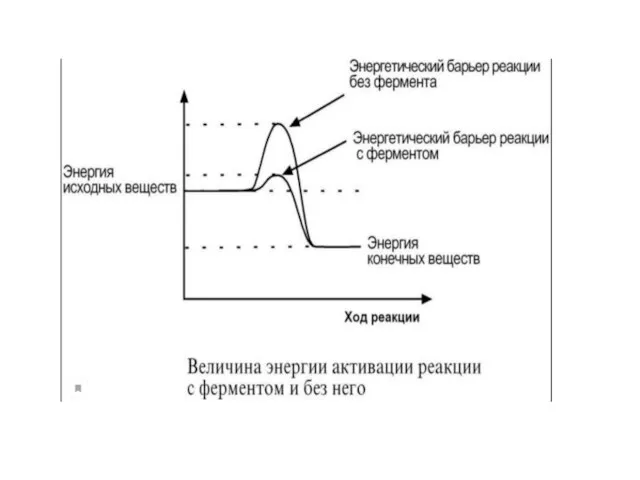
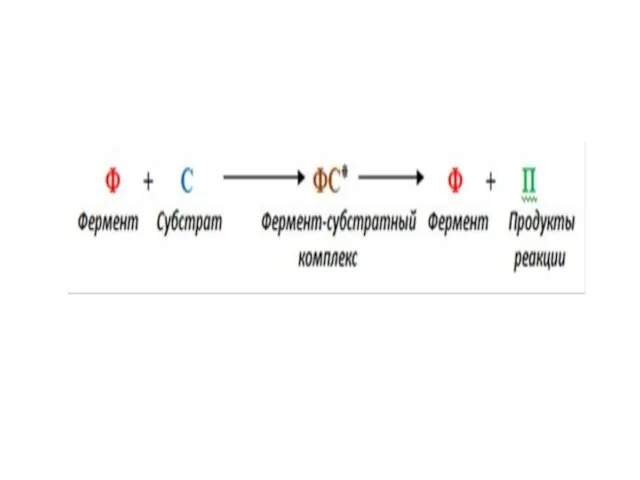
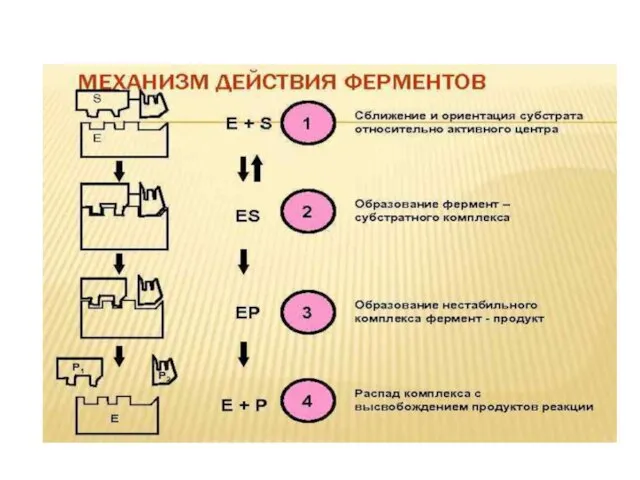
Слайд 27Механизм действия ферментов состоит в образовании комплекса между ферментом и субстратом за

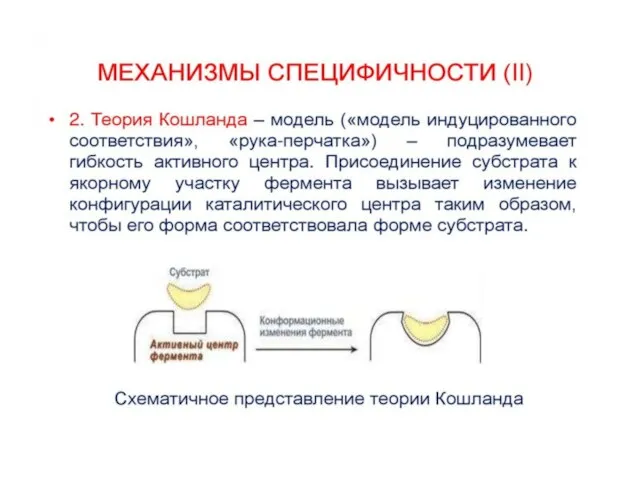
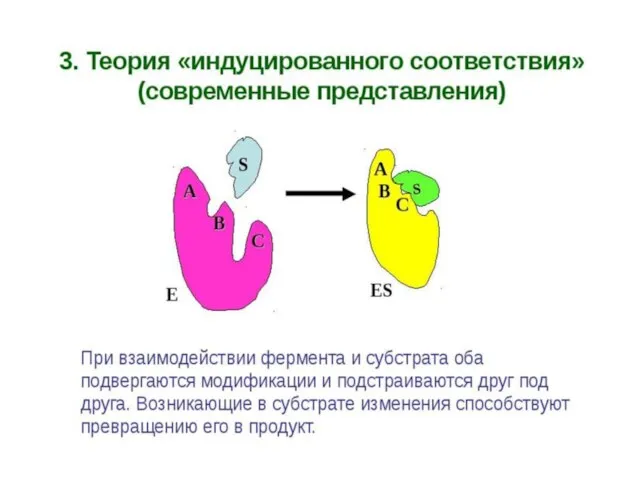
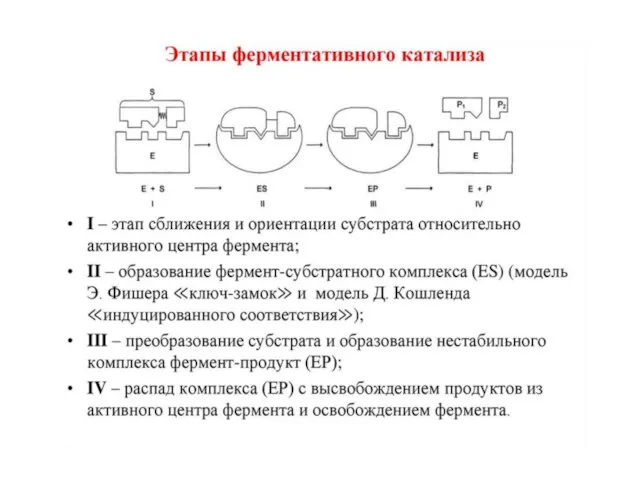
счет образования нековалентных связей (ионных,водородных, гидрофобных). Для образования фермент-субстратного комплекса необходимо, чтобы пространственная форма активного центра фермента была сходна с формой подходящего к нему субстрата. Этот комплекс вступает в химическую реакцию, после чего он распадается, приводя к образованию фермента и продуктов реакции:
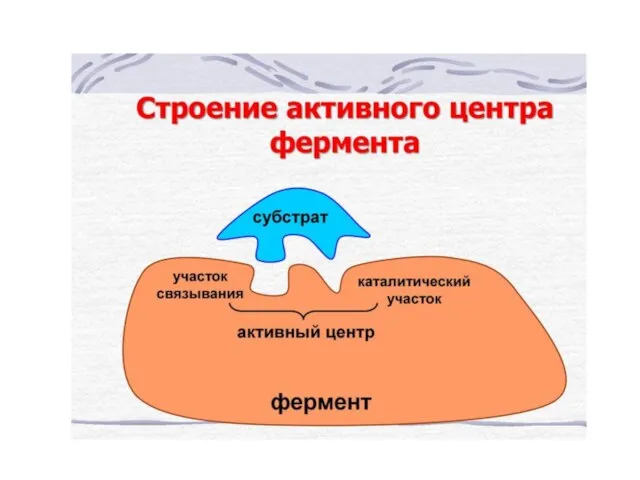
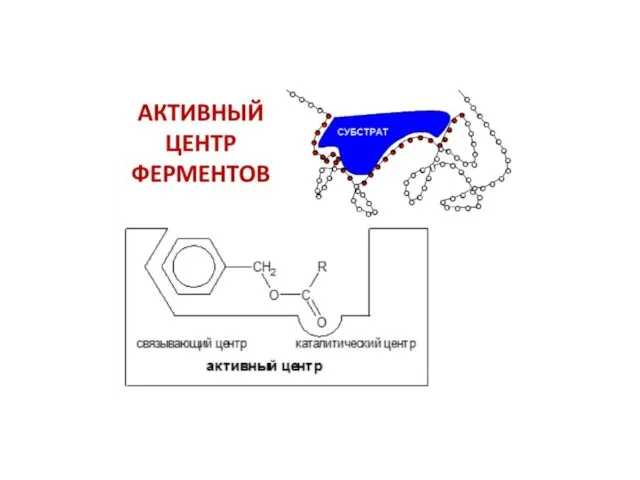
Слайд 30Активный центр фермента
Активный центр – это часть молекулы фермента, на которой происходит

связывание и превращение субстратов.
АЦ формируется при скручивании белковой молекулы в третичную структуру.
Слайд 39Свойства ферментов
Ферменты обладают всеми свойствами белков.
Также обладают уникальными свойствами.
СПЕЦИФИЧНОСТЬ
ТЕРМОЛАБИЛЬНОСТЬ
рН-ЧУВСТВИТЕЛЬНОСТЬ

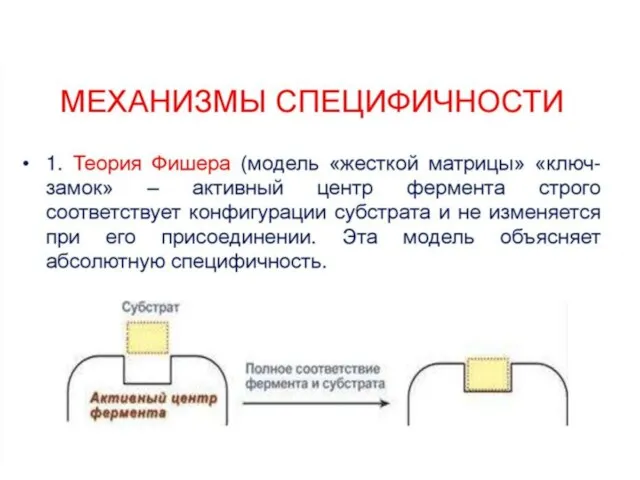
Слайд 40Специфичность
А. Субстратная
Б. Специфичность действия

Слайд 42Термолабильность – это неустойчивость ферментов к действию высоких температур. Это свойство объясняется
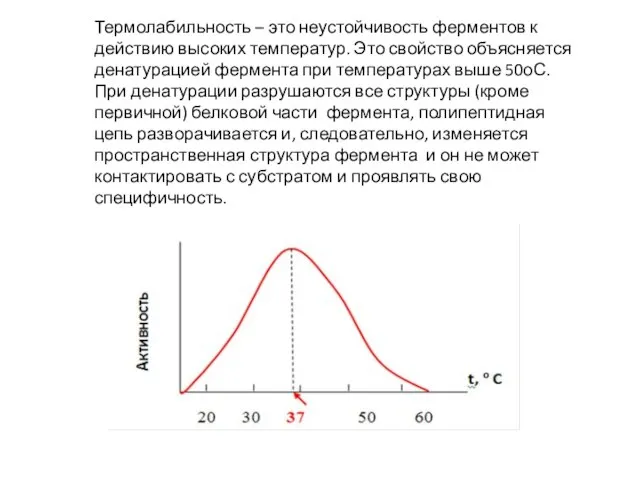
денатурацией фермента при температурах выше 50оС. При денатурации разрушаются все структуры (кроме первичной) белковой части фермента, полипептидная цепь разворачивается и, следовательно, изменяется пространственная структура фермента и он не может контактировать с субстратом и проявлять свою специфичность.
Слайд 43Линейное увеличение скорости ферментативной реакции от температуры наблюдается в области 5-25 о

С. При дальнейшем повышении температуры скорость увеличивается до определенного максимального значения, а затем происходит ее снижение вследствие тепловой денатурации фермента. Для большинства ферментов температурный оптимум лежит в области 37-40 о С.
Слайд 45Ферменты проявляют наибольшую активность при разном рН среды, например пепсин – при
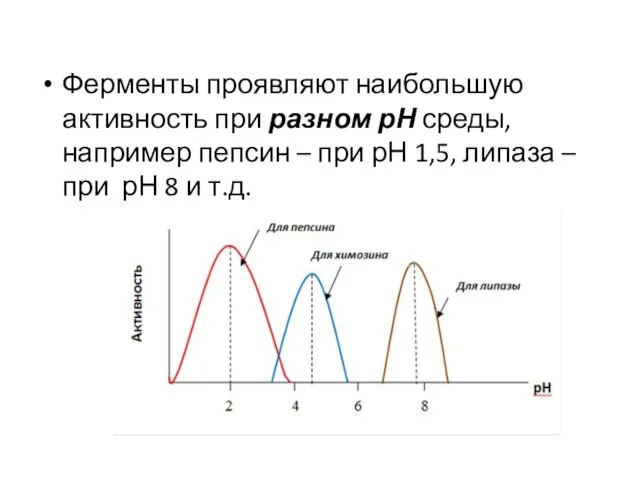
рН 1,5, липаза – при рН 8 и т.д.
Слайд 46рН, при котором наблюдается максимальная активность фермента, называется рН-оптимумом. Он зависит от

степени ионизации функциональных полярных групп активного центра фермента. При отклонении рН от оптимального значения активность фермента снижается. Это снижение объясняется подавлением ионизации групп активного центра фермента и в результате изменением его пространственной структуры.
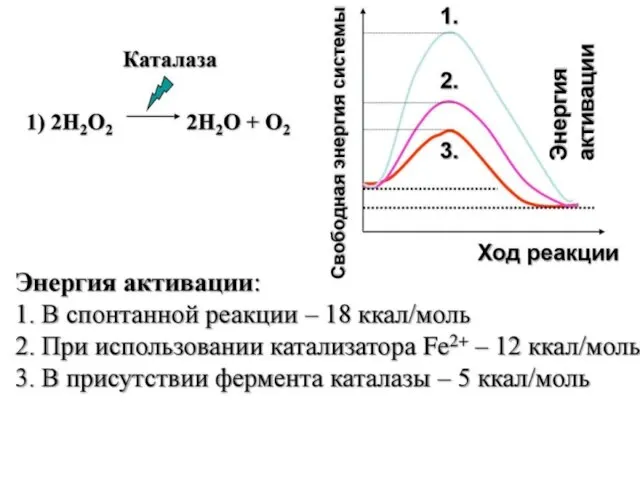
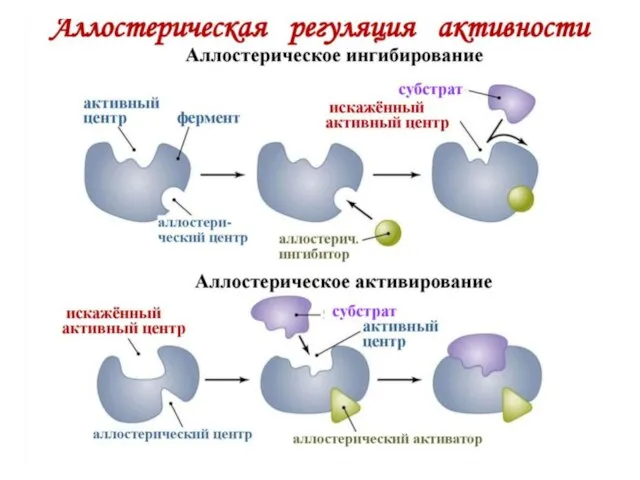
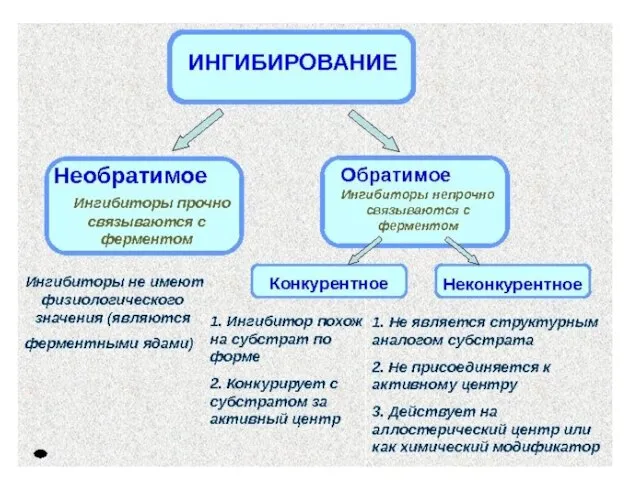
Слайд 47АКТИВАЦИЯ И ИНГИБИРОВАНИЕ АКТИВНОСТИ ФЕРМЕНТОВ

Слайд 48Активаторы ферментов
Вещества, повышающие активность ферментов.
Активаторами могут быть: ионы металлов: натрия, магния, калия,

кальция, цинка и др., а также разные химические соединения: белки; желчные кислоты, другие ферменты и пр.
Слайд 54Кинетика ферментативной реакции
Активность фермента – количество фермента, катализирующее превращение 1 моля субстрата

за 1 сек.
За единицу активности фермента принимают 1 катал: 1 катал = 1 моль/сек
Активность часто выражают в условных единицах: для амилазы, разрушающей крахмал – в молях глюкозы /сек; для пепсина, разрушающего белок – в молях аминокислоты тирозина/сек (тирозиновые единицы – ТЕ) и т.д.
Удельная активность фермента – это число единиц ферментативной активности на 1 мг белка.
Активность фермента определяют при температуре 37 о С, оптимуме рН и концентрации субстрата, превышающей концентрацию насыщения
Слайд 55ВЛИЯНИЕ КОНЦЕНТРАЦИИ ФЕРМЕНТА И СУБСТРАТА НА СКОРОСТЬ ФЕРМЕНТАТИВНОЙ РЕАКЦИИ
При постоянной концентрации фермента

скорость реакции при повышении концентрации субстрата увеличивается до достижения определенного максимума. Это состояние насыщения субстрата ферментом. Дальнейшее увеличение концентрации субстрата не приводит к изменению скорости реакции
Слайд 56С повышением концентрации фермента при избытке субстрата скорость реакции линейно возрастает
Влияние
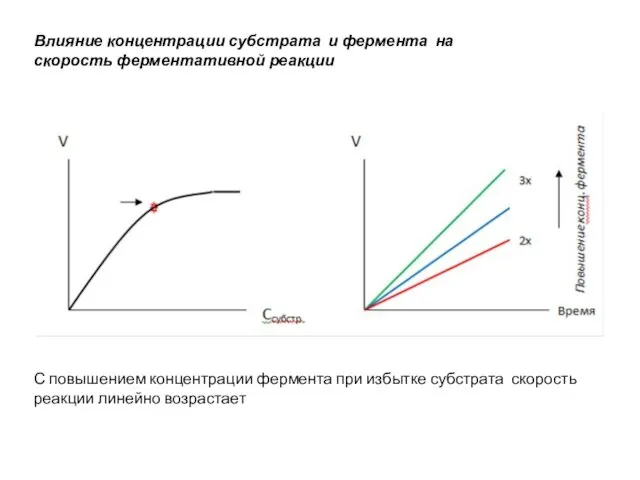
концентрации субстрата и фермента на
скорость ферментативной реакции
Слайд 57Количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции выражается уравнением Михаэлиса-Ментен






































 Виды изменчивости. Модификационная изменчивость
Виды изменчивости. Модификационная изменчивость Мұнай қалдықтарын гидроөндеу. Катализаторлары
Мұнай қалдықтарын гидроөндеу. Катализаторлары Строение тела человека как единая система
Строение тела человека как единая система Облепиха
Облепиха Экология грибов
Экология грибов История генетики
История генетики Презентация на тему Альбинизм
Презентация на тему Альбинизм  Удивительный мир природы
Удивительный мир природы Дикие и домашние птицы
Дикие и домашние птицы Тип Кишечнополостные
Тип Кишечнополостные Позвоночные животные
Позвоночные животные Трахея. Поперечный срез трахеи
Трахея. Поперечный срез трахеи Презентация на тему АРОМАТЕРАПИЯ
Презентация на тему АРОМАТЕРАПИЯ  Подкормка птиц
Подкормка птиц Органические вещества клеток: углеводы, липиды, жиры, воска
Органические вещества клеток: углеводы, липиды, жиры, воска Викторина
Викторина Макроэволюция. Факторы макроэволюции
Макроэволюция. Факторы макроэволюции Клеточное строение организмов как доказательство их родства, единства живой природы
Клеточное строение организмов как доказательство их родства, единства живой природы Женские прелести
Женские прелести Генно-инженерные вакцины
Генно-инженерные вакцины Анализаторы. Проверочная работа
Анализаторы. Проверочная работа Антропологическая альтернатива и её принципы: многообразие, целостности, субстанциональности, свободы
Антропологическая альтернатива и её принципы: многообразие, целостности, субстанциональности, свободы Анатомия и физиология пищеварительной системы
Анатомия и физиология пищеварительной системы Анатомия. Строение органов
Анатомия. Строение органов Воздух и его свойства
Воздух и его свойства Дзерены пришли
Дзерены пришли Витамины и их антимутагенное влияние на организм
Витамины и их антимутагенное влияние на организм Микро- и макропрепараты
Микро- и макропрепараты