Содержание
- 2. Биологическая химия является наукой, которая изучает химический состав и превращения веществ в организме, а также устанавливает
- 3. -ОН -ОН -ОН -ОН -О- -ОН J J J J J J J J -О- -ОН
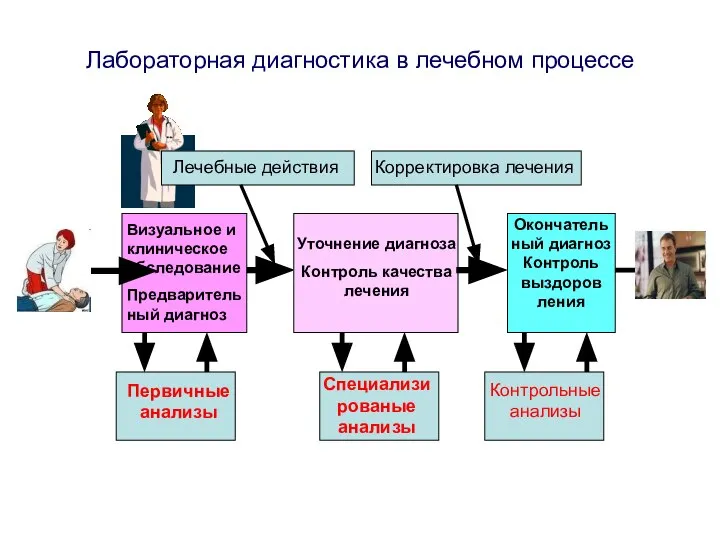
- 4. Визуальное и клиническое обследование Предваритель ный диагноз Уточнение диагноза Контроль качества лечения Окончатель ный диагноз Контроль
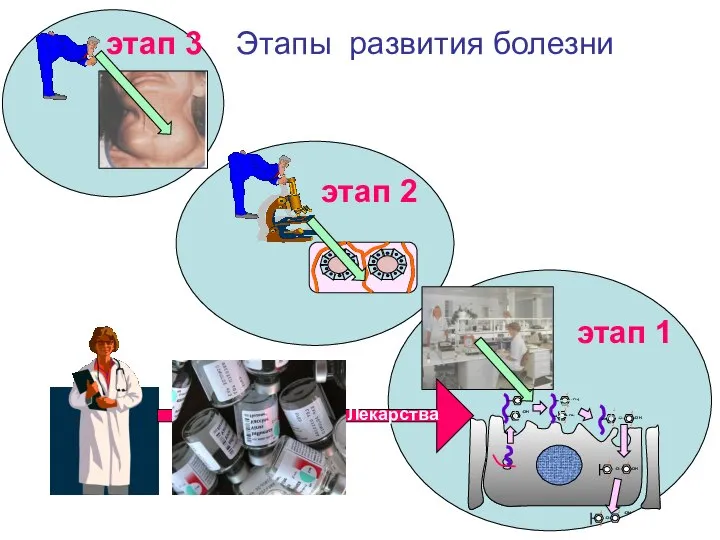
- 5. Роль биохимии в медицине Дает возможность установить причину, вызывающую болезнь; Позволяет понять закономерности, лежащие в основе
- 6. Роль биохимии в медицине С помощью веществ (лекарств) можно устранить нарушения и восстановить нормальное протекание химических
- 7. Разделы биохимии: 1. Статическая биохимия 2. Динамическая биохимия 3. Функциональная биохимия
- 8. Статическая биохимия – изучает химический состав живых организмов; Динамическая биохимия – изучает превращения химических веществ; Функциональная
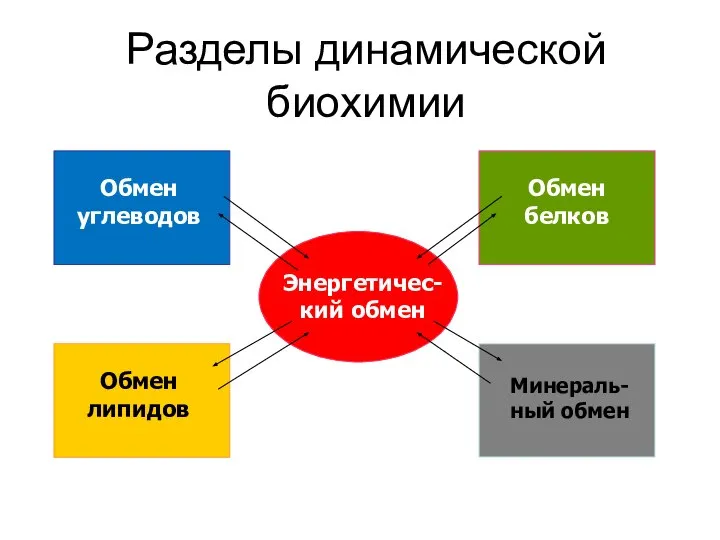
- 9. Разделы динамической биохимии Обмен углеводов Обмен липидов Обмен белков Минераль-ный обмен Энергетичес-кий обмен
- 10. Тема № 1 Строение и свойства белков
- 11. Роль белков в организме Структурная Каталитическая Транспортная Регуляторная Защитная Гомеостатическая Депонирующая Функциональная
- 12. Уровни организации белковой молекулы Первичная структура Вторичная структура Третичная структура Четвертичная структура
- 13. Под первичной структурой белка понимают порядок соединения аминокислот в полипептидной цепи
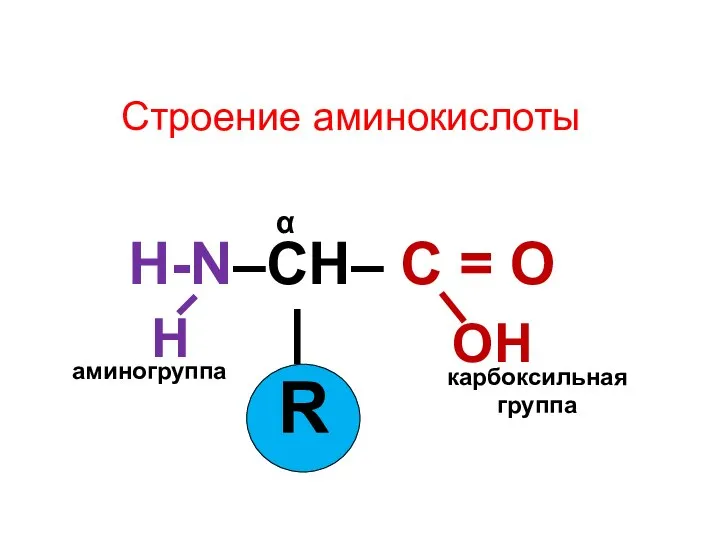
- 14. Строение аминокислоты H-N–CH– C = O | R ОН карбоксильная группа аминогруппа α Н
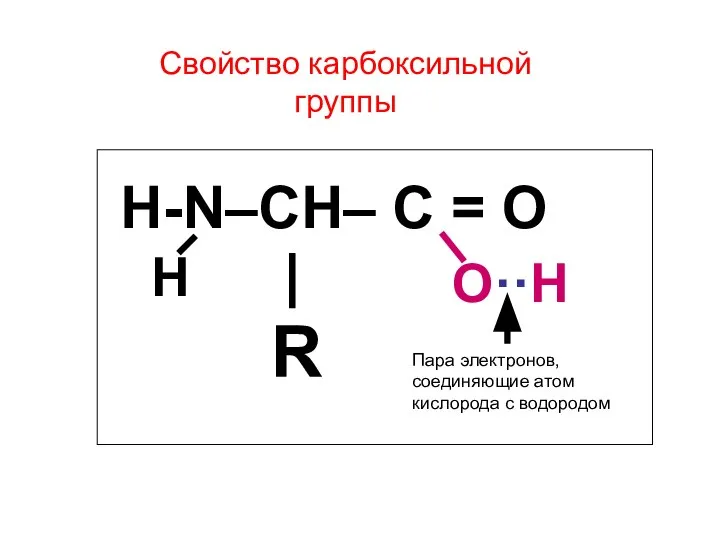
- 15. Свойство карбоксильной группы H-N–CH– C = O | R О··Н Н Пара электронов, соединяющие атом кислорода
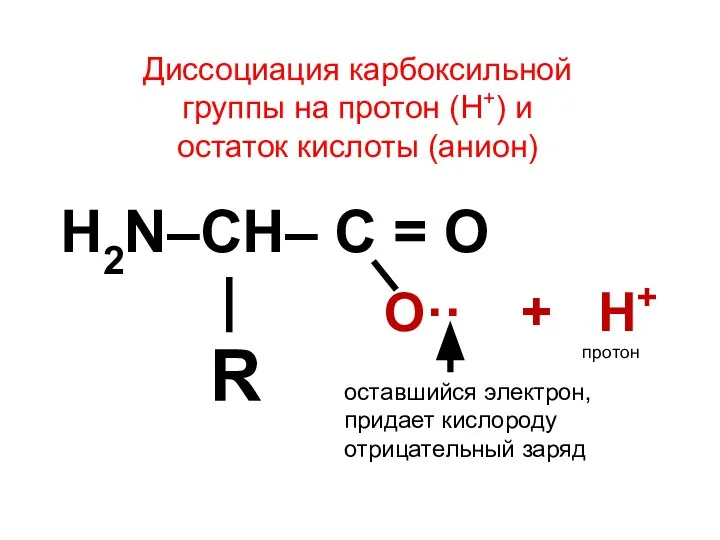
- 16. Диссоциация карбоксильной группы на протон (Н+) и остаток кислоты (анион) H2N–CH– C = O | R
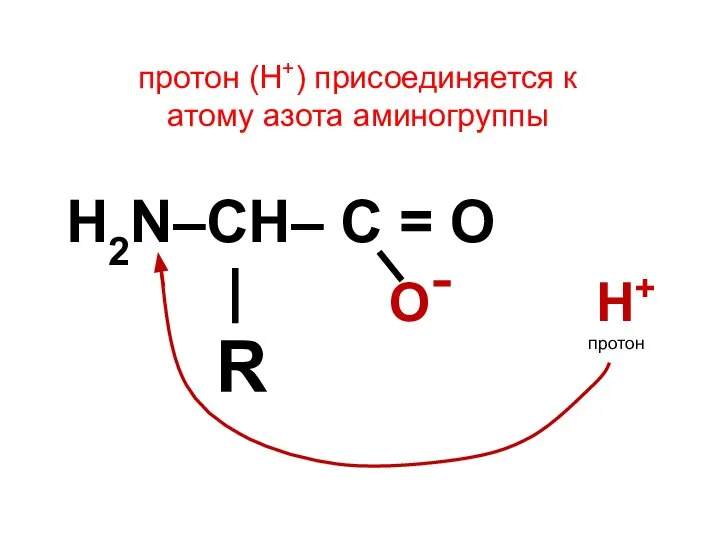
- 17. протон (Н+) присоединяется к атому азота аминогруппы H2N–CH– C = O | R О Н+ протон
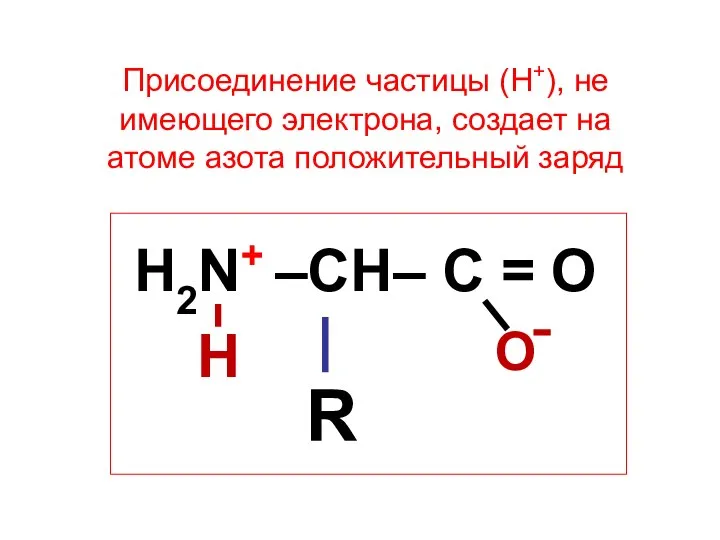
- 18. Присоединение частицы (Н+), не имеющего электрона, создает на атоме азота положительный заряд H2N+ –CH– C =
- 19. H2N–CH– COОН | R В каком состоянии находится аминокислота - в виде сухого порошка или в
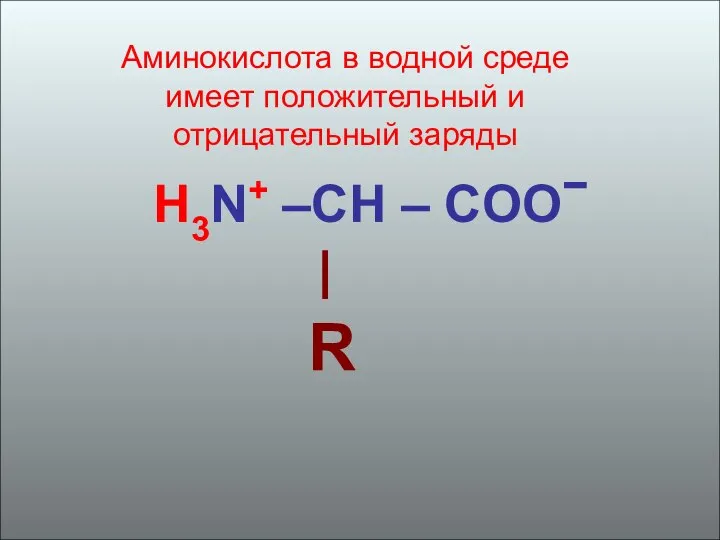
- 20. Аминокислота в водной среде имеет положительный и отрицательный заряды H3N+ –CH – COО | R
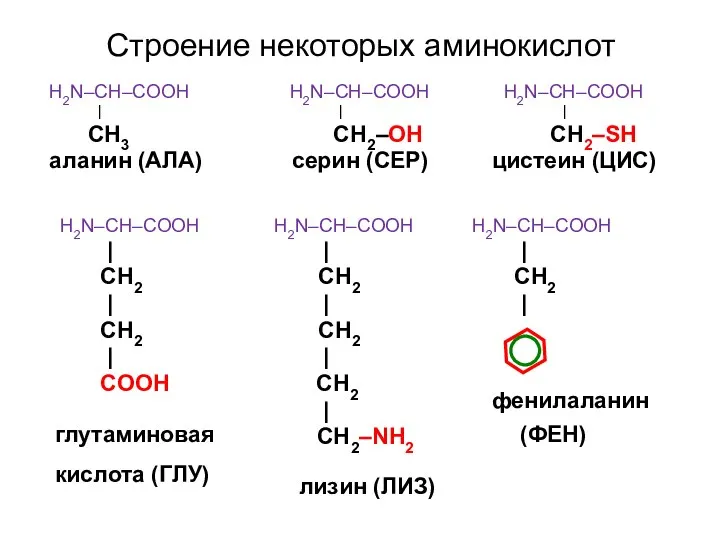
- 21. Строение некоторых аминокислот H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH | | | СН3 СН2–ОН СН2–SН аланин (АЛА) серин (СЕР)
- 22. Классификация аминокислот 1. Моноаминомонокарбоновые 2. Моноаминодикарбоновые 3. Диаминомонокарбоновые 4. Серусодержащие 5. Имеющие спиртовую группу 6. Циклические
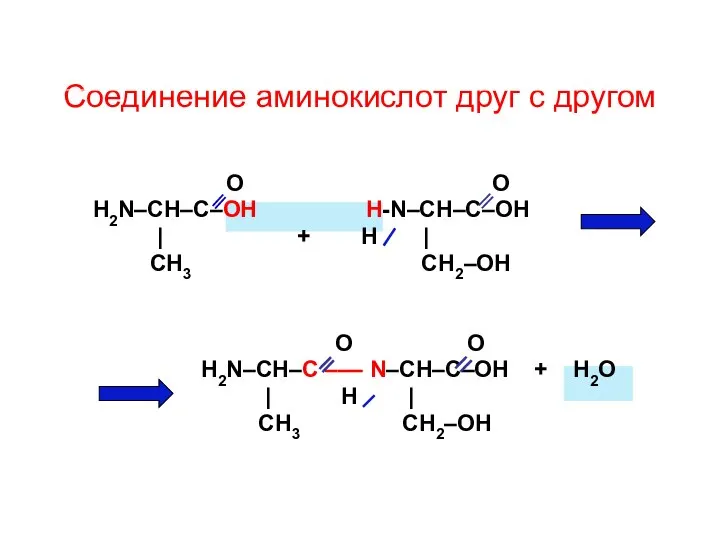
- 23. Соединение аминокислот друг с другом О О H2N–CH–C–OH H-N–CH–C–OH | + H | СН3 СН2–ОН О
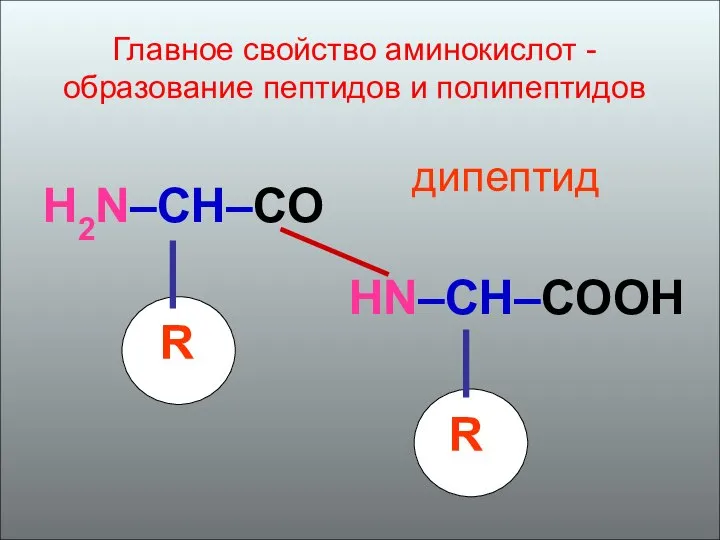
- 24. H2N–CH–CO R HN–CH–COOH R дипептид Главное свойство аминокислот - образование пептидов и полипептидов
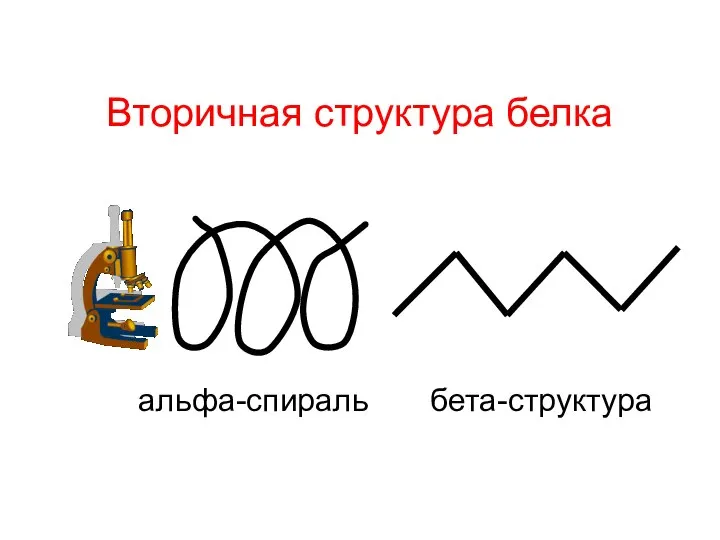
- 25. Вторичная структура белка альфа-спираль бета-структура
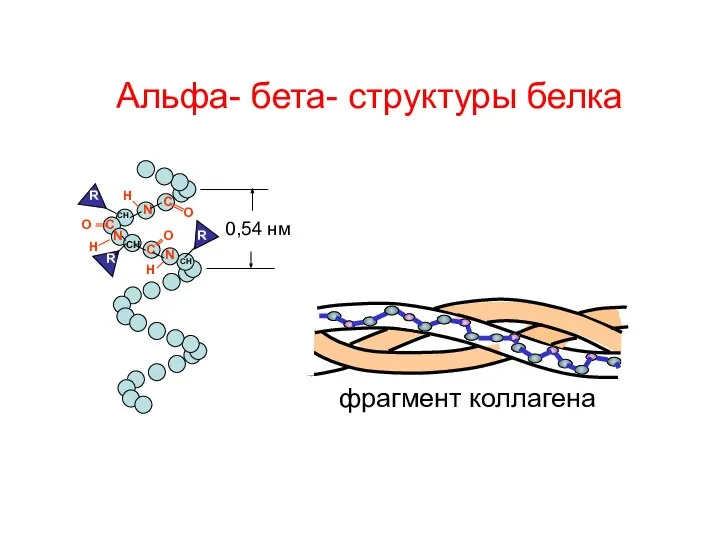
- 26. Альфа- бета- структуры белка 0,54 нм С N CH O C N CH C N CH
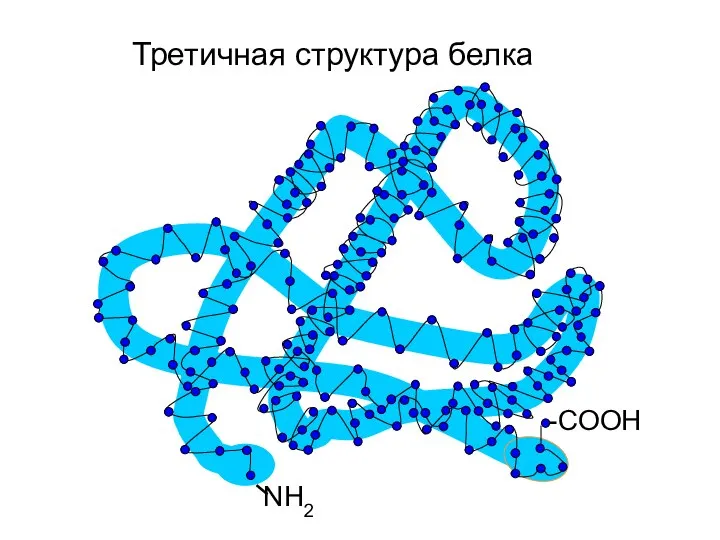
- 27. Третичная структура белка
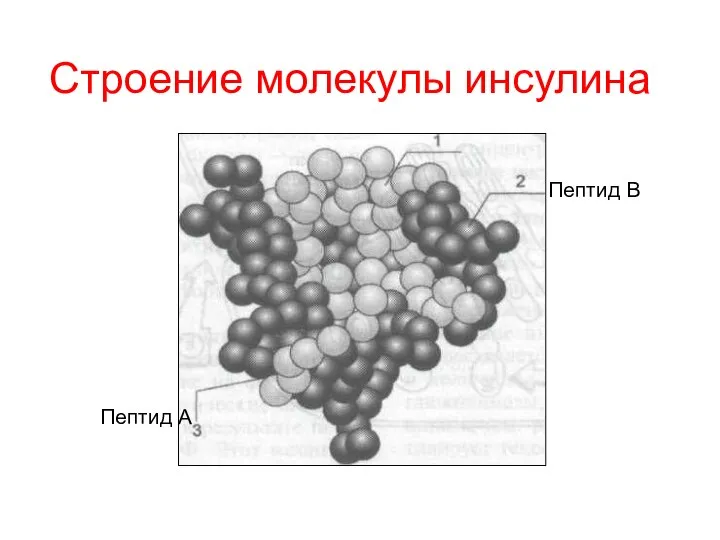
- 28. Строение молекулы инсулина Пептид В Пептид А
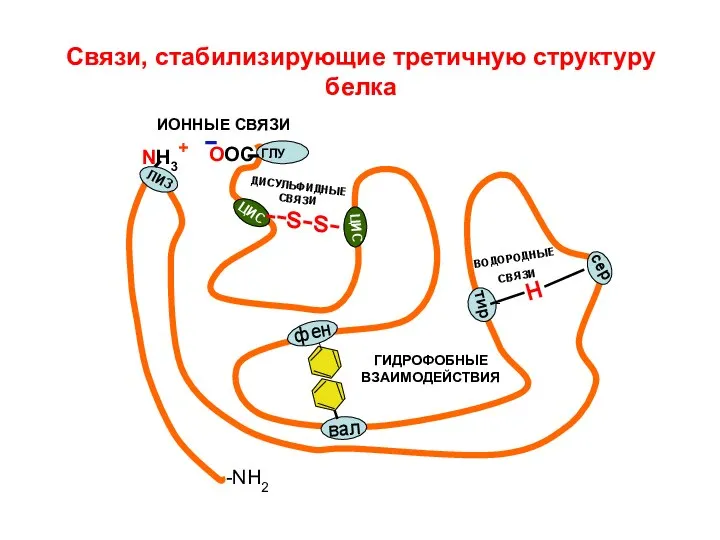
- 29. Связи, стабилизирующие третичную структуру белка фен вал тир сер NH3+ ЛИЗ ГЛУ ЦИС ЦИС --s-s- -NH2
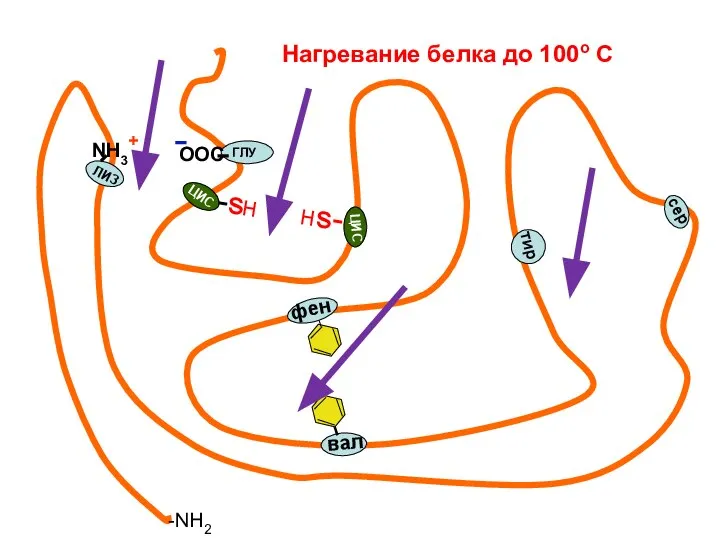
- 30. фен вал тир сер NH3+ ЛИЗ ГЛУ ЦИС ЦИС -sН Нs- -NH2 ООС Нагревание белка до
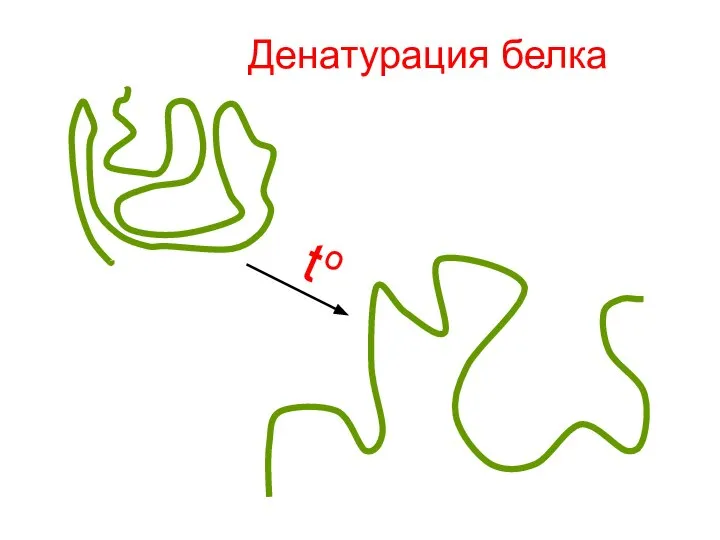
- 31. Денатурация белка tо
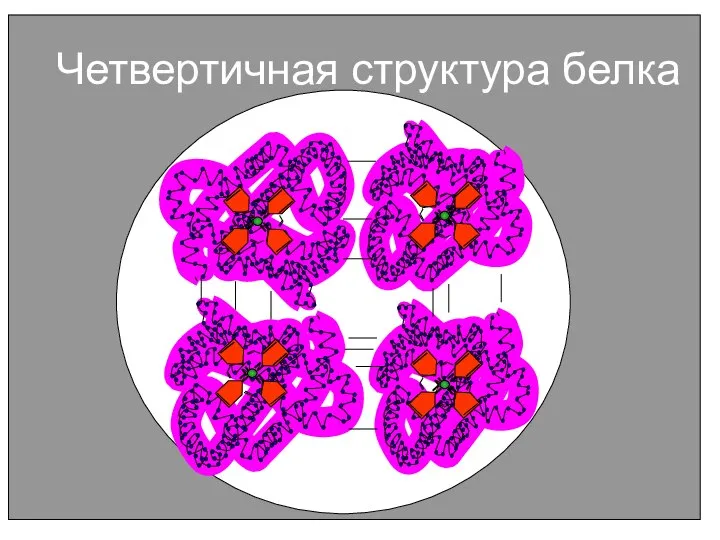
- 32. Четвертичная структура белка N N N N N N N N N N N N N
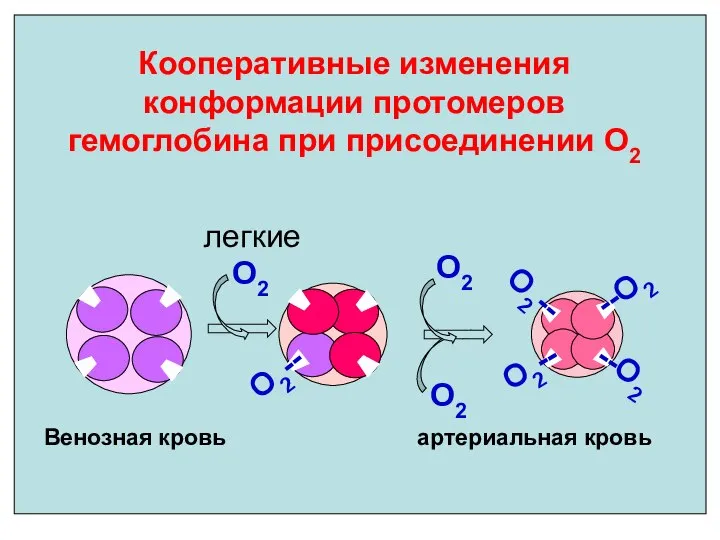
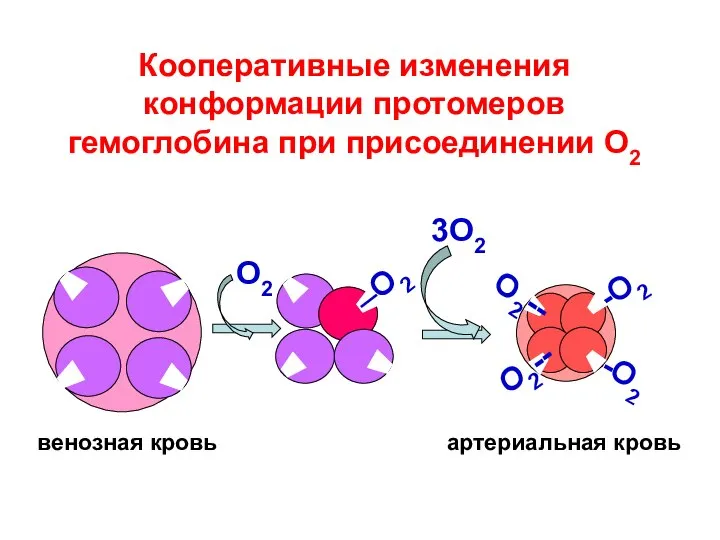
- 33. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2 О2-- --О2 О2-- О2 О2 Венозная кровь артериальная
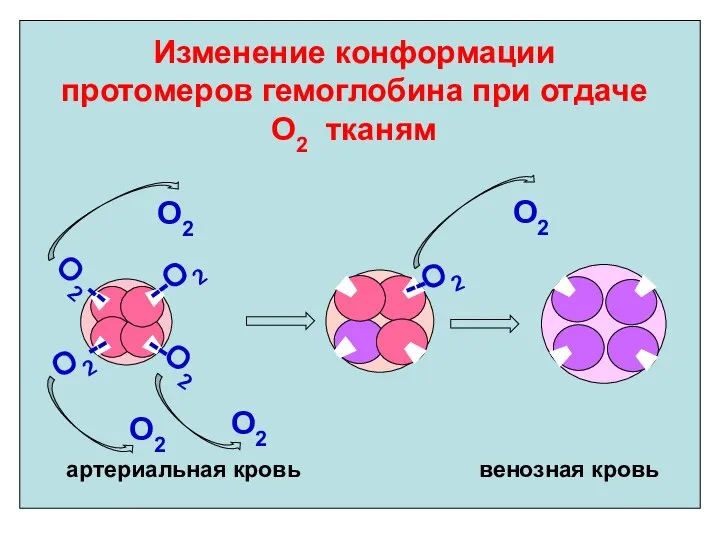
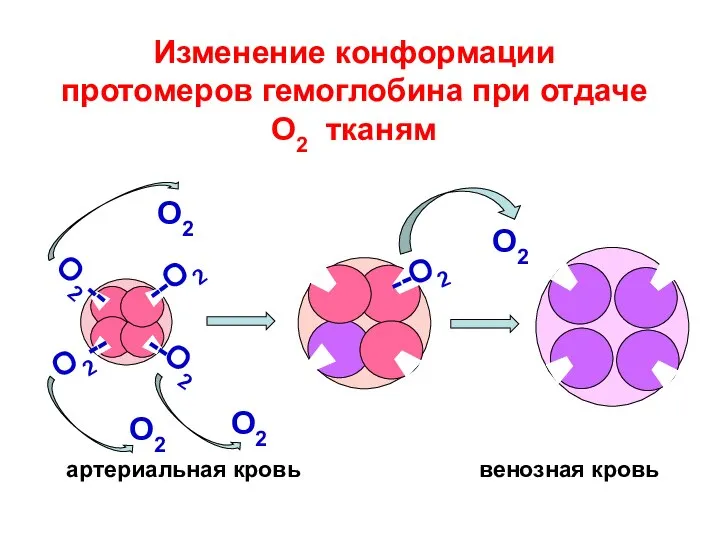
- 34. Изменение конформации протомеров гемоглобина при отдаче О2 тканям О2 О2 артериальная кровь венозная кровь О2 О2
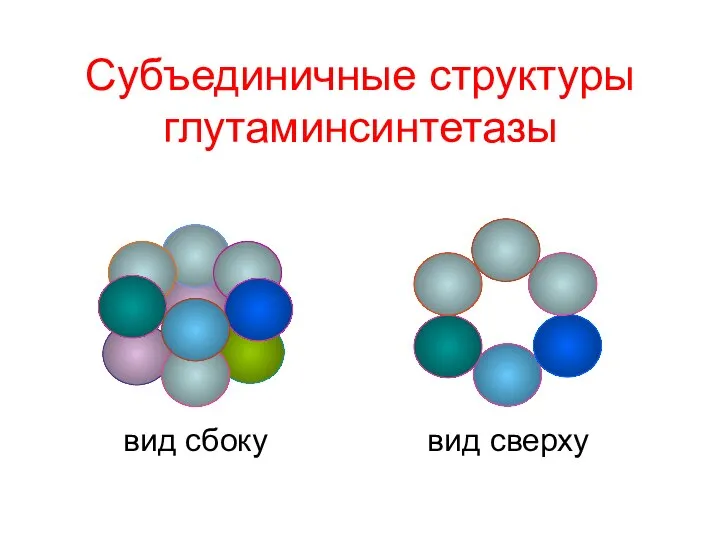
- 35. Субъединичные структуры глутаминсинтетазы вид сбоку вид сверху
- 36. Свойства белков Имеют заряды (положительные и отрицательные) Имеют разную растворимость в воде Способны выпадать в осадок
- 37. Белки сыворотки крови
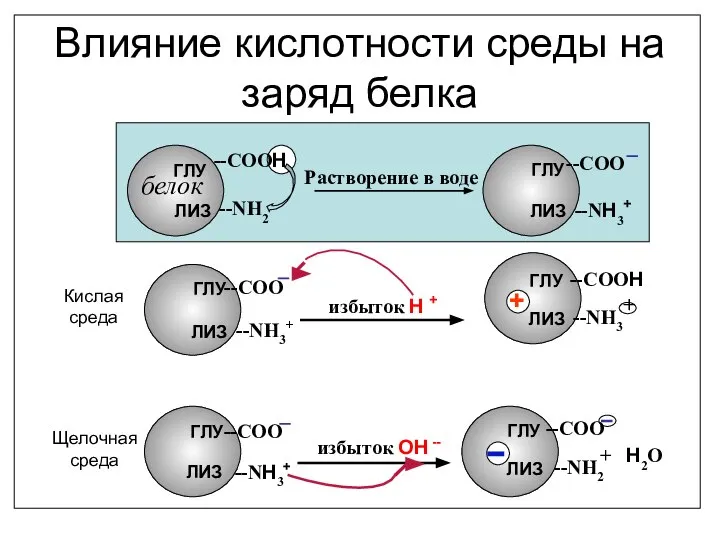
- 38. Отрицательные заряды создают глутаминовая и аспарагиновая кислоты. Положительные заряды создают лизин, аргинин и гистидин. Белки имеют
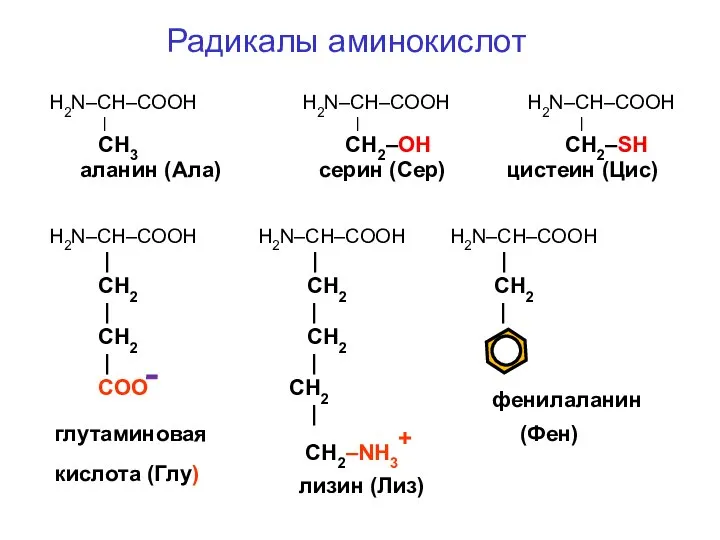
- 39. Радикалы аминокислот H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH | | | СН3 СН2–ОН СН2–SН аланин (Ала) серин (Сер) цистеин
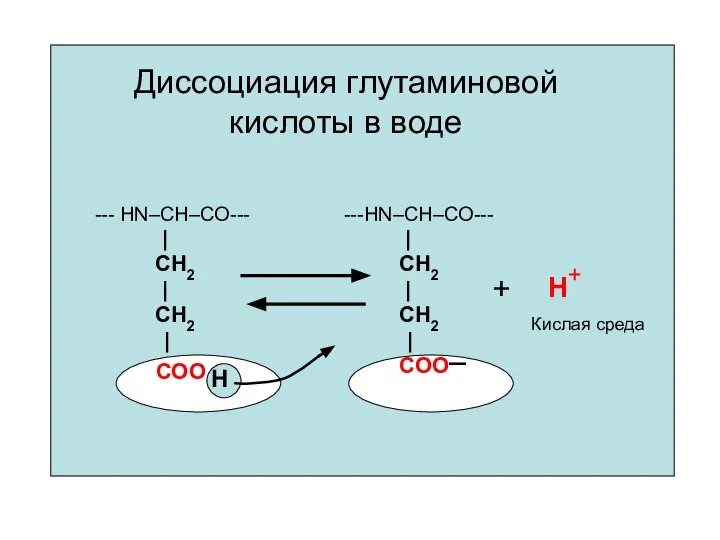
- 40. Диссоциация глутаминовой кислоты в воде ---HN–CH–CO--- | CH2 | CH2 | COO Н+ + Кислая среда
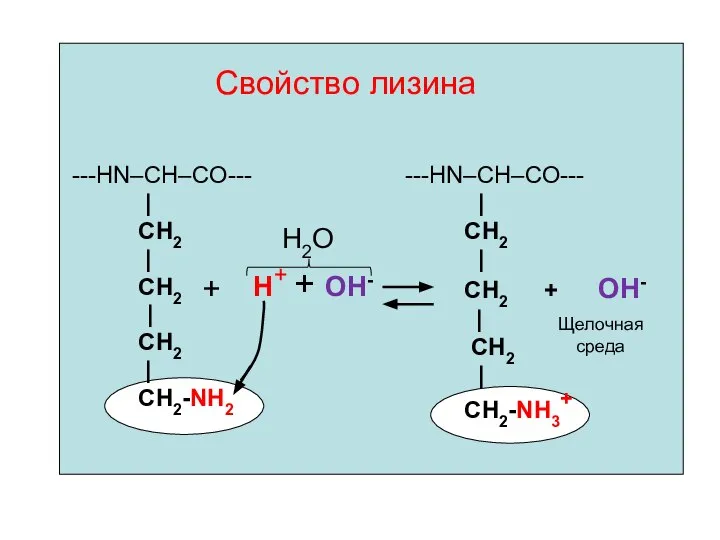
- 41. Свойство лизина ---HN–CH–CO--- | CH2 | CH2 | СН2 | СН2-NН2 Н+ + ОН- + ---HN–CH–CO---
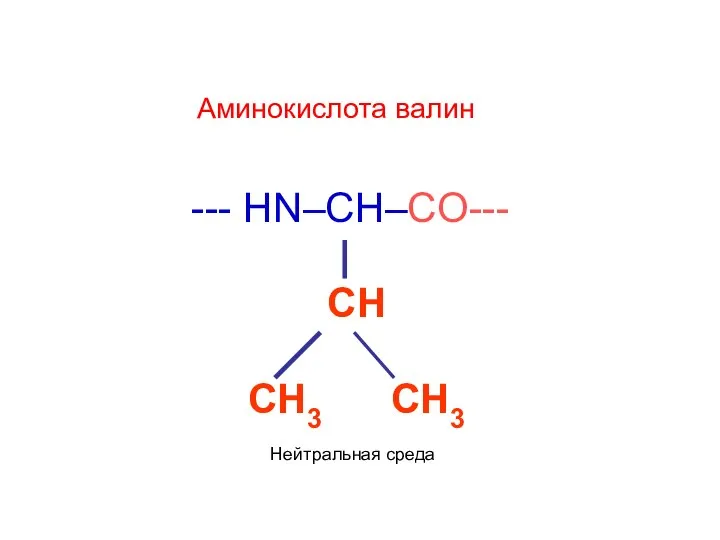
- 42. --- HN–CH–CO--- | CH CH3 CH3 Аминокислота валин Нейтральная среда
- 43. Влияние кислотности среды на заряд белка белок --СООН --NH2 Растворение в воде --NH3+ --СОО --СОО --NH3+
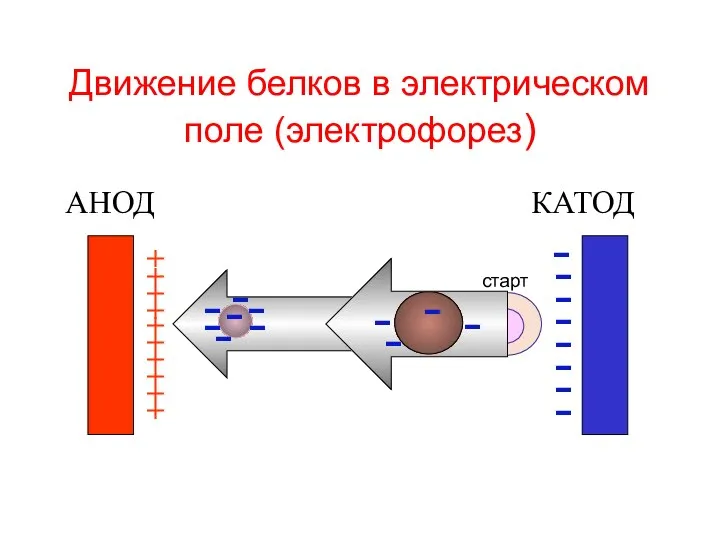
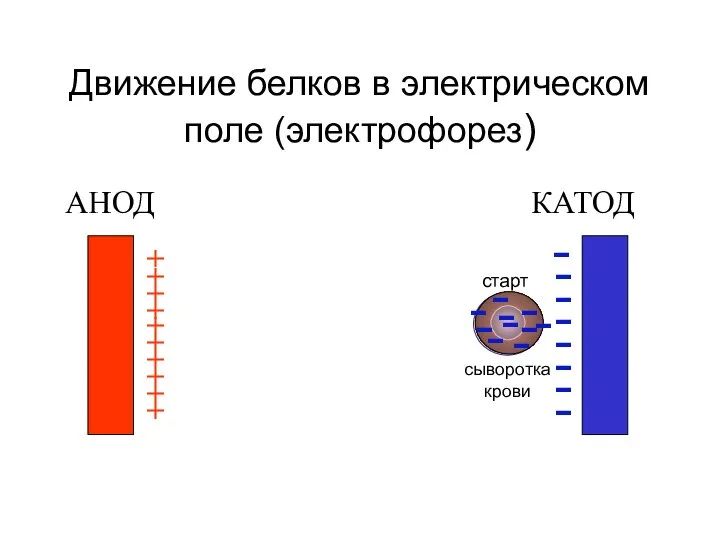
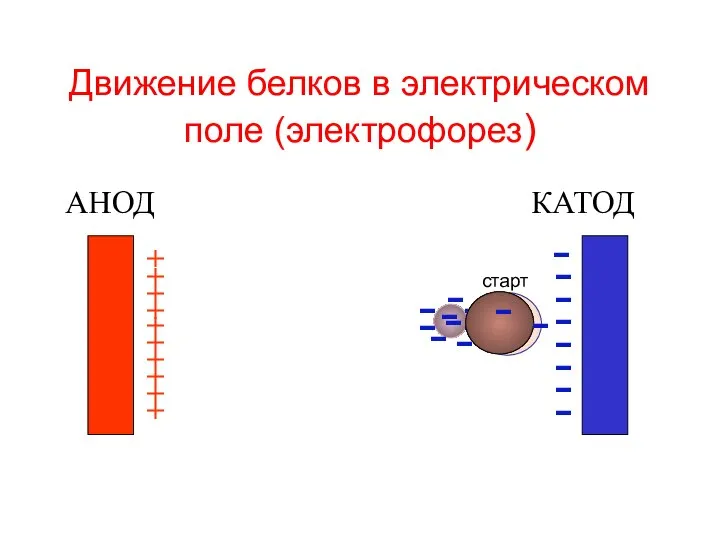
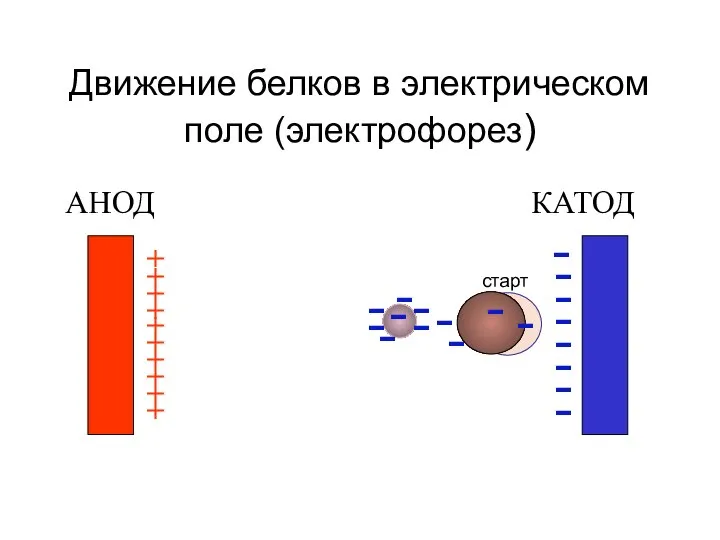
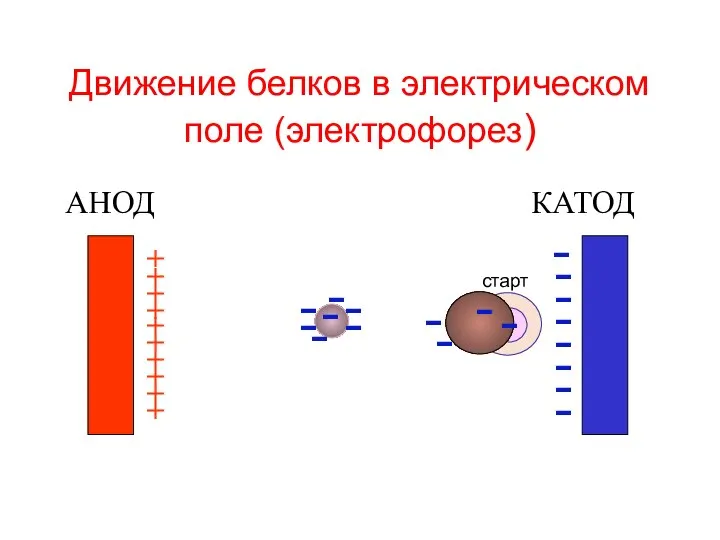
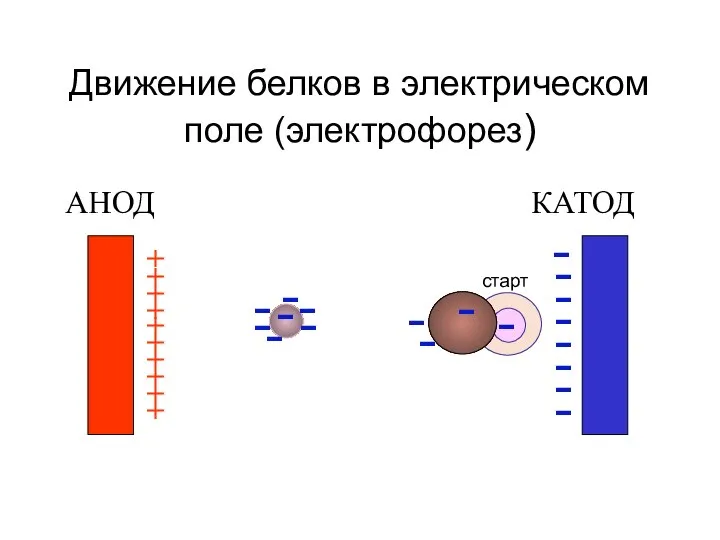
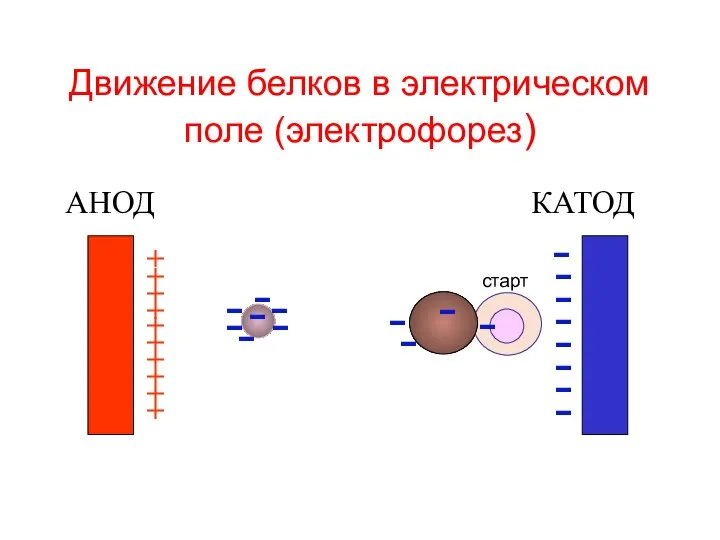
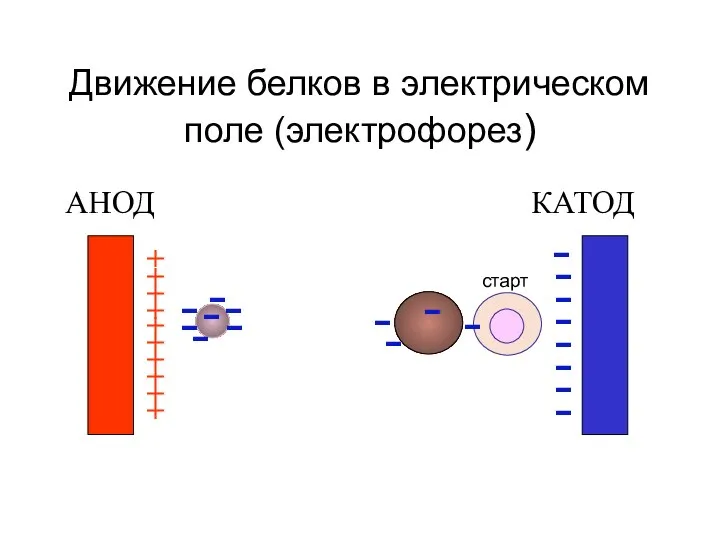
- 44. Движение белков в электрическом поле (электрофорез) АНОД КАТОД + + + + + + + +
- 45. Движение белков в электрическом поле (электрофорез) АНОД КАТОД + + + + + + + +
- 46. Движение белков в электрическом поле (электрофорез) АНОД КАТОД + + + + + + + +
- 47. Движение белков в электрическом поле (электрофорез) АНОД КАТОД + + + + + + + +
- 48. Движение белков в электрическом поле (электрофорез) АНОД КАТОД + + + + + + + +
- 49. Движение белков в электрическом поле (электрофорез) АНОД КАТОД + + + + + + + +
- 50. Движение белков в электрическом поле (электрофорез) АНОД КАТОД + + + + + + + +
- 51. Движение белков в электрическом поле (электрофорез) АНОД КАТОД + + + + + + + +
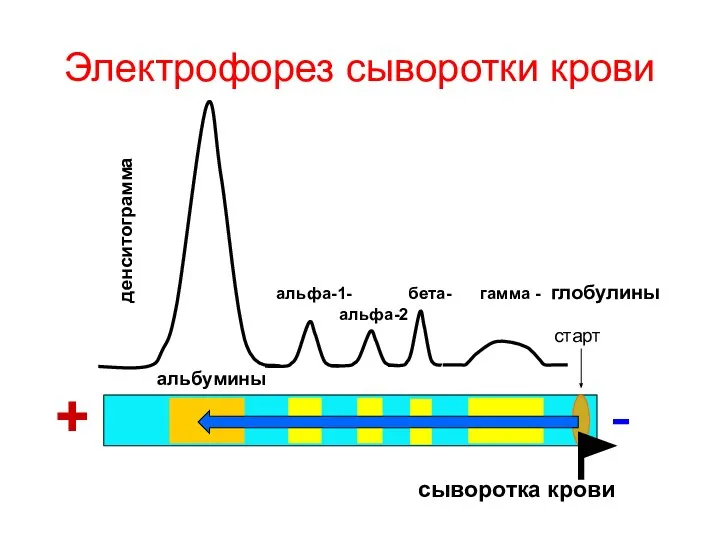
- 52. Электрофорез сыворотки крови + - старт денситограмма альбумины альфа-1- бета- гамма - глобулины альфа-2 сыворотка крови
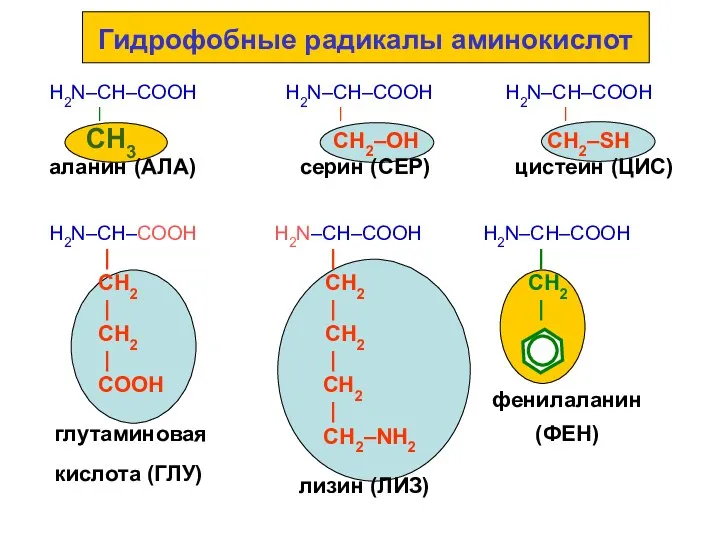
- 53. Роль аминокислот, содержащих гидрофобные радикалы (аланин, валин, лейцин, изолейцин, фенилаланин, тирозин)
- 54. Гидрофобные радикалы аминокислот H2N–CH–COOH H2N–CH–COOH H2N–CH–COOH | | | СН3 СН2–ОН СН2–SН аланин (АЛА) серин (СЕР)
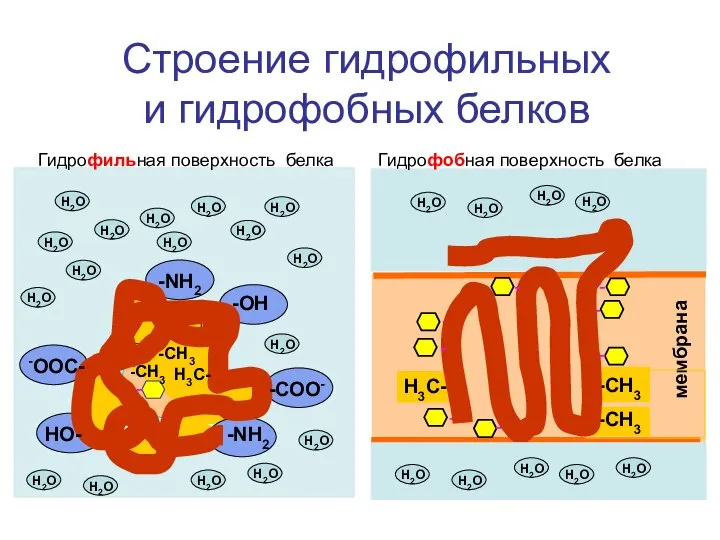
- 55. Строение гидрофильных и гидрофобных белков -ОН -СОО- -NH2 -NH2 -OOC- НО- - -СН3 -СН3 Н3С- -
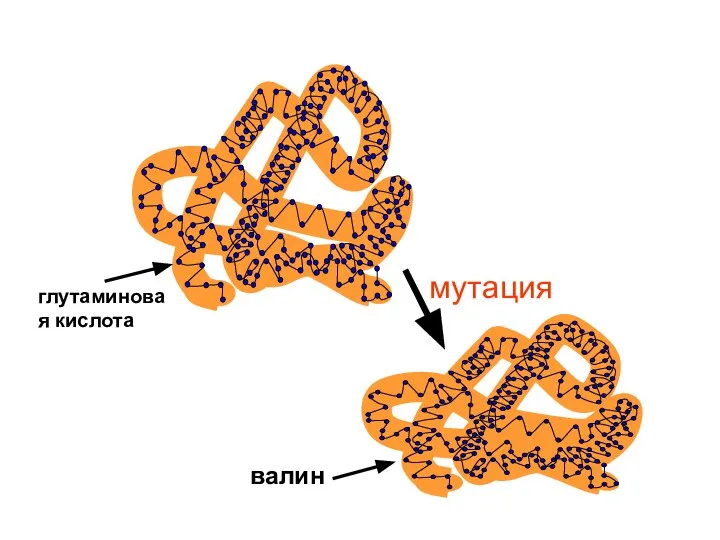
- 57. Протеинопатии Серповидно-клеточная анемия нормальный эритроцит анемия
- 58. глутаминовая кислота валин мутация
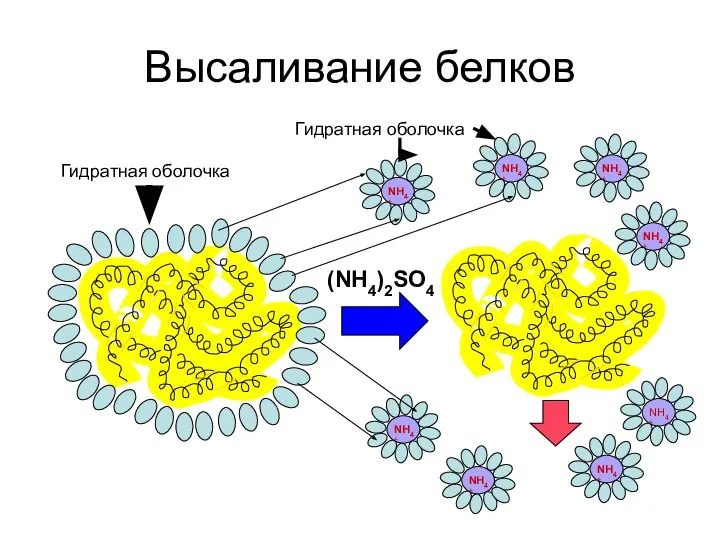
- 59. Высаливание белков (NH4)2SO4 Гидратная оболочка Гидратная оболочка
- 60. Классификация белков Простые белки ( состоят только из аминокислот) Сложные белки (в состав белка входят различные
- 61. Простые и сложные белки ГЕМ альбумин миоглобин
- 62. Простые белки Альбумины Глобулины Протамины Гистоны Глютелины Проламины
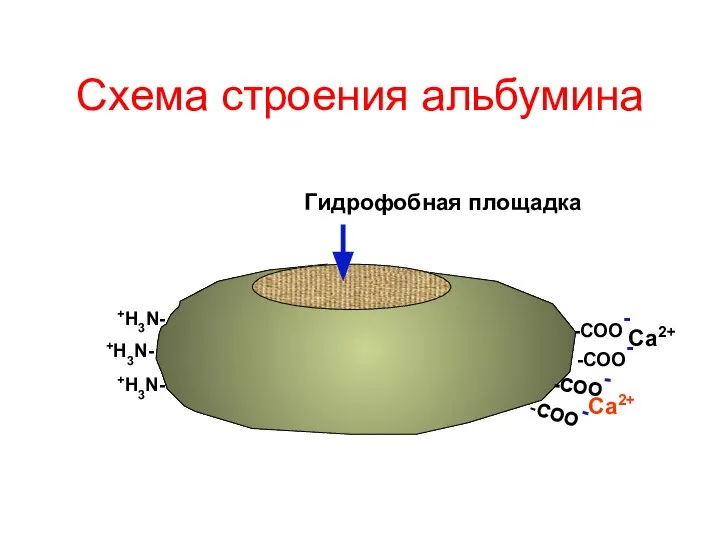
- 63. Схема строения альбумина Гидрофобная площадка -СОО- -СОО- -СОО- -СОО- Са2+ Са2+ +Н3N- +Н3N- +Н3N-
- 64. Роль альбумина Запасной источник аминокислот Компонент буферной системы Осмотически активный белок Переносчик жирных кислот Переносчик жирорастворимых
- 65. глобулины
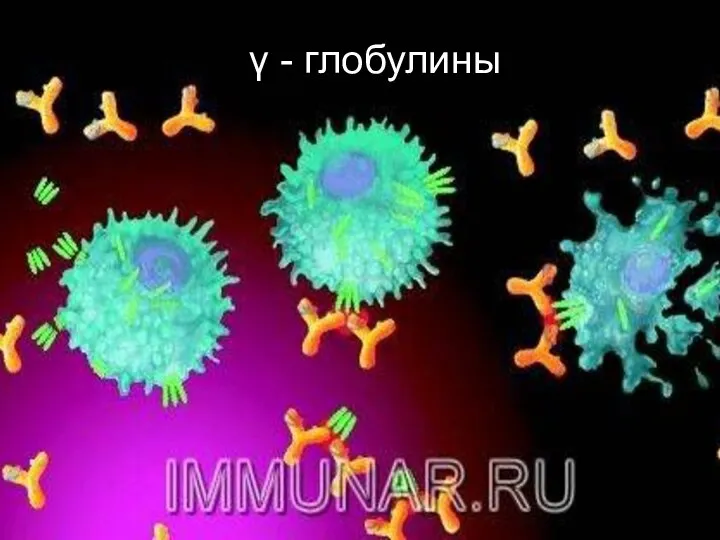
- 66. γ - глобулиновая фракция сыворотки крови Содержит иммунные глобулины (IgA; IgЕ; IgМ; IgD; IgG).
- 67. α1-глобулины α2-глобулины β - глобулины γ - глобулины
- 68. Основной функцией сывороточного IgA является обеспечение местного иммунитета, защита дыхательных, мочеполовых путей и желудочно-кишечного тракта от
- 69. Протамины и гистоны
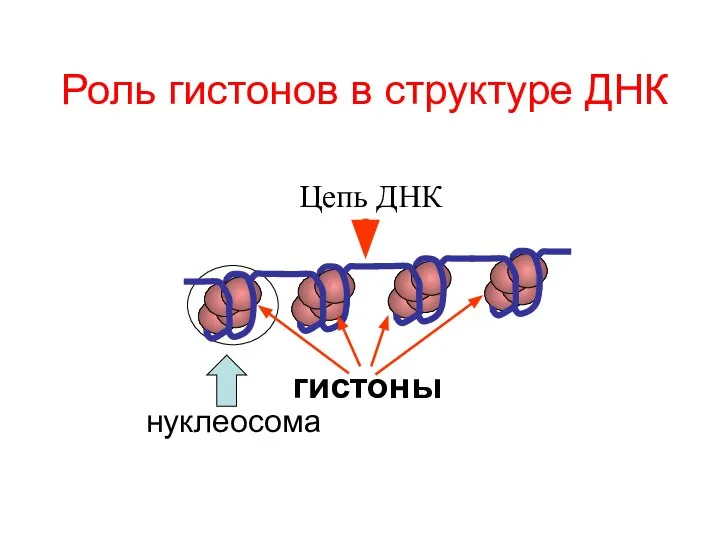
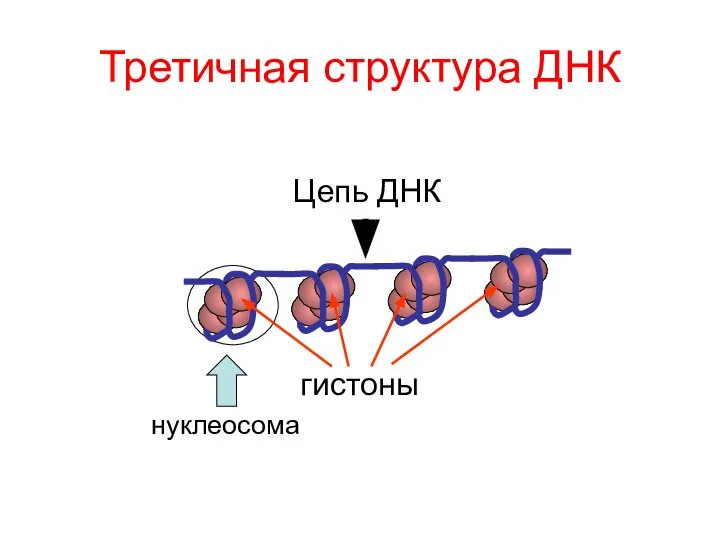
- 70. Роль гистонов в структуре ДНК гистоны Цепь ДНК нуклеосома
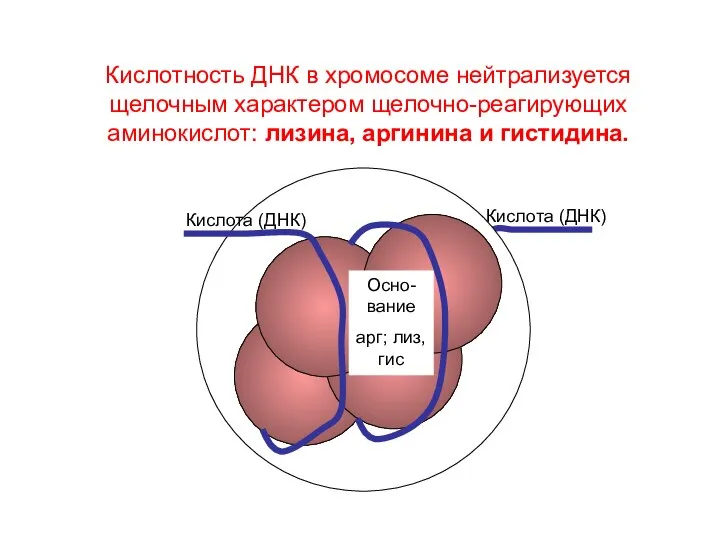
- 71. Кислотность ДНК в хромосоме нейтрализуется щелочным характером щелочно-реагирующих аминокислот: лизина, аргинина и гистидина. Кислота (ДНК) Осно-вание
- 72. Роль протаминов и гистонов Факторы укорочения полинуклеотидной цепи Нейтрализуют кислотность ДНК Являются регуляторами транскрипции (места нуклеосом
- 73. Проламины и глютелины – белки растительного происхождения
- 75. Сложные белки Нуклеопротеины Липопротеины Хромопротеины Фосфопротеины Гликопротеины Белки-ферменты
- 76. Строение нуклеопротеинов
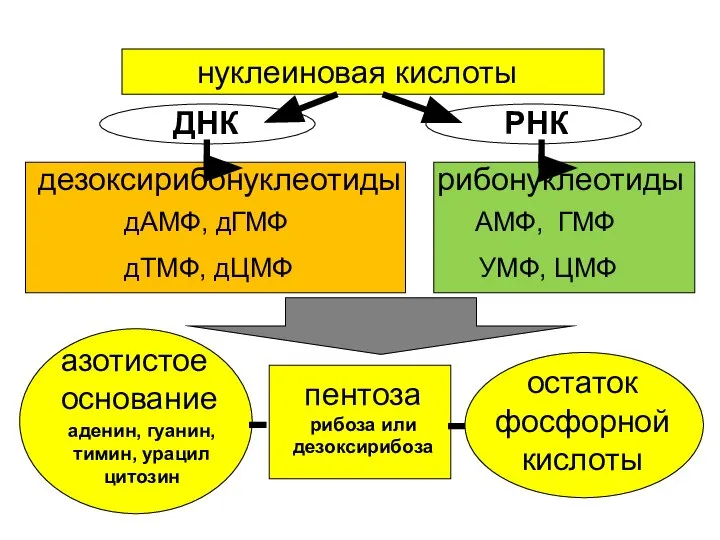
- 77. нуклеиновая кислоты дезоксирибонуклеотиды рибонуклеотиды ДНК РНК дАМФ, дГМФ АМФ, ГМФ дТМФ, дЦМФ УМФ, ЦМФ азотистое основание
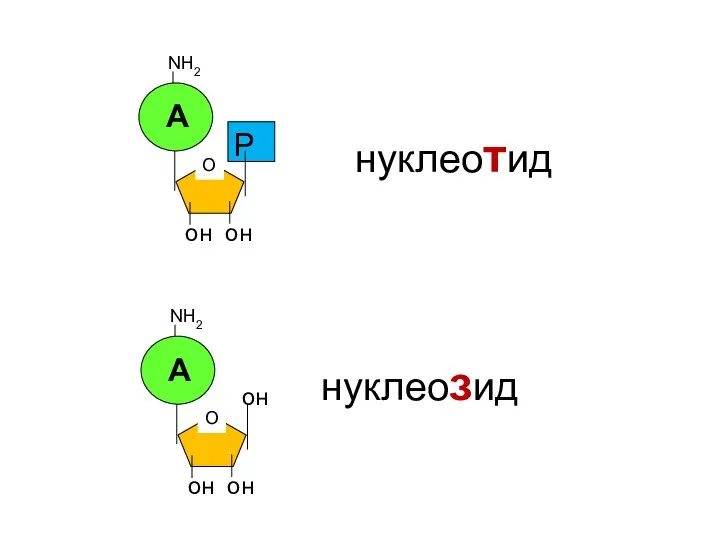
- 78. он он NН2 Р О А он он NН2 О А он нуклеотид нуклеозид
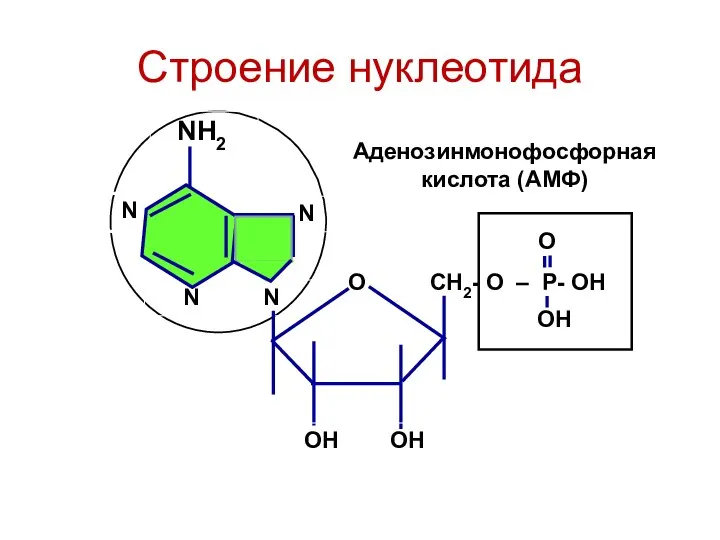
- 79. N N N NH2 N Строение нуклеотида О СН2- О – Р- ОН ОH ОН О
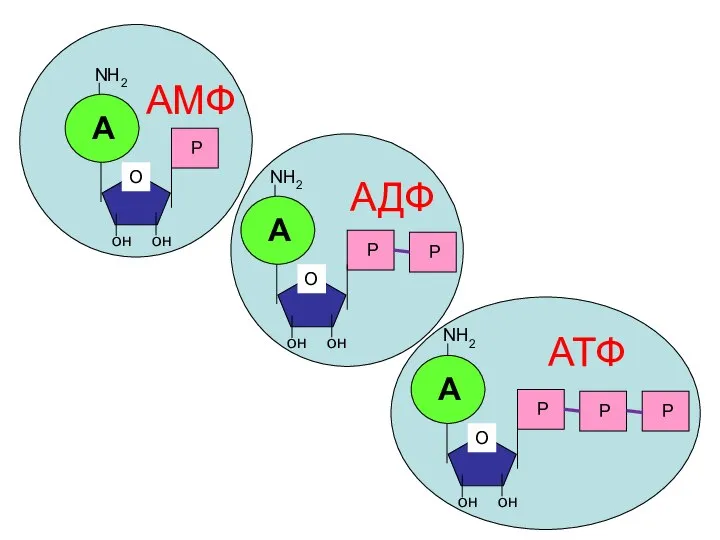
- 80. он он NН2 Р О А он он NН2 Р О А Р он он NН2
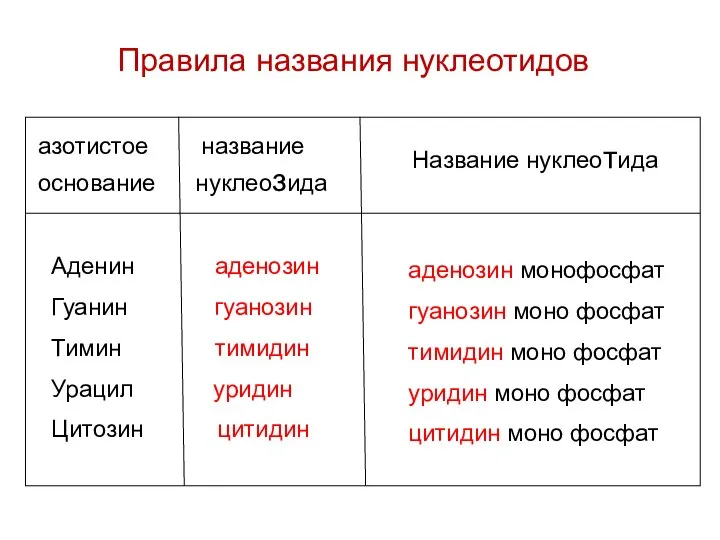
- 81. азотистое название основание нуклеозида Аденин аденозин Гуанин гуанозин Тимин тимидин Урацил уридин Цитозин цитидин аденозин монофосфат
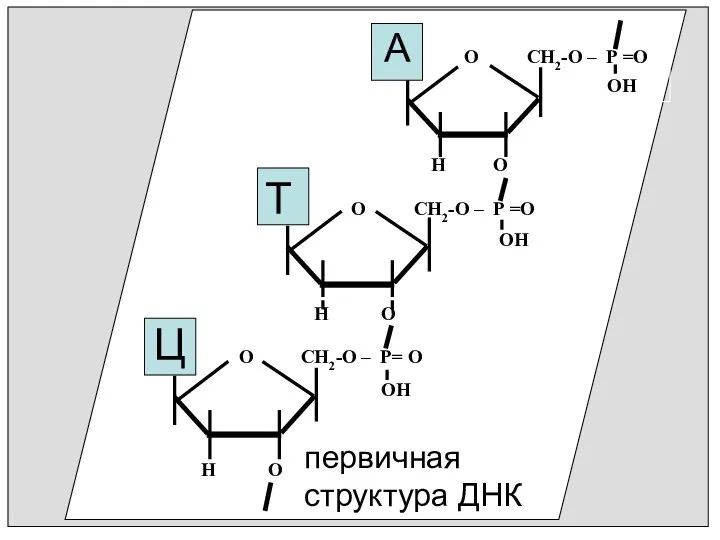
- 82. О СН2-О – Р =О ОН О СН2-О – Р =О Н О ОН О СН2-О
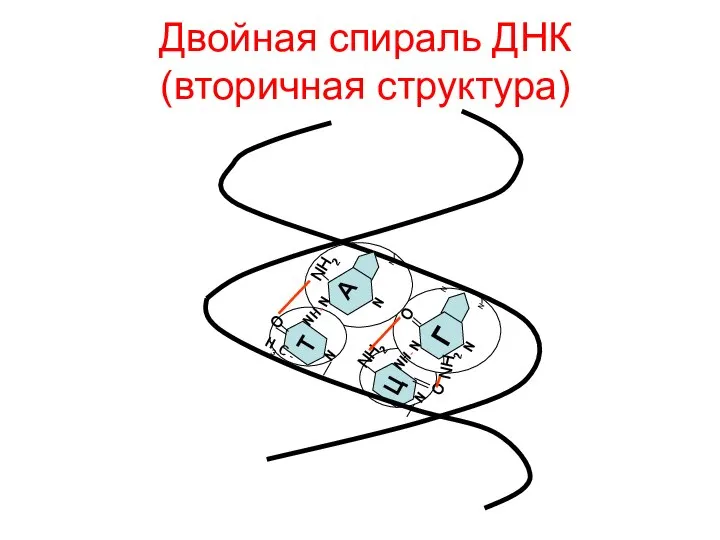
- 83. Двойная спираль ДНК (вторичная структура) O NH2 N N N N NH- N A T H3C
- 84. Третичная структура ДНК гистоны Цепь ДНК нуклеосома
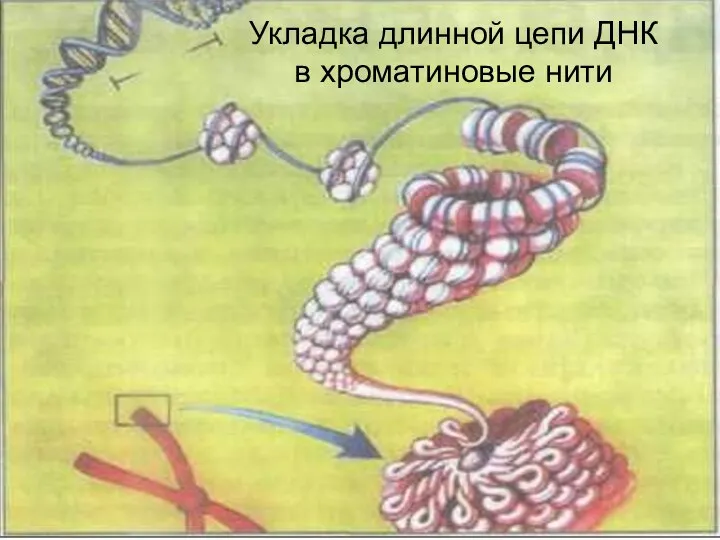
- 85. Укладка длинной цепи ДНК в хроматиновые нити
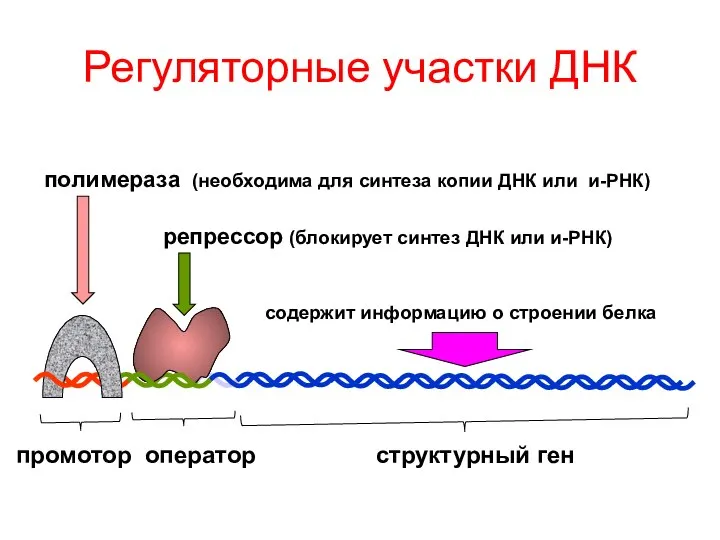
- 86. Регуляторные участки ДНК промотор оператор структурный ген полимераза (необходима для синтеза копии ДНК или и-РНК) репрессор
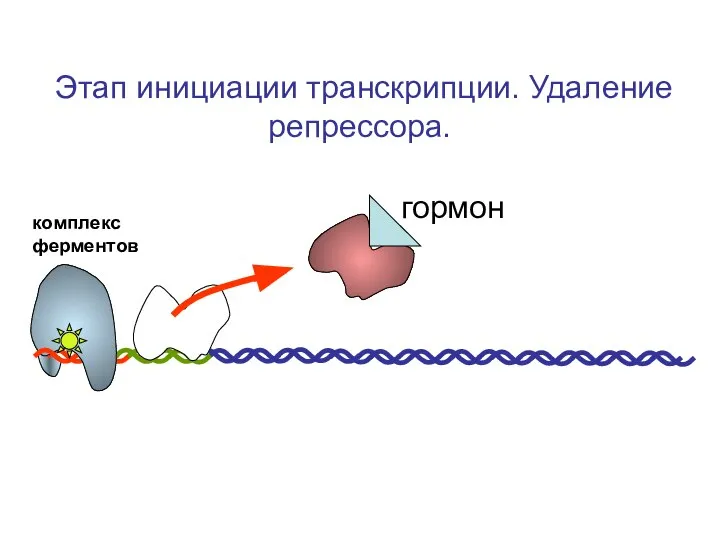
- 87. Этап инициации транскрипции. Удаление репрессора. комплекс ферментов гормон
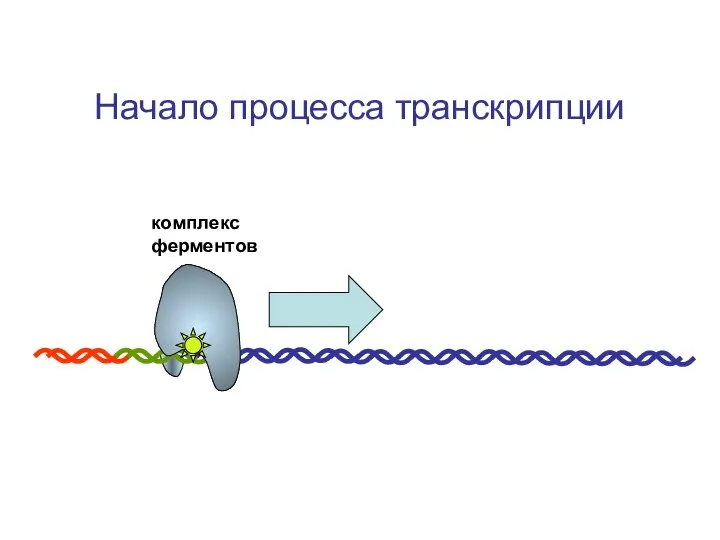
- 88. Начало процесса транскрипции комплекс ферментов
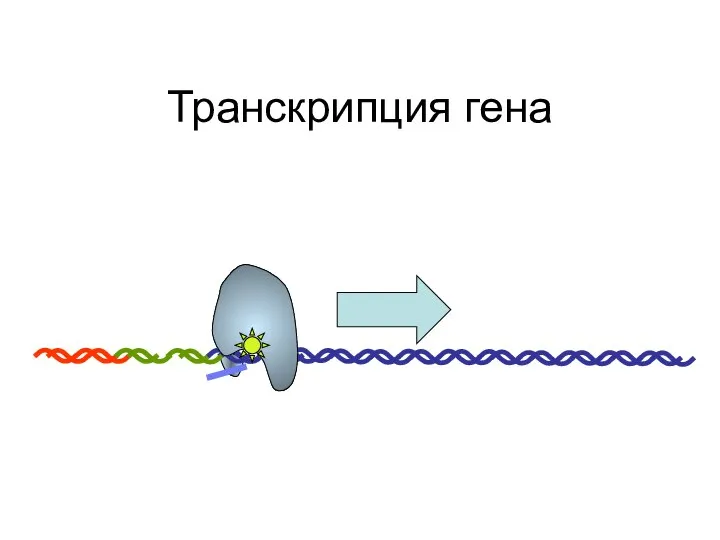
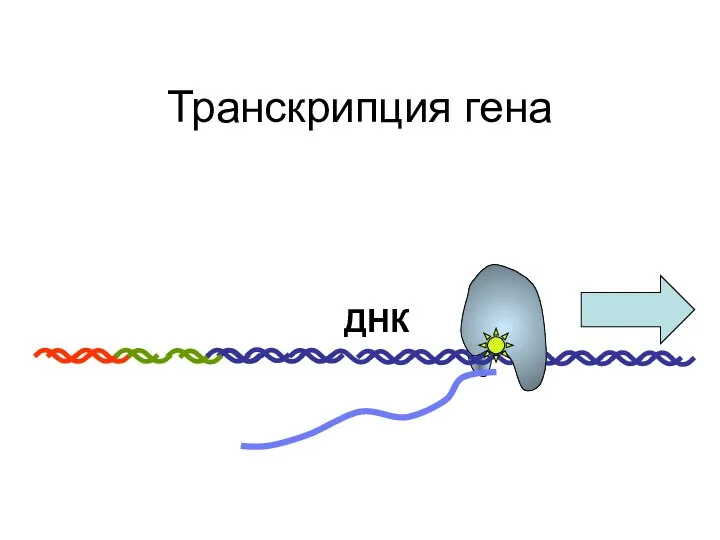
- 89. Транскрипция гена
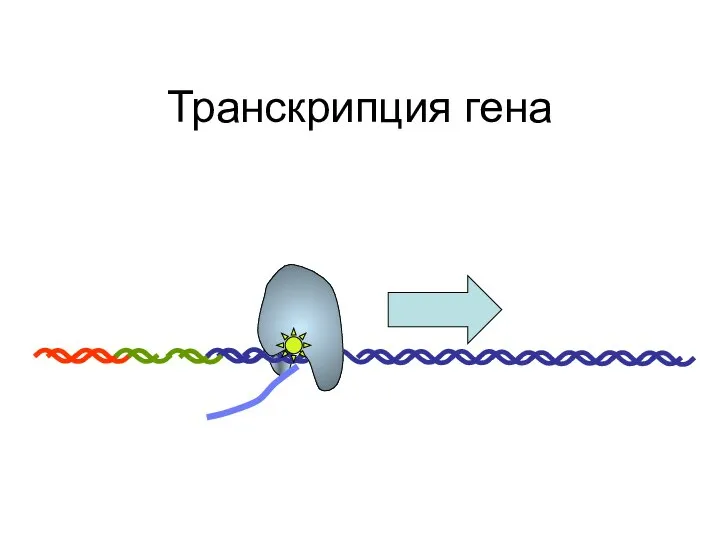
- 90. Транскрипция гена
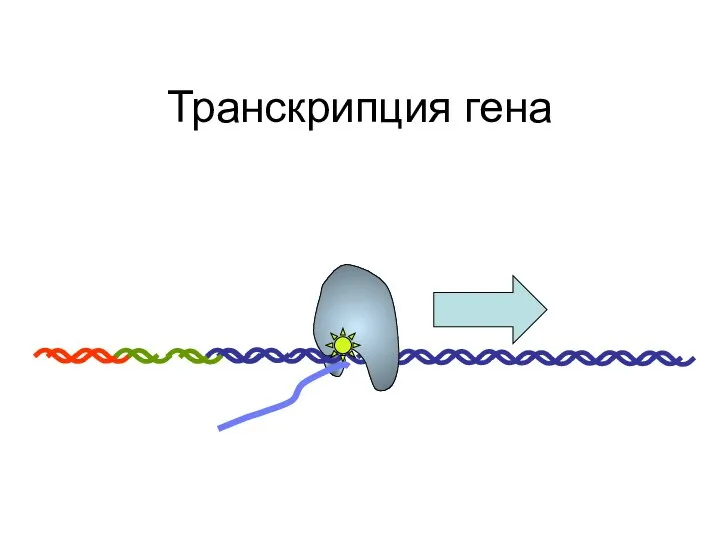
- 91. Транскрипция гена
- 92. Транскрипция гена
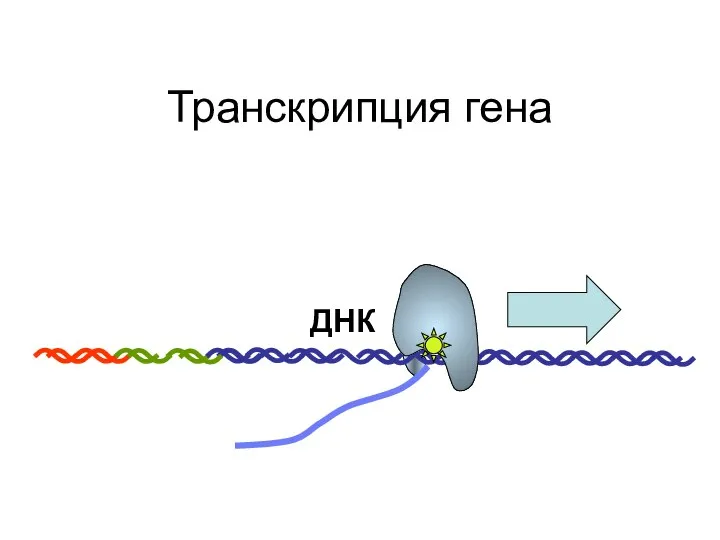
- 93. Транскрипция гена ДНК
- 94. Транскрипция гена ДНК
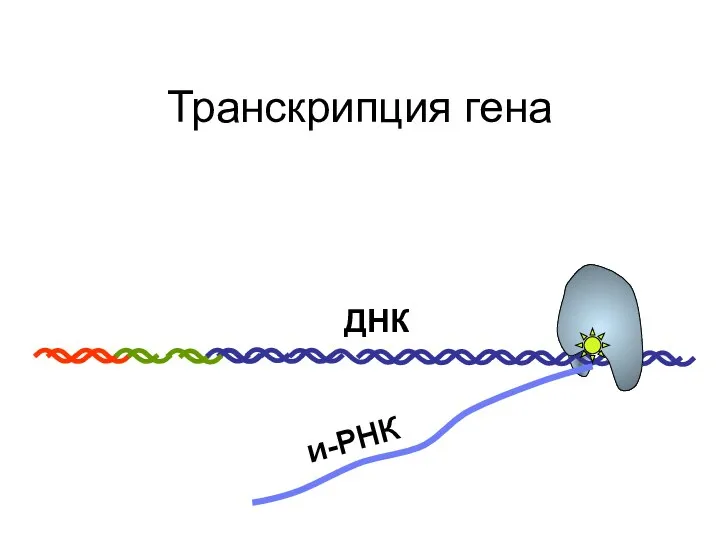
- 95. Транскрипция гена и-РНК ДНК
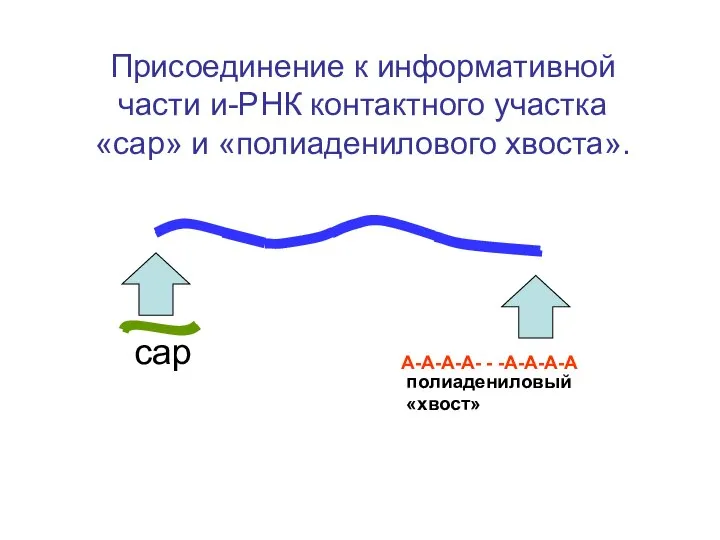
- 96. А-А-А-А- - -А-А-А-А сар полиадениловый «хвост» Присоединение к информативной части и-РНК контактного участка «сар» и «полиаденилового
- 97. А-А-А-А- - -А-А-А-А Завершение синтеза и-РНК сар
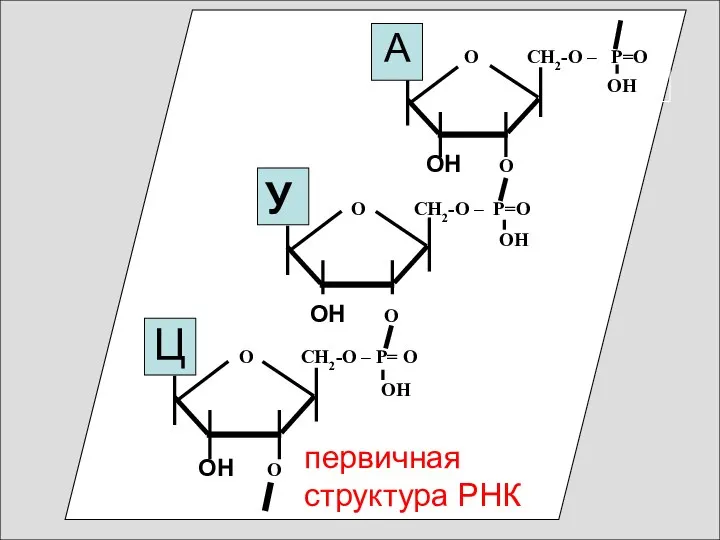
- 98. О СН2-О – Р=О ОН О СН2-О – Р=О ОН О ОН О СН2-О – Р=
- 99. Задача -1 Сколько нуклеотидов содержит информативная часть и-РНК, кодирующая белок, состоящий из 100 аминокислот?
- 100. Задача-2 Кто читает информацию, заключенную в и-РНК?
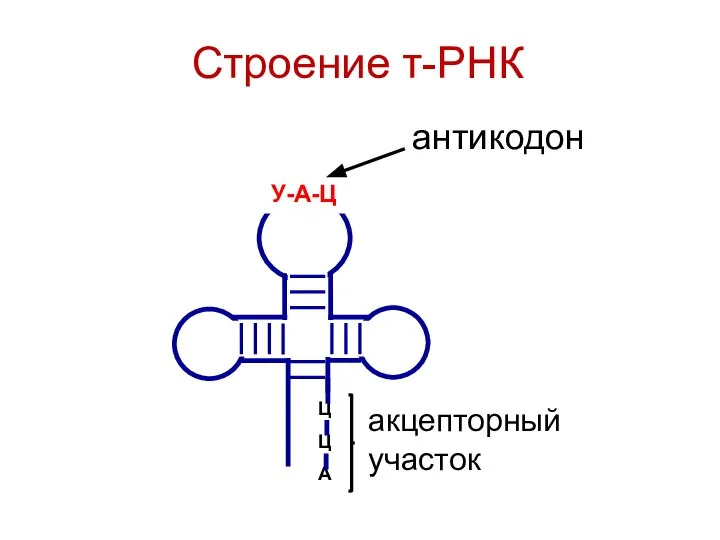
- 101. Строение т-РНК Ц Ц А антикодон акцепторный участок У-А-Ц
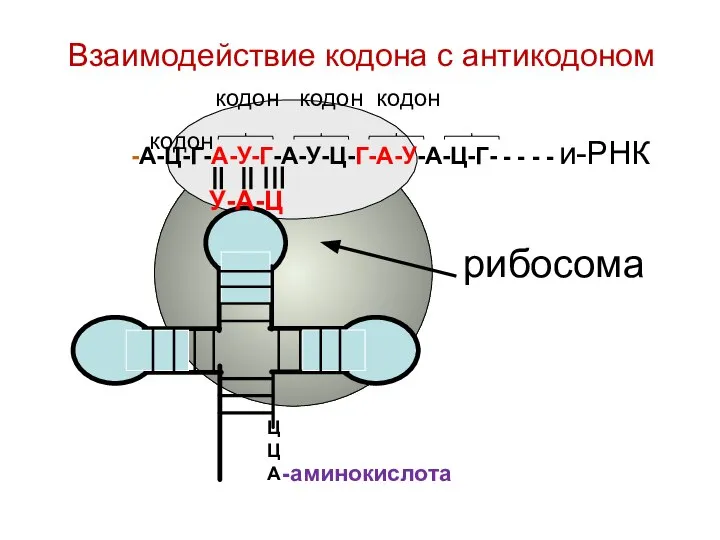
- 102. Взаимодействие кодона с антикодоном кодон кодон кодон кодон -А-Ц-Г-А-У-Г-А-У-Ц-Г-А-У-А-Ц-Г- - - - - и-РНК У-А-Ц ЦЦА
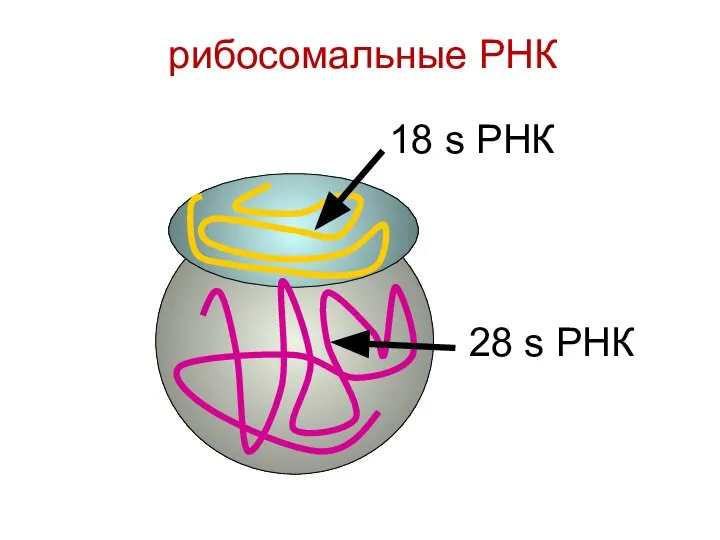
- 103. 18 s РНК 28 s РНК рибосомальные РНК
- 104. Строение липопротеинов
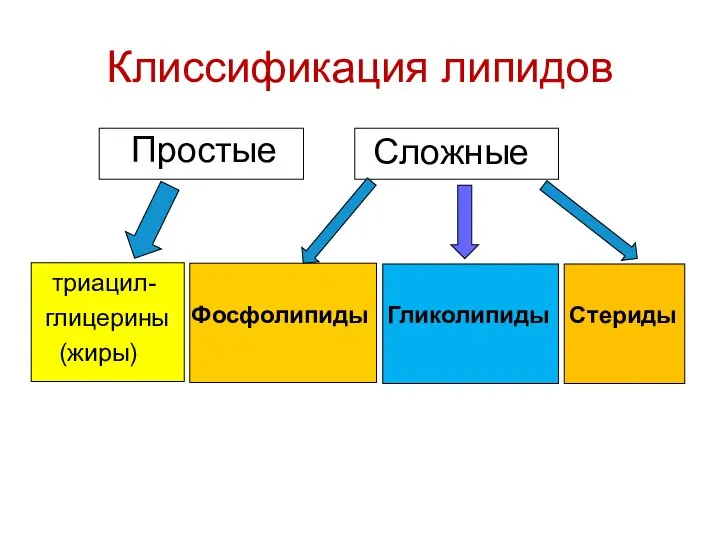
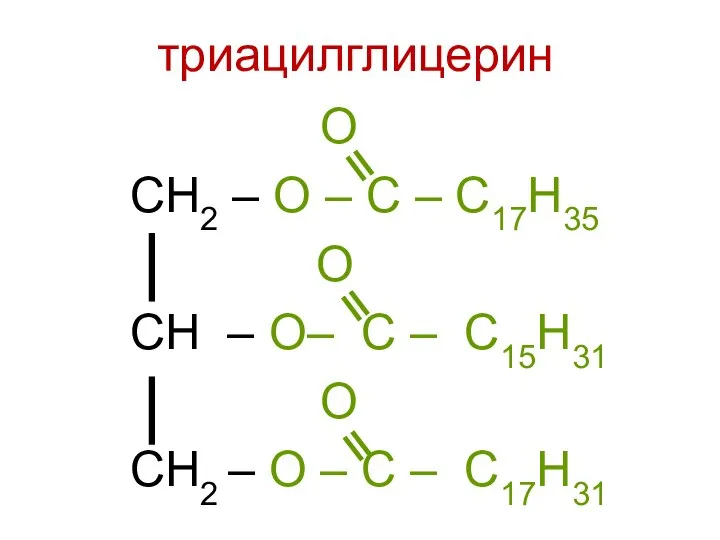
- 105. Клиссификация липидов триацил- глицерины (жиры) Фосфолипиды Гликолипиды Стериды Сложные Простые
- 106. О СН2 – О – С – С17Н35 О СН – О– С – С15Н31 О
- 107. С15Н31 СООН – пальмитиновая кислота С17Н35 СООН – стеариновая кислота С17Н33 СООН – олеиновая кислота С17Н31
- 108. Н3С- СН2-СН2-СН2= СН2-СН2-СН2= СН2-СН2-СН2- СН2-СН2-СН2- СН2-СН2-СООН 16 15 14 13 12 11 10 9 8 7
- 109. Непредельные высшие кислоты не синтезируются в организме человека. Поэтому люди испытывают необходимость ежедневного приема ненасыщенных жирных
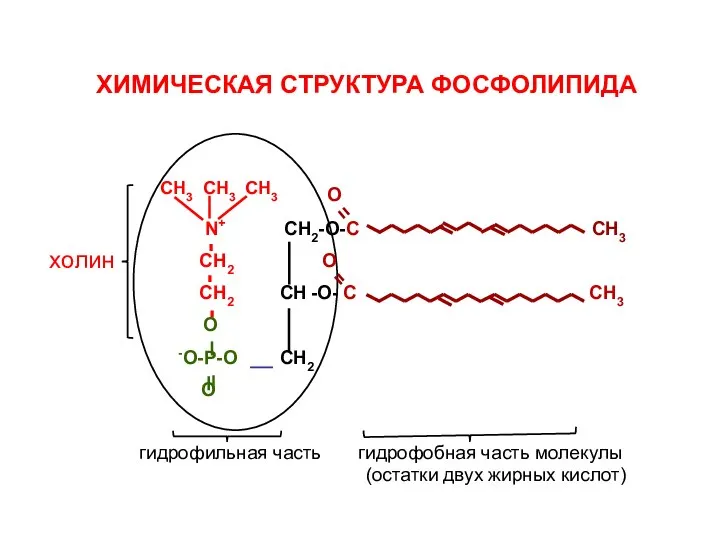
- 110. ХИМИЧЕСКАЯ СТРУКТУРА ФОСФОЛИПИДА гидрофильная часть гидрофобная часть молекулы (остатки двух жирных кислот) О N+ СН2-О-С СН3
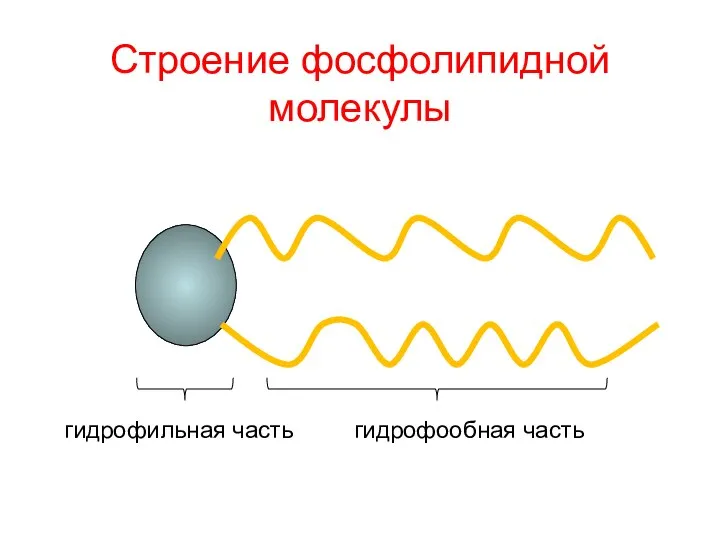
- 111. Строение фосфолипидной молекулы гидрофильная часть гидрофообная часть
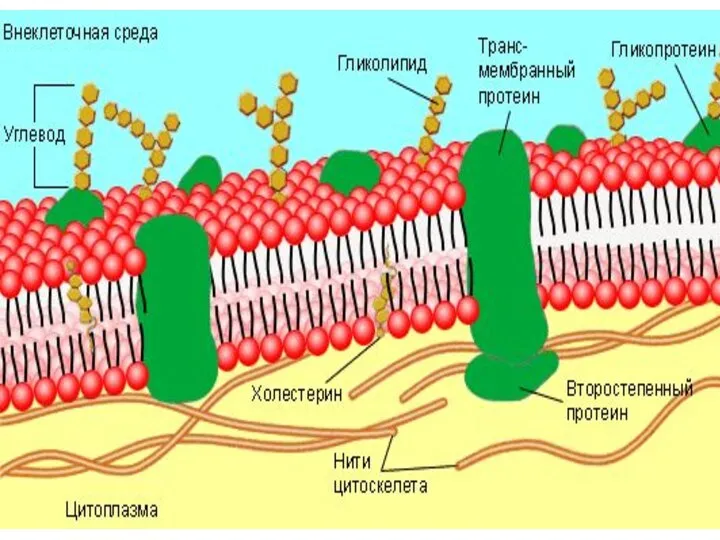
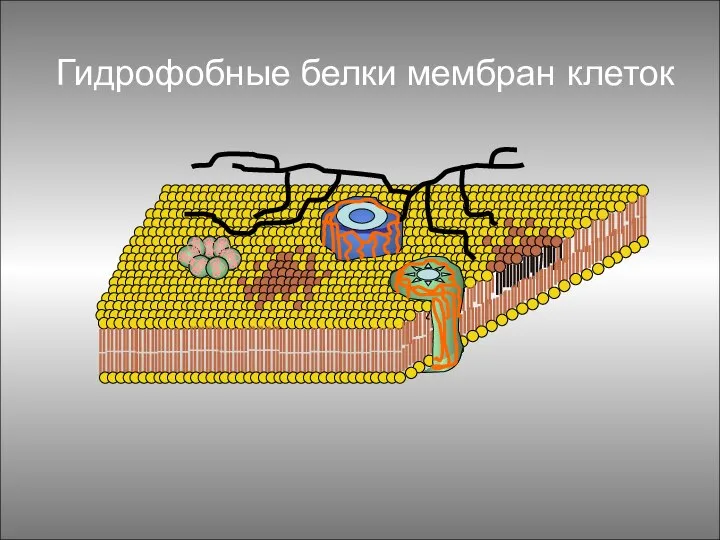
- 112. Гидрофобные белки мембран клеток
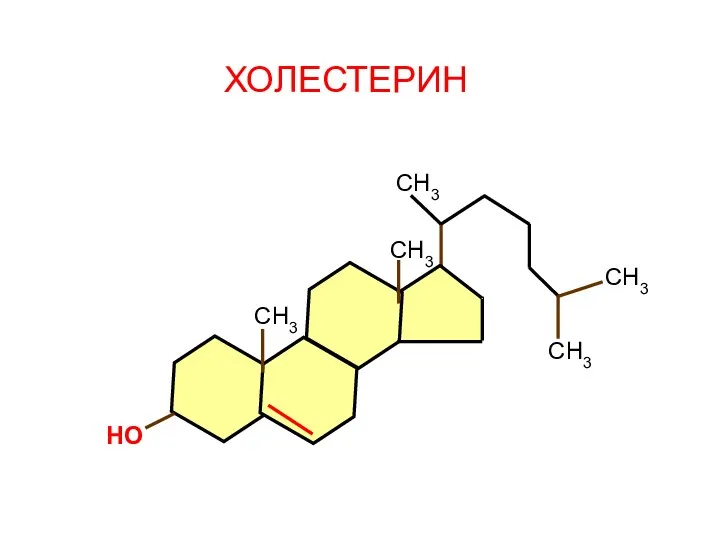
- 113. СН3 СН3 СН3 СН3 СН3 НО ХОЛЕСТЕРИН
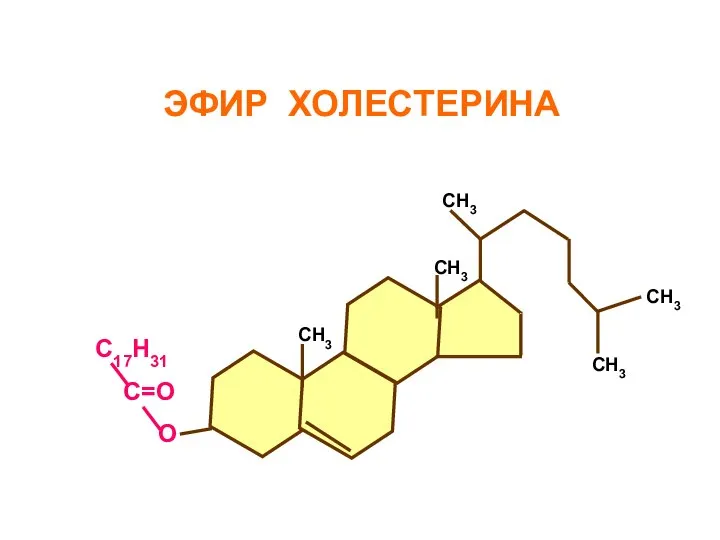
- 114. СН3 СН3 СН3 СН3 СН3 С17Н31 С=О О ЭФИР ХОЛЕСТЕРИНА
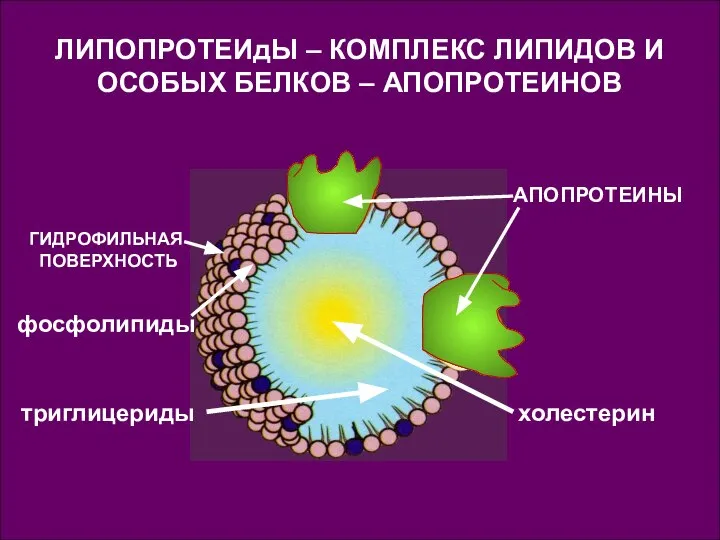
- 115. ЛИПОПРОТЕИдЫ – КОМПЛЕКС ЛИПИДОВ И ОСОБЫХ БЕЛКОВ – АПОПРОТЕИНОВ АПОПРОТЕИНЫ холестерин фосфолипиды ГИДРОФИЛЬНАЯ ПОВЕРХНОСТЬ триглицериды
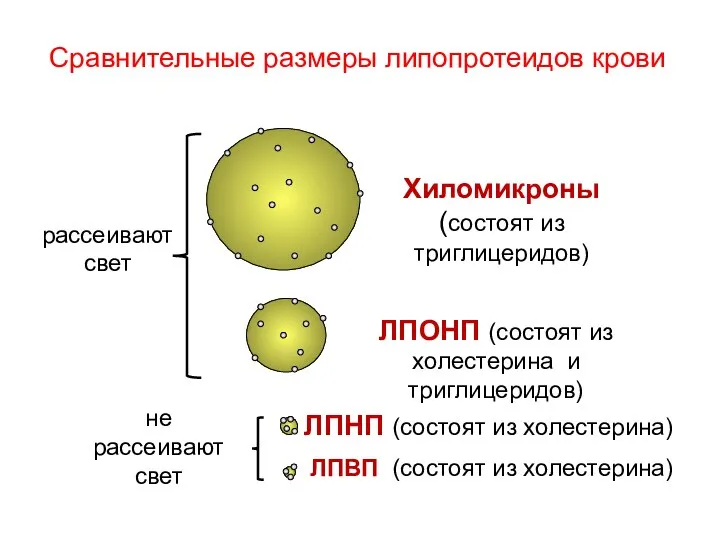
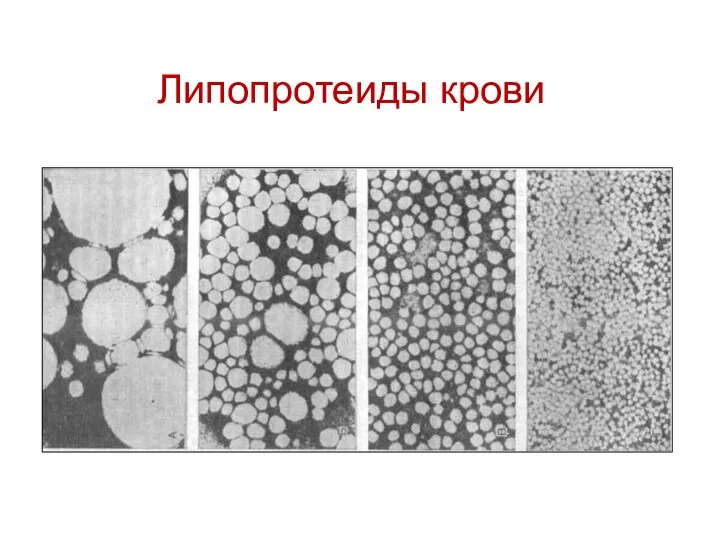
- 116. Сравнительные размеры липопротеидов крови Хиломикроны (состоят из триглицеридов) ЛПОНП (состоят из холестерина и триглицеридов) ЛПНП (состоят
- 117. Липопротеиды крови
- 118. Строение хромопротеинов
- 119. Примеры белков хромопротеинов миоглобин гемоглобин цитохромы
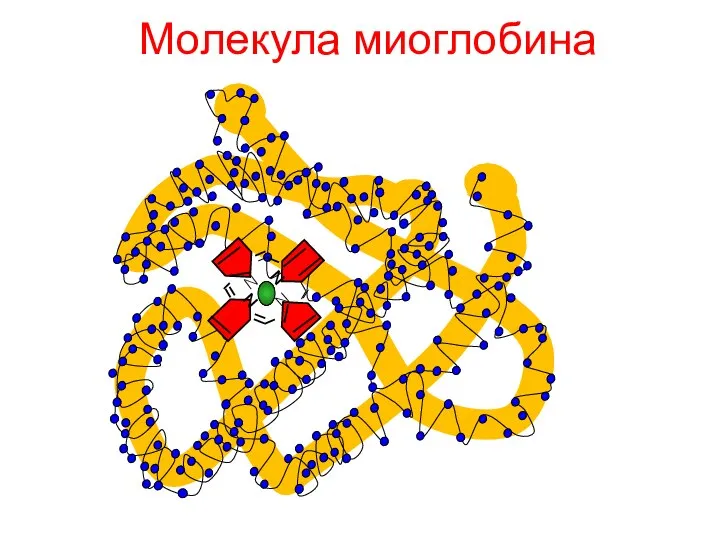
- 120. Молекула миоглобина N N N N
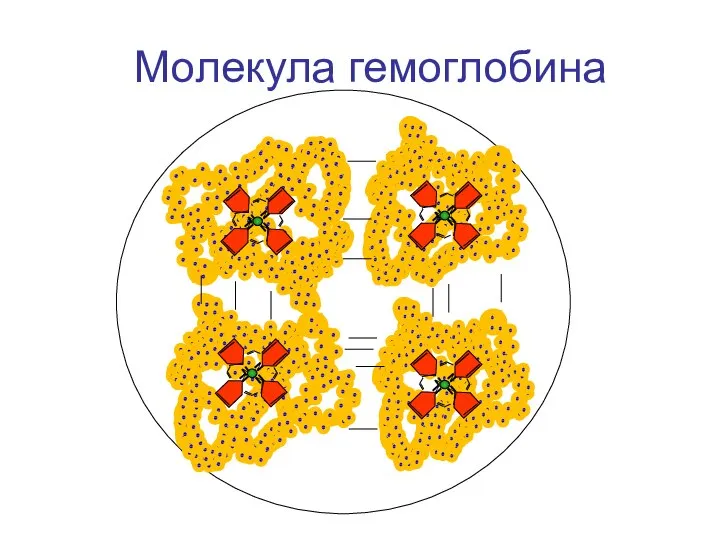
- 121. Молекула гемоглобина N N N N N N N N N N N N N N
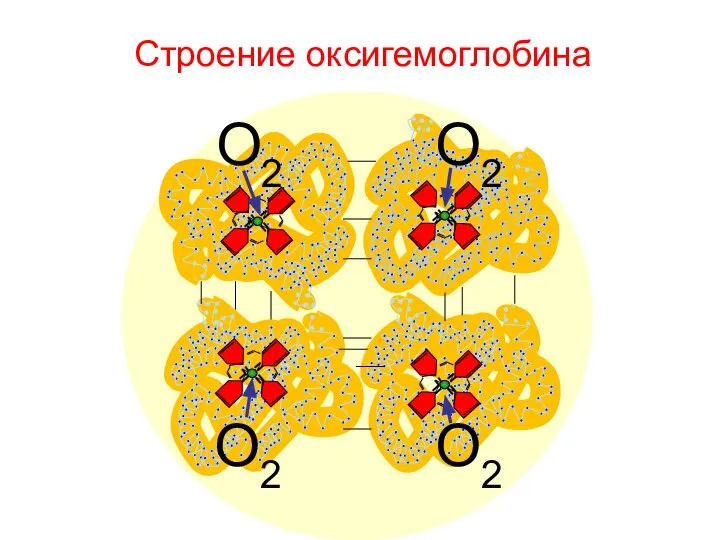
- 122. Строение оксигемоглобина N N N N N N N N N N N N N N
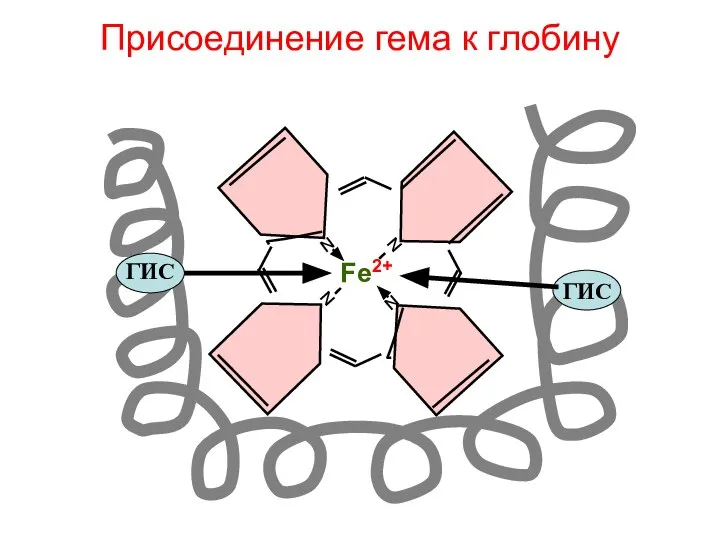
- 123. Присоединение гема к глобину N N N N Fe2+ ГИС ГИС
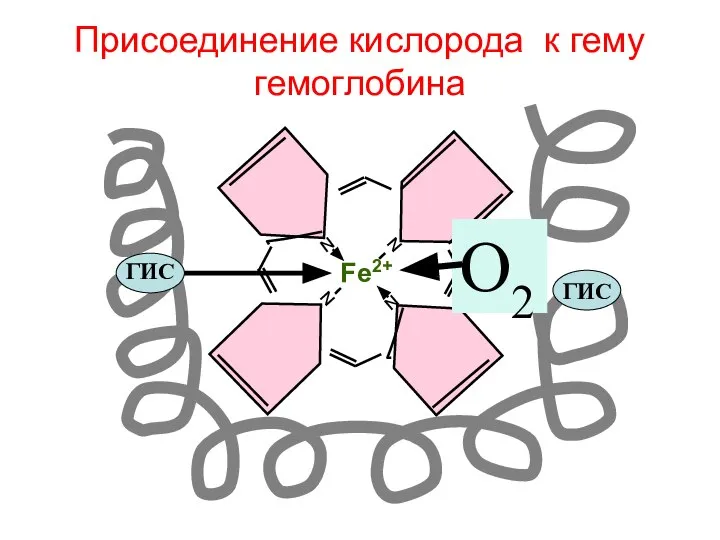
- 124. Присоединение кислорода к гему гемоглобина N N N N Fe2+ ГИС ГИС О2
- 125. Кооперативные изменения конформации протомеров гемоглобина при присоединении О2 --О2 --О2 3О2 О2 венозная кровь артериальная кровь
- 126. Изменение конформации протомеров гемоглобина при отдаче О2 тканям О2 О2 артериальная кровь венозная кровь О2 О2
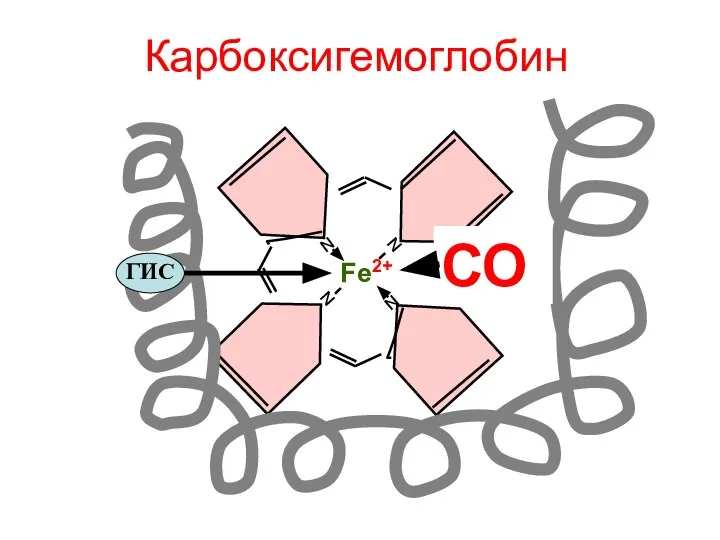
- 127. Карбоксигемоглобин N N N N Fe2+ ГИС СО
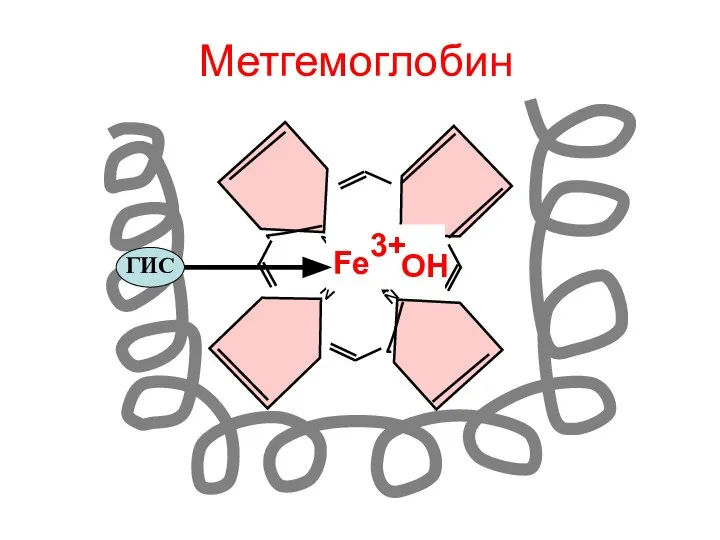
- 128. Метгемоглобин N N N N Fe3+ ГИС ОН
- 129. Гликопротеины (преобладает белковая часть) Протеогликаны (преобладает углеводный компонент)
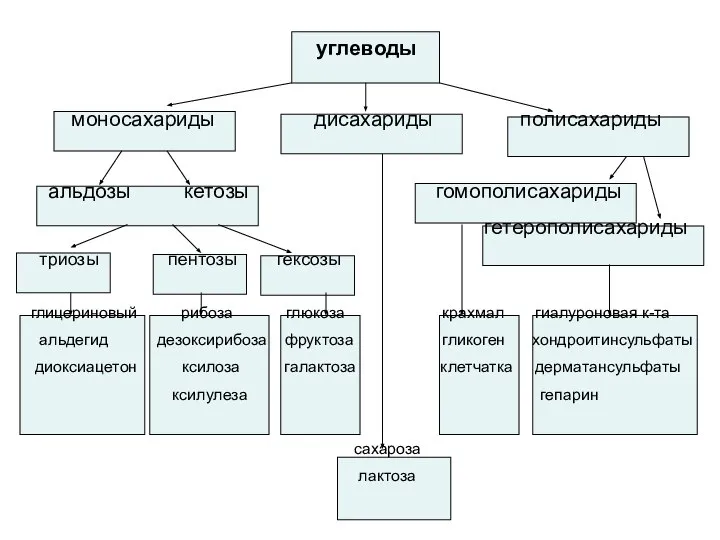
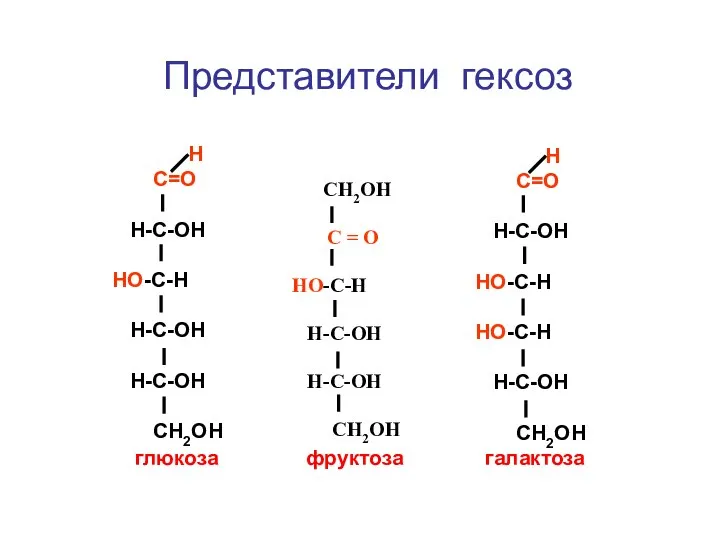
- 130. углеводы моносахариды дисахариды полисахариды альдозы кетозы гомополисахариды гетерополисахариды триозы пентозы гексозы глицериновый рибоза глюкоза крахмал гиалуроновая
- 131. Н С=О Н-С-ОН СН2ОН СН2ОН С=О СН2ОН СН3 С=О СН2ОН Н С=О Н-С-Н СН2ОН Есть ли
- 132. Н С=О Н-С-ОН СН2ОН СН2ОН С=О СН2ОН диоксиацетон глицериновый альдегид формулы триоз
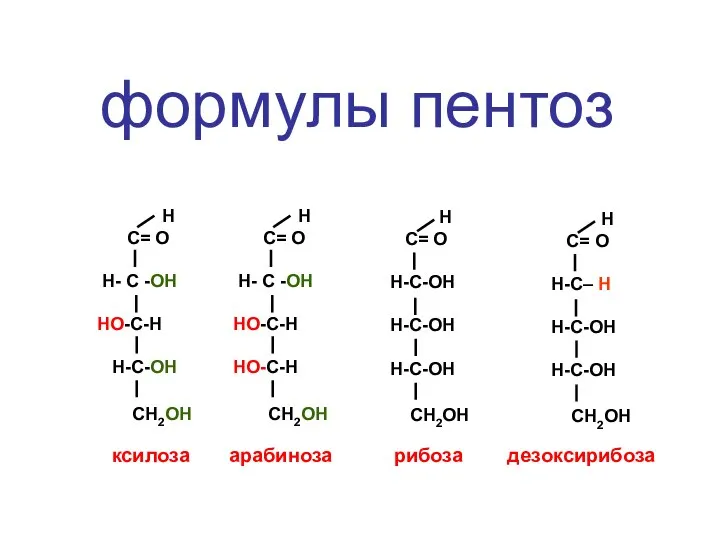
- 133. Н С= О Н- С -ОН НО-С-Н H-C-ОН СН2ОН Н С= О Н-С-ОН Н-С-ОН H-C-ОН СН2ОН
- 134. Н С=О Н-С-ОН HO-С-Н Н-С-ОН H-C-OH СН2ОН СН2ОН С = О НО-С-Н Н-С-ОН Н-С-ОН СН2ОН Н
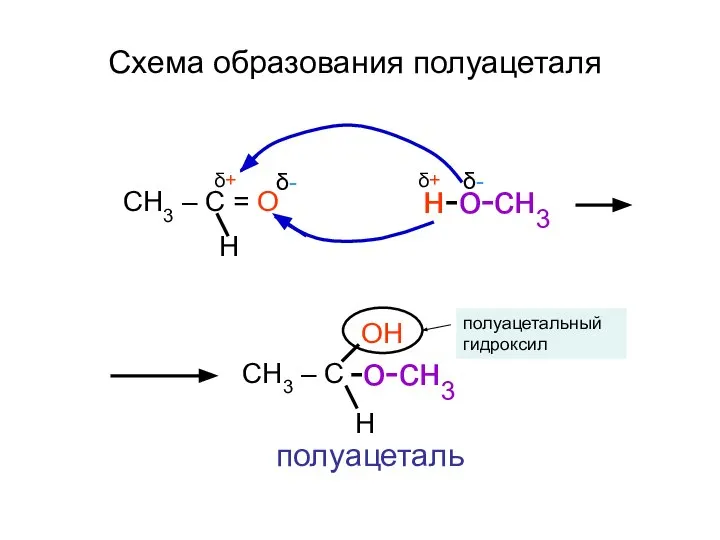
- 135. СН3 – С = О Н н-о-сн3 δ- δ+ δ- δ+ СН3 – С -о-сн3 Н
- 136. С = О СН2ОН ОН Н ОН ОН ОН О СН2ОН ОН ОН ОН ОН Н
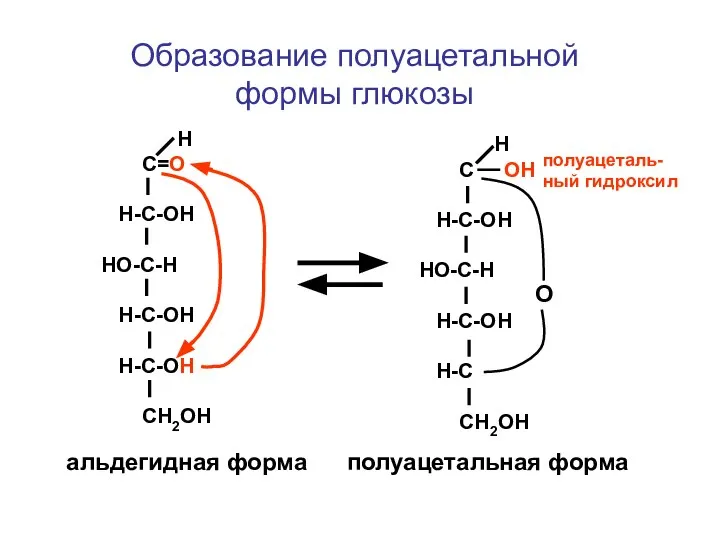
- 137. Н С=О Н-С-ОН HO-С-Н Н-С-ОН H-C-OH СН2ОН Н С ОН Н-С-ОН HO-С-Н Н-С-ОН H-C СН2ОН О
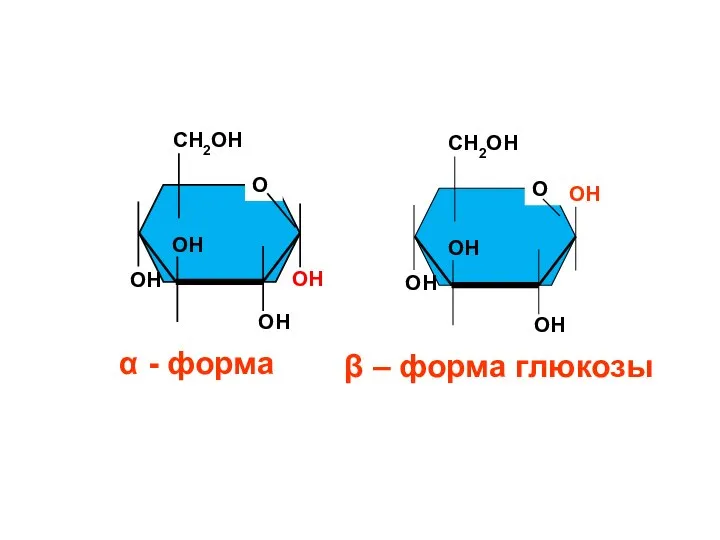
- 138. О СН2ОН ОН ОН ОН ОН β – форма глюкозы О СН2ОН ОН ОН ОН ОН
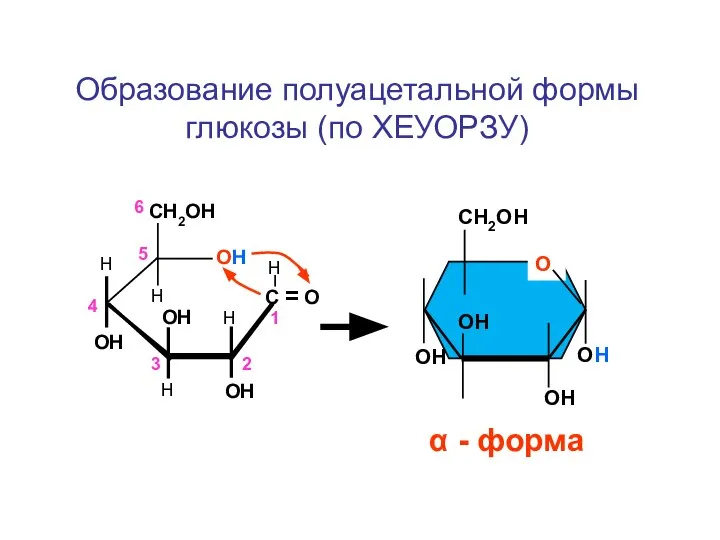
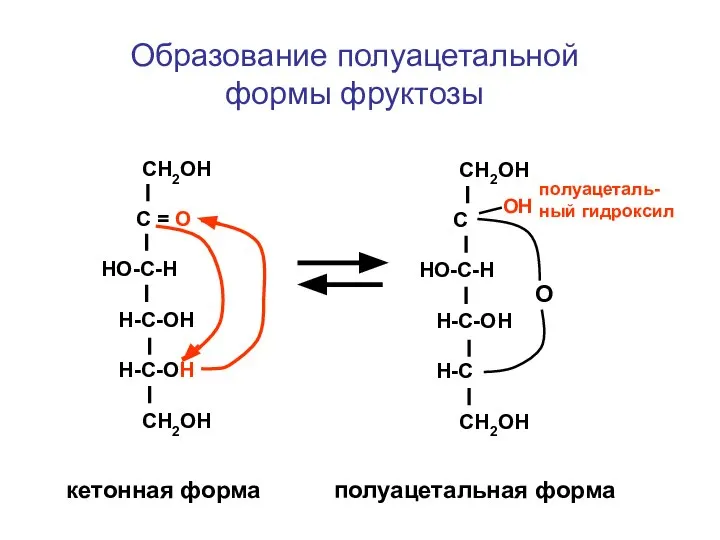
- 139. СН2ОН С = О HO-С-Н Н-С-ОН H-C-OH СН2ОН СН2ОН С HO-С-Н Н-С-ОН H-C СН2ОН О Образование
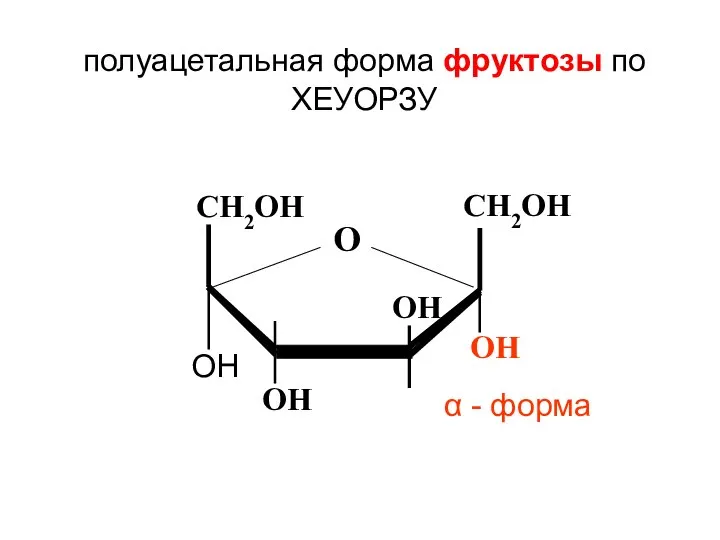
- 140. CH2ОН О CH2ОН ОН ОН ОН ОН полуацетальная форма фруктозы по ХЕУОРЗУ α - форма
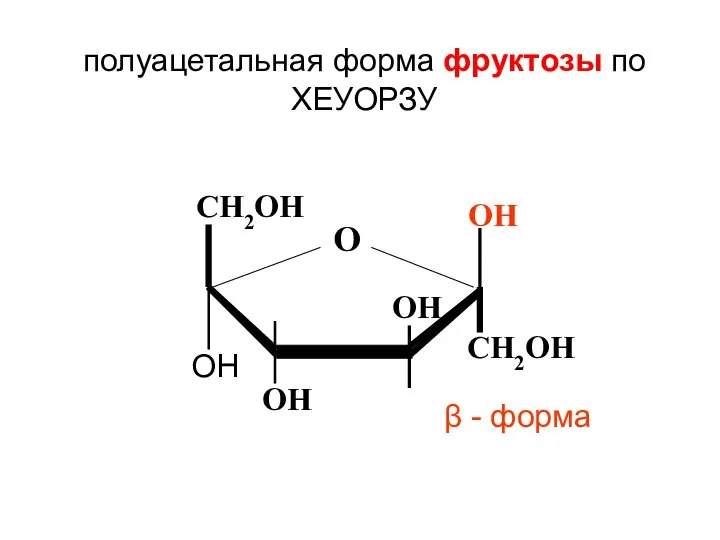
- 141. CH2ОН О CH2ОН ОН ОН ОН ОН полуацетальная форма фруктозы по ХЕУОРЗУ β - форма
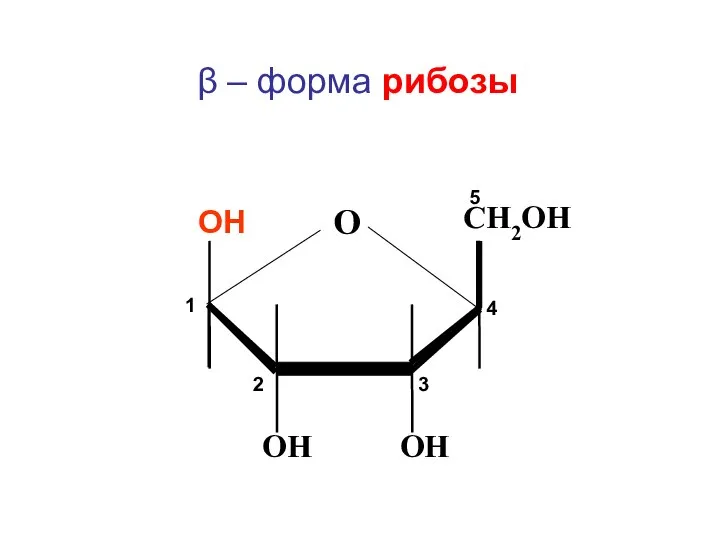
- 142. CH2ОН ОН ОН О ОН β – форма рибозы 1 2 3 4 5
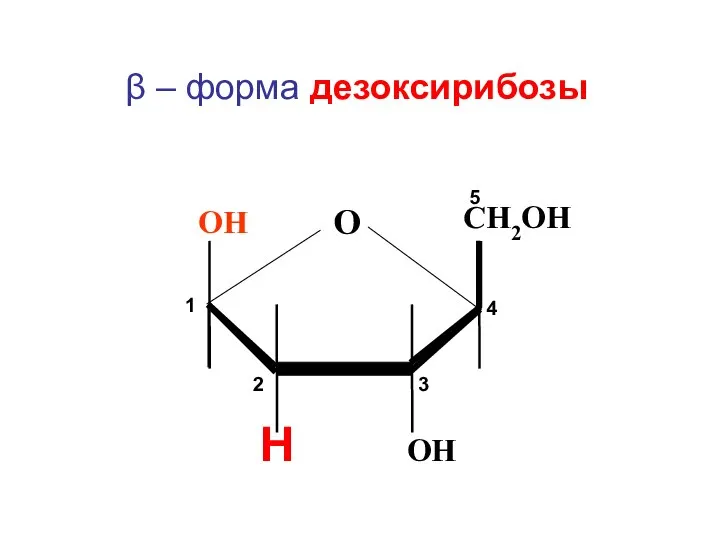
- 143. CH2ОН Н ОН О ОН β – форма дезоксирибозы 1 2 3 4 5
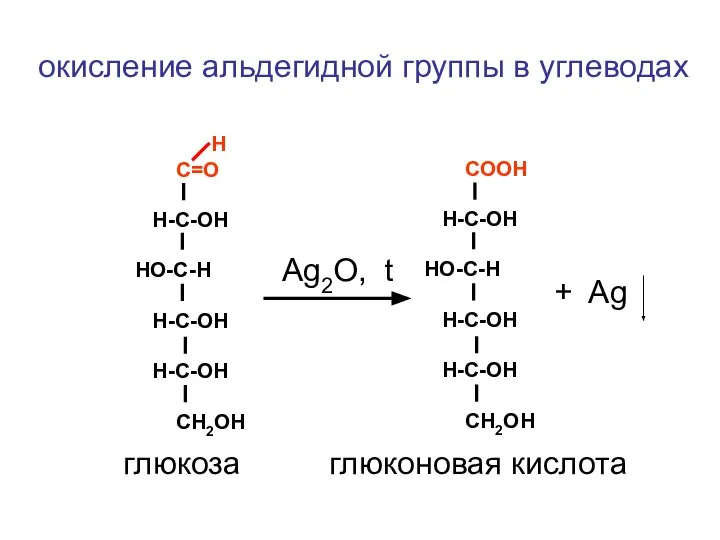
- 144. Н С=О Н-С-ОН HO-С-Н Н-С-ОН H-C-OH СН2ОН СООН Н-С-ОН HO-С-Н Н-С-ОН H-C-OH СН2ОН Аg2O, t +
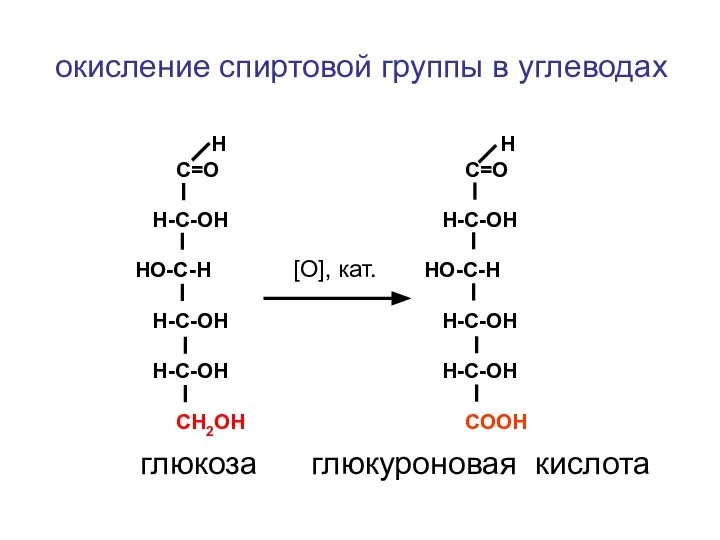
- 145. Н С=О Н-С-ОН HO-С-Н Н-С-ОН H-C-OH СН2ОН глюкоза глюкуроновая кислота окисление спиртовой группы в углеводах Н
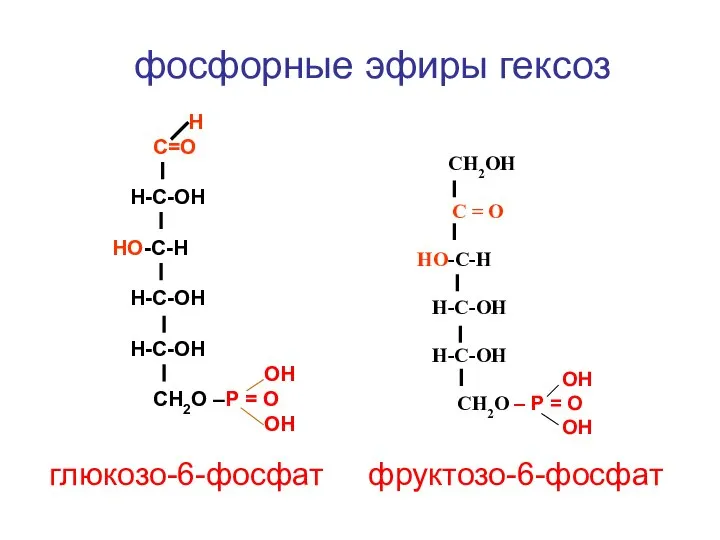
- 146. Н С=О Н-С-ОН HO-С-Н Н-С-ОН H-C-OH ОН СН2О –Р = О ОН СН2ОН С = О
- 147. О СН3 ОН ОН ОН ОН О СН2ОН ОН ОН ОН ОН О СН2ОН ОН ОН
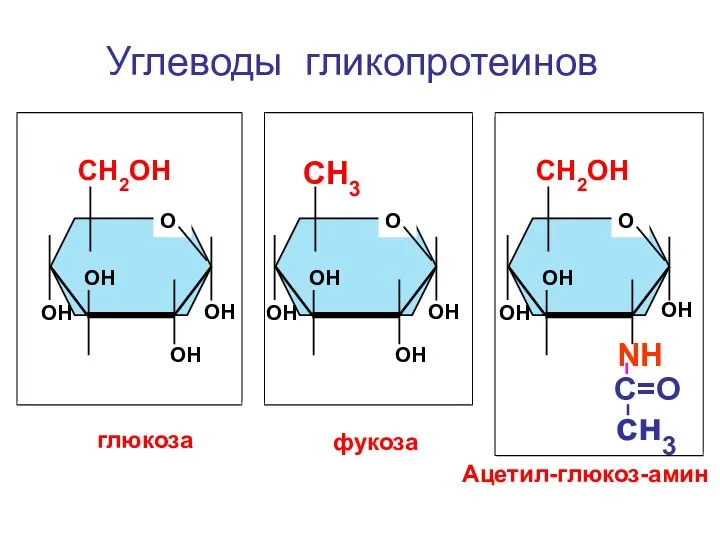
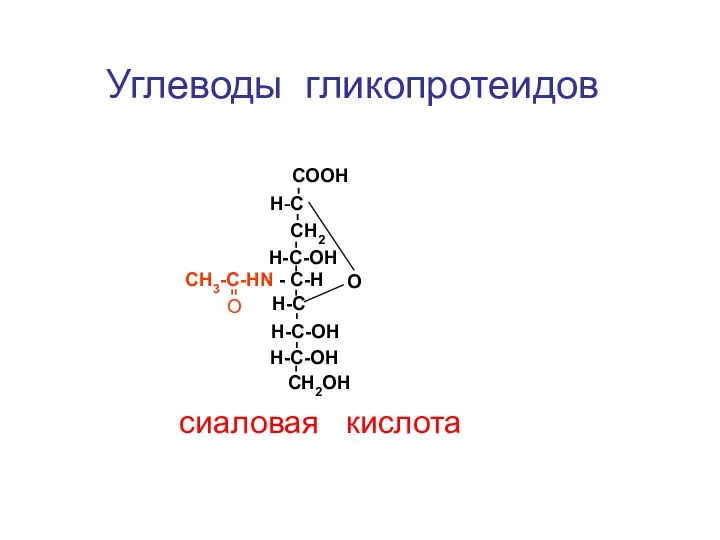
- 148. СООН Н-С СН2 Н-С-ОН СН3-С-НN - С-Н Н-С Н-С-ОН Н-С-ОН СН2ОН О О сиаловая кислота Углеводы
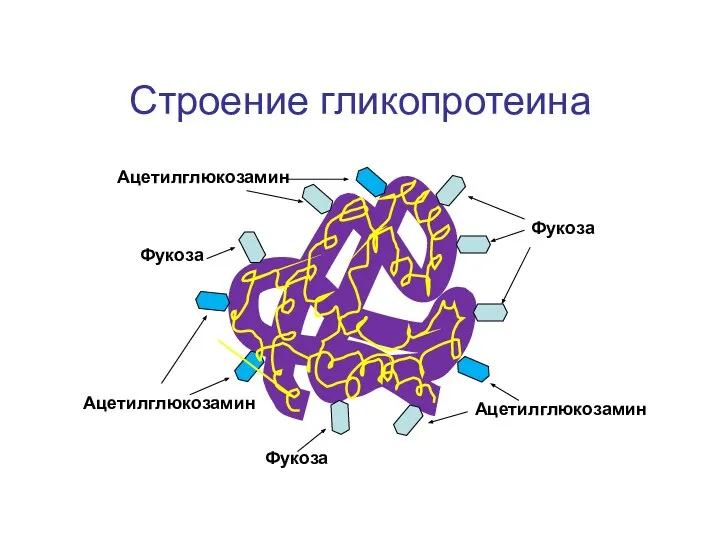
- 149. Строение гликопротеина Фукоза Фукоза Фукоза Ацетилглюкозамин Ацетилглюкозамин Ацетилглюкозамин
- 150. Роль углеводного компонента в гликопротеинах Стабилизирует молекулу белка; Защищает белок от протеолиза (расщепления ферментами);
- 151. Протеогликаны Преобладает углеводный компонент Состоит из белка и гетерополисахарида
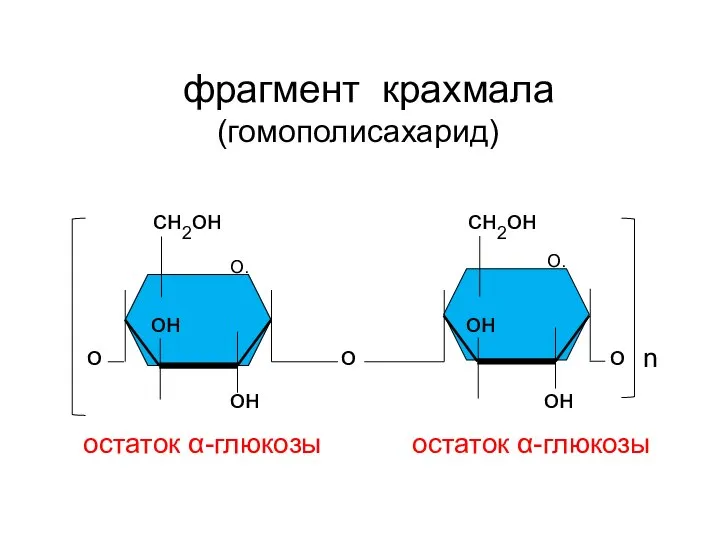
- 152. сн2он сн2он он он о о о он он n фрагмент крахмала (гомополисахарид) остаток α-глюкозы остаток
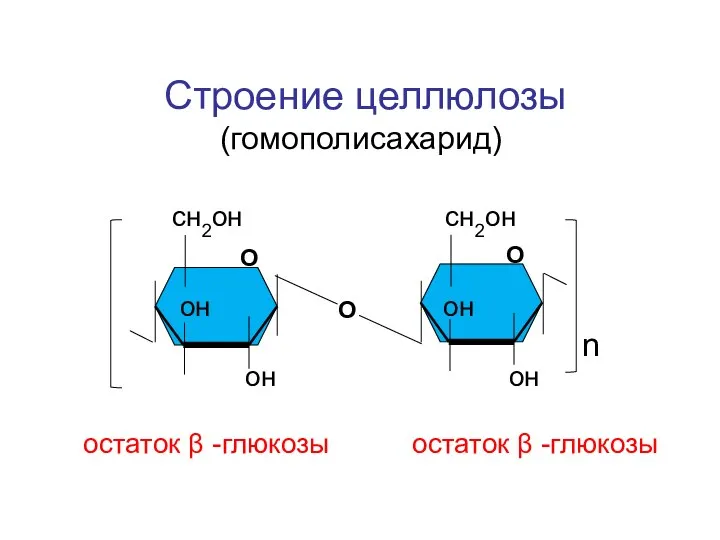
- 153. сн2он сн2он он он он он n Строение целлюлозы (гомополисахарид) О О О остаток β -глюкозы
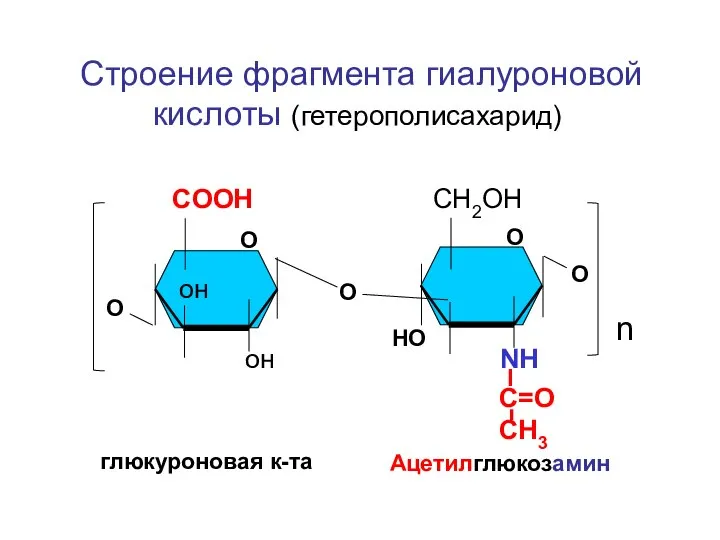
- 154. COOH СН2ОН он он NH n Строение фрагмента гиалуроновой кислоты (гетерополисахарид) О О О C=OCH3 глюкуроновая
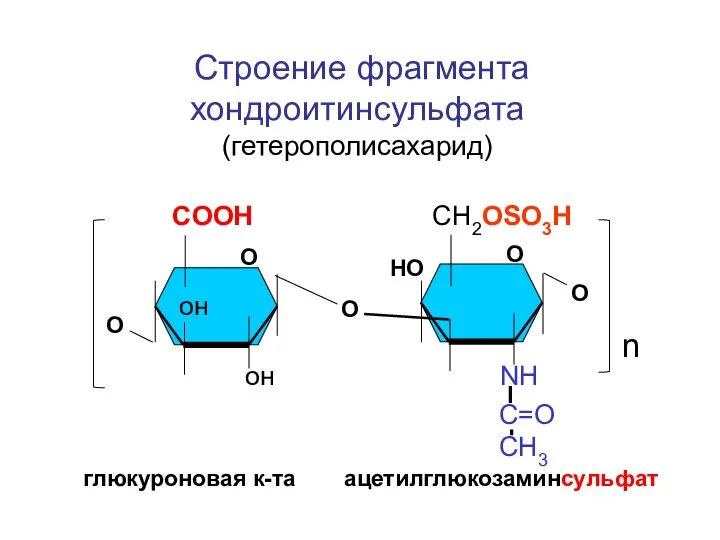
- 155. COOH СН2OSO3H он он NH n Строение фрагмента хондроитинсульфата (гетерополисахарид) О О О C=OCH3 глюкуроновая к-та
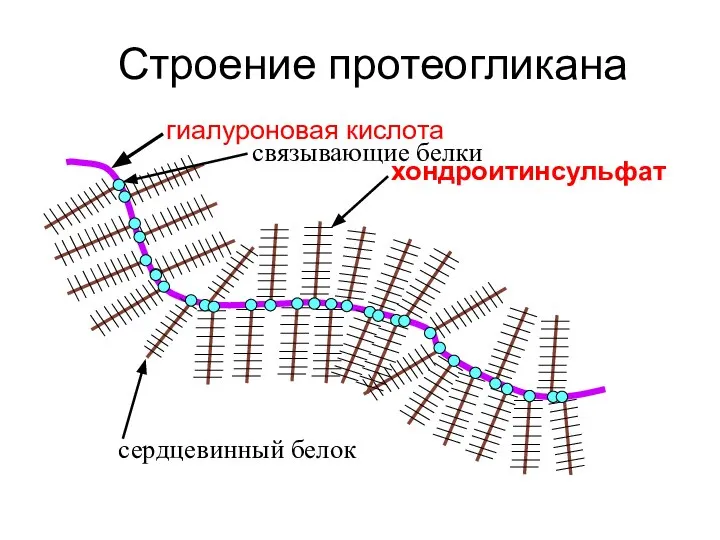
- 156. Строение протеогликана гиалуроновая кислота связывающие белки сердцевинный белок хондроитинсульфат
- 157. Роль протеогликанов в организме человека Повышает прочность оболочек клеток (плазматической мембраны); Проявляет свойство универсального клея. В
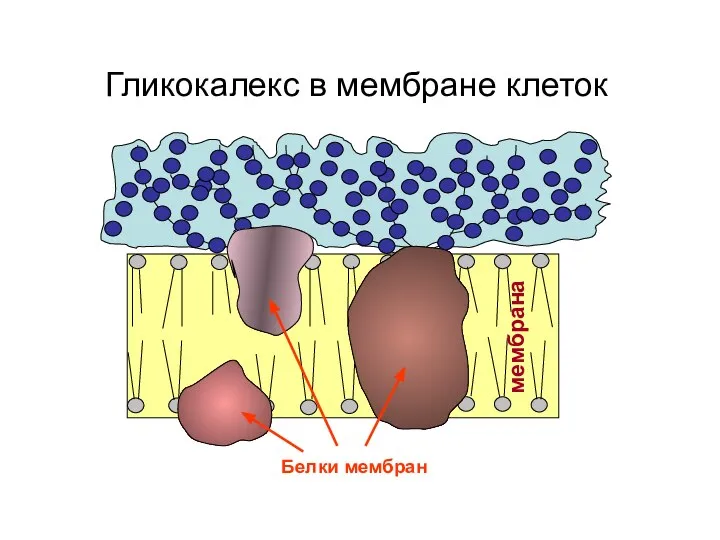
- 158. Гликокалекс в мембране клеток мембрана Белки мембран
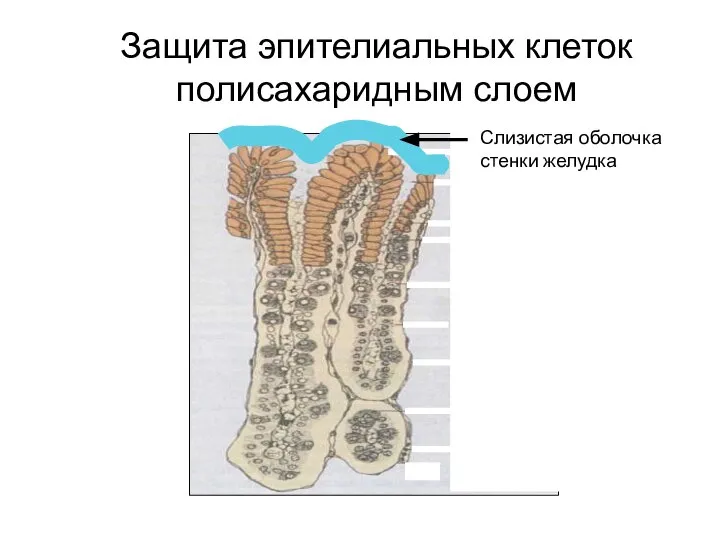
- 159. Защита эпителиальных клеток полисахаридным слоем Слизистая оболочка стенки желудка
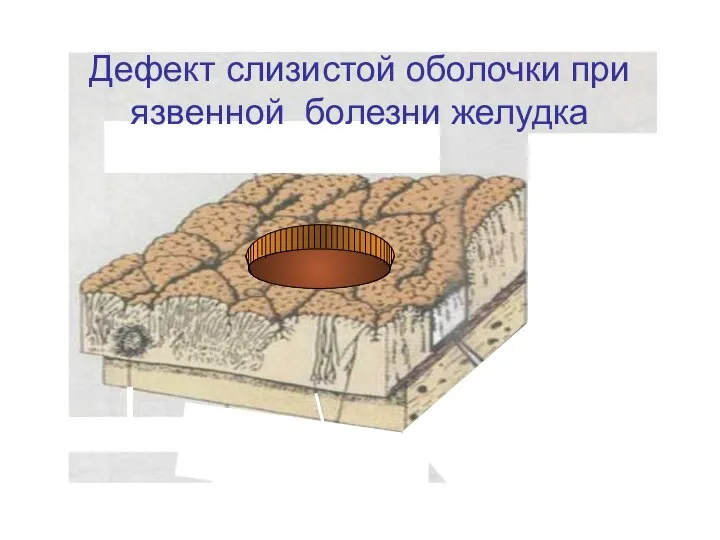
- 160. Дефект слизистой оболочки при язвенной болезни желудка
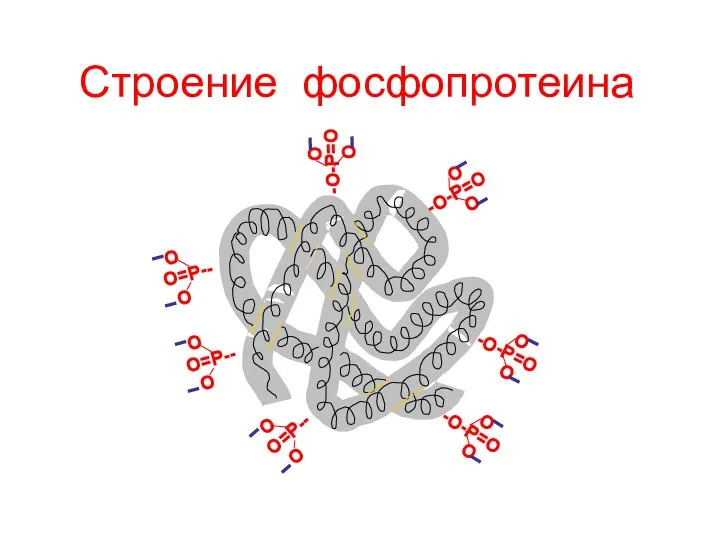
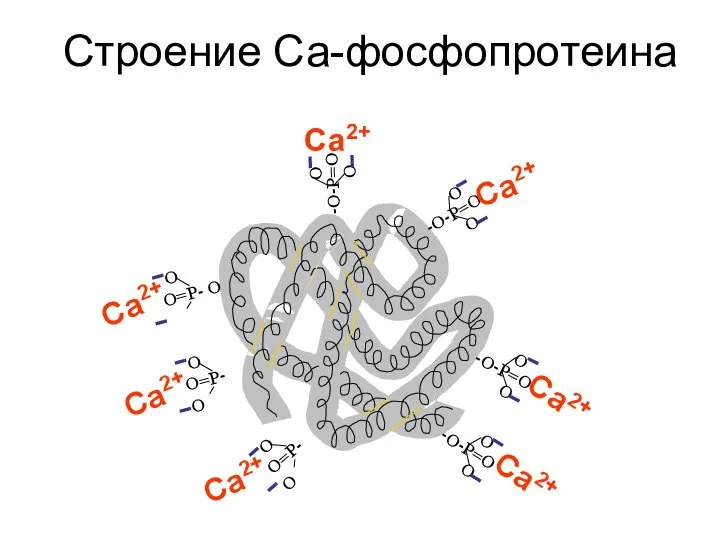
- 162. Фосфопротеины
- 163. -О-Р=О О О -О-Р=О О О -О-Р=О О О -О-Р=О О О О=Р-- О О О=Р--
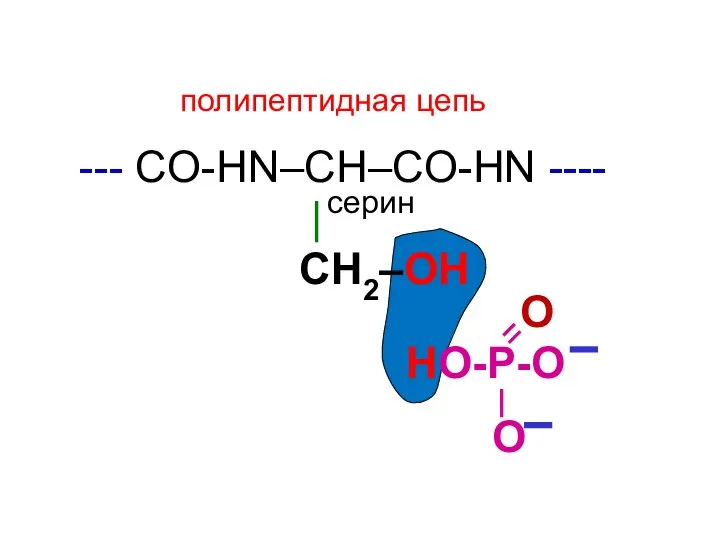
- 164. --- CO-HN–CH–CO-НN ---- | СН2–ОН НО-Р-О О О полипептидная цепь серин
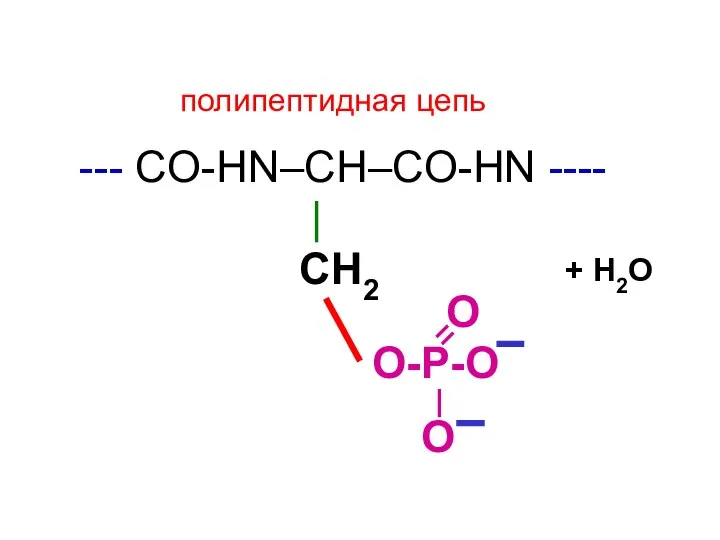
- 165. --- CO-HN–CH–CO-НN ---- | СН2 О-Р-О О О полипептидная цепь + Н2О
- 166. -О-Р=О О О -О-Р=О О О -О-Р=О О О -О-Р=О О О О=Р- О О О=Р-О
- 168. Скачать презентацию












































 Птицы нашего края
Птицы нашего края Тип Плоские черви
Тип Плоские черви Кто такие насекомые
Кто такие насекомые Пӗр пӗлтерӗшлӗ тата нумай пӗлтерӗшлӗ сӑмахсем
Пӗр пӗлтерӗшлӗ тата нумай пӗлтерӗшлӗ сӑмахсем Витаминдер және олардың маңызы
Витаминдер және олардың маңызы Биомембраны. Функции и общая характеристика строения биомембран. Виды мембранного транспорта
Биомембраны. Функции и общая характеристика строения биомембран. Виды мембранного транспорта Зоологический рисунок Майский жук
Зоологический рисунок Майский жук Общие свойства живых организмов
Общие свойства живых организмов Животные дикие и домашние
Животные дикие и домашние Физиология стресса (3 часть). Адренокортикотропный гормон, или АКТГ
Физиология стресса (3 часть). Адренокортикотропный гормон, или АКТГ Кормление аквариумных рыбок
Кормление аквариумных рыбок Пищеварительная система. Витамины
Пищеварительная система. Витамины Изучение жизненных циклов бычьего и свинного цепней
Изучение жизненных циклов бычьего и свинного цепней Подготовка к контрольной работе по биологии (6 класс)
Подготовка к контрольной работе по биологии (6 класс) Растения - псаммофиты. Экологические условия произрастания растений на песках
Растения - псаммофиты. Экологические условия произрастания растений на песках Скелет человека
Скелет человека Голо- и Покрытосеменные
Голо- и Покрытосеменные Наши пернатые друзья
Наши пернатые друзья 2_Биология_7 класс_Дефицит макроэлементов у растений_Презентация
2_Биология_7 класс_Дефицит макроэлементов у растений_Презентация Жители почвы. Кроссворд
Жители почвы. Кроссворд Презентация на тему ИСПАРЕНИЕ ВОДЫ РАСТЕНИЯМИ
Презентация на тему ИСПАРЕНИЕ ВОДЫ РАСТЕНИЯМИ  Почва и ее значение
Почва и ее значение Зрительный анализатор. Урок 13
Зрительный анализатор. Урок 13 Пищеварительная трубка
Пищеварительная трубка Тип хордовые
Тип хордовые Грибы и лишайники
Грибы и лишайники Строение и функции оболочки клетки
Строение и функции оболочки клетки Методы генетики человека
Методы генетики человека