Магнитные изотопные эффекты (миэ) в металл-зависимом ферментативном катализе и их роль в фармакологии. Нанокатиониты
Содержание
- 2. Магнитный изотопный эффект выражается в зависимости скорости химической реакции (или вероятности рождения молекулы) от ядерного спина,
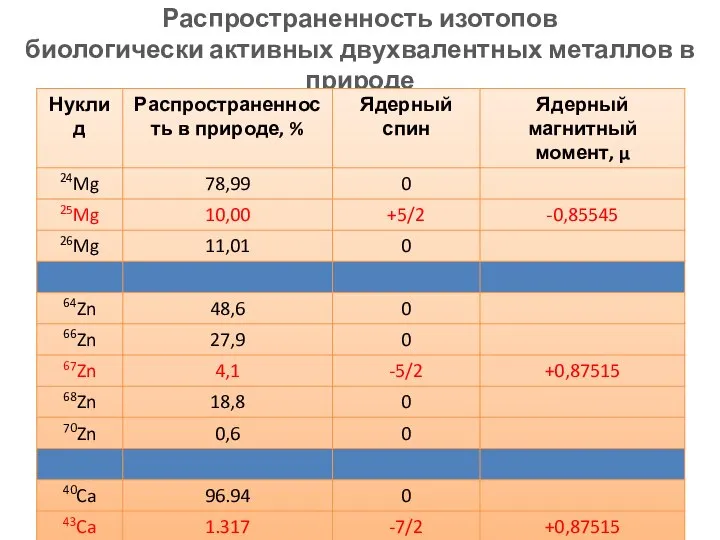
- 3. Распространенность изотопов биологически активных двухвалентных металлов в природе
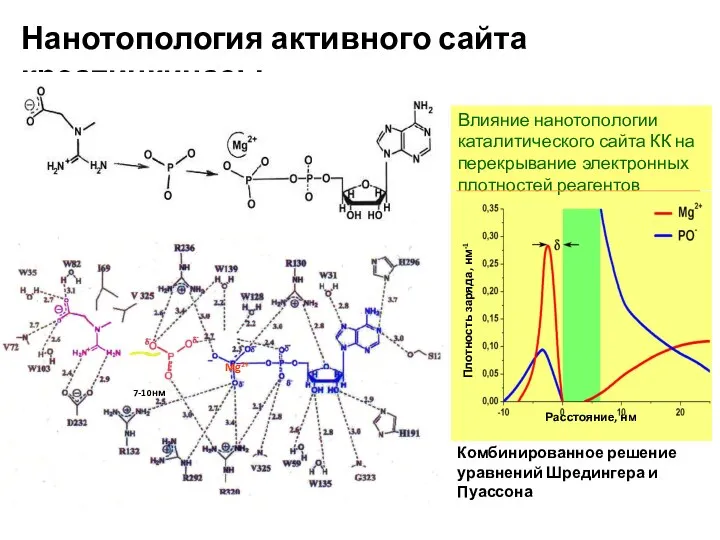
- 4. Нанотопология активного сайта креатинкиназы Комбинированное решение уравнений Шредингера и Пуассона Влияние нанотопологии каталитического сайта КК на
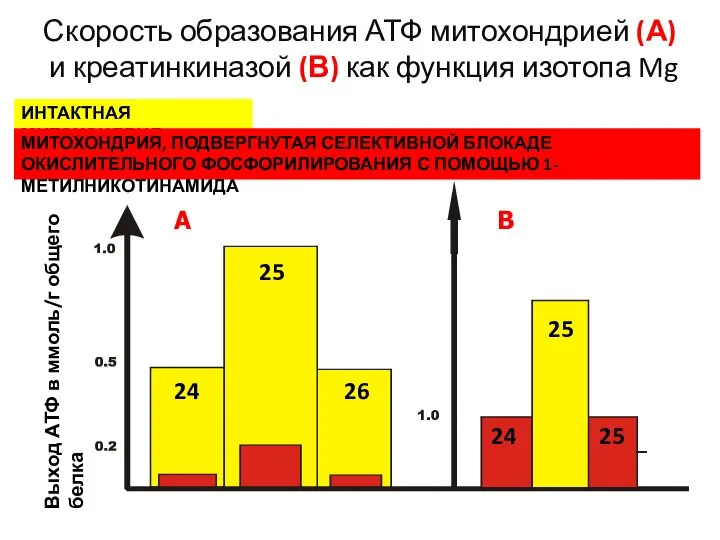
- 5. Скорость образования АТФ митохондрией (А) и креатинкиназой (В) как функция изотопа Mg ИНТАКТНАЯ МИТОХОНДРИЯ МИТОХОНДРИЯ, ПОДВЕРГНУТАЯ
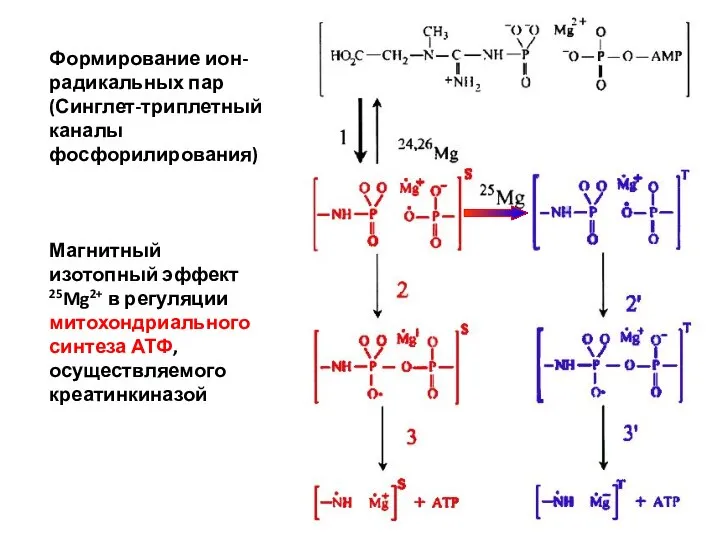
- 6. Формирование ион-радикальных пар (Синглет-триплетный каналы фосфорилирования) Магнитный изотопный эффект 25Mg2+ в регуляции митохондриального синтеза АТФ, осуществляемого
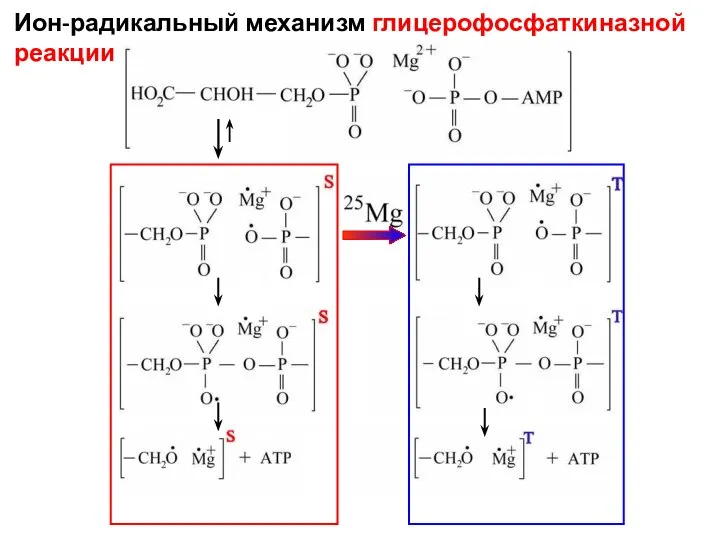
- 7. Ион-радикальный механизм глицерофосфаткиназной реакции
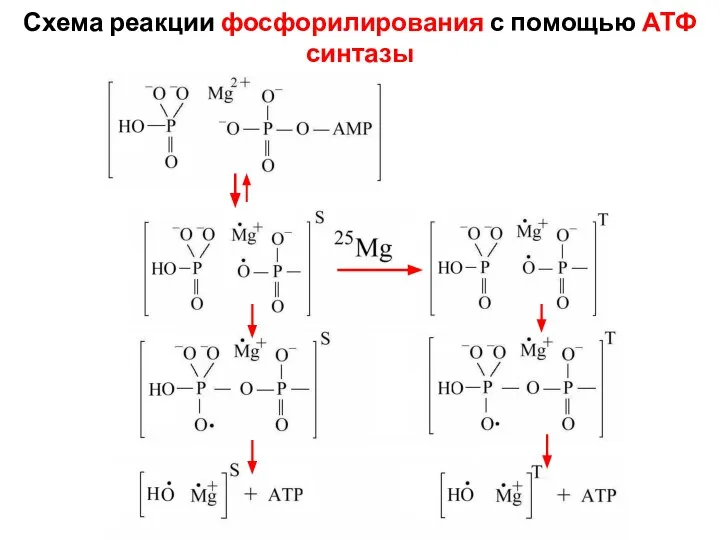
- 8. Схема реакции фосфорилирования с помощью АТФ синтазы
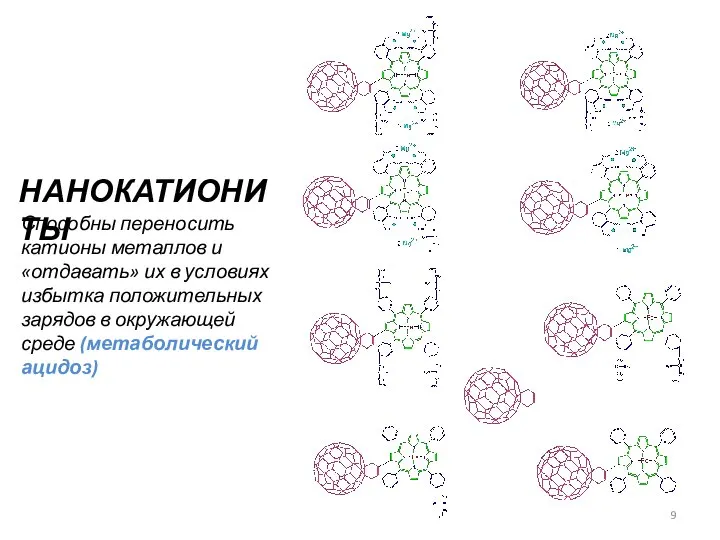
- 9. НАНОКАТИОНИТЫ Способны переносить катионы металлов и «отдавать» их в условиях избытка положительных зарядов в окружающей среде
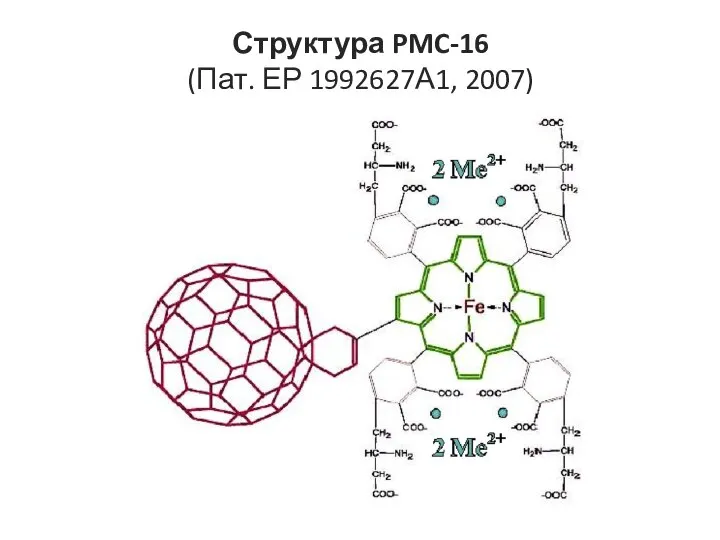
- 10. Структура PMC-16 (Пат. ЕР 1992627А1, 2007)
- 11. ПЕЧЕНЬ МИТОХОНДРИЯ ЦИТОПЛАЗМА ПЛАЗМОЛЕММА ЯДРО Время, ч (имп/мин[59Fe]PMC16 ) / мг белка) х 10-3
- 12. Время, ч МИТОХОНДРИЯ ЦИТОПЛАЗМА ПЛАЗМОЛЕММА ЯДРО МИОКАРД (имп/мин[59Fe]PMC16 ) / мг белка) х 10-3
- 13. ФАРМАКОКИНЕТИКА [Mg]PMC16 (КРЫСЫ) Однократная внутривенная инъекция 20мг/кг (M ± SEM, n = 6) мониторинг в течение
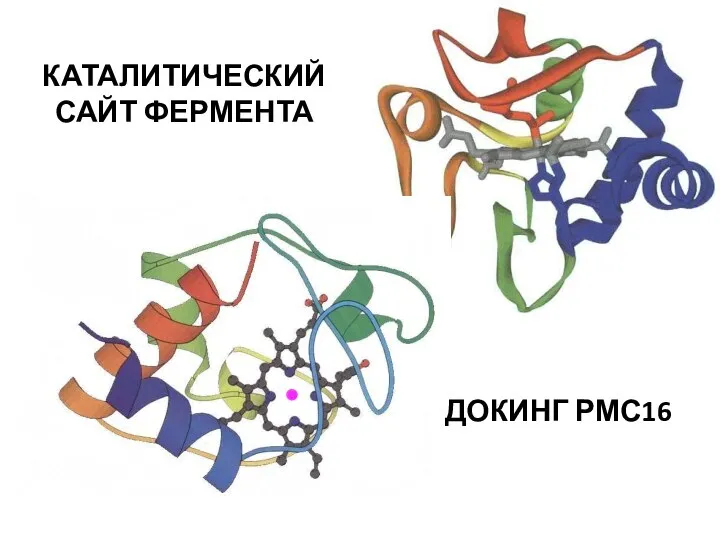
- 14. КАТАЛИТИЧЕСКИЙ САЙТ ФЕРМЕНТА ДОКИНГ РМС16
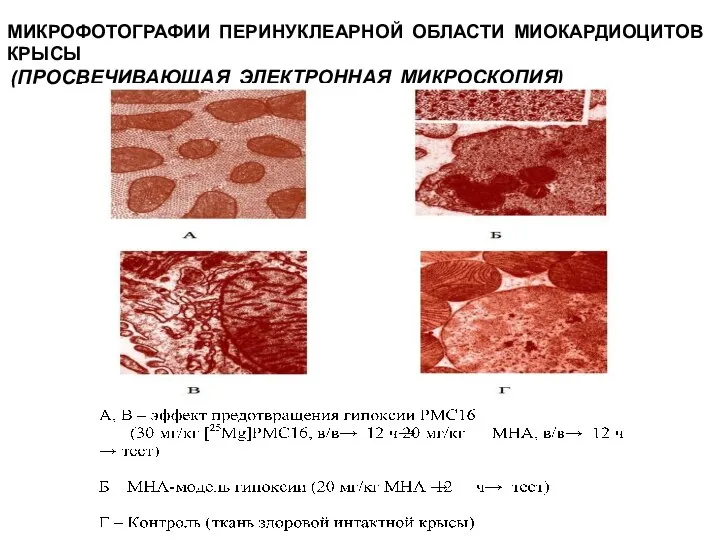
- 15. МИКРОФОТОГРАФИИ ПЕРИНУКЛЕАРНОЙ ОБЛАСТИ МИОКАРДИОЦИТОВ КРЫСЫ (ПРОСВЕЧИВАЮЩАЯ ЭЛЕКТРОННАЯ МИКРОСКОПИЯ)
- 16. ДИСПЛАЗИЯ МИТОХОНДРИЙ МИОКАРДИОЦИТОВ КРОЛИКА (ИНДУЦИРОВАНА ДОКСОРУБИЦИНОМ) (B) Митохондрия (M): 0.2 DL50 PMC16, 6 часов → 0.5
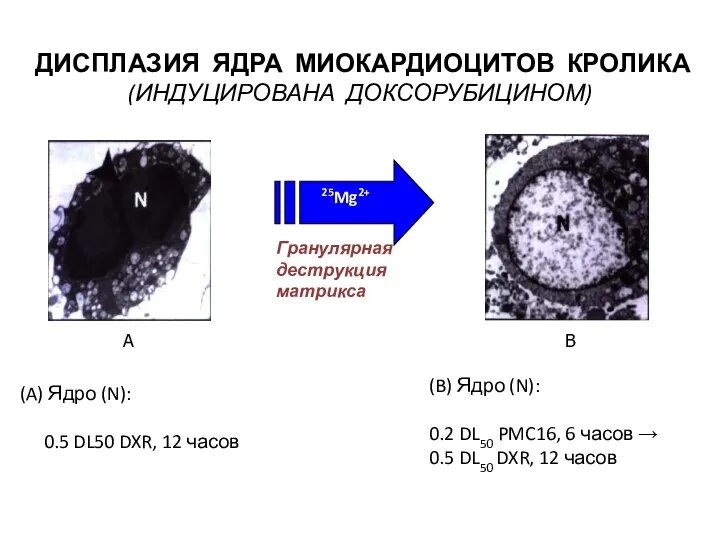
- 17. A B 25Mg2+ ДИСПЛАЗИЯ ЯДРА МИОКАРДИОЦИТОВ КРОЛИКА (ИНДУЦИРОВАНА ДОКСОРУБИЦИНОМ) 25Mg2+ Гранулярная деструкция матрикса Ядро (N): 0.5
- 18. Перспективы применения в нейробиологии «умных» нанокатионитов на основе порфириновых аддуктов фуллерена С60 Магнитные изотопные эффекты в
- 19. ВОЗМОЖНЫЕ БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ [Mg]PMC16, ПРЕДСКАЗАННЫЕ НА ОСНОВЕ ИХ СТРУКТУРЫ
- 20. Магнитный изотопный эффект 43Ca Y, [(нмоль АТФ/мин)/мг КК]х10-3 A, [имп/мин γ-[32P]АТФ/мг КК]х10-3
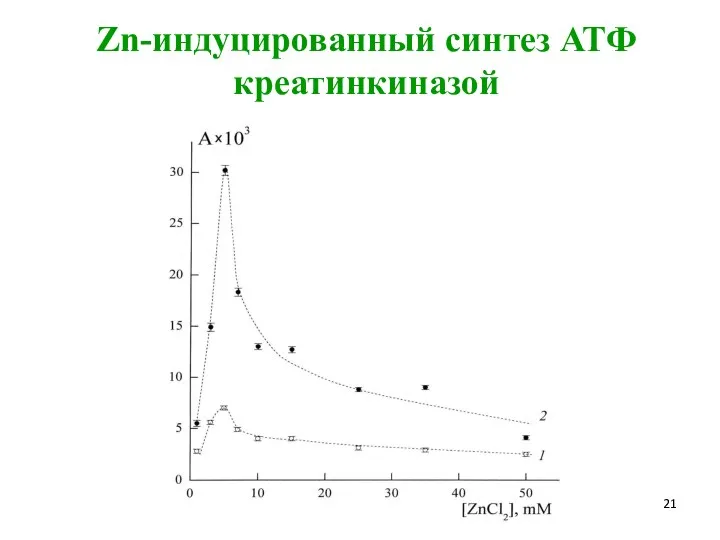
- 21. Zn-индуцированный синтез АТФ креатинкиназой
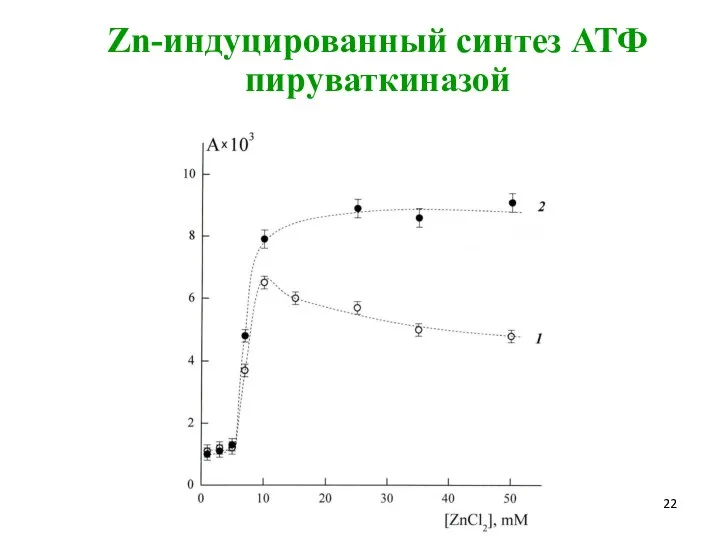
- 22. Zn-индуцированный синтез АТФ пируваткиназой
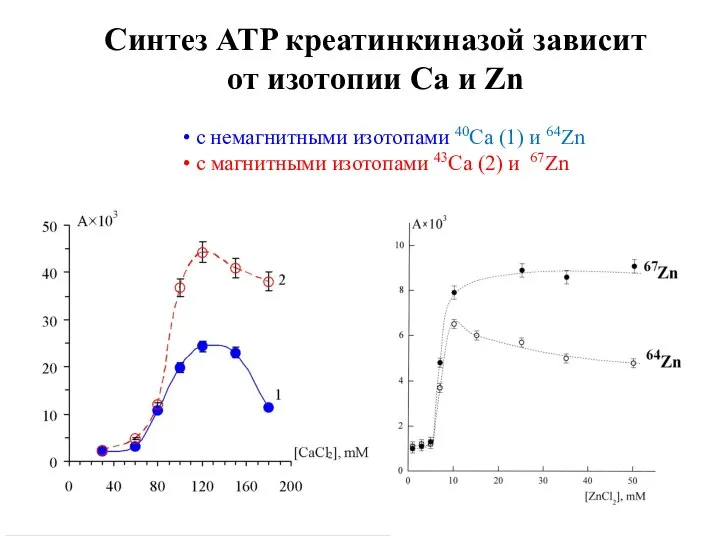
- 23. Синтез ATP креатинкиназой зависит от изотопии Ca и Zn • с немагнитными изотопами 40Ca (1) и
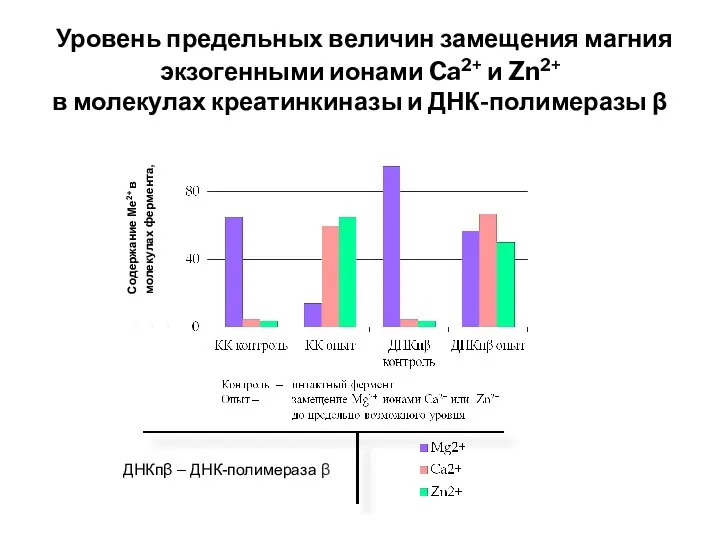
- 24. Уровень предельных величин замещения магния экзогенными ионами Ca2+ и Zn2+ в молекулах креатинкиназы и ДНК-полимеразы β
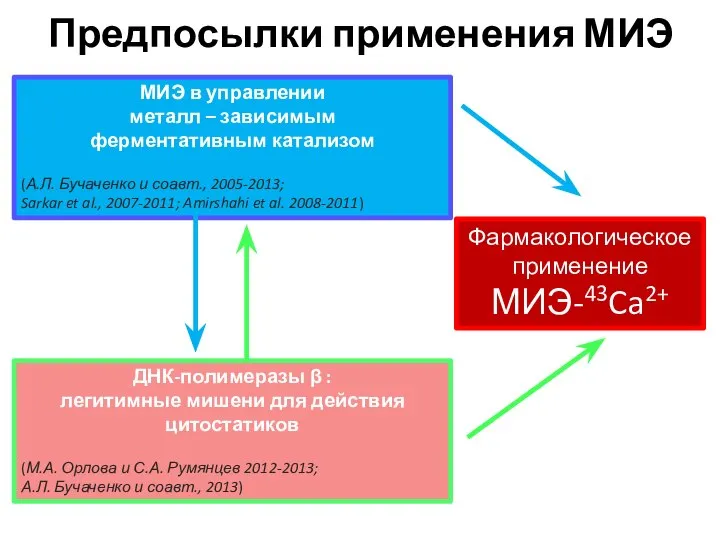
- 25. Предпосылки применения МИЭ МИЭ в управлении металл – зависимым ферментативным катализом (А.Л. Бучаченко и соавт., 2005-2013;
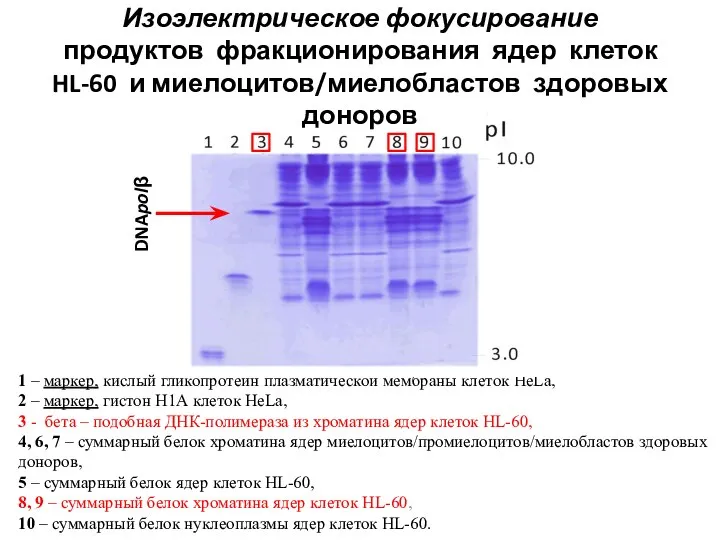
- 26. 1 – маркер, кислый гликопротеин плазматической мембраны клеток HeLa, 2 – маркер, гистон Н1А клеток HeLa,
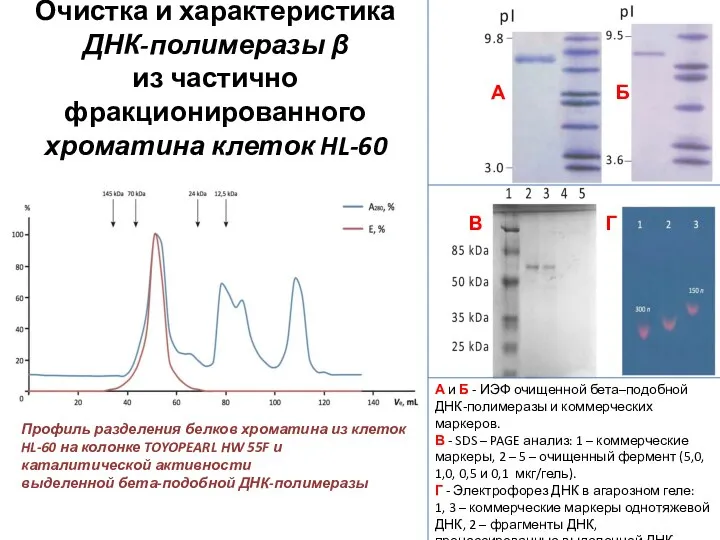
- 27. Очистка и характеристика ДНК-полимеразы β из частично фракционированного хроматина клеток HL-60 А и Б - ИЭФ
- 28. Идентификационные критерии ДНК-полимераз семейства β Молекулярная масса Низкая процессивность фермента Низкая продуктивность (n Mg-зависимый фермент Мономер
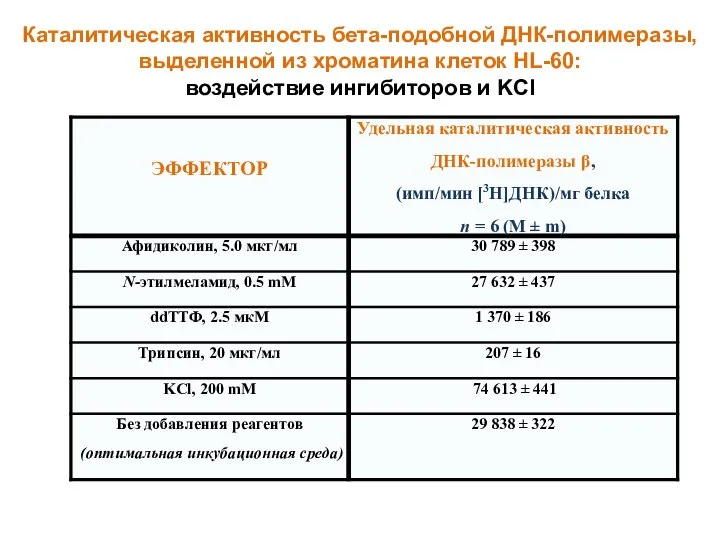
- 29. Каталитическая активность бета-подобной ДНК-полимеразы, выделенной из хроматина клеток HL-60: воздействие ингибиторов и KCl
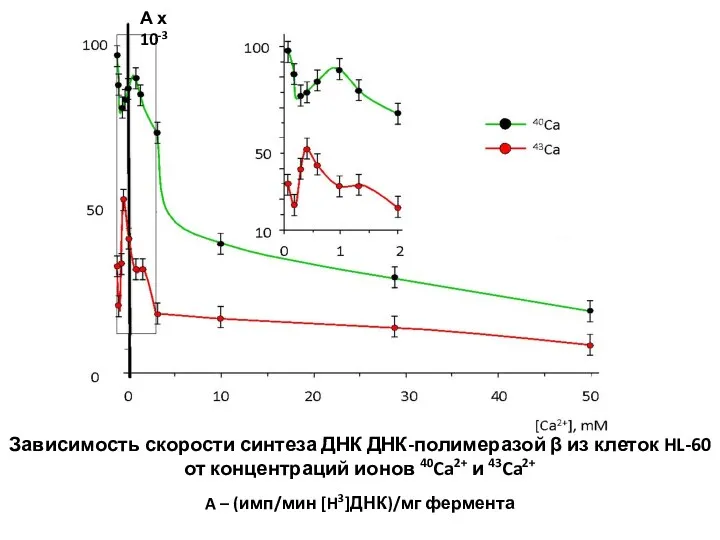
- 30. Зависимость скорости синтеза ДНК ДНК-полимеразой β из клеток HL-60 от концентраций ионов 40Ca2+ и 43Ca2+ A
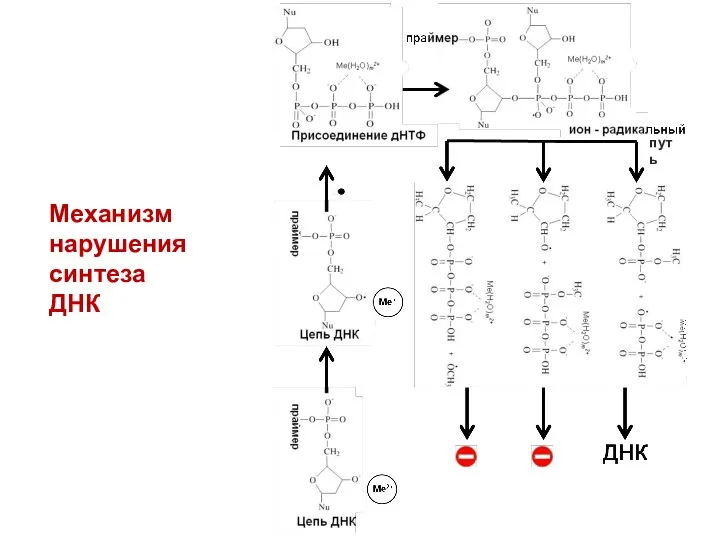
- 31. Механизм нарушения синтеза ДНК путь
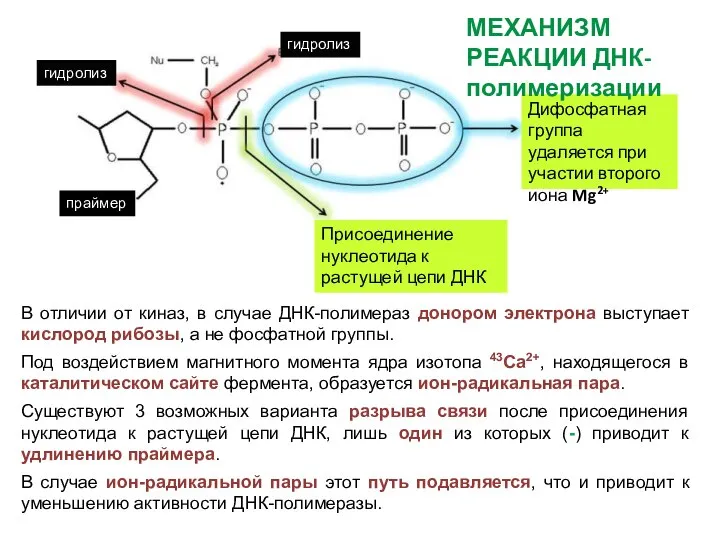
- 32. В отличии от киназ, в случае ДНК-полимераз донором электрона выступает кислород рибозы, а не фосфатной группы.
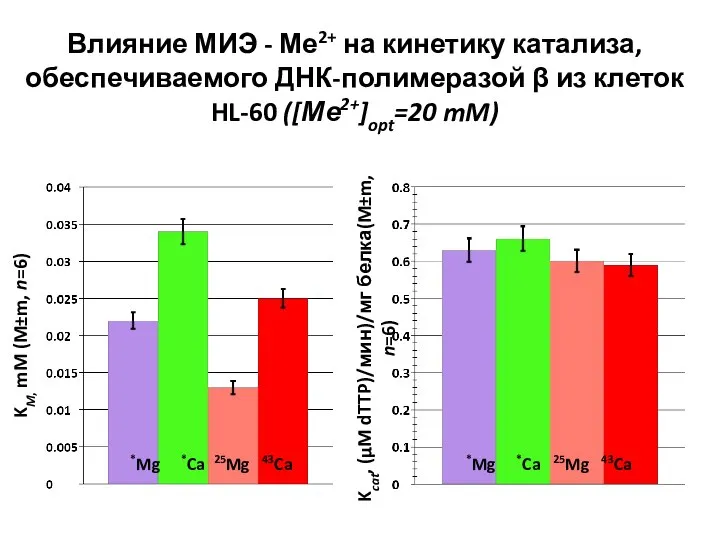
- 33. Влияние МИЭ - Ме2+ на кинетику катализа, обеспечиваемого ДНК-полимеразой β из клеток HL-60 ([Ме2+]opt=20 mM) *Mg
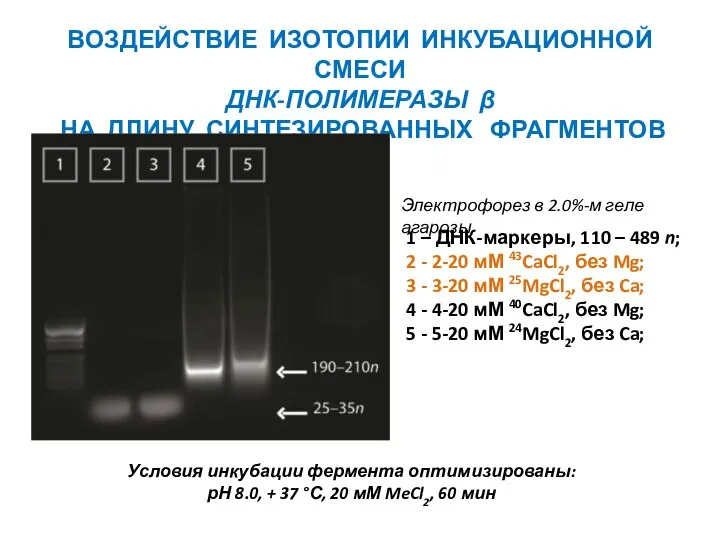
- 34. Условия инкубации фермента оптимизированы: рН 8.0, + 37 °С, 20 мМ MeCl2, 60 мин ВОЗДЕЙСТВИЕ ИЗОТОПИИ
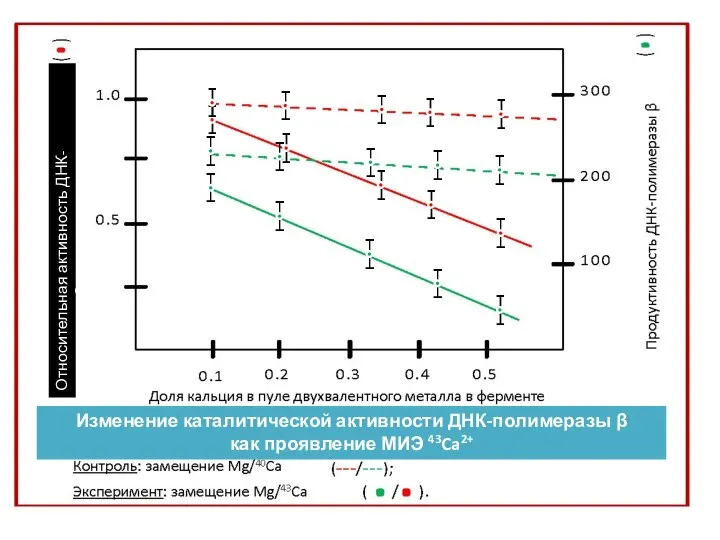
- 35. n n n Относительная активность ДНК-полимеразы β Изменение каталитической активности ДНК-полимеразы β как проявление МИЭ 43Ca2+
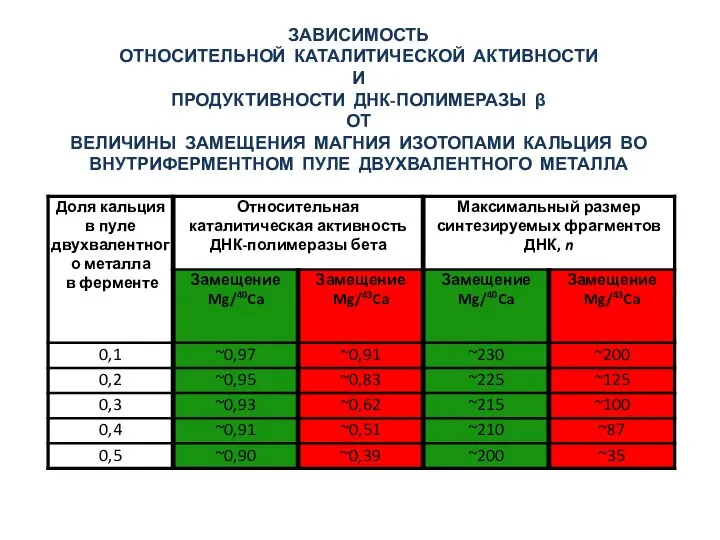
- 36. ЗАВИСИМОСТЬ ОТНОСИТЕЛЬНОЙ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ И ПРОДУКТИВНОСТИ ДНК-ПОЛИМЕРАЗЫ β ОТ ВЕЛИЧИНЫ ЗАМЕЩЕНИЯ МАГНИЯ ИЗОТОПАМИ КАЛЬЦИЯ ВО ВНУТРИФЕРМЕНТНОМ
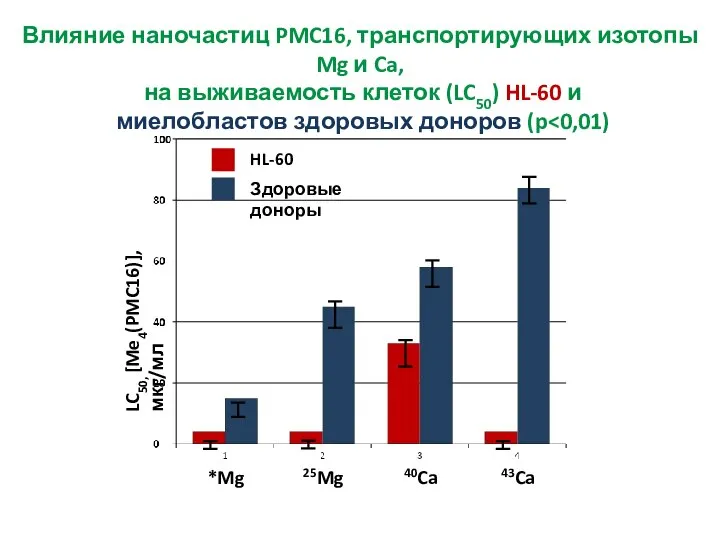
- 37. Влияние наночастиц PMC16, транспортирующих изотопы Mg и Ca, на выживаемость клеток (LC50) HL-60 и миелобластов здоровых
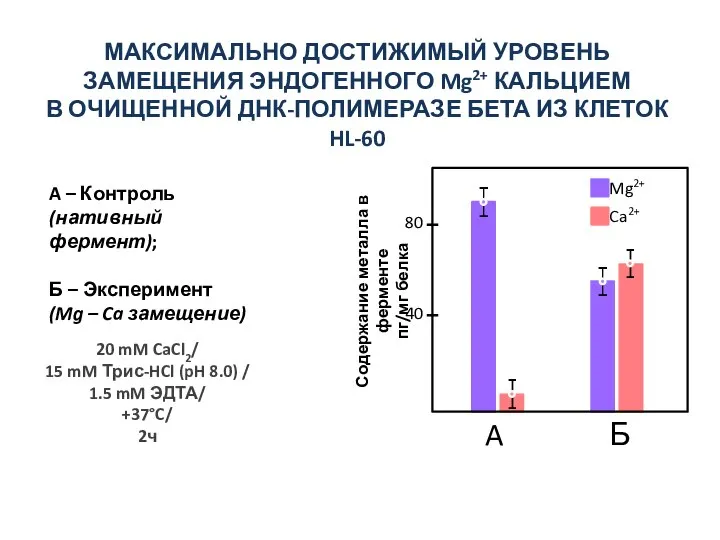
- 38. МАКСИМАЛЬНО ДОСТИЖИМЫЙ УРОВЕНЬ ЗАМЕЩЕНИЯ ЭНДОГЕННОГО Mg2+ КАЛЬЦИЕМ В ОЧИЩЕННОЙ ДНК-ПОЛИМЕРАЗЕ БЕТА ИЗ КЛЕТОК HL-60 A –
- 39. Кривые доза-эффект препаратов порфирин-фуллеренов (Ме4[PMC16]) для клеток линии HL60 (миелобластный лейкоз) Цитотоксический эффект магнитных изотопов проявляется
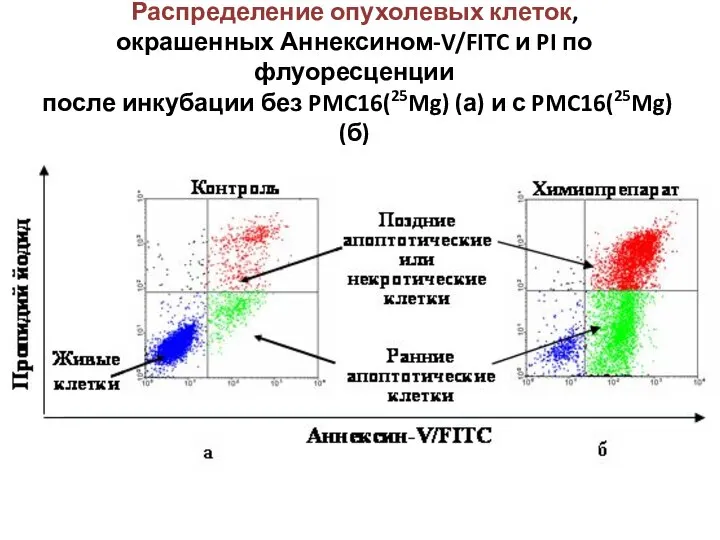
- 40. Распределение опухолевых клеток, окрашенных Аннексином-V/FITC и PI по флуоресценции после инкубации без PMC16(25Mg) (а) и с
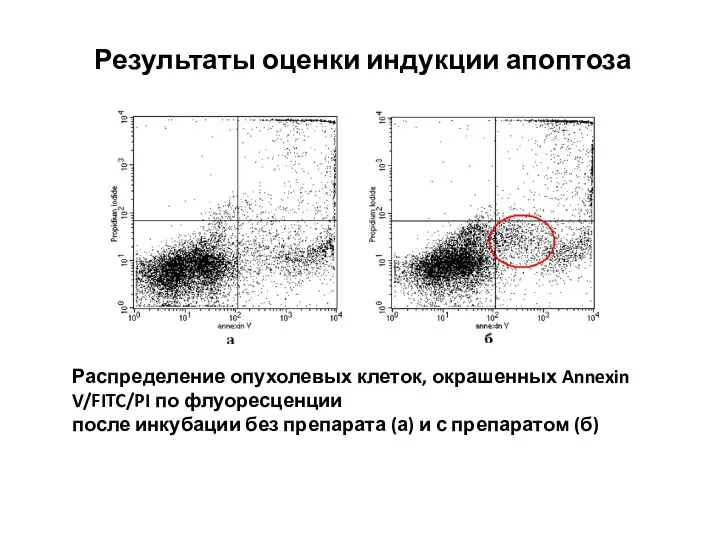
- 41. Результаты оценки индукции апоптоза Распределение опухолевых клеток, окрашенных Annexin V/FITC/PI по флуоресценции после инкубации без препарата
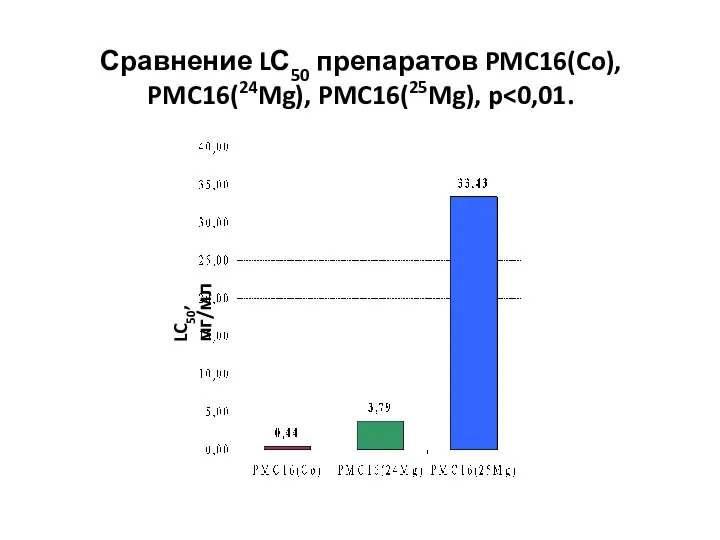
- 42. Сравнение LС50 препаратов PMC16(Co), PMC16(24Mg), PMC16(25Mg), p LC50, мг/мл
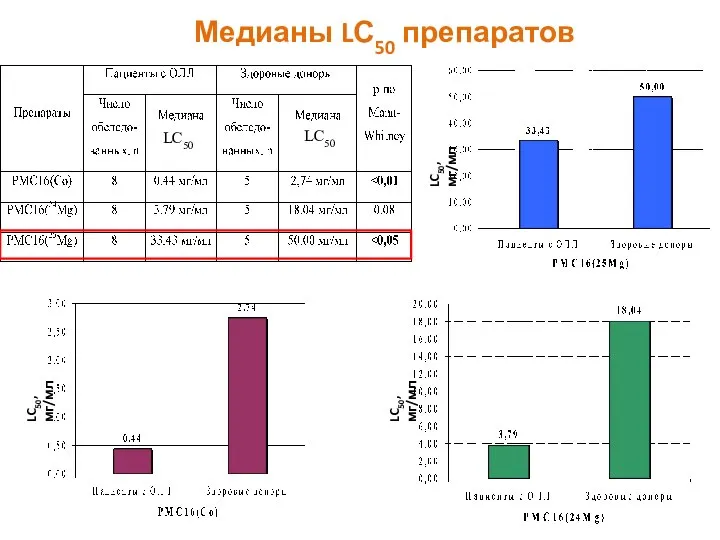
- 43. Медианы LС50 препаратов LC50, мг/мл LC50, мг/мл LC50, мг/мл LC50 LC50
- 44. PMC16 25Mg2+,43Ca2+ PMC16 PMC16 25Mg2+,43Ca2+ 25Mg2+, 43Ca2+ КК, αФГК, ПК, АТФ-синтаза ∆[дНТФ]↑ Поддержка Анаболизма Перинуклеальные Пермеазы
- 46. Скачать презентацию

![ПЕЧЕНЬ МИТОХОНДРИЯ ЦИТОПЛАЗМА ПЛАЗМОЛЕММА ЯДРО Время, ч (имп/мин[59Fe]PMC16 ) / мг белка) х 10-3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1064917/slide-10.jpg)
![Время, ч МИТОХОНДРИЯ ЦИТОПЛАЗМА ПЛАЗМОЛЕММА ЯДРО МИОКАРД (имп/мин[59Fe]PMC16 ) / мг белка) х 10-3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1064917/slide-11.jpg)
![ФАРМАКОКИНЕТИКА [Mg]PMC16 (КРЫСЫ) Однократная внутривенная инъекция 20мг/кг (M ± SEM, n =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1064917/slide-12.jpg)


![ВОЗМОЖНЫЕ БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ [Mg]PMC16, ПРЕДСКАЗАННЫЕ НА ОСНОВЕ ИХ СТРУКТУРЫ](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1064917/slide-18.jpg)
![Магнитный изотопный эффект 43Ca Y, [(нмоль АТФ/мин)/мг КК]х10-3 A, [имп/мин γ-[32P]АТФ/мг КК]х10-3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1064917/slide-19.jpg)

![Кривые доза-эффект препаратов порфирин-фуллеренов (Ме4[PMC16]) для клеток линии HL60 (миелобластный лейкоз) Цитотоксический](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1064917/slide-38.jpg)
![PMC16 25Mg2+,43Ca2+ PMC16 PMC16 25Mg2+,43Ca2+ 25Mg2+, 43Ca2+ КК, αФГК, ПК, АТФ-синтаза ∆[дНТФ]↑](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1064917/slide-43.jpg)
 Кожа
Кожа Когда известно название гена
Когда известно название гена Мир кораллового рифа
Мир кораллового рифа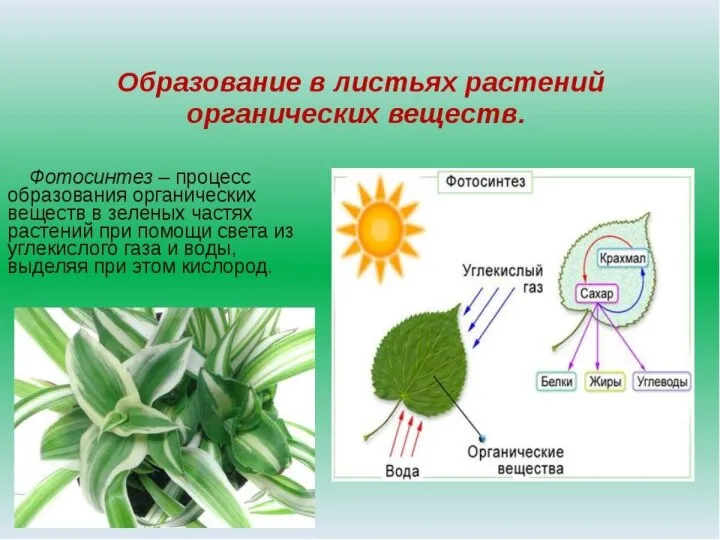 Фотосинтез и его значение в природе и жизни человека
Фотосинтез и его значение в природе и жизни человека Белки - состав, строение, свойства
Белки - состав, строение, свойства Высшие функции коры головного мозга. Глава 9
Высшие функции коры головного мозга. Глава 9 Опорно двигательная система
Опорно двигательная система Тип Кольчатые черви
Тип Кольчатые черви Влияние регуляторов роста на прорастание семян
Влияние регуляторов роста на прорастание семян Паразиты, их разновидности, образ жизни, внешние признаки
Паразиты, их разновидности, образ жизни, внешние признаки Проращивание лука (опыт)
Проращивание лука (опыт) День экологических знаний 15 апреля. Прощание с ботаникой 6 класс
День экологических знаний 15 апреля. Прощание с ботаникой 6 класс Количественный анализ в вирусологии
Количественный анализ в вирусологии Презентация на тему Биогеоценоз луга
Презентация на тему Биогеоценоз луга  Генетика різноманітності антиген-специфічних рецепторів
Генетика різноманітності антиген-специфічних рецепторів Blue botanical image 2-11x14
Blue botanical image 2-11x14 Биотические связи
Биотические связи Строение кости. Типы соединения костей
Строение кости. Типы соединения костей Лиственница
Лиственница Строение Живого организма
Строение Живого организма Секреты растительной клетки. Почему желтеют листья?
Секреты растительной клетки. Почему желтеют листья? Вид: Критерии и структура
Вид: Критерии и структура Доисторические животные
Доисторические животные Животные в городе
Животные в городе Презентация на тему Борьба с вредителями и грызунами химическими средствами
Презентация на тему Борьба с вредителями и грызунами химическими средствами  Merveilles de la nature
Merveilles de la nature Презентация на тему Юный натуралист
Презентация на тему Юный натуралист  Ангиогенез
Ангиогенез