Содержание
- 2. Физиологические свойства скелетных мышц: 1) возбудимость ниже, чем у нервных волокон; 2) проводимость низкая (10–13 м/с);
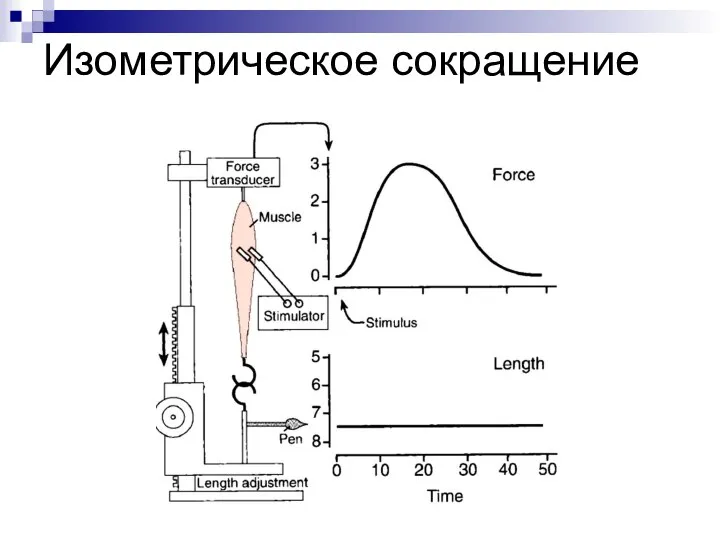
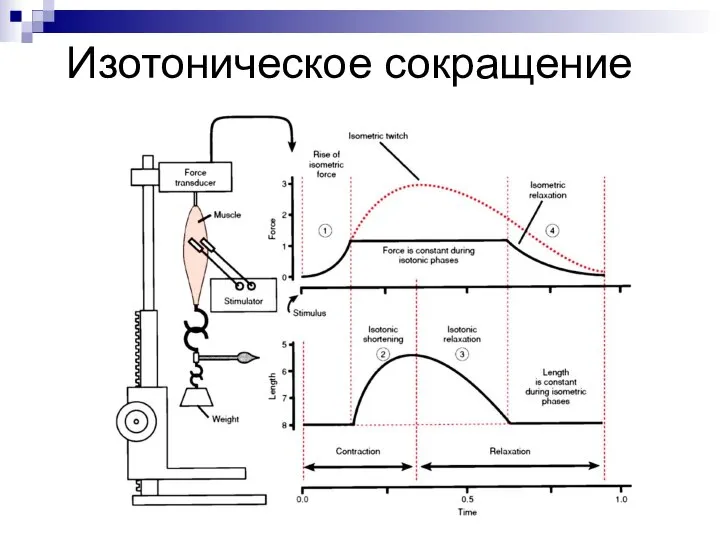
- 3. ВИДЫ СОКРАЩЕНИЯ: изометрическое (длина мышцы не меняется, изменяется лишь напряжение (при фиксированных концах мышцы). изотоническое (длина
- 4. Изометрическое сокращение
- 5. Изотоническое сокращение
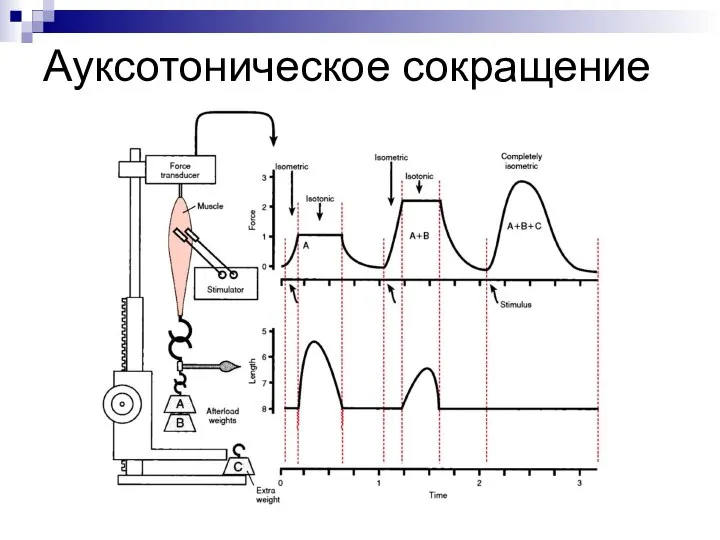
- 6. Ауксотоническое сокращение
- 7. Классификация сокращений по выполняемой работе Концентрический тип: когда внешняя нагрузка меньше, чем развиваемое мышцей напряжение (мышца
- 8. Каждая мышца — гетерогенная популяция разных типов МВ. Тип мышцы определяют, исходя из преобладания в ней
- 9. По характеру сокращения: Фазные - осуществляют энергичные сокращения (произвольная мускулатура человека) , Тонические - специализированы на
- 10. По скорости сокращения (определяется типом миозина) Быстрые - быстрый миозин (высокая активность АТФазы), Медленные - медленный
- 11. По типу окисления: Окислительные (красные): источник АТФ - аэробное окисление глюкозы. Гликолитические (белые): источник АТФ -
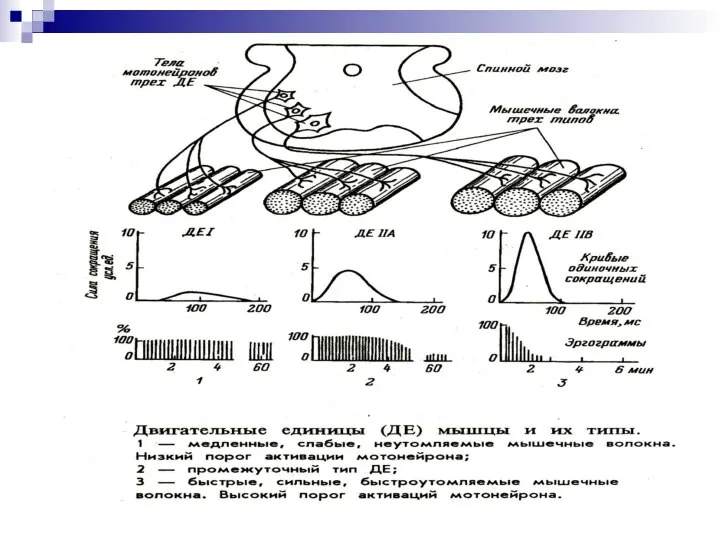
- 12. На практике результаты типирования МВ комбинируют и различают три типа МВ: 1А – медленные неутомляемые (нейроны
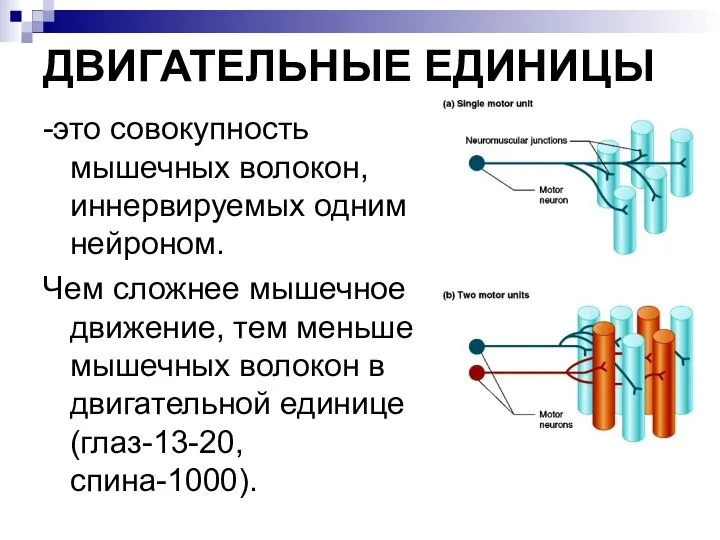
- 13. ДВИГАТЕЛЬНЫЕ ЕДИНИЦЫ -это совокупность мышечных волокон, иннервируемых одним нейроном. Чем сложнее мышечное движение, тем меньше мышечных
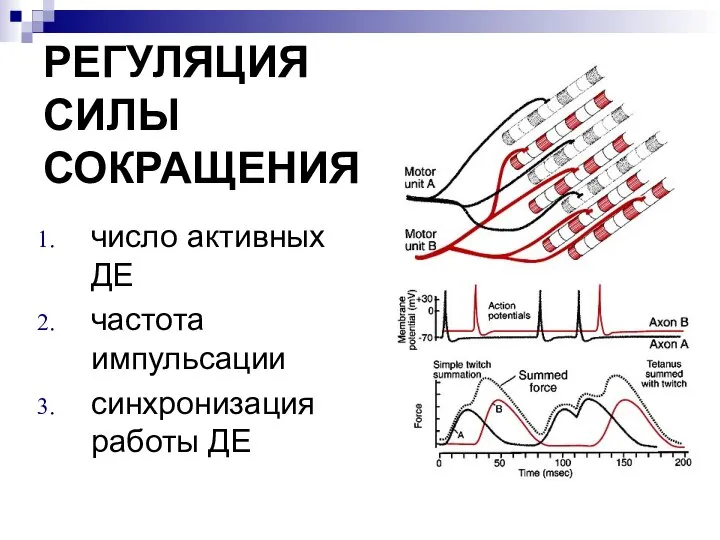
- 15. РЕГУЛЯЦИЯ СИЛЫ СОКРАЩЕНИЯ число активных ДЕ частота импульсации синхронизация работы ДЕ
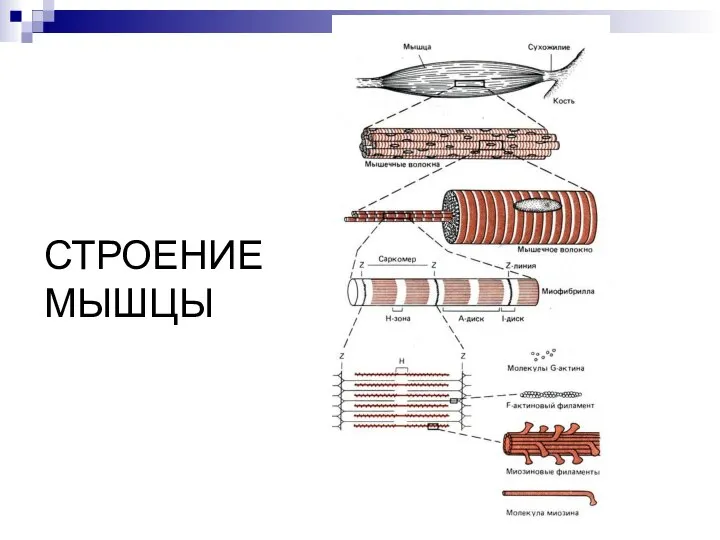
- 16. СТРОЕНИЕ МЫШЦЫ
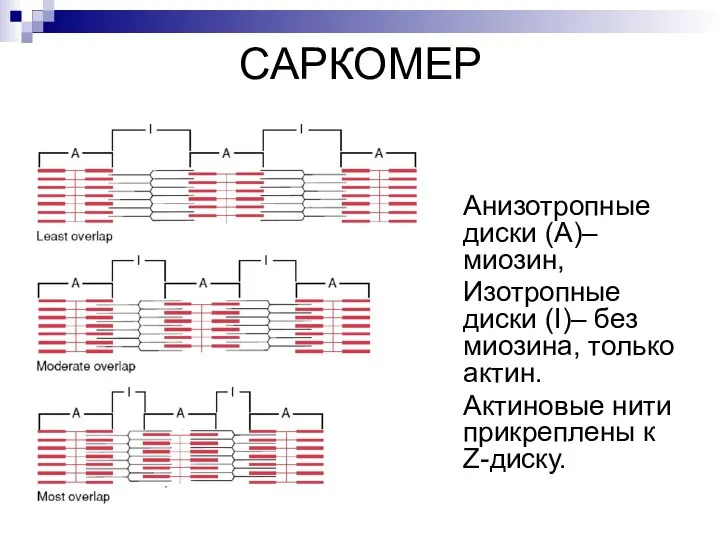
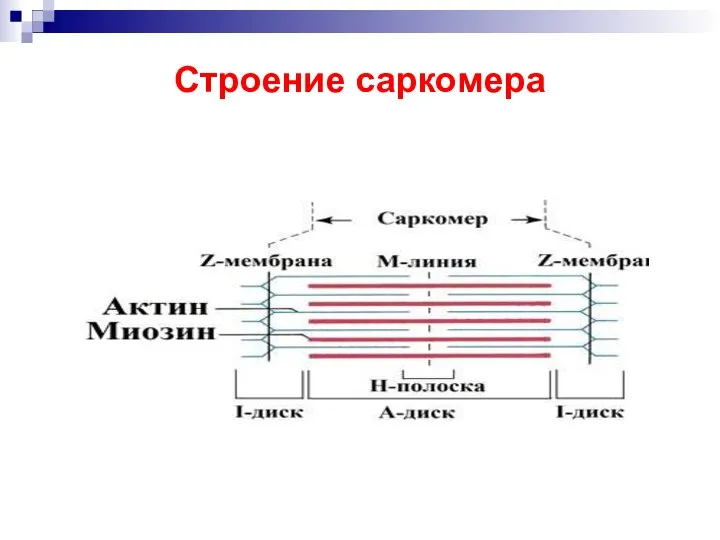
- 17. САРКОМЕР Анизотропные диски (А)– миозин, Изотропные диски (I)– без миозина, только актин. Актиновые нити прикреплены к
- 18. Строение саркомера
- 19. Саркомер — часть миофибриллы, расположенная между двумя последовательными Z–дисками. В состоянии покоя и полностью растянутой мышце
- 20. Толстая миофибрилла . Каждая миозиновая нить состоит из 300–400 молекул миозина и С‑белка. Каждую миозиновую нить
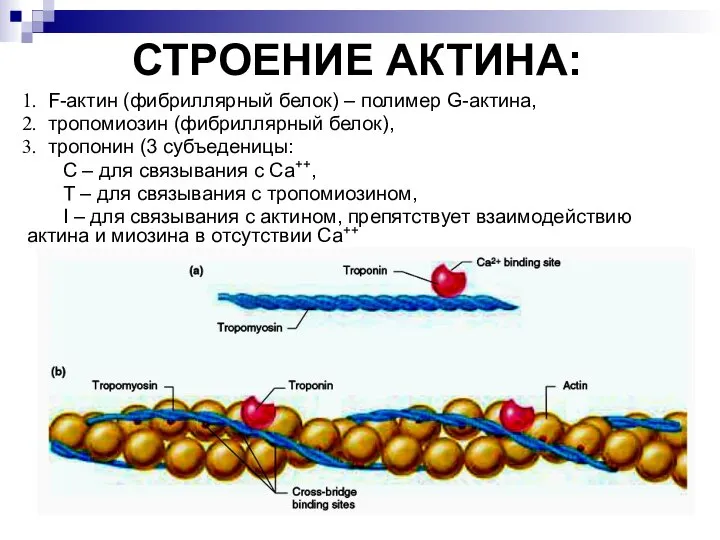
- 21. СТРОЕНИЕ АКТИНА: F-актин (фибриллярный белок) – полимер G-актина, тропомиозин (фибриллярный белок), тропонин (3 субъеденицы: С –
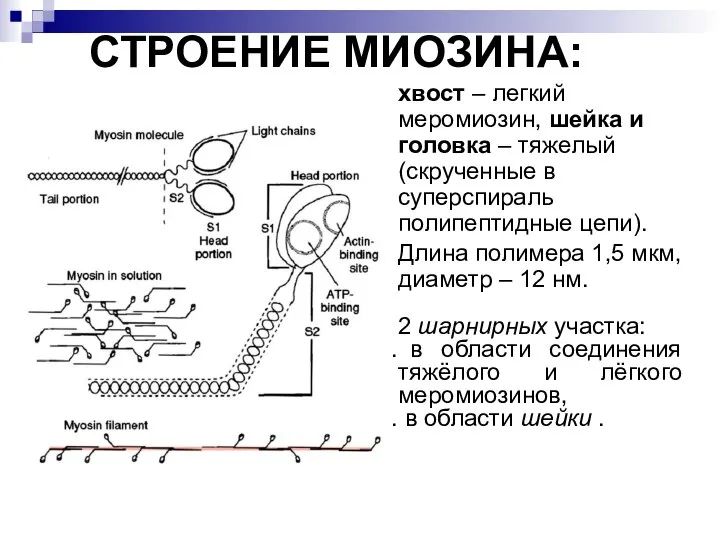
- 22. СТРОЕНИЕ МИОЗИНА: хвост – легкий меромиозин, шейка и головка – тяжелый (скрученные в суперспираль полипептидные цепи).
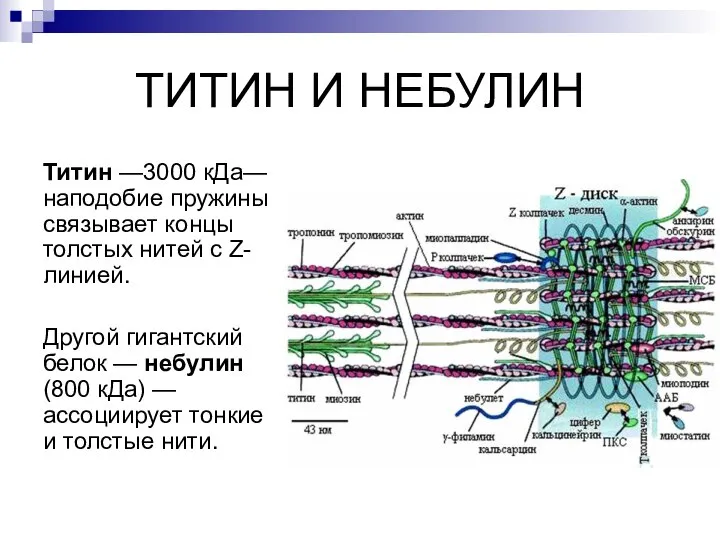
- 23. ТИТИН И НЕБУЛИН Титин —3000 кДа— наподобие пружины связывает концы толстых нитей с Z-линией. Другой гигантский
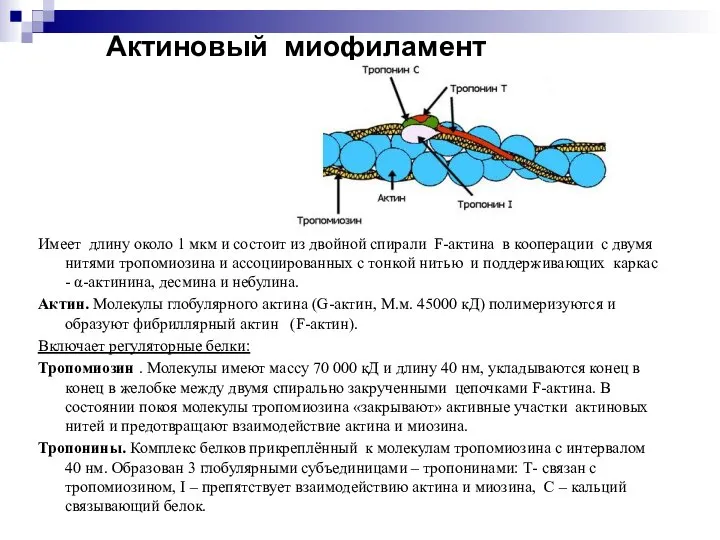
- 24. Актиновый миофиламент Имеет длину около 1 мкм и состоит из двойной спирали F-актина в кооперации с
- 25. Механизм мышечного сокращения
- 26. МЕХАНИЗМ МЫШЕЧНОГО СОКРАЩЕНИЯ ИСТОРИЯ: 1) Гален 2 век – живой дух, 2) линейное сокращение белка, 3)
- 27. ТЕОРИЯ СКОЛЬЖЕНИЯ НИТЕЙ предложена Хью Хаксли
- 28. Сокращение мышцы происходит в результате движения актиновой и миозиновой нити относительно друг друга (благодаря присоединению головок
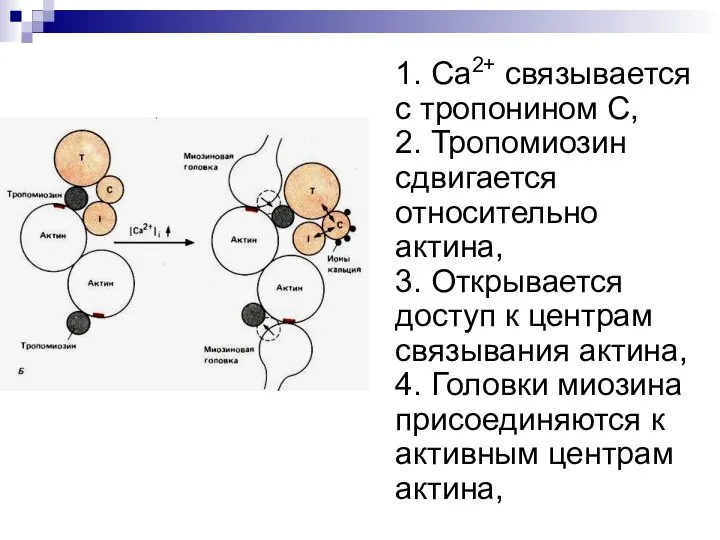
- 29. 1. Ca2+ связывается с тропонином C, 2. Тропомиозин сдвигается относительно актина, 3. Открывается доступ к центрам
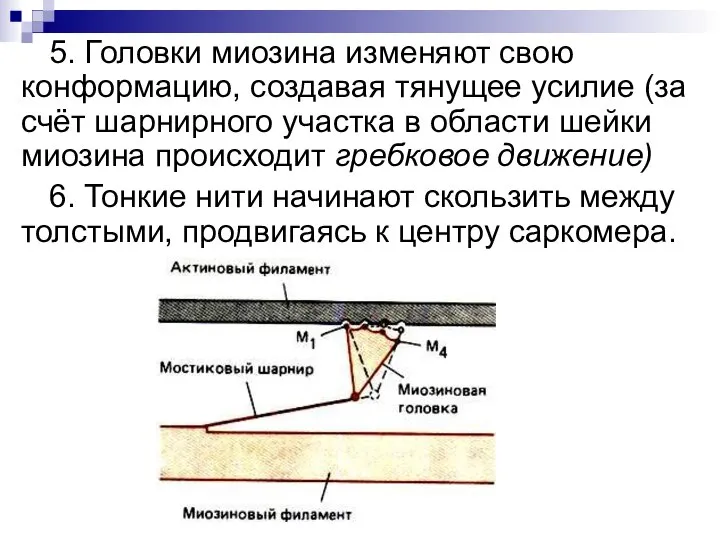
- 30. 5. Головки миозина изменяют свою конформацию, создавая тянущее усилие (за счёт шарнирного участка в области шейки
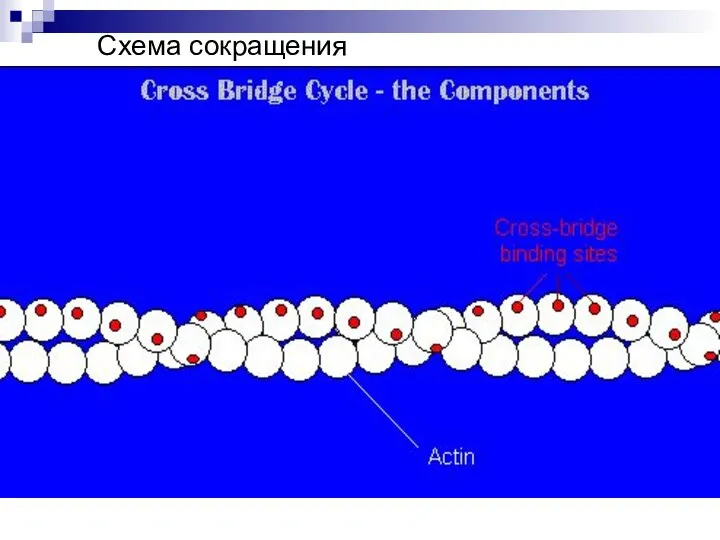
- 31. Схема сокращения
- 32. 7. Затем головка миозина связывается с молекулой АТФ, что приводит к отделению миозина от актина. 8.
- 34. Электро-механическое сопряжение - это процесс превращения импульса нервного волокна в сокращение мышцы
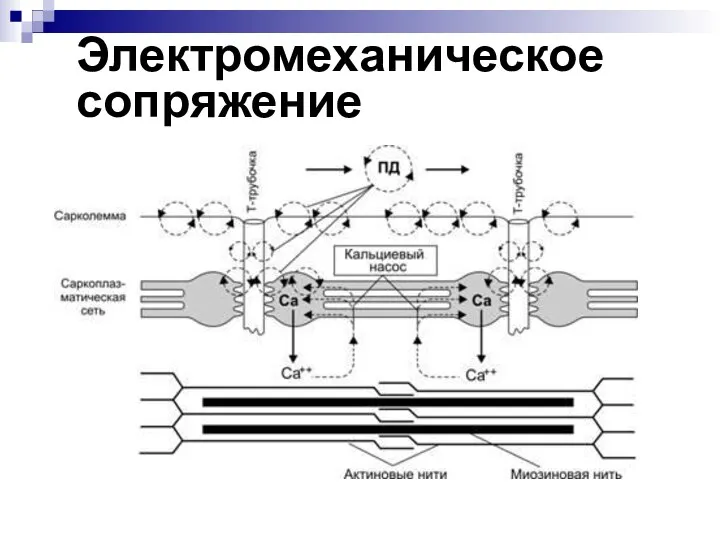
- 35. Электромеханическое сопряжение
- 36. Этапы электромеханического сопряжения Передача импульса через нервно-мышечный синапс. Возникновение ВПСП. Возникновение ПД на околосинаптической мембране. Проведение
- 37. Освобождение Са2+ из СПР и повышение его концентрации в саркоплазме на порядок (от 10-7 до 10-6
- 38. Каким образом Са2+ выделяется из СПР?
- 39. Существует несколько гипотез высвобождения Са2+ из СПР: 1. Волна деполяризации спускается по Т-трубочкам и переходит на
- 40. 2. Во внешнюю мембрану миоцита встроены потенциалзависимые и/или рецепторуправляемые Са2+-каналы. Небольшое повышение концентрации Са2+ в миоплазме
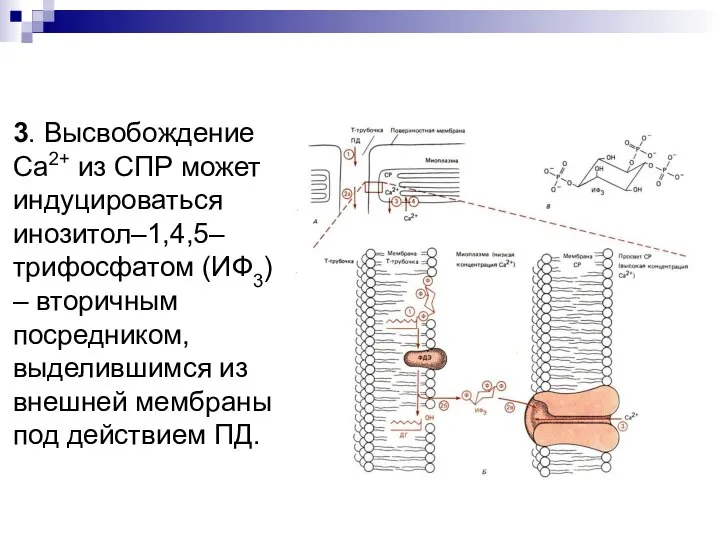
- 41. 3. Высвобождение Са2+ из СПР может индуцироваться инозитол–1,4,5–трифосфатом (ИФ3) – вторичным посредником, выделившимся из внешней мембраны
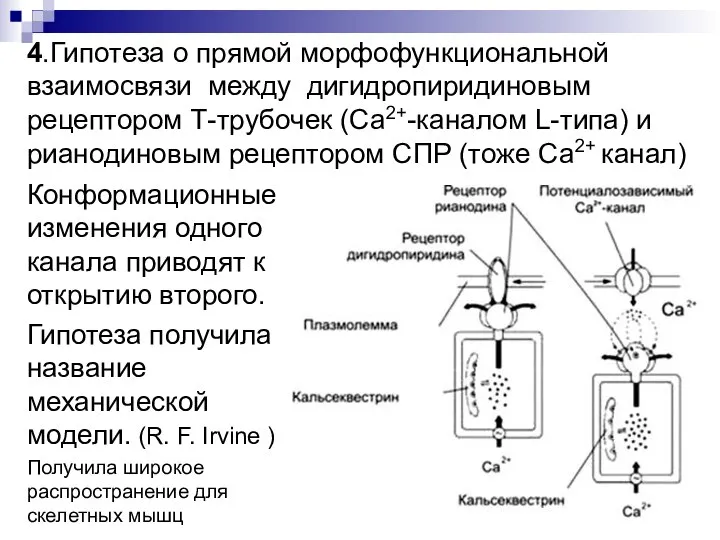
- 42. 4.Гипотеза о прямой морфофункциональной взаимосвязи между дигидропиридиновым рецептором Т-трубочек (Са2+-каналом L-типа) и рианодиновым рецептором СПР (тоже
- 43. Суммация мышечных сокращений
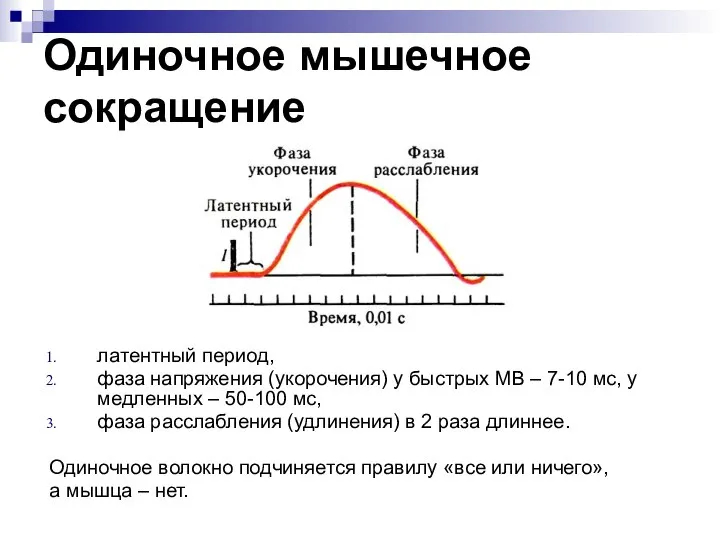
- 44. Одиночное мышечное сокращение латентный период, фаза напряжения (укорочения) у быстрых МВ – 7-10 мс, у медленных
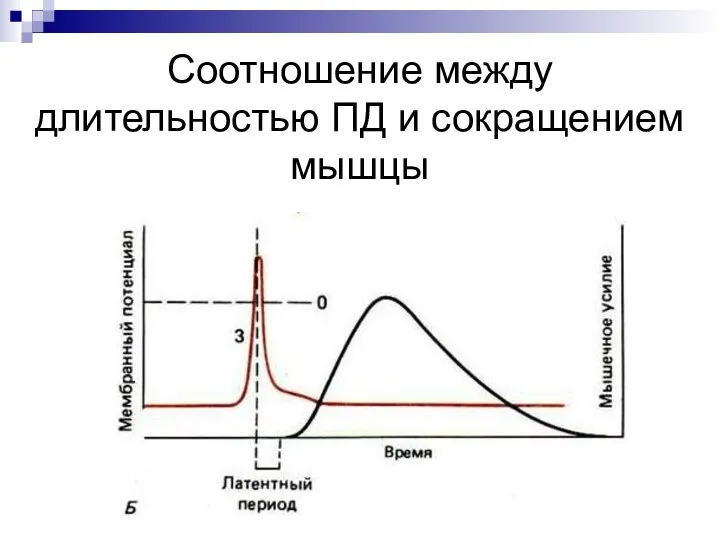
- 45. Соотношение между длительностью ПД и сокращением мышцы
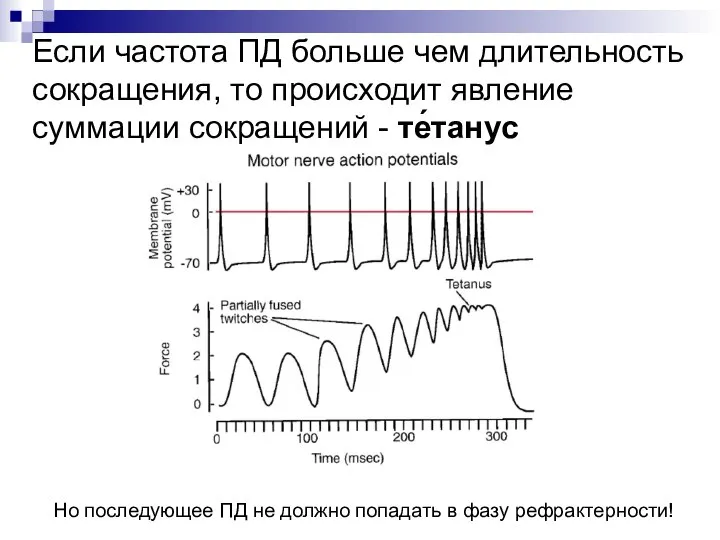
- 46. Если частота ПД больше чем длительность сокращения, то происходит явление суммации сокращений - те́танус Но последующее
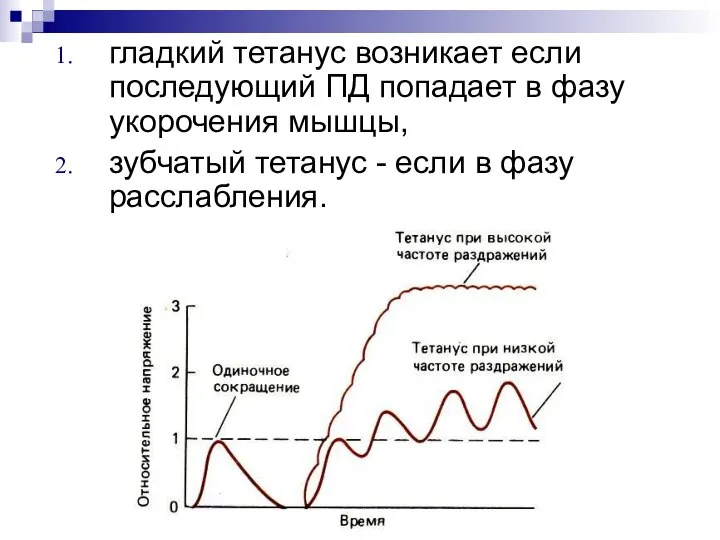
- 47. гладкий тетанус возникает если последующий ПД попадает в фазу укорочения мышцы, зубчатый тетанус - если в
- 48. Теории возникновения тетануса Гельмгольц – тетанус – это механическое сложение одиночных мышечных сокращений, Введенский – тетанус
- 49. КОНТРАКТУРА - обратимое нераспространяющееся стационарное сокращение Типы контрактур: Посттетаническая (высокий остаточный Са2+) Кофеиновая – кофеин проникая
- 50. Гладкие мышцы
- 51. Физиологические особенности гладких мышц 1) нестабильный мембранный потенциал, который поддерживает мышцы в состоянии постоянного частичного сокращения
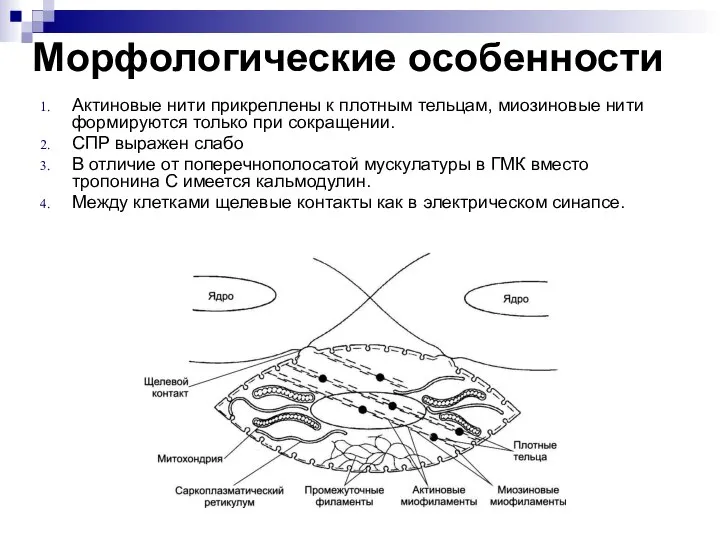
- 52. Морфологические особенности Актиновые нити прикреплены к плотным тельцам, миозиновые нити формируются только при сокращении. СПР выражен
- 53. Иннервация ГМК иннервируют симпатические (адренергические) и отчасти парасимпатические (холинергические) нервные волокна. Нейромедиаторы диффундируют из варикозных терминальных
- 54. Гуморальная регуляция В мембрану разных ГМК встроены рецепторы ацетилхолина, гистамина, атриопептина, ангиотензина, адренорецепторы и множество других.
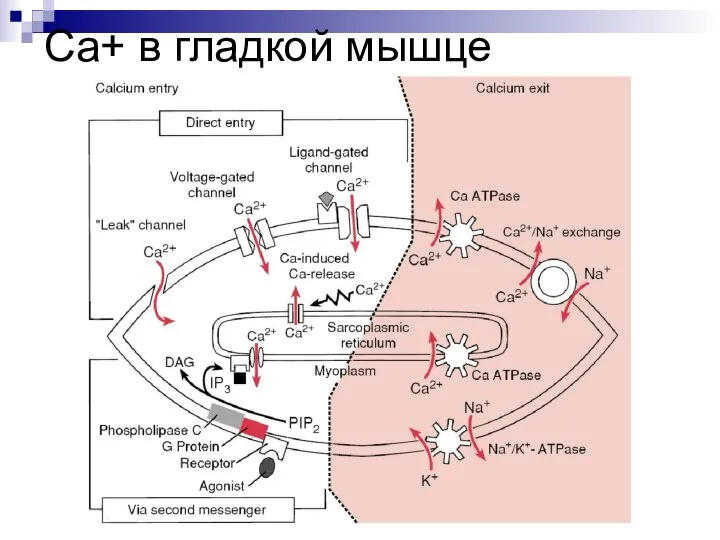
- 55. Са+ в гладкой мышце
- 56. Холиномиметики усиливают сокращение оказывают на мышцу тот же эффект, что и ацетилхолин. Различие заключается в том,
- 57. Кураре и курареподобные препараты широко применяются в анестезиологии. Тубокурарин препятствует деполяризующему действию ацетилхолина. Дитилин приводит к
- 58. Ботулотоксин и столбнячный токсин блокируют секрецию медиатора из нервных терминалей, подавляя торможение в ЦНС. Поэтому сокращение
- 60. Скачать презентацию































 Зеленое чудо
Зеленое чудо Обменные процессы в организме
Обменные процессы в организме Презентация к предмету ОМ
Презентация к предмету ОМ Корень, его строение и значение
Корень, его строение и значение Вирусы. История открытия
Вирусы. История открытия Клетка живого организма
Клетка живого организма Мышечная система
Мышечная система Птицы для дошкольников
Птицы для дошкольников Взаимоотношения организмов разных видов
Взаимоотношения организмов разных видов Презентация на тему Верблюд - царь домашних животных
Презентация на тему Верблюд - царь домашних животных  ЦНС (центральная нервная система)
ЦНС (центральная нервная система) Урок – игра Семейства класса двудольных
Урок – игра Семейства класса двудольных Типы взаимодействия между организмами
Типы взаимодействия между организмами Биология и биотехнология. Второй закон Менделя
Биология и биотехнология. Второй закон Менделя Голосеменные и покрытосеменные растения
Голосеменные и покрытосеменные растения Органы чувств человека. Строение уха
Органы чувств человека. Строение уха Вегетативная нервная система
Вегетативная нервная система Детёныши животных
Детёныши животных Применение мультимедийных пособий в изучении биологии МОУ «Серединская средняя общеобразовательная школа» Учитель биологии Ки
Применение мультимедийных пособий в изучении биологии МОУ «Серединская средняя общеобразовательная школа» Учитель биологии Ки Химический состав клетки
Химический состав клетки Домашние животные
Домашние животные Филин обыкновенный
Филин обыкновенный Бактерии. Размножение бактерий
Бактерии. Размножение бактерий Значение живых организмов в природе и жизни человека
Значение живых организмов в природе и жизни человека Зимующие птицы Ярославской области
Зимующие птицы Ярославской области Строение стебля
Строение стебля 10178_7807320_13
10178_7807320_13 Цветок. Строение
Цветок. Строение