Содержание
- 2. ПЛАН ЛЕКЦИИ I. Переваривание белков и всасывание АК в ЖКТ. II. Аминокислотный фонд клетки. III. Метаболизм
- 3. СПИСОК СОКРАЩЕНИЙ АК - аминокислоты ЖКТ – желудочно-кишечный тракт Гл – SH – глутатион ГАМК –
- 4. I. ПЕРЕВАРИВАНИЕ БЕЛКОВ И ВСАСЫВАНИЕ АК В ЖКТ 1) Белки пищи поэтапно гидролизуются до свободных АК
- 5. I. ПЕРЕВАРИВАНИЕ БЕЛКОВ И ВСАСЫВАНИЕ АК В ЖКТ 2) Пептидазы обладают относительной субстратной специфичностью, но с
- 6. I. ПЕРЕВАРИВАНИЕ БЕЛКОВ И ВСАСЫВАНИЕ АК В ЖКТ 4) От пептидаз СОЖ и кишечника защищают муцины,
- 7. II. АМИНОКИСЛОТНЫЙ ФОНД КЛЕТКИ ИСТОЧНИКИ ПОСТУПЛЕНИЯ АК: 1) белки пищи; 2) белки тканей 3) синтез заменимых
- 8. III. Метаболизм АК в тканях: общие пути обмена АК 1. ТРАНСАМИНИРОВАНИЕ – это реакции переноса аминогруппы
- 9. Рис. 1. РЕАКЦИИ ТРАНСАМИНИРОВАНИЯ α- α- АСТ АЛТ ПФ(В6) ПФ(В6)
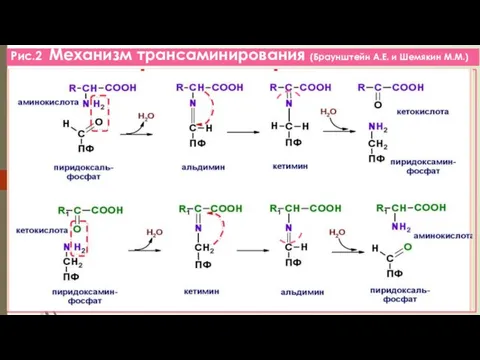
- 10. Рис.2 Механизм трансаминирования (Браунштейн А.Е. и Шемякин М.М.)
- 11. Б/РОЛЬ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ Образование заменимых АК из α-кетокислот (α-КГ- коллектор, собирает аминогруппы; Глу - универсальный донор
- 12. III. Метаболизм АК в тканях: общие пути обмена АК 2. ДЕЗАМИНИРОВАНИЕ – это реакции отщеплениия α-аминогруппы
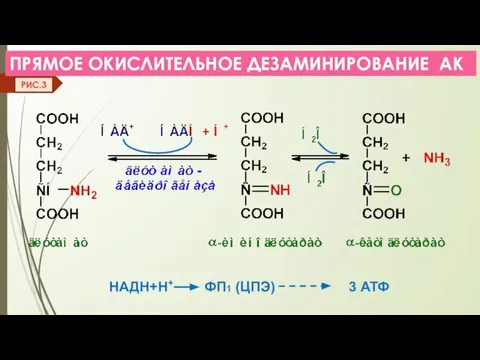
- 13. ПРЯМОЕ ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ АК НАДН+Н+ ФП1 (ЦПЭ) 3 АТФ РИС.3
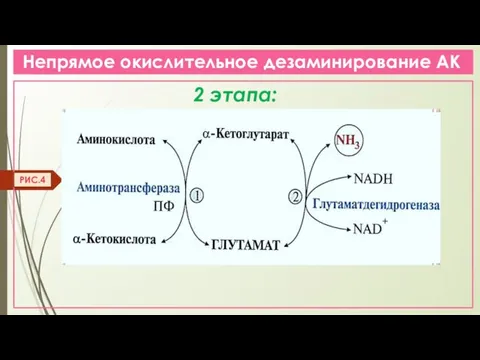
- 14. Непрямое окислительное дезаминирование АК 2 этапа: РИС.4
- 15. НЕПРЯМОЕ ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ ТРАНСФЕРАЗА α- ПФ(В6) РИС. 5 2 1
- 16. Биологическая РОЛЬ РЕАКЦИЙ ДЕЗАМИНИРОВАНИЯ АК Реакции распада АК Образование α-кетокислот, к-е могут поступать В ЦТК (ЩУК,
- 17. III. Метаболизм АК в тканях: общие пути обмена АК 3. ДЕКАРБОКСИЛИРОВАНИЕ – это необратимые реакции отщеплениия
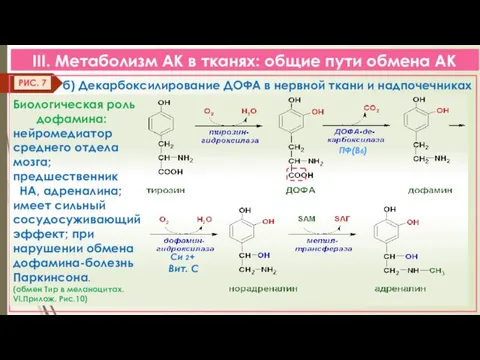
- 18. III. Метаболизм АК в тканях: общие пути обмена АК б) Декарбоксилирование ДОФА в нервной ткани и
- 19. III. Метаболизм АК в тканях: общие пути обмена АК в) Декарбоксилирование Глу: Биологическая роль ГАМК: основной
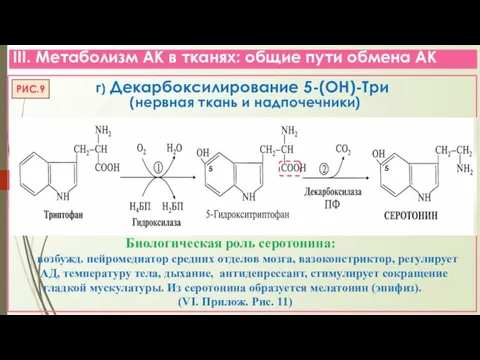
- 20. III. Метаболизм АК в тканях: общие пути обмена АК г) Декарбоксилирование 5-(ОН)-Три РИС.9 5 5 (нервная
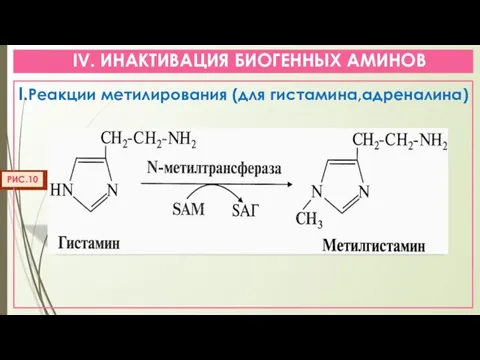
- 21. IV. ИНАКТИВАЦИЯ БИОГЕННЫХ АМИНОВ I.Реакции метилирования (для гистамина,адреналина) РИС.10
- 22. IV. ИНАКТИВАЦИЯ БИОГЕННЫХ АМИНОВ 2. Реакции окислительного дезаминирования (для дофамина, НА, серотонина, ГАМК) РИС.11 Биологическая роль
- 23. V. Метаболизм АК в тканях: индивидуальные пути обмена АК РИС.12 Биологическая роль реакции: образование Глу, к-я
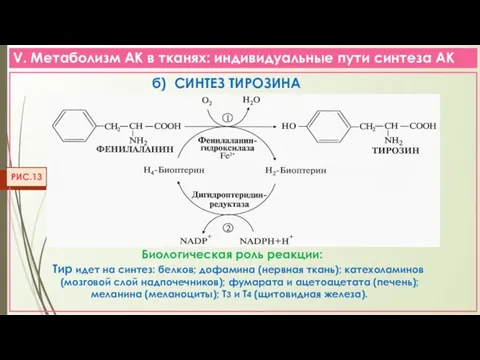
- 24. V. Метаболизм АК в тканях: индивидуальные пути синтеза АК РИС.13 б) СИНТЕЗ ТИРОЗИНА Биологическая роль реакции:
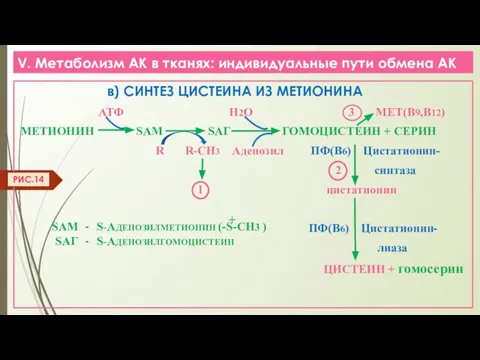
- 25. V. Метаболизм АК в тканях: индивидуальные пути обмена АК в) СИНТЕЗ ЦИСТЕИНА ИЗ МЕТИОНИНА АТФ Н2О
- 26. V. Метаболизм АК в тканях: индивидуальные пути обмена АК 1 ТРАНСМЕТИЛИРОВАНИЕ СУБСТРАТОВ (R) НЕОБХОДИМО ДЛЯ: СИНТЕЗА
- 27. Б/РОЛЬ ЦИСТЕИНА (Цис) 1) Цистеин содержат многие ферменты (ДГ, ЩФ), гормоны (кальцитонин, АДГ, инсулин), Гл-SH; Цис
- 28. VI. ПРИЛОЖЕНИЕ: ГОМОЦИСТИНУРИЯ В основе заболевания гомоцистинурия (МКБ 10: Е72.1) лежит метаболический блок на пути превращения
- 29. VI. ПРИЛОЖЕНИЕ: ГОМОЦИСТИНУРИЯ Повышенное содержание метаболитов метионина в крови и тканях оказывает токсическое действие на нервную
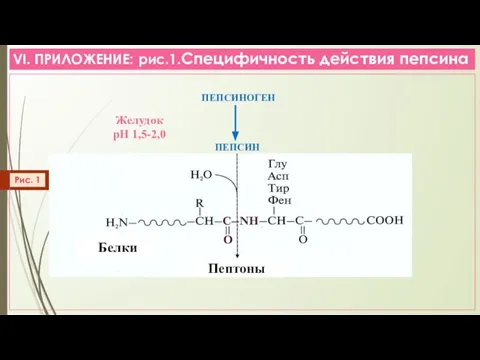
- 30. VI. ПРИЛОЖЕНИЕ: рис.1.Специфичность действия пепсина ПЕПСИНОГЕН ПЕПСИН Рис. 1 Пептоны Белки Желудок рН 1,5-2,0
- 31. Пептоны Рис. 2 Олигопептиды + аминокислоты Про Сер Аром. АК VI. ПРИЛОЖЕНИЕ: рис. 2. Специфичность действия
- 32. VI. ПРИЛОЖЕНИЕ: рис. 3 М.Г. Крицман (1905-1971) Окончила Одесский медицинский институт. Работала в Москве в Биохимическом
- 33. VI. ПРИЛОЖЕНИЕ: рис. 4 РИС.4
- 34. VI. ПРИЛОЖЕНИЕ: рис.5. Виды реакций дезаминирования РИС.5
- 35. VI. ПРИЛОЖЕНИЕ: рис.6. : Неокислительное дезаминирование Сер,Тре (элиминирующее) РИС. 6
- 36. VI. ПРИЛОЖЕНИЕ: рис.7 Неокислительное дезаминирование ЦИС (цистатионин - γ – лиаза, ПФ,) и неокислительное (внутримолекулярное) дезаминирование
- 37. VI.ПРИЛОЖЕНИЕ: рис.8 Непрямое дезаминирование АК с участием цикла ИМФ – АМФ (для мышечной ткани и мозга)
- 38. VI. ПРИЛОЖЕНИЕ: рис.9. Декарбоксилирование серусодержащих АК РИС. 9
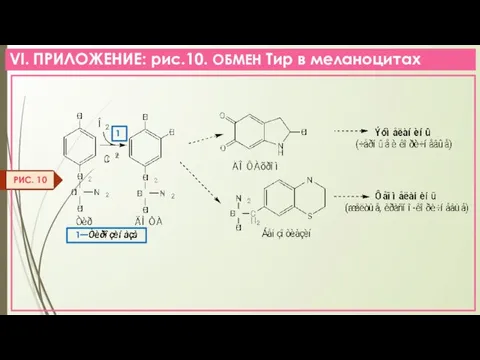
- 39. VI. ПРИЛОЖЕНИЕ: рис.10. ОБМЕН Тир в меланоцитах РИС. 10 1 1
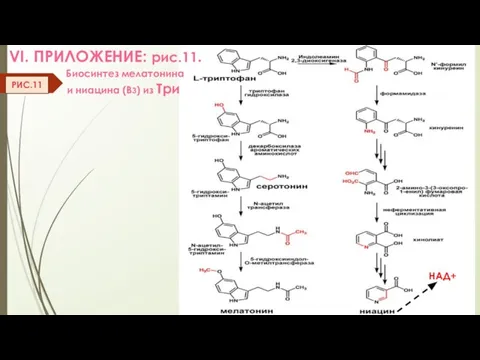
- 40. VI. ПРИЛОЖЕНИЕ: рис.11. Биосинтез мелатонина и ниацина (В3) из Три РИС.11 НАД+
- 41. СПИСОК ЛИТЕРАТУРЫ ЛК 6 Основная литература: 1. а) Биохимия: учебник/ под ред. Е.С. Северина.- М.: ГЭОТАР-
- 42. VII. СПИСОК ЛИТЕРАТУРЫ ЛК 6 Дополнительная литература: Биологическая химия: учебник. Т.Т. Березов, Б.Ф. Коровкин. – 3-е
- 44. Скачать презентацию






























 Как стареют лица
Как стареют лица Анатомо-физиологические механизмы безопасности и защиты человека от негативных факторов
Анатомо-физиологические механизмы безопасности и защиты человека от негативных факторов Spring Book
Spring Book Менингиомы передней черепной ямки
Менингиомы передней черепной ямки Борщевик Сосновского. Памятка о безопасности
Борщевик Сосновского. Памятка о безопасности Видоизменённые побеги
Видоизменённые побеги Общие вопросы анатомии и физиологии опорно-двигательного аппарата
Общие вопросы анатомии и физиологии опорно-двигательного аппарата Туя западная Смарагд
Туя западная Смарагд Понятие экосистемы
Понятие экосистемы Побе́г (лат. córmus) — один из основных вегетативных органов высших растений
Побе́г (лат. córmus) — один из основных вегетативных органов высших растений Иммунная система человека
Иммунная система человека Презентация на тему Антропоген
Презентация на тему Антропоген  Сцепленное с полом наследование
Сцепленное с полом наследование Морфология анализатора зрения
Морфология анализатора зрения Презентация на тему ИСТОРИЯ ИЗУЧЕНИЯ КЛЕТКИ. КЛЕТОЧНАЯ ТЕОРИЯ
Презентация на тему ИСТОРИЯ ИЗУЧЕНИЯ КЛЕТКИ. КЛЕТОЧНАЯ ТЕОРИЯ  Презентация на тему Класс Земноводные 7 класс
Презентация на тему Класс Земноводные 7 класс  Хищничество и паразитизм
Хищничество и паразитизм Строение клетки
Строение клетки Характеристика царства Животные. 5 класс
Характеристика царства Животные. 5 класс Нервная система человека
Нервная система человека Общая характеристика земноводных
Общая характеристика земноводных Презентация на тему Клеточное строение листа
Презентация на тему Клеточное строение листа  Аксолотль. Отращивание конечностей
Аксолотль. Отращивание конечностей Доказательства происхождения животных
Доказательства происхождения животных Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Интеллектуальная игра Брейн-ринг. Афанасий Никитин
Интеллектуальная игра Брейн-ринг. Афанасий Никитин Строение и жизнедеятельность рыб
Строение и жизнедеятельность рыб Многообразие живых организмов – основа организации и устойчивости биосферы. 9 класс. 3 урок. биология
Многообразие живых организмов – основа организации и устойчивости биосферы. 9 класс. 3 урок. биология