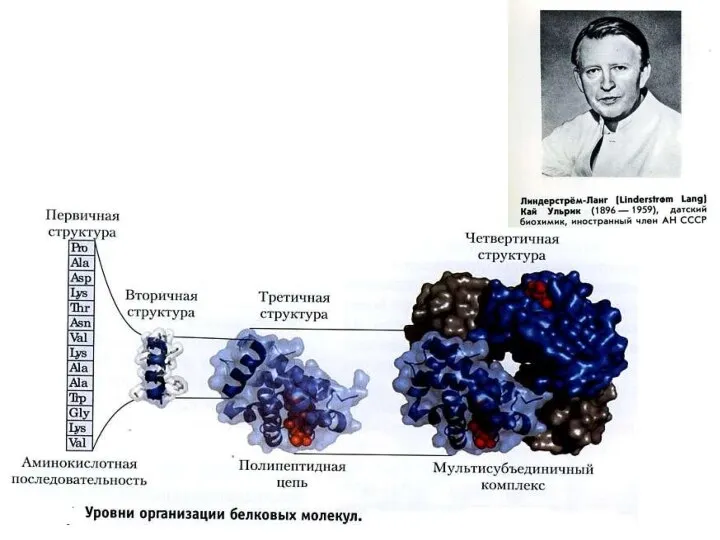
Содержание
- 3. Как живые организмы получают азот?
- 4. ЦИКЛ АЗОТА В БИОСФЕРЕ СИНТЕЗ АМИНОКИСЛОТ, по учебнику Анисимова п. 5.1 и 5.2 по: Нельсон, Кокс
- 5. Для синтеза заменимых аминокислот человеку и животным подходит только NH3 (в воде NH4OH, NH4+)
- 6. Источники аммиака Фриц Габер, Карл Бош – Нобелевская премия 1918 и 1931 соответственно за создание технологии
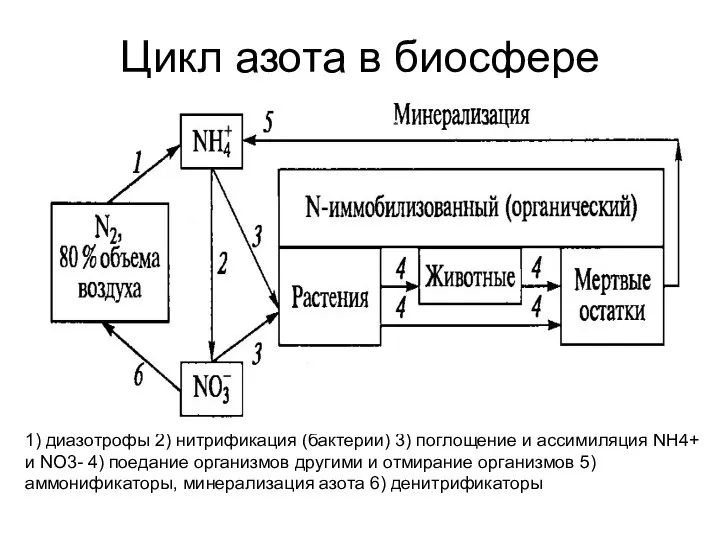
- 7. Цикл азота в биосфере 1) диазотрофы 2) нитрификация (бактерии) 3) поглощение и ассимиляция NH4+ и NO3-
- 8. 1. Фиксация NΞN. НИТРОГЕНАЗА БАКТЕРИИ – диазотрофы: - свободноживущие (рр. Azotobacter, Clostridium, все фотосинтезирующие, ряд АРХЕЙ…)
- 9. Повсеместность азотфиксации 1895 - Наббе, Хилтнер – патент на микробное удобрение Nitragin (культуры азотфиксаторов для разных
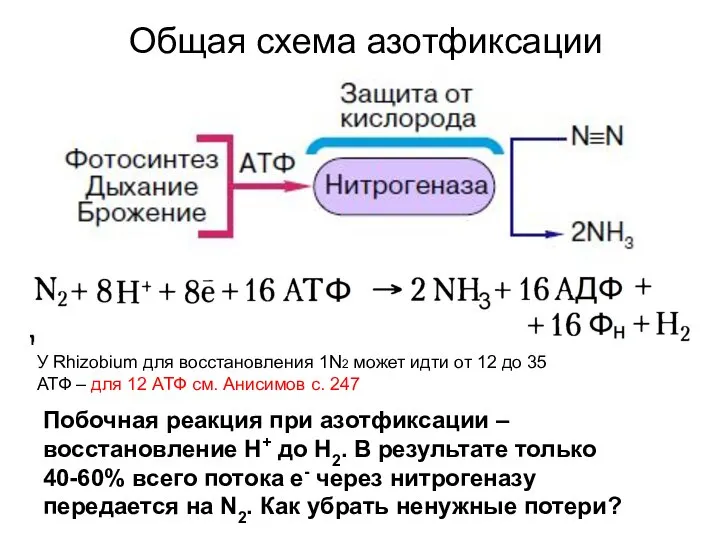
- 10. Общая схема азотфиксации У Rhizobium для восстановления 1N2 может идти от 12 до 35 АТФ –
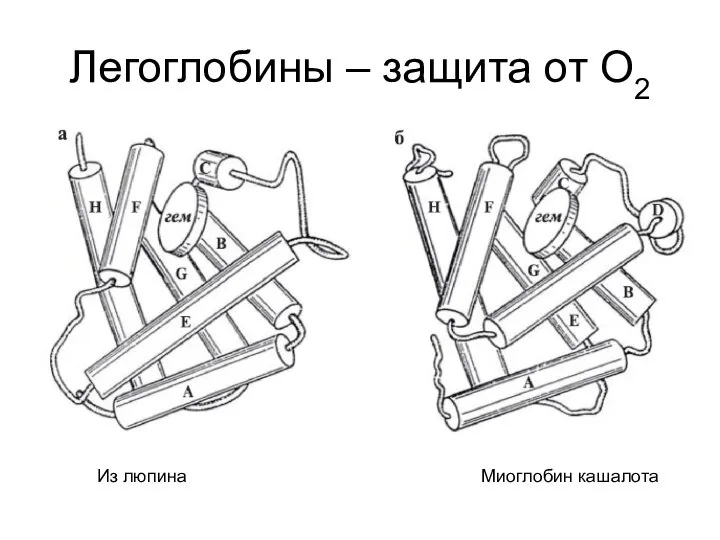
- 11. Легоглобины – защита от О2 Из люпина Миоглобин кашалота
- 12. “Из аммиака в аммонийную форму” - работает нитрогеназный комплекс (упрощенно называемый нитрогеназой). Комплекс состоит из 2х
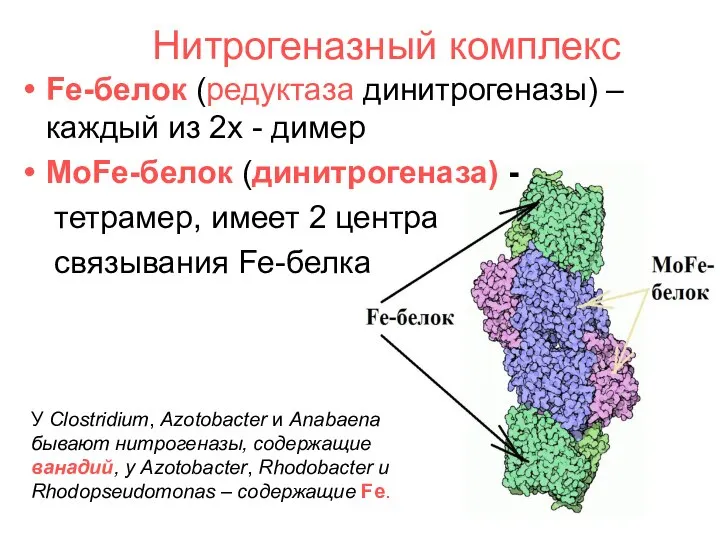
- 13. Нитрогеназный комплекс Fe-белок (редуктаза динитрогеназы) – каждый из 2х - димер MoFe-белок (динитрогеназа) - тетрамер, имеет
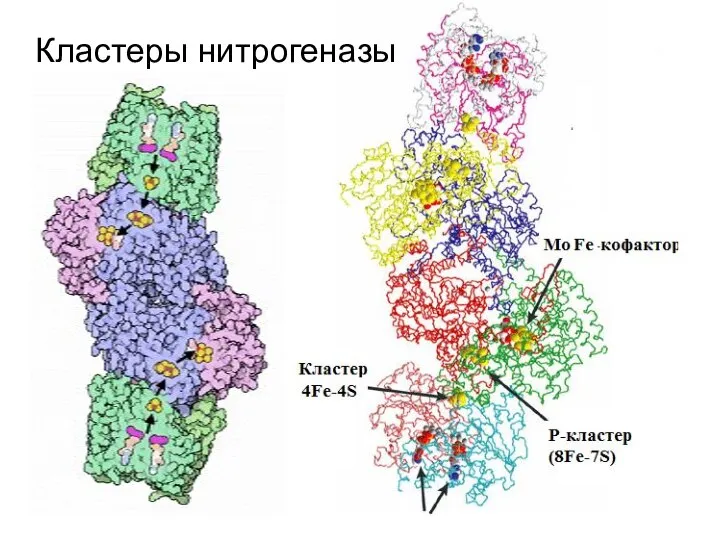
- 14. Кластеры нитрогеназы
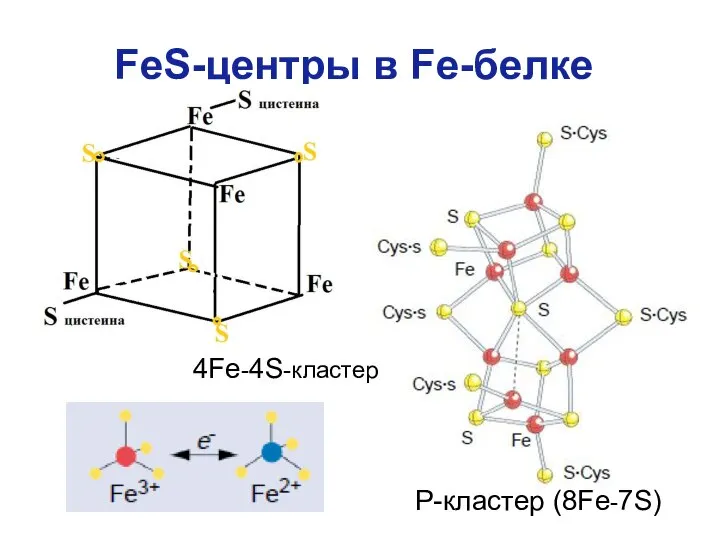
- 15. FeS-центры в Fe-белке Р-кластер (8Fe-7S) 4Fe-4S-кластер
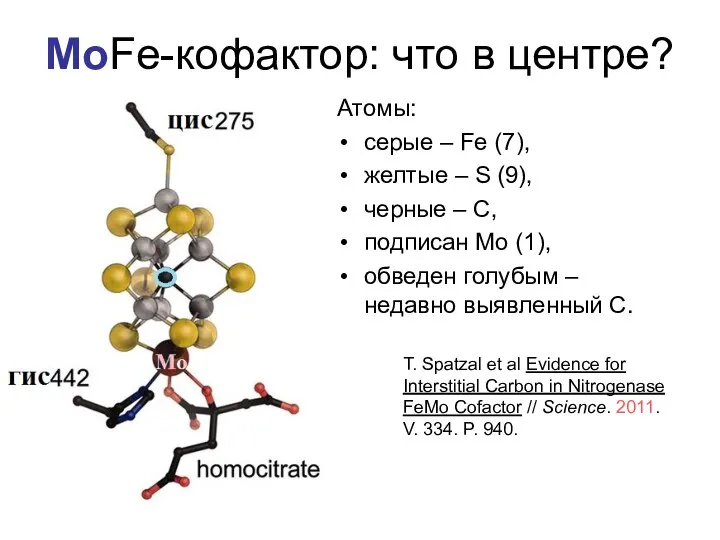
- 16. MoFe-кофактор: что в центре? Атомы: cерые – Fe (7), желтые – S (9), черные – С,
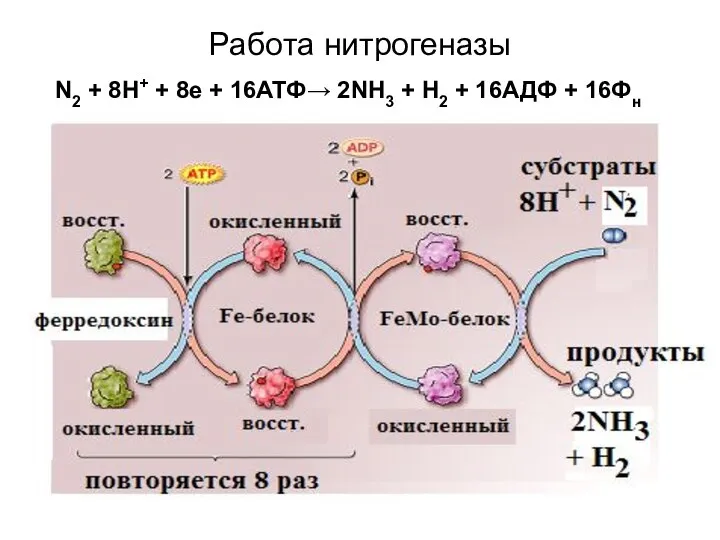
- 17. Работа нитрогеназы N2 + 8H+ + 8e + 16АТФ→ 2NH3 + H2 + 16АДФ + 16Фн
- 18. Расшифровка к предыдущему слайду В молекуле Fe-белка (димере) 1 FeS-центр, поэтому Fe-белок может переносить только по
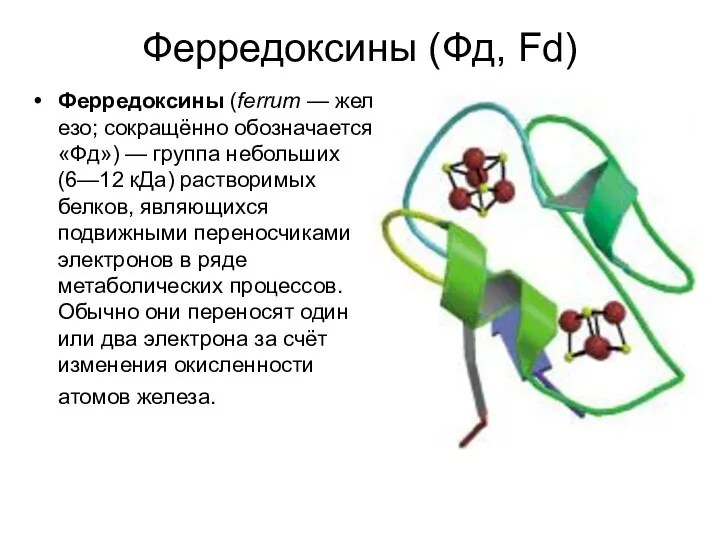
- 19. Ферредоксины (Фд, Fd) Ферредоксины (ferrum — железо; сокращённо обозначается «Фд») — группа небольших (6—12 кДа) растворимых
- 20. Дополнительный материал Направления исследований: 1) Разработка технологий для сельского хозяйства на базе изучения физиологии и биохимии
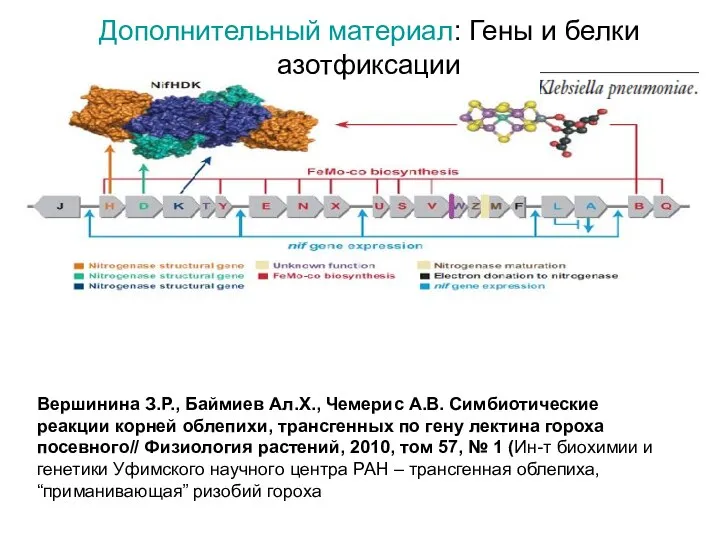
- 21. Дополнительный материал: Гены и белки азотфиксации Вершинина З.Р., Баймиев Ал.Х., Чемерис А.В. Симбиотические реакции корней облепихи,
- 22. ПУТИ СИНТЕЗА АМИНОКИСЛОТ Семейства аминокислот по происхождению
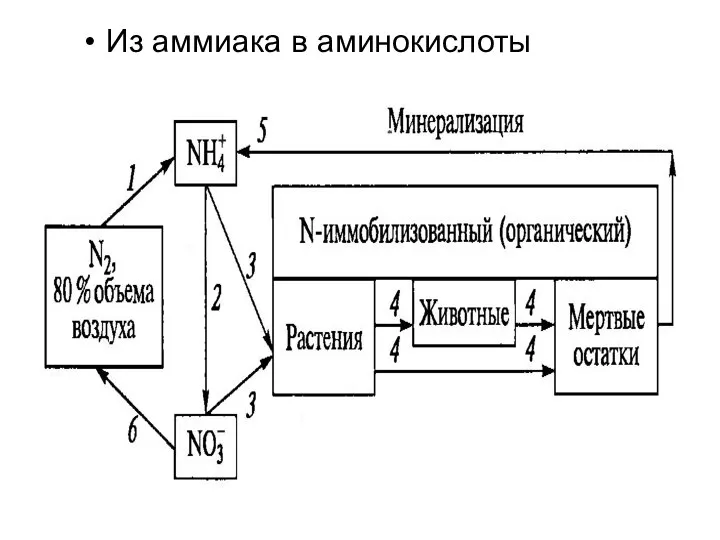
- 23. Из аммиака в аминокислоты
- 24. РАСТЕНИЕ: поглощение и переработка NH4+ из почвы (или от симбионтов) Дополнит. информация:2 типа транспортных систем: если
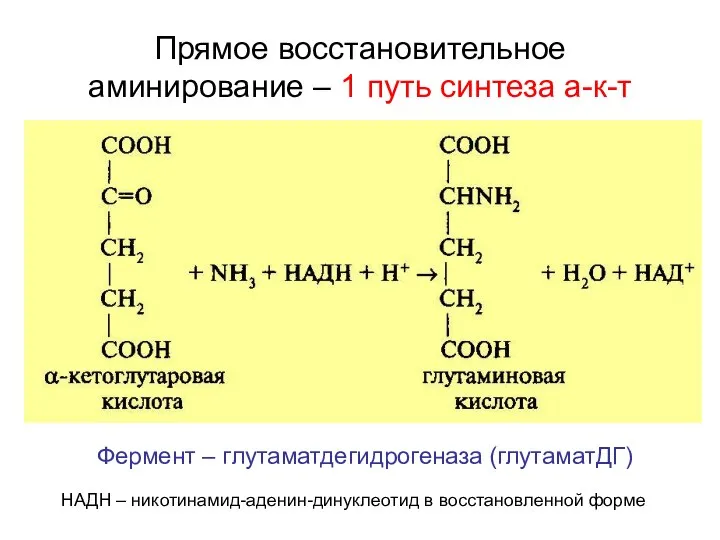
- 25. Прямое восстановительное аминирование – 1 путь синтеза а-к-т Фермент – глутаматдегидрогеназа (глутаматДГ) НАДН – никотинамид-аденин-динуклеотид в
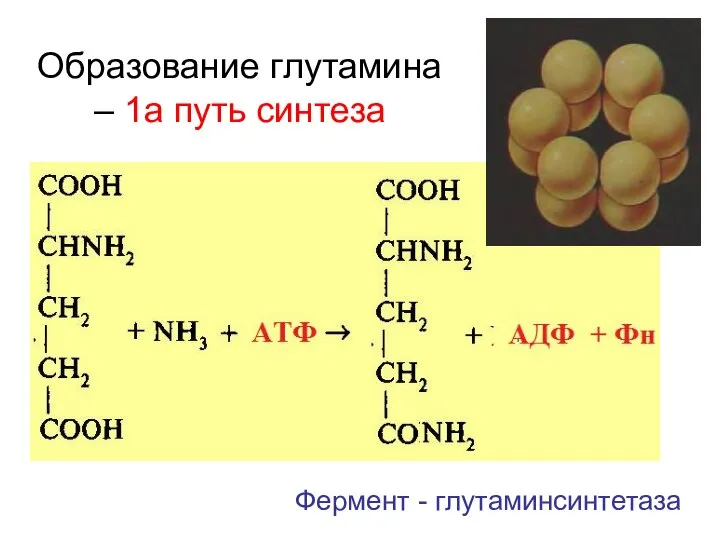
- 26. Образование глутамина – 1а путь синтеза Фермент - глутаминсинтетаза
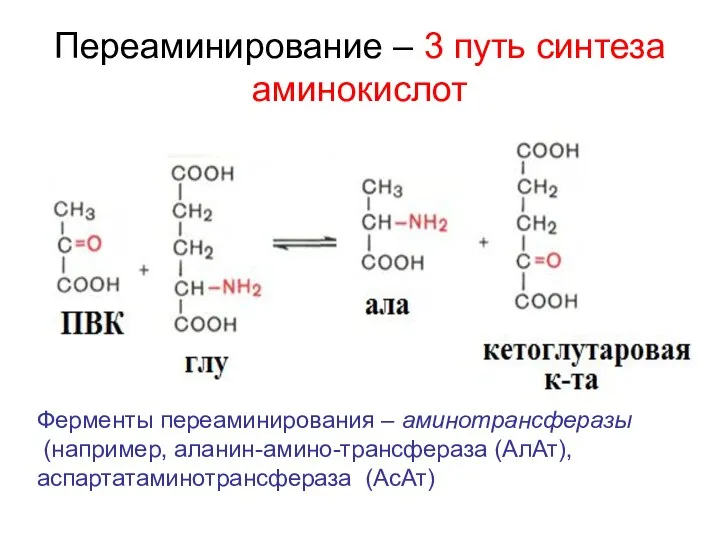
- 27. Переаминирование – 3 путь синтеза аминокислот Ферменты переаминирования – аминотрансферазы (например, аланин-амино-трансфераза (АлАт), аспартатаминотрансфераза (АсАт)
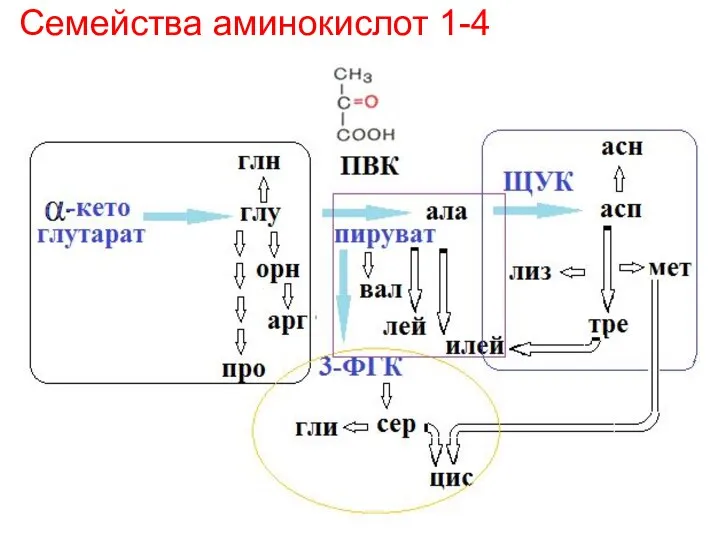
- 28. 3 путь синтеза аминокислот - ферментативные превращения 1) Семейства аминокислот 1 – 4 (на основе α-кетоглутаровой
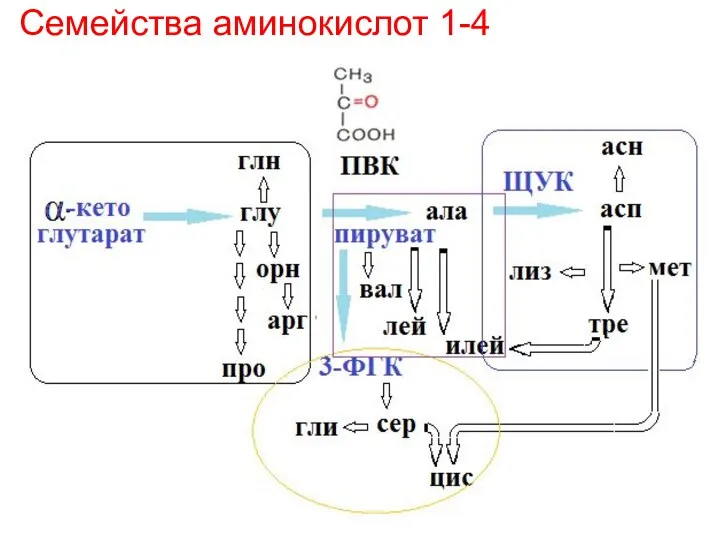
- 29. Семейства аминокислот 1-4
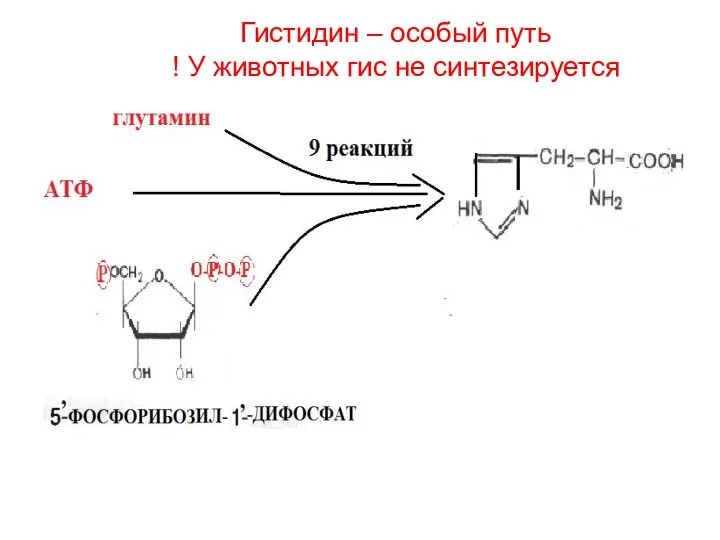
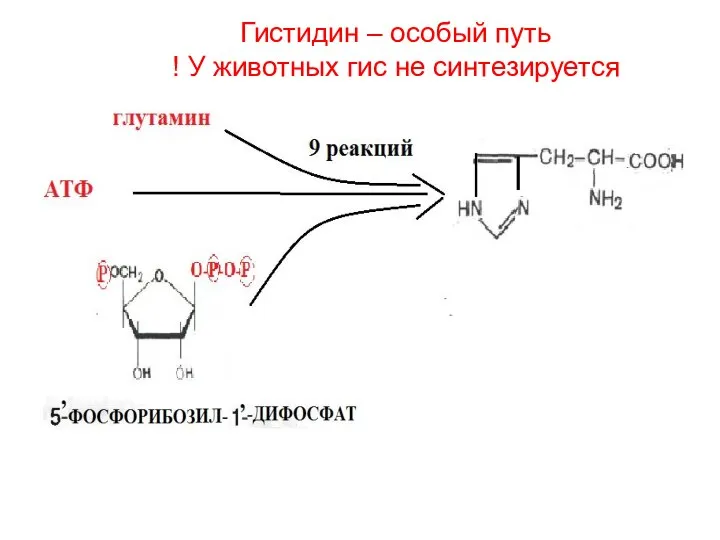
- 30. Гистидин – особый путь ! У животных гис не синтезируется
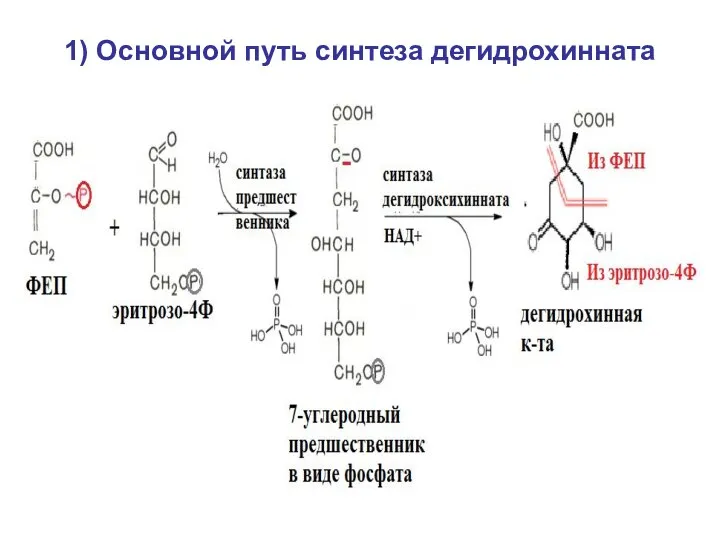
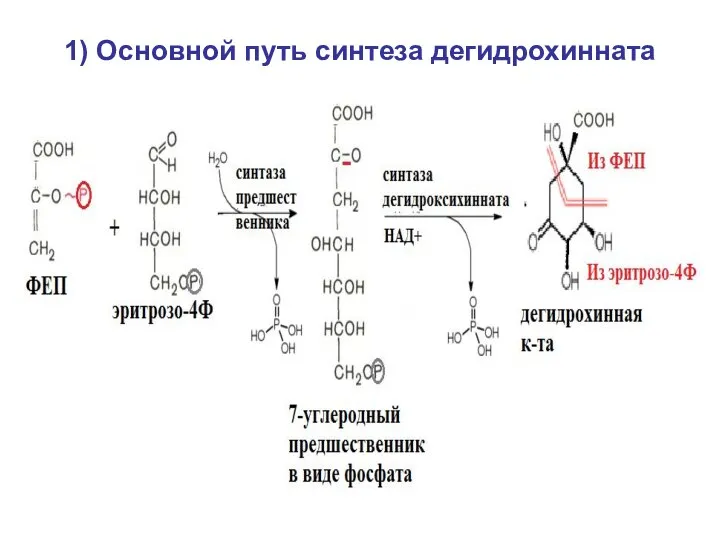
- 31. Семейство 5 (ароматические) – по шикиматному пути 1) синтез дегидрохинной кислоты (дегидрохинната), у большинства видов -
- 32. 1) Основной путь синтеза дегидрохинната
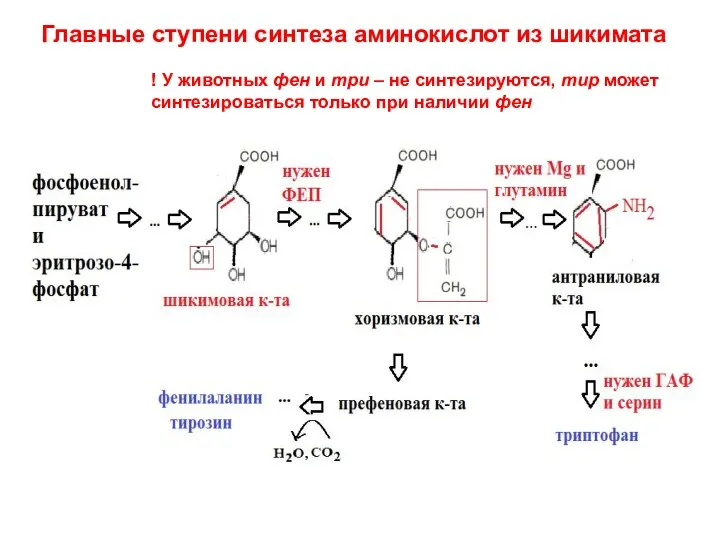
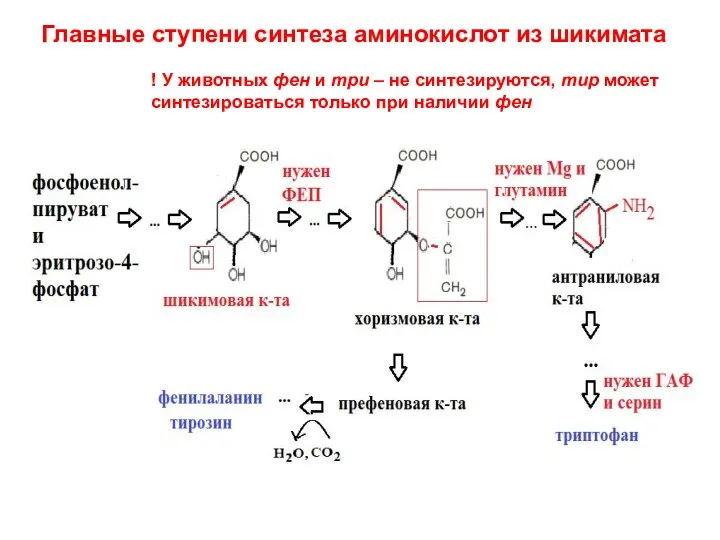
- 33. Главные ступени синтеза аминокислот из шикимата ! У животных фен и три – не синтезируются, тир
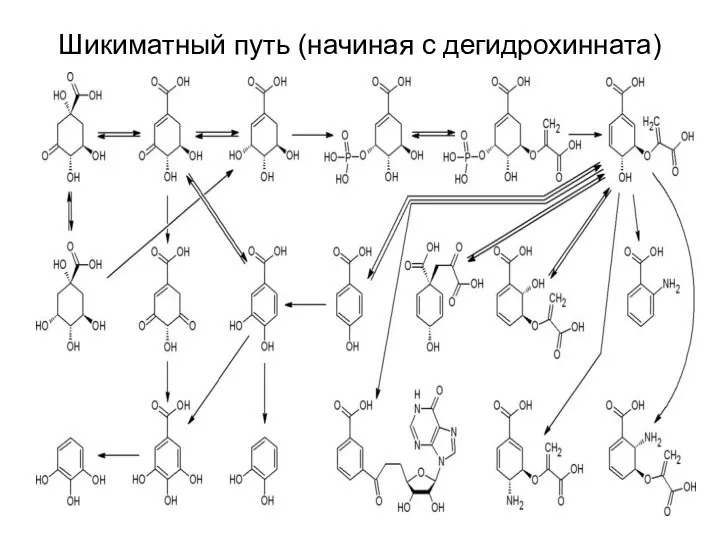
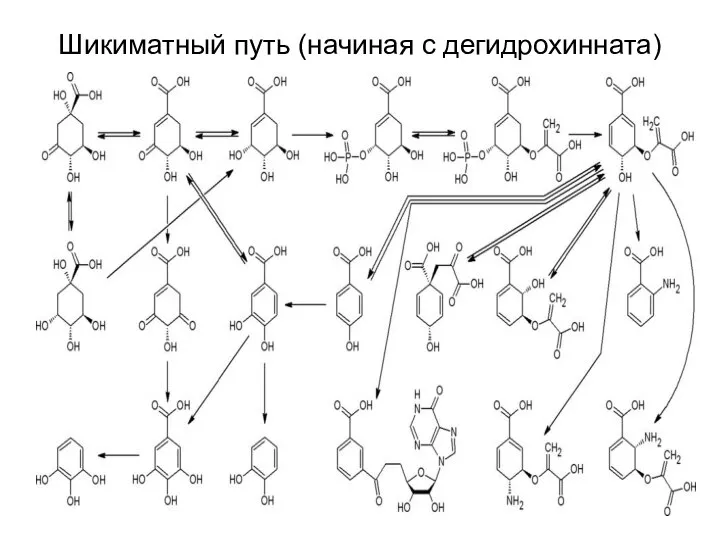
- 34. Шикиматный путь (начиная с дегидрохинната)
- 35. ИТОГО: основные пути синтеза белковых аминокислот 1) прямое восстановительное аминирование 1а) – образование амидов 2) переаминирование
- 36. Ферментативные превращения в синтезе аминокислот 1) Семейства аминокислот 1 – 4 (на основе α-кетоглутаровой к-ты, ПВК,
- 37. Семейства аминокислот 1-4
- 38. Гистидин – особый путь ! У животных гис не синтезируется
- 39. Семейство 5 (ароматические) – по шикиматному пути 1) синтез дегидрохинной кислоты (дегидрохинната), у большинства видов -
- 40. 1) Основной путь синтеза дегидрохинната
- 41. Главные ступени синтеза аминокислот из шикимата ! У животных фен и три – не синтезируются, тир
- 42. Шикиматный путь (начиная с дегидрохинната)
- 43. Нитрификация: 1) автотрофная (бактерии сем. Nitrobacteriaceae, археи), при окислении аммиака получающие энергию в виде АТФ, которую
- 44. Автотрофная нитрификация у бактерий a) NH4+ в клетку – транспортный белок Сu-содержащая транслоказа б) образование нитрита
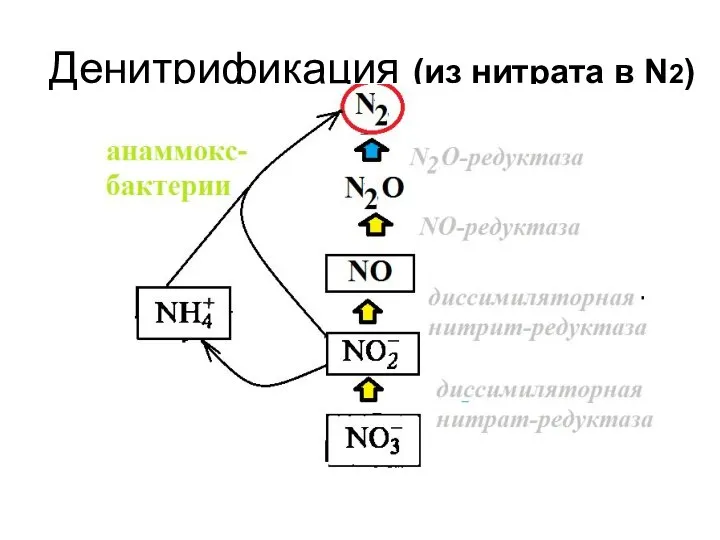
- 45. Денитрификация (из нитрата в N2)
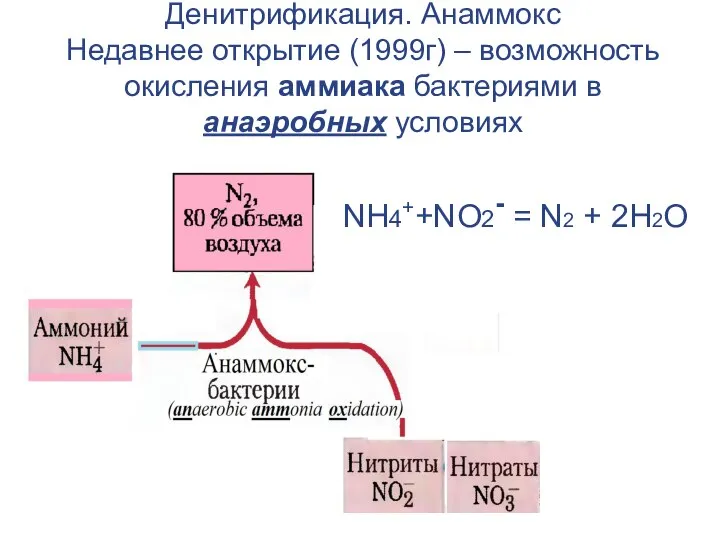
- 46. Денитрификация. Анаммокс Недавнее открытие (1999г) – возможность окисления аммиака бактериями в анаэробных условиях NH4++NO2- = N2
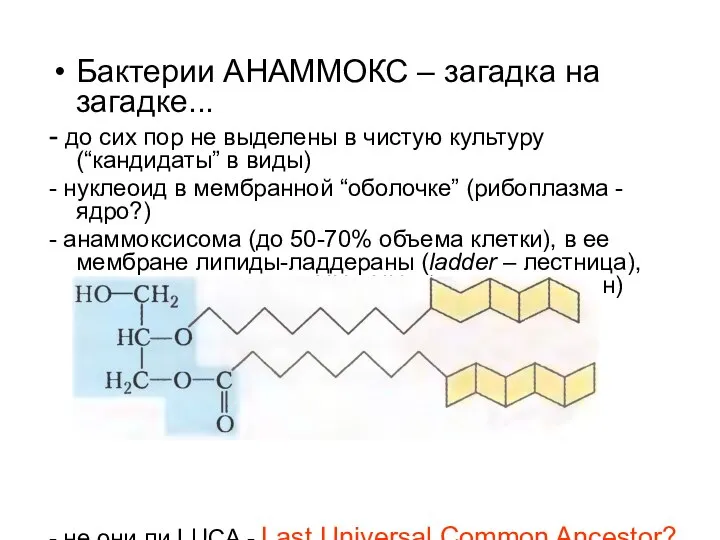
- 47. Бактерии АНАММОКС – загадка на загадке... - до сих пор не выделены в чистую культуру (“кандидаты”
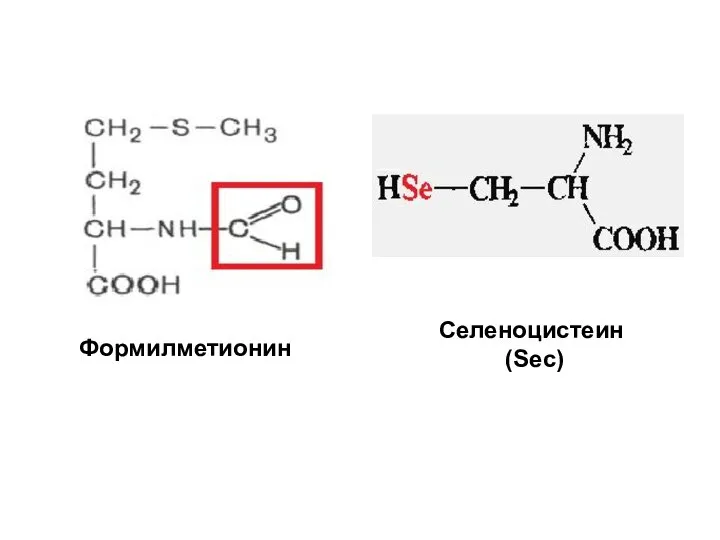
- 48. Селеноцистеин (Sec) Формилметионин
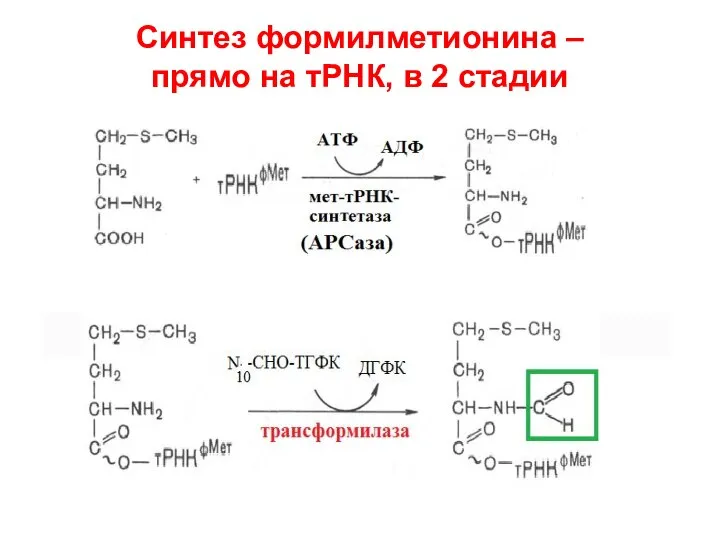
- 49. Синтез формилметионина – прямо на тРНК, в 2 стадии
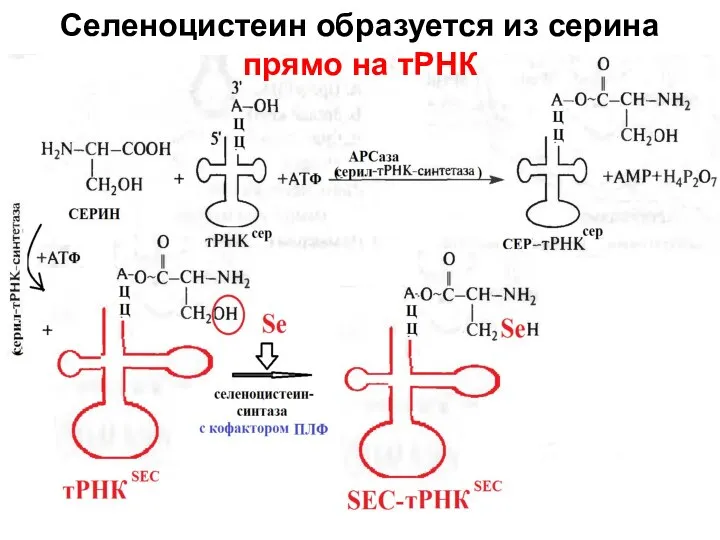
- 50. Селеноцистеин образуется из серина прямо на тРНК
- 51. γ-аминомасляная кислота (ГАМК) основной нейромедиатор торможения, рецепторы ГАМК A и ГАМК C – ионные каналы, активация
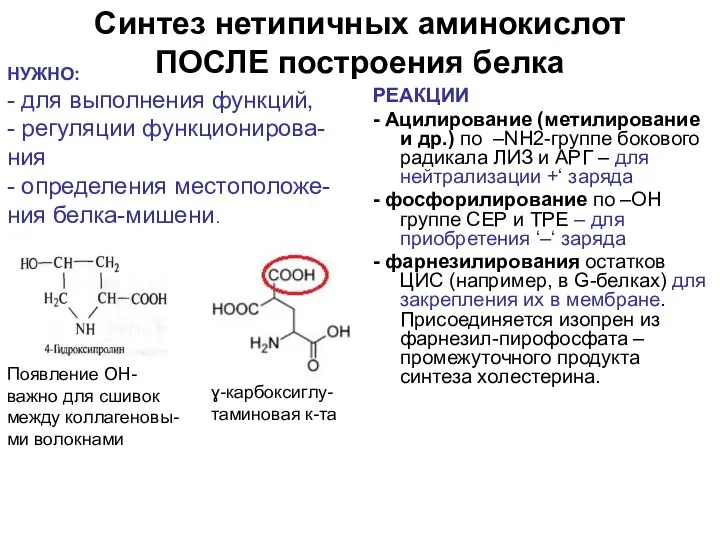
- 52. Синтез нетипичных аминокислот ПОСЛЕ построения белка РЕАКЦИИ - Ацилирование (метилирование и др.) по –NH2-группе бокового радикала
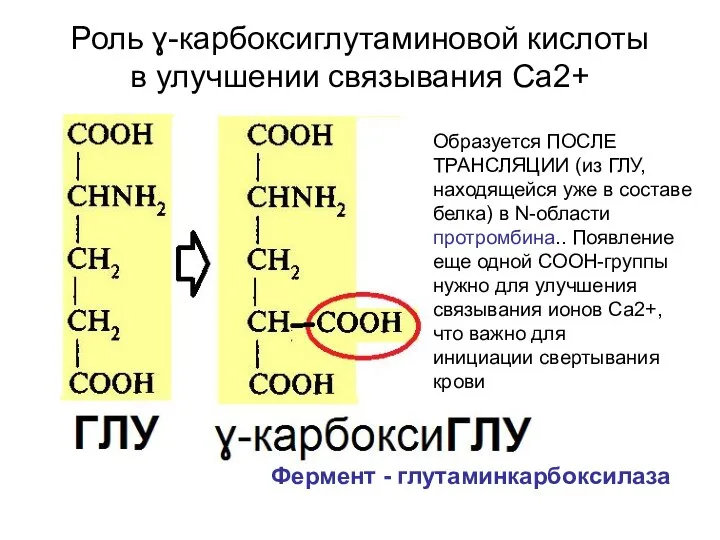
- 53. Роль ɣ-карбоксиглутаминовой кислоты в улучшении связывания Са2+ Образуется ПОСЛЕ ТРАНСЛЯЦИИ (из ГЛУ, находящейся уже в составе
- 54. Mucuna (сем. Бобовые) – зудящие бобы Гриффония (Griffonia simplicifolia, сем. Бобовые) 3,4-дигидроксифенилаланин 5-гидрокситриптофан Ландыш, юкки ЗАЩИТА.
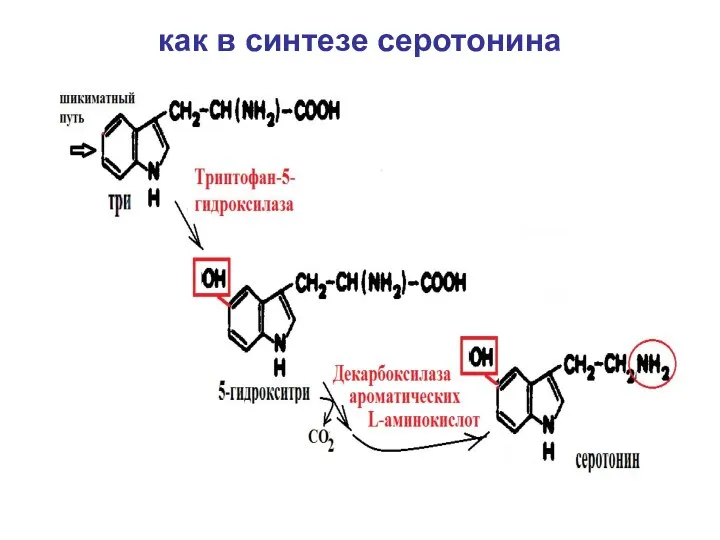
- 55. как в синтезе серотонина
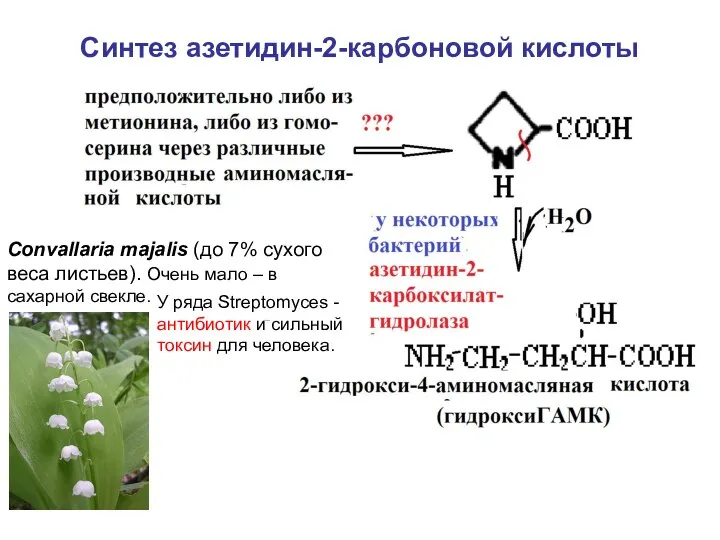
- 56. Синтез азетидин-2-карбоновой кислоты Convallaria majalis (до 7% сухого веса листьев). Очень мало – в сахарной свекле.
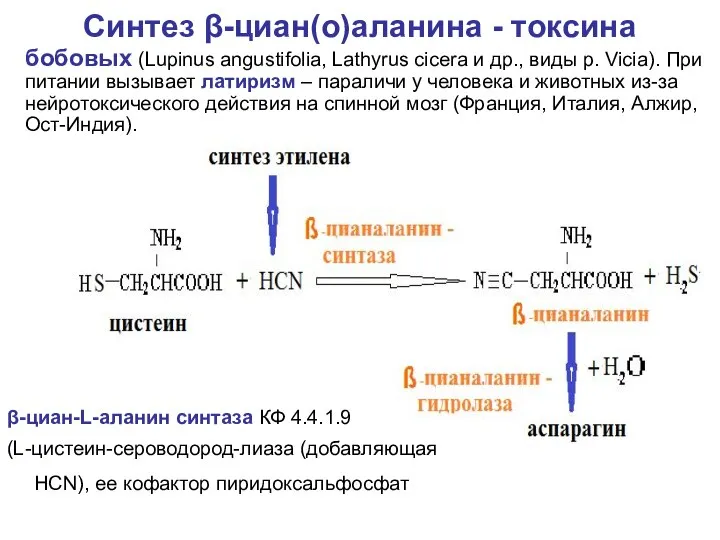
- 57. Синтез β-циан(о)аланина - токсина β-циан-L-аланин синтаза КФ 4.4.1.9 (L-цистеин-сероводород-лиаза (добавляющая HCN), ее кофактор пиридоксальфосфат бобовых (Lupinus
- 59. Скачать презентацию




















 Экологические факторы и их значение в жизни организмов
Экологические факторы и их значение в жизни организмов Выполнил ученик 6-4 класса Выполнил ученик 6-4 класса Чегодайкин Андрей
Выполнил ученик 6-4 класса Выполнил ученик 6-4 класса Чегодайкин Андрей Многообразие покрытосеменных
Многообразие покрытосеменных Иммунитет. Иммунная система человека
Иммунитет. Иммунная система человека Замкнутый круговорот веществ и энергии в изолированной почвенной культуре
Замкнутый круговорот веществ и энергии в изолированной почвенной культуре Группы растений
Группы растений Еволюція органічного світу
Еволюція органічного світу Бактерии среди нас. Техники микроскопии. Окраска бактерий по Граму. Часть 3
Бактерии среди нас. Техники микроскопии. Окраска бактерий по Граму. Часть 3 Зоны корня
Зоны корня Биология – наука о живой природе
Биология – наука о живой природе Презентация на тему Разнообразие пауков
Презентация на тему Разнообразие пауков  Способы передвижения животных
Способы передвижения животных Побег. Внешнее строение побега
Побег. Внешнее строение побега урок 3_ 8 класс
урок 3_ 8 класс Жизнедеятельность клетки, ее деление и рост
Жизнедеятельность клетки, ее деление и рост Плоды. Найдите лишнюю картинку. Почему она лишняя?
Плоды. Найдите лишнюю картинку. Почему она лишняя? Лапландский заповедник
Лапландский заповедник Биологические шарады
Биологические шарады Анализ современных методов, используемых для идентификации микроорганизмов и определения их видовой принадлежности
Анализ современных методов, используемых для идентификации микроорганизмов и определения их видовой принадлежности Применение инфузорий стилонихий для биологической оценки меда
Применение инфузорий стилонихий для биологической оценки меда Внешнее и внутреннее строение листа растения. 7 класс
Внешнее и внутреннее строение листа растения. 7 класс Белки
Белки Проект Берегите птиц. Большой пестрый дятел
Проект Берегите птиц. Большой пестрый дятел Двигательный аппарат человека
Двигательный аппарат человека Железы смешанной секреции
Железы смешанной секреции Опорно-двигательный аппарат человека. Скелет
Опорно-двигательный аппарат человека. Скелет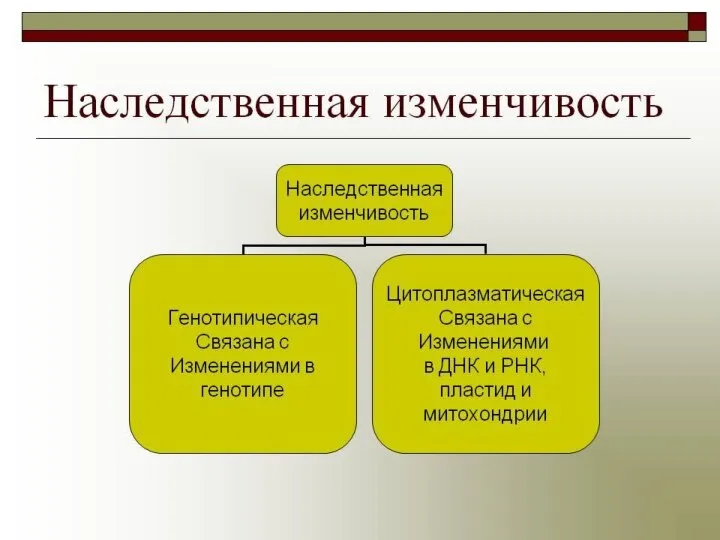 Внеядерная изменчивость
Внеядерная изменчивость Наследственная информация и её реализация в клетке
Наследственная информация и её реализация в клетке