Содержание
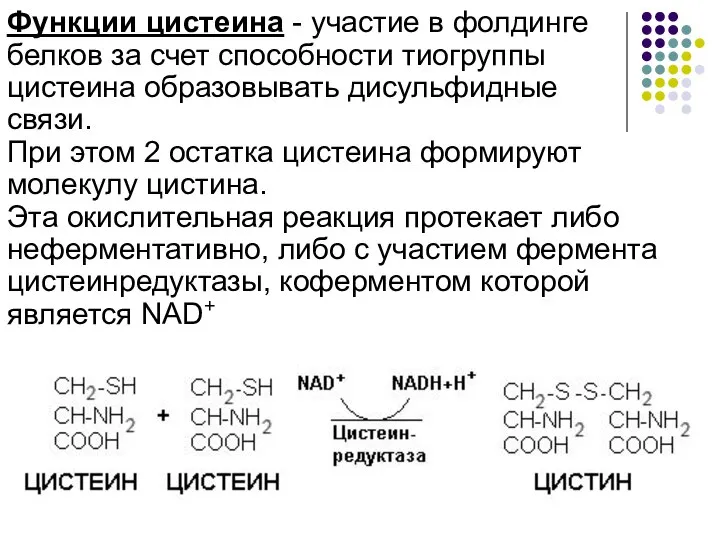
- 2. Функции цистеина - участие в фолдинге белков за счет способности тиогруппы цистеина образовывать дисульфидные связи. При
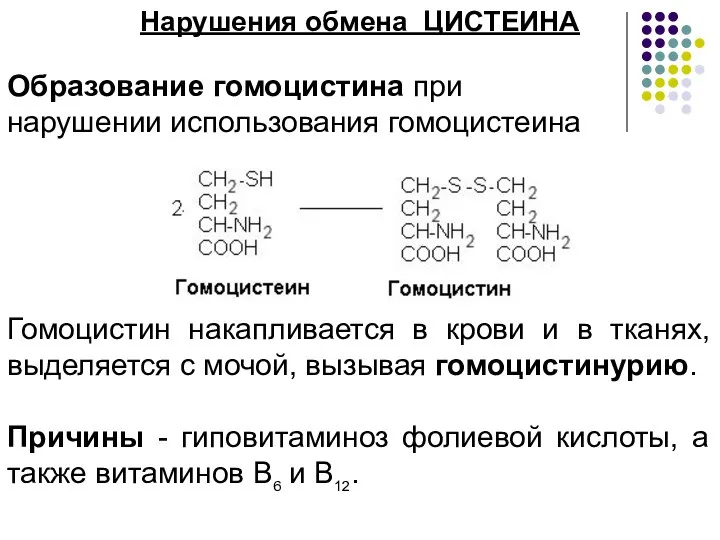
- 3. Нарушения обмена ЦИСТЕИНА Образование гомоцистина при нарушении использования гомоцистеина Гомоцистин накапливается в крови и в тканях,
- 4. Дисульфидные связи стабилизируют пространственную структуру полипептидной цепи или связывают между собой 2 цепи (например:А и В-цепи
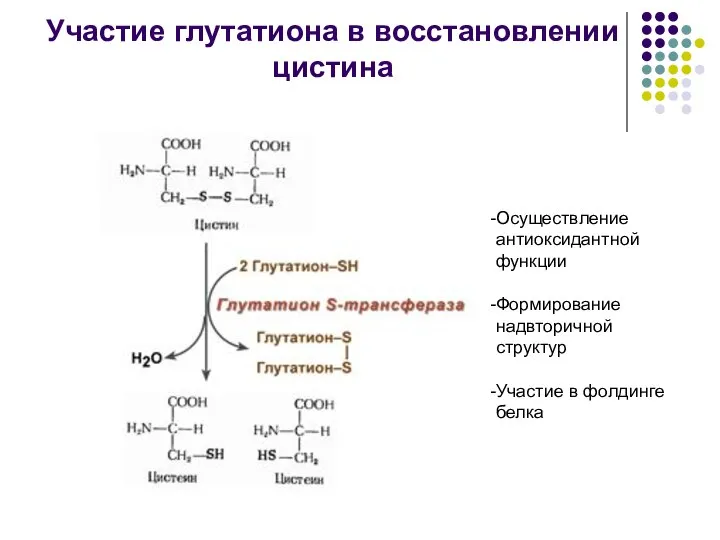
- 5. Участие глутатиона в восстановлении цистина Осуществление антиоксидантной функции Формирование надвторичной структур Участие в фолдинге белка
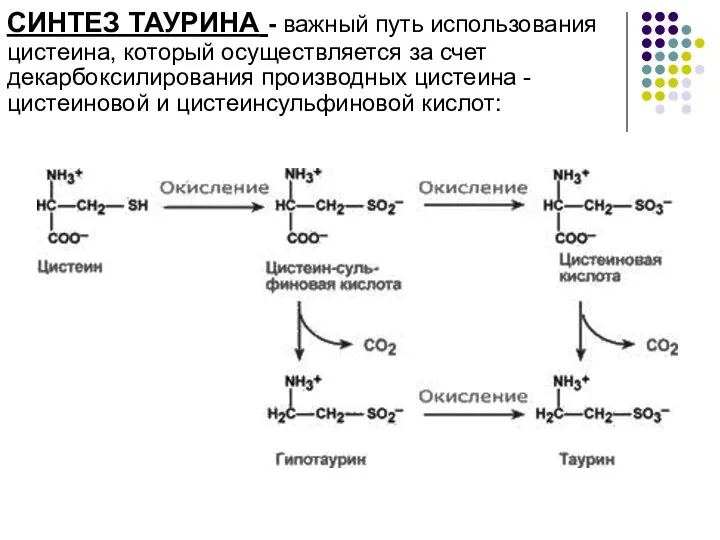
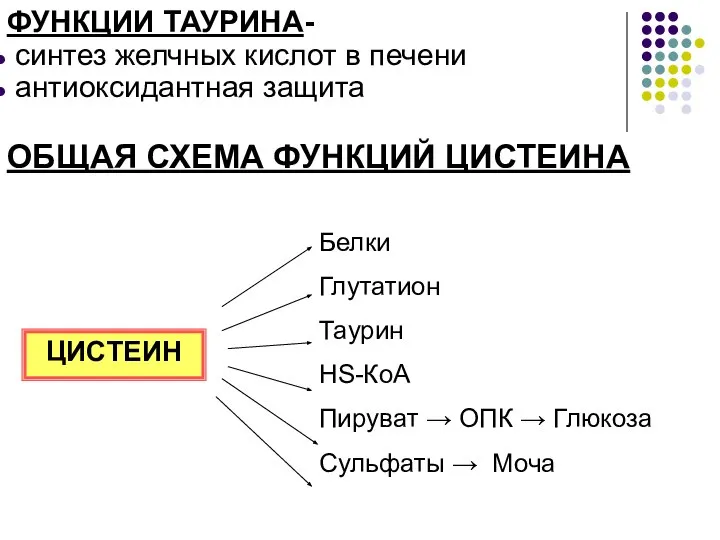
- 6. СИНТЕЗ ТАУРИНА - важный путь использования цистеина, который осуществляется за счет декарбоксилирования производных цистеина - цистеиновой
- 7. ФУНКЦИИ ТАУРИНА- синтез желчных кислот в печени антиоксидантная защита ОБЩАЯ СХЕМА ФУНКЦИЙ ЦИСТЕИНА ЦИСТЕИН Белки Глутатион
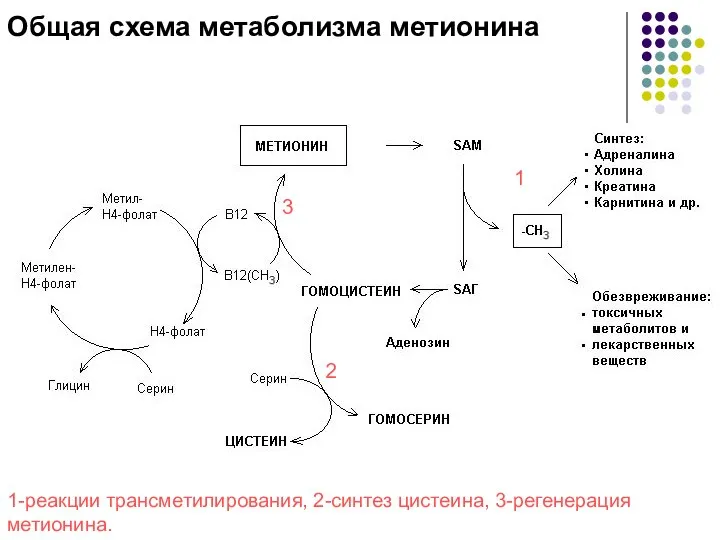
- 8. МЕТИОНИН - незаменимая АМК, однако она может регенерироваться из гомоцистеина. Следовательно, незаменим именно гомоцистеин, но единственным
- 9. Общая схема метаболизма метионина 1-реакции трансметилирования, 2-синтез цистеина, 3-регенерация метионина. 1 3 2
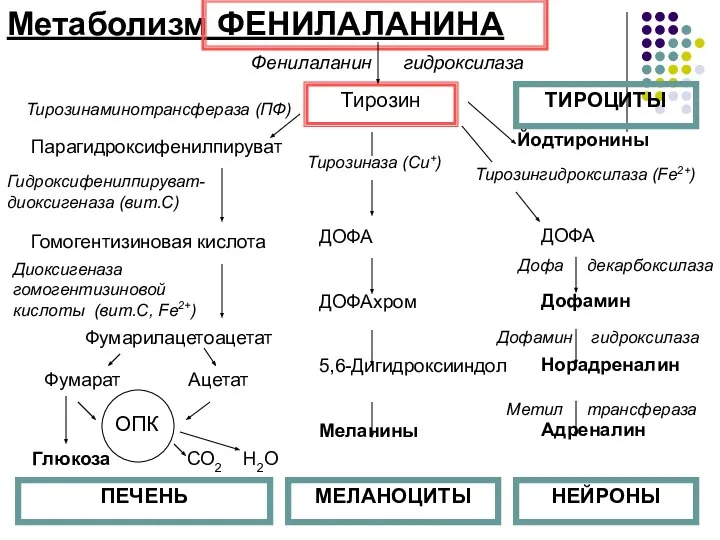
- 10. Метаболизм ФЕНИЛАЛАНИНА 2 основных пути: включение в белки и превращение в тирозин Тирозин - заменимая АМК,
- 11. Метаболизм ФЕНИЛАЛАНИНА Тирозин Фенилаланин гидроксилаза Тирозинаминотрансфераза (ПФ) Парагидроксифенилпируват Гомогентизиновая кислота Гидроксифенилпируват-диоксигеназа (вит.С) Диоксигеназа гомогентизиновой кислоты (вит.С,
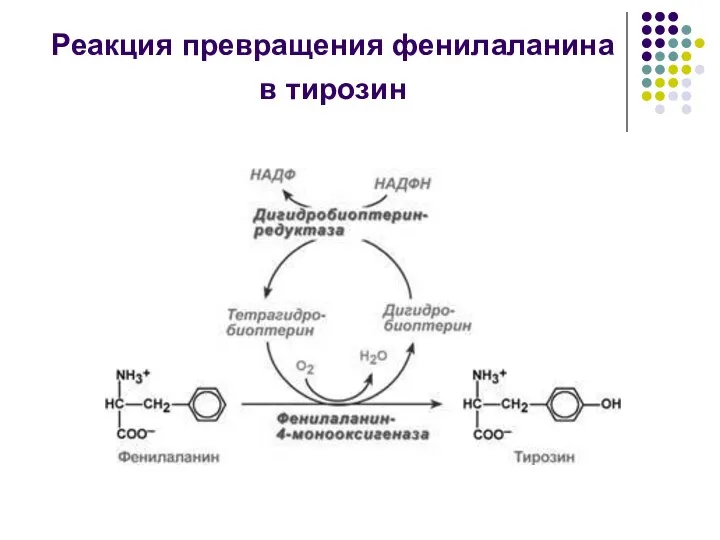
- 12. Реакция превращения фенилаланина в тирозин
- 13. Обмен ФЕНИЛАЛАНИНА и ТИРОЗИНА связан со значительным количеством реакций гидроксилирования, катализируемых оксигеназами (гидроксилазами), использующими молекулу О2
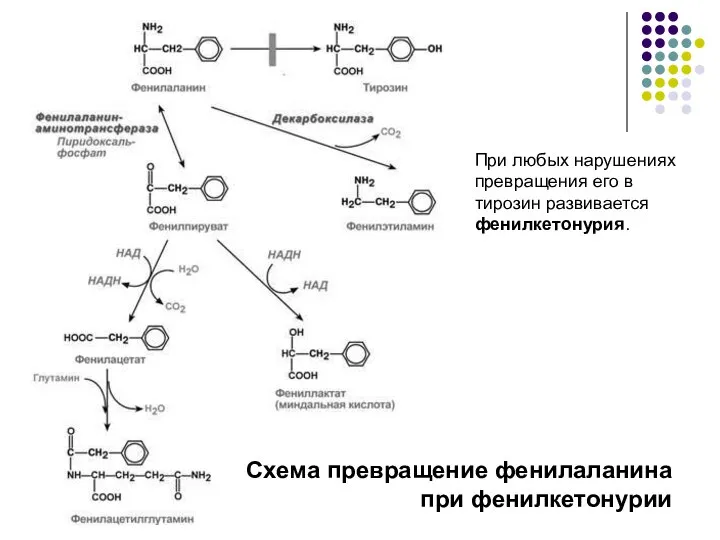
- 14. Схема превращение фенилаланина при фенилкетонурии При любых нарушениях превращения его в тирозин развивается фенилкетонурия.
- 15. В патогенезе фенилкетонурии имеют значение многие обстоятельства, в частности: 1) значительное накопление в тканях и жидкостях
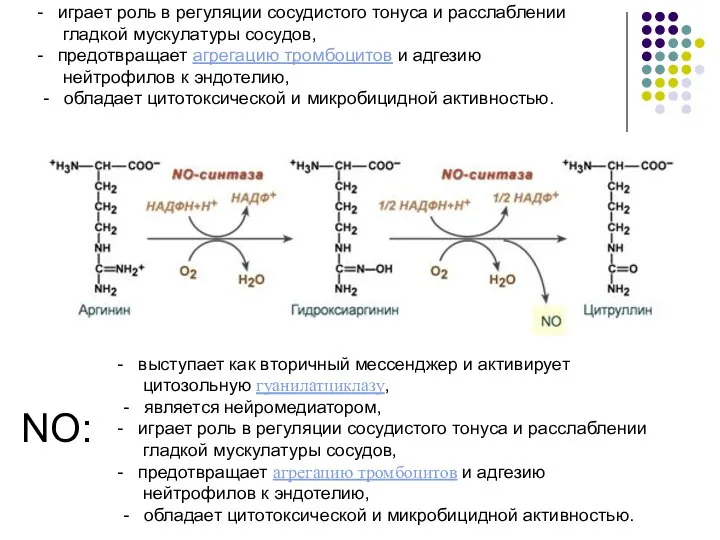
- 16. Обмен АРГИНИНА Аргинин - источник оксида азота (NO, ЭРФ) и орнитина (АМК, не входящей в состав
- 17. выступает как вторичный мессенджер и активирует цитозольную гуанилатциклазу, - является нейромедиатором, играет роль в регуляции сосудистого
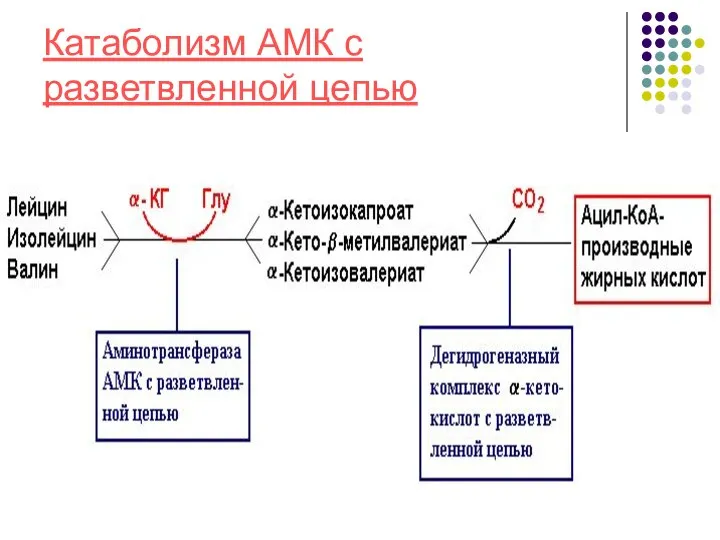
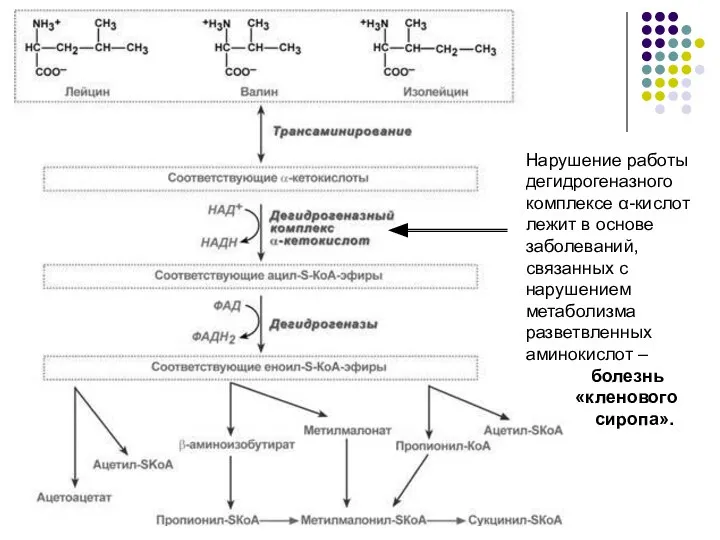
- 18. (Вал, Лей, Илей) - не в печени, как у других АМК, а в мышцах, жировой ткани,
- 19. Катаболизм АМК с разветвленной цепью
- 20. Нарушение работы дегидрогеназного комплексе α-кислот лежит в основе заболеваний, связанных с нарушением метаболизма разветвленных аминокислот –
- 21. Обмен триптофана - незаменимая АМК. Триптофан под действием гемсодержащего фермента триптофан-2,3-диоксигеназы в присутствии молекулярного кислорода превращается
- 22. Обмен дикарбоновых АМК (глутаминовой и аспарагиновой) и их амидов (глутамина и аспарагина) Аспарагиновая кислота - участвует
- 24. Скачать презентацию









 Молекулярные и биохимические основы наследственности
Молекулярные и биохимические основы наследственности Презентация на тему Органы чувств
Презентация на тему Органы чувств  Презентация на тему Строение и функции хромосом
Презентация на тему Строение и функции хромосом  Физиология бактерий
Физиология бактерий Кислотно-основное состояние крови
Кислотно-основное состояние крови Животные Челябинской области
Животные Челябинской области Популяции. Примеры популяций
Популяции. Примеры популяций Кровеносная система человека. Сердце и сосуды
Кровеносная система человека. Сердце и сосуды Анализирующее скрещивание в сельском хозяйстве
Анализирующее скрещивание в сельском хозяйстве Мужские половые органы
Мужские половые органы Мышечная система и ее функции
Мышечная система и ее функции Nuklein kislatasy
Nuklein kislatasy Класс млекопитающие. Отряд мозоленогие, отряд парнокопытные
Класс млекопитающие. Отряд мозоленогие, отряд парнокопытные Подкормка птиц
Подкормка птиц Обмен веществ
Обмен веществ Нервная система
Нервная система Экосистема - совместное хозяйство
Экосистема - совместное хозяйство Красной книги знатоки
Красной книги знатоки Кто такие птицы
Кто такие птицы Влияние окружающей среды на развивающийся организм в эмбриональный период
Влияние окружающей среды на развивающийся организм в эмбриональный период Покормите птиц!
Покормите птиц! Дыхательная система
Дыхательная система Структурные единицы организма человека
Структурные единицы организма человека Основы генетики
Основы генетики Презентация на тему Доказательства животного происхождения человека
Презентация на тему Доказательства животного происхождения человека  Nerve & Muscle
Nerve & Muscle Гигиена питания. Аппетит
Гигиена питания. Аппетит Лейкон, группы крови и иммунитет. Лекция 7
Лейкон, группы крови и иммунитет. Лекция 7