Содержание
- 2. Цель работы: Научится работать с текстом ГОСТ Р 52249-2009 – правила производства и контроля качества лекарственных
- 3. 14.1. Отклонение Промежуточные продукты и АФС, которые не соответствуют требованиям спецификации, маркируют и помещают на карантинное
- 4. 14.2. Повторная обработка Повторная обработка – это повтор стадий обработки (кристаллизация, измельчение, фильтрация и др.), которые
- 5. 14.2. Повторная обработка Повторную обработку включают в технологический процесс в качестве отдельной стадии, если она (обработка)
- 6. 14.2. Повторная обработка Введение материала, который не вступил в реакцию, в процесс и повторное проведение химической
- 7. 14.3. Переработка Перед принятием решения о переработке следует разобраться в причинах несоответствия требованиям спецификации.
- 8. 14.3. Переработка Для методик переработки можно использовать подход текущей аттестации - позволяет отработать методику и определить
- 9. 14.4. Регенерация реактивов, промежуточных продуктов и АФС Для проведения регенерации необходимо : Знать каким образом следует
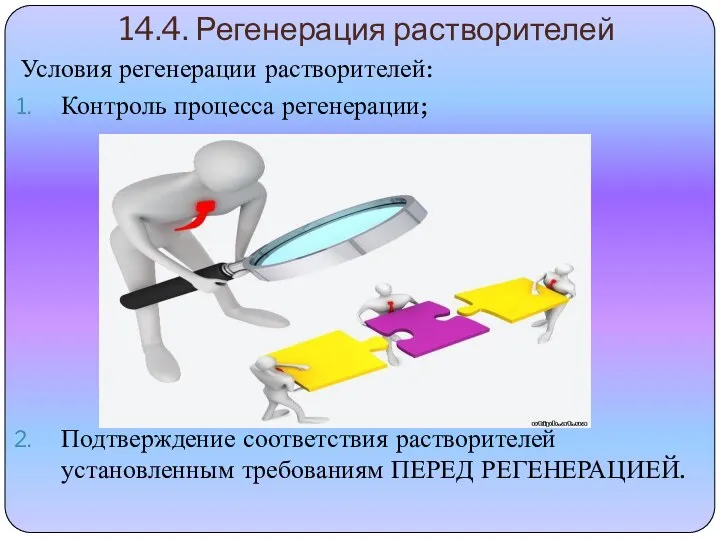
- 10. 14.4. Регенерация растворителей Условия регенерации растворителей: Контроль процесса регенерации; Подтверждение соответствия растворителей установленным требованиям ПЕРЕД РЕГЕНЕРАЦИЕЙ.
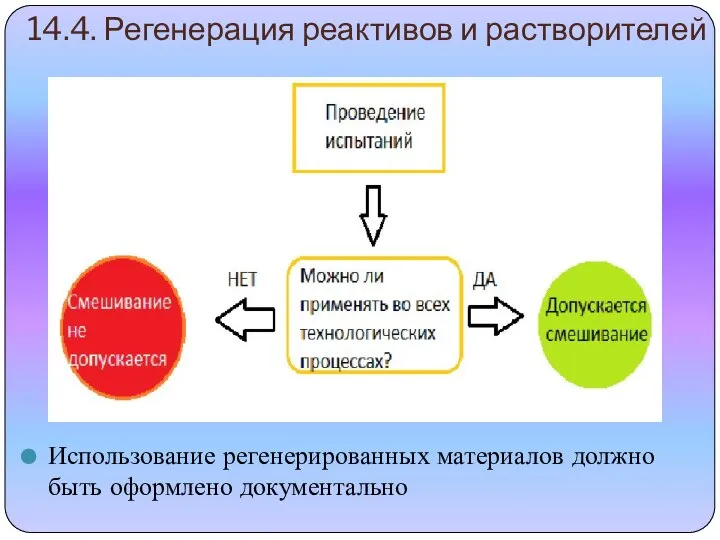
- 11. 14.4. Регенерация реактивов и растворителей Использование регенерированных материалов должно быть оформлено документально
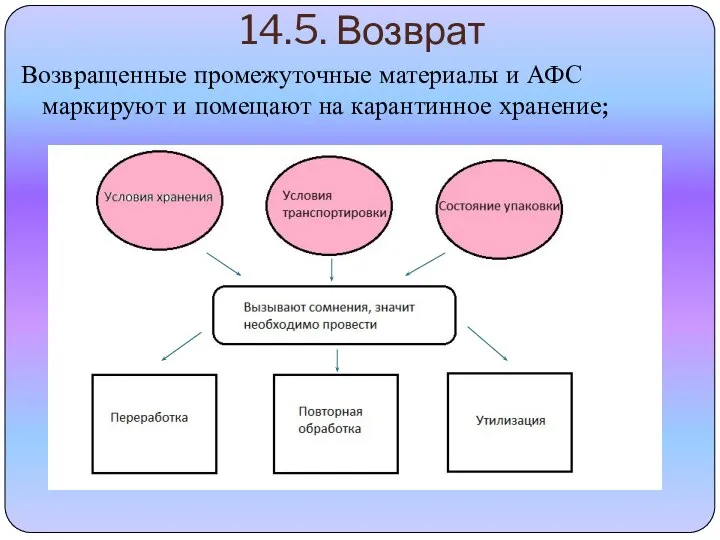
- 12. 14.5. Возврат Возвращенные промежуточные материалы и АФС маркируют и помещают на карантинное хранение;
- 13. 14.5. Возврат Следует хранить протоколы о всех возвращенных промежуточных продуктах и АФС.
- 14. 14.5. Возврат Протокол возврата должен содержать информацию: Наименование и адрес грузополучателя Кому и куда отправить возвращенную
- 15. Вывод Я научилась работать с текстом ГОСТ Р 52249-2009 – правила производства и контроля качества лекарственных
- 16. Список литературы ГОСТ Р 52249-2009. Правила производства и контроля качества лекарственных средств, изд. М.: Стандартинформ, 2009.
- 18. Скачать презентацию












 Следопыты. Чьи следы
Следопыты. Чьи следы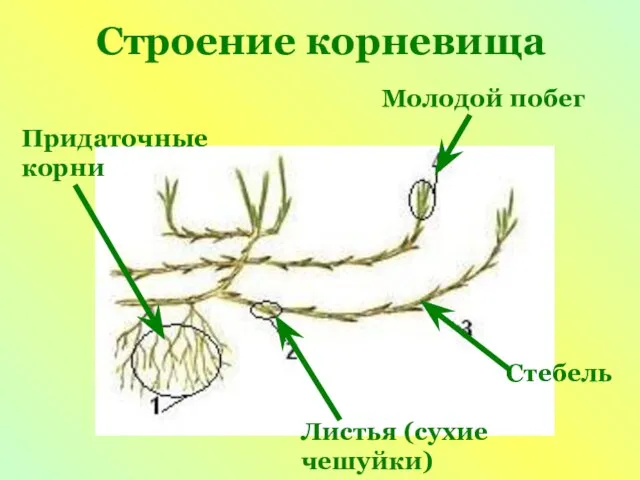 Презентация на тему Видоизмененные побеги
Презентация на тему Видоизмененные побеги  Строение и функция кожи
Строение и функция кожи Лестница жизни. Виды нуклениновых кислот. Д Н К
Лестница жизни. Виды нуклениновых кислот. Д Н К Цвет, его восприятие и воспроизведение
Цвет, его восприятие и воспроизведение транскрипция и трансляция
транскрипция и трансляция Строение, значение и классификация плодов
Строение, значение и классификация плодов Тип Губки
Тип Губки Транспорт веществ у растений
Транспорт веществ у растений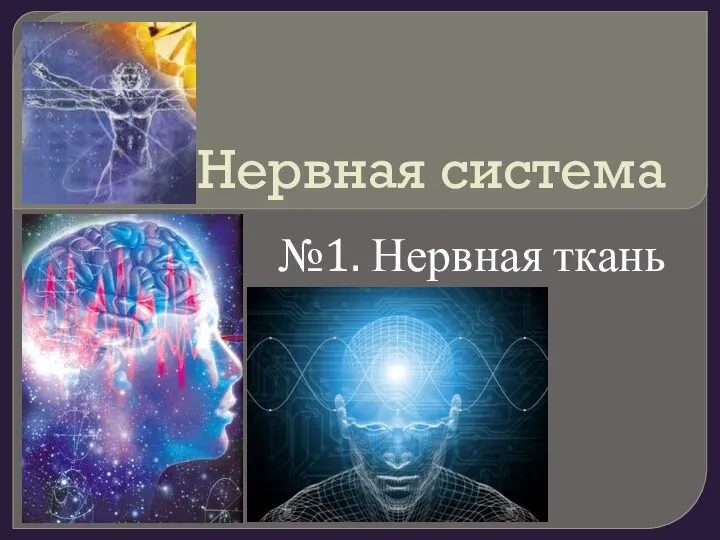 Нервная система. Нервная ткань
Нервная система. Нервная ткань Основные систематические группы рыб
Основные систематические группы рыб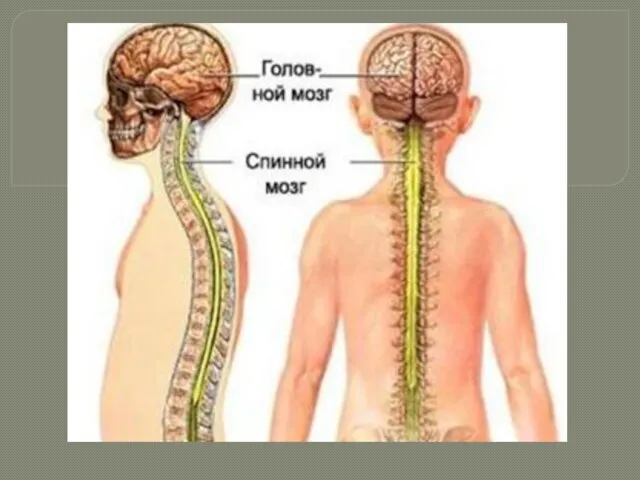 Головной мозг
Головной мозг Растительный мир Ивановской области. Растения болот
Растительный мир Ивановской области. Растения болот Сова
Сова Митоз и мейоз
Митоз и мейоз Процесс кровообращения. Анатомия и физиология сердца
Процесс кровообращения. Анатомия и физиология сердца Как работают в лаборатории (5 ласс)
Как работают в лаборатории (5 ласс) Класс Паукообразные
Класс Паукообразные Регуляция дыхания
Регуляция дыхания Наука о живой природе
Наука о живой природе Немецкая овчарка
Немецкая овчарка Дрозд-рябинник
Дрозд-рябинник Презентация на тему Разнообразие живых организмов
Презентация на тему Разнообразие живых организмов  Кто главный в лесу. Лесник
Кто главный в лесу. Лесник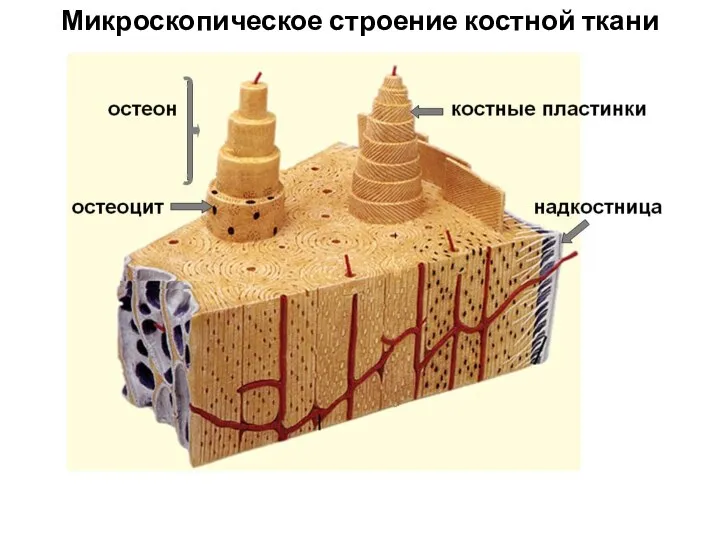 Микроскопическое строение костной ткани
Микроскопическое строение костной ткани Экология микроорганизмов
Экология микроорганизмов В.В. Бианки Сова
В.В. Бианки Сова Какие бывают растения?
Какие бывают растения?