Содержание
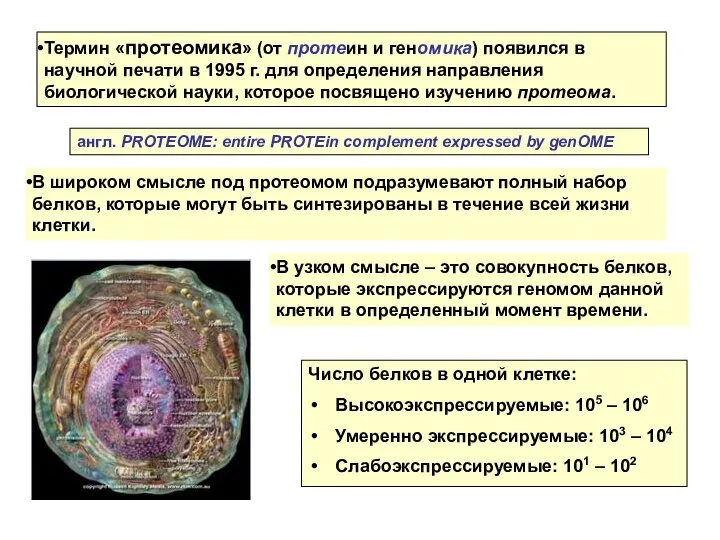
- 2. В широком смысле под протеомом подразумевают полный набор белков, которые могут быть синтезированы в течение всей
- 3. В отличие от биохимии и иммунохимии, которые ориентированы на последовательное изучение отдельных белков, в протеомике используется
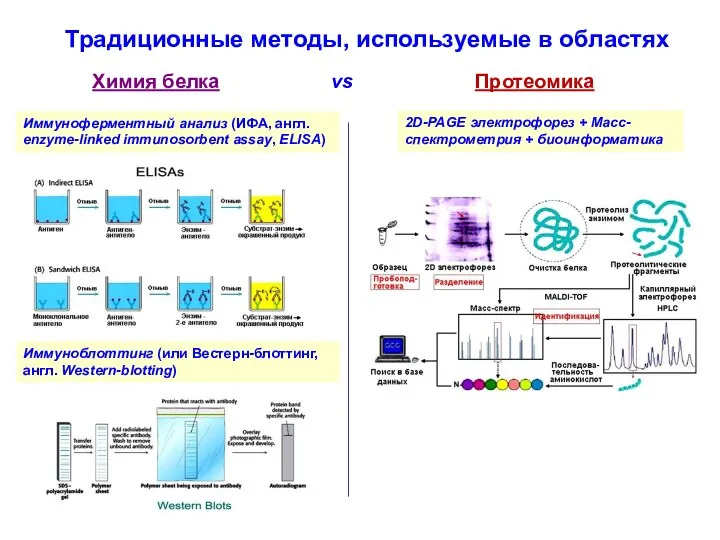
- 4. Иммуноблоттинг (или Вестерн-блоттинг, англ. Western-blotting) Иммуноферментный анализ (ИФА, англ. enzyme-linked immunosorbent assay, ELISA) 2D-PAGE электрофорез +
- 5. Почему надо исследовать протеом? белки обладают разнообразными пространственными структурами, которые на сегодняшний день нельзя определить по
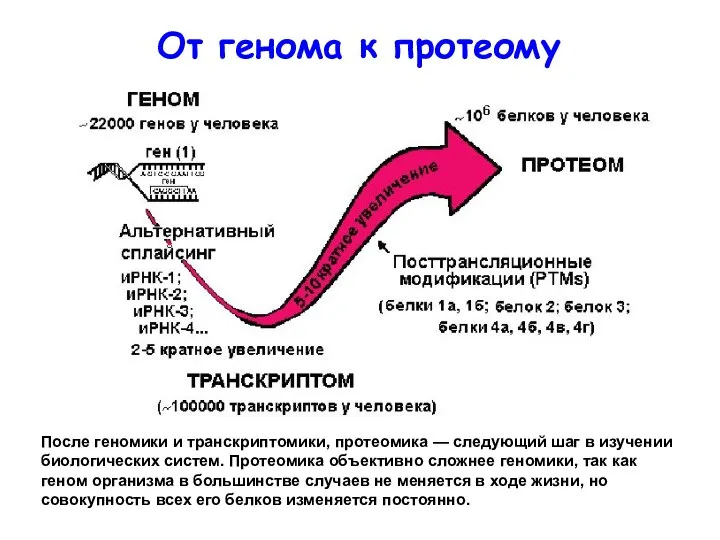
- 6. От генома к протеому После геномики и транскриптомики, протеомика — следующий шаг в изучении биологических систем.
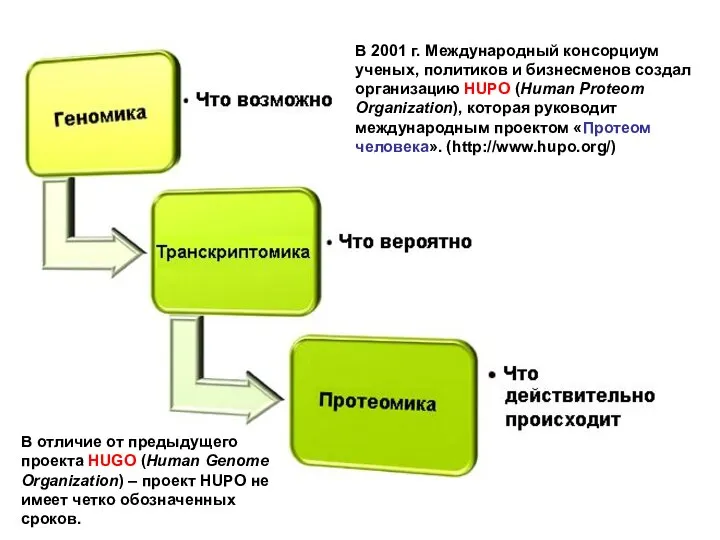
- 7. В 2001 г. Международный консорциум ученых, политиков и бизнесменов создал организацию HUPO (Human Proteom Organization), которая
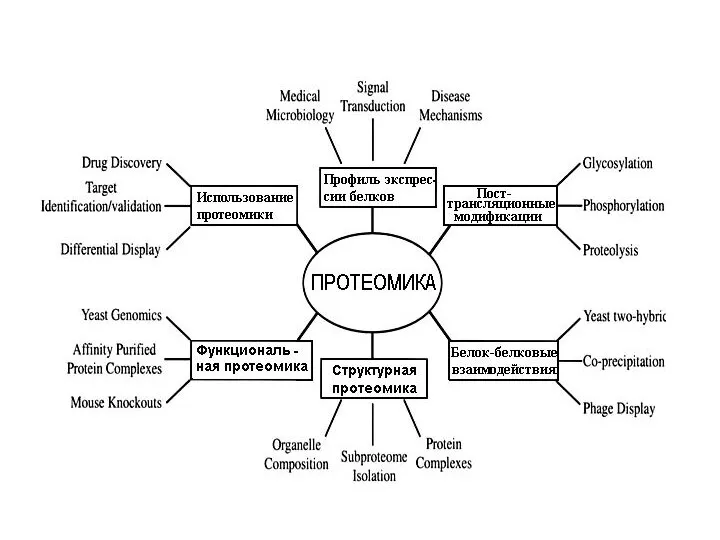
- 8. Цель и задачи протеомики Конечная цель протеомики – установление и характеристика полного набора белков данного организма,
- 9. Структурная протеомика – занимается инвентаризацией белков, их пространственной структурой и пострансляционными модификациями; Основные направления в протеомике
- 11. Общие подходы к получению информации о молекулах белков и их взаимодействиях: 1. Биоинформатический (in silico) Первый
- 12. Европейская лаборатория молекулярной биологии (EMBL, European Molecular Biology Laboratory, отдел EBI) http://www.embl.de/ Основные центры протеомной биоинформатики
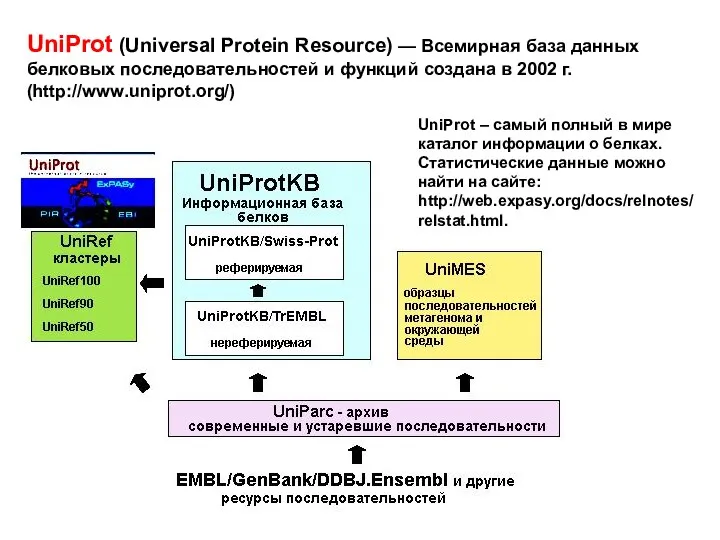
- 13. UniProt (Universal Protein Resource) — Всемирная база данных белковых последовательностей и функций создана в 2002 г.
- 14. Программное обеспечение работ с протеомными базами данных позволяет достаточно быстро и эффективно: делать заключения на основе
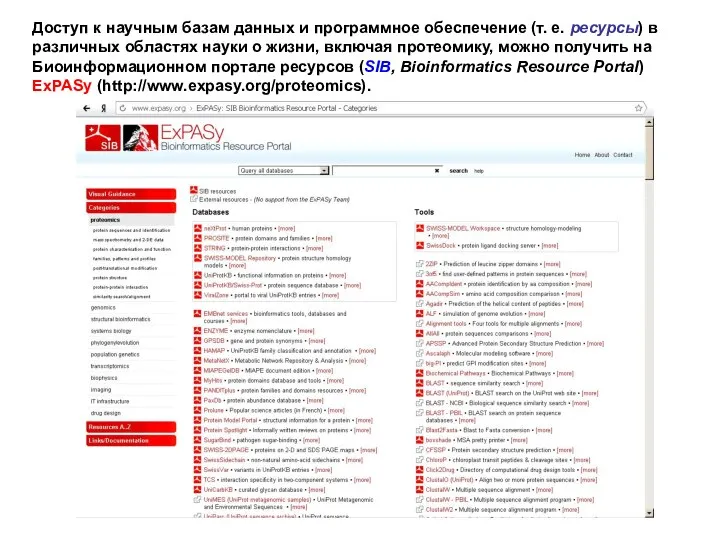
- 15. Доступ к научным базам данных и программное обеспечение (т. е. ресурсы) в различных областях науки о
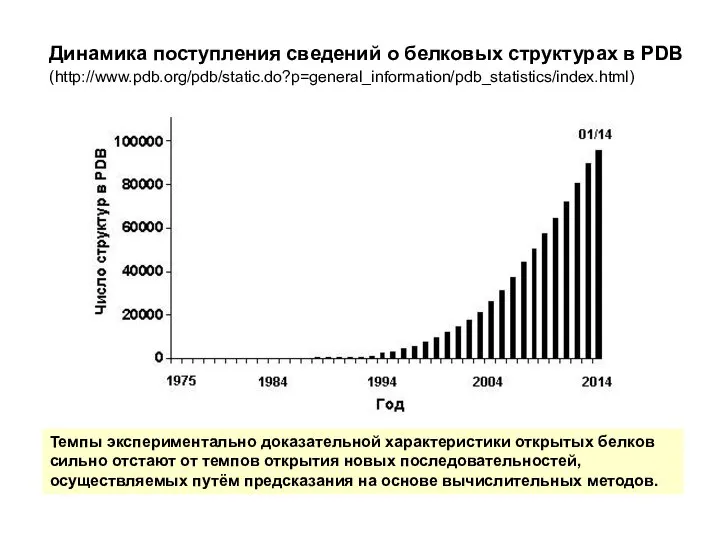
- 16. Динамика поступления сведений о белковых структурах в PDB (http://www.pdb.org/pdb/static.do?p=general_information/pdb_statistics/index.html) Темпы экспериментально доказательной характеристики открытых белков сильно
- 17. Широкий спектр методов: разные виды электрофореза, хроматографии, масс-спектрометрии, криоэлектронной и конфокальной микроскопии, методы иммунохимического, рентгеноструктурного и
- 18. Структурная протеомика 5) определение посттрансляционных модификаций и внутримолекулярной динамики белков (вторичной и третичной структур). Цель —
- 19. Выделение белков протеома (пробоподготовка) требует проведения следующих операций: – разрушение первоначальной структуры биологического материала; – предотвращение
- 20. 2. Разделение белков протеома Для задач протеомики наиболее адекватными из всех методов разделения белков оказались: а)
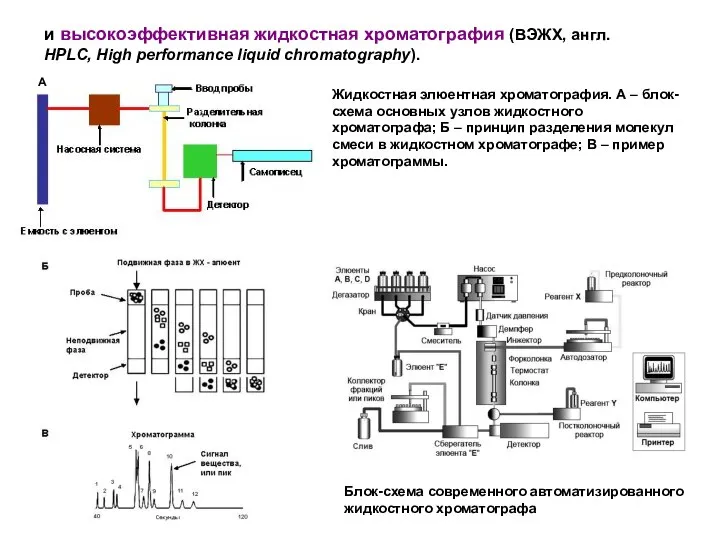
- 21. и высокоэффективная жидкостная хроматография (ВЭЖХ, англ. HPLC, High performance liquid chromatography). Жидкостная элюентная хроматография. А –
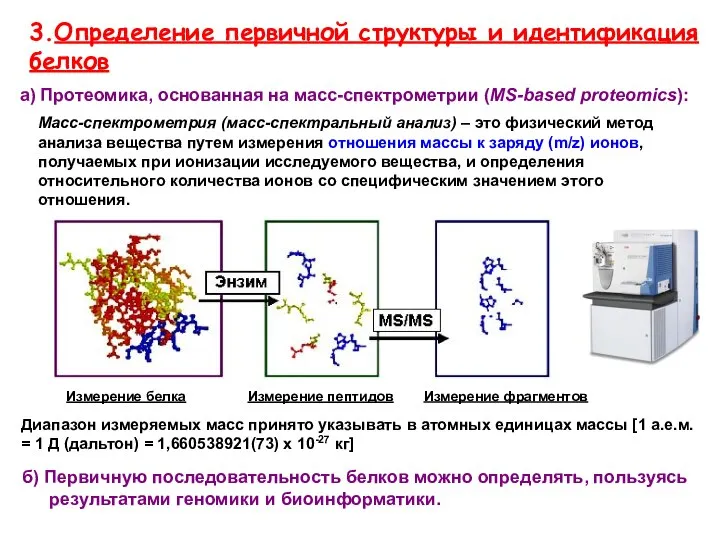
- 22. 3.Определение первичной структуры и идентификация белков б) Первичную последовательность белков можно определять, пользуясь результатами геномики и
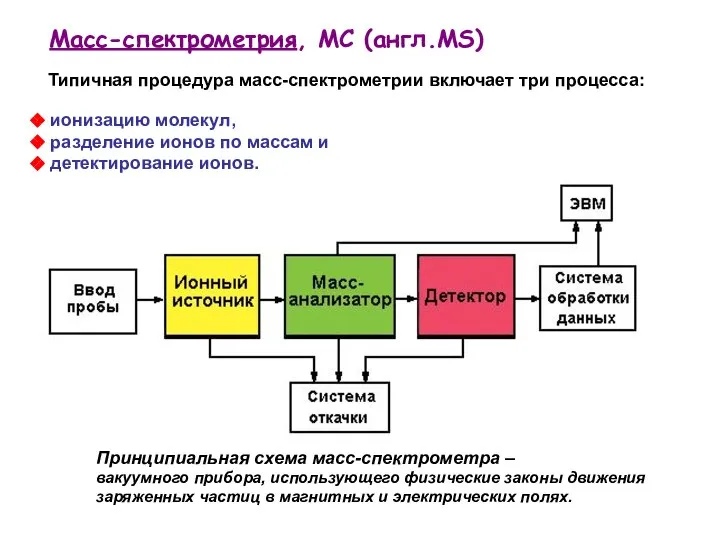
- 23. Типичная процедура масс-спектрометрии включает три процесса: Принципиальная схема масс-спектрометра – вакуумного прибора, использующего физические законы движения
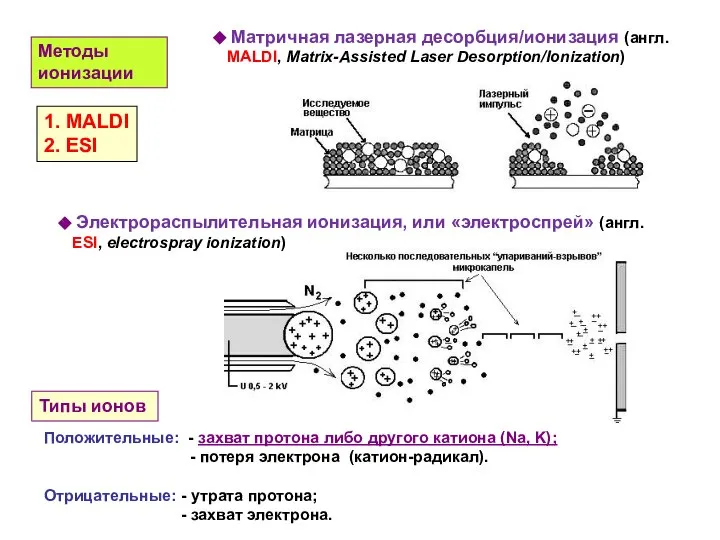
- 24. Матричная лазерная десорбция/ионизация (англ. MALDI, Matrix-Assisted Laser Desorption/Ionization) Электрораспылительная ионизация, или «электроспрей» (англ. ESI, electrospray ionization)
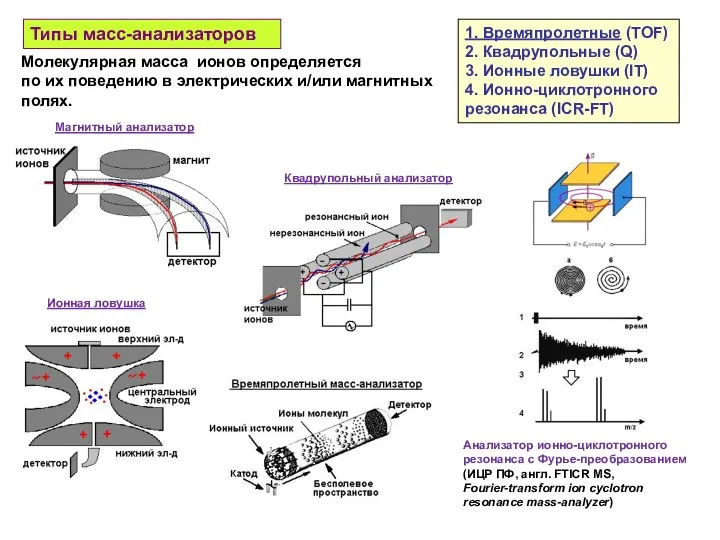
- 25. Типы масс-анализаторов Анализатор ионно-циклотронного резонанса с Фурье-преобразованием (ИЦР ПФ, англ. FTICR MS, Fourier-transform ion cyclotron resonance
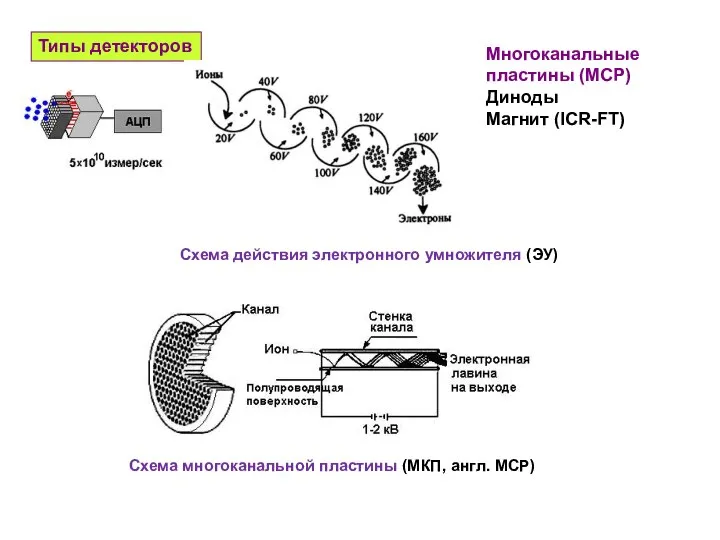
- 26. Типы детекторов Многоканальные пластины (MCP) Диноды Магнит (ICR-FT) Схема многоканальной пластины (МКП, англ. MCP) Схема действия
- 27. MALDI-TOF (Matrix-Assisted Laser Desorption/Ionization -Time-Of-Flight ) - матричная лазерная десорбция/ионизация → времяпролетный масс-анализатор; ESI-MS/MS (Electro Spray
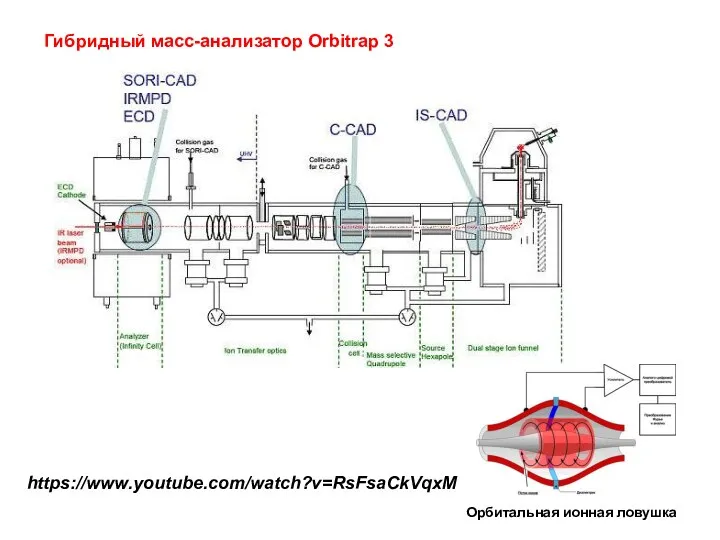
- 28. Гибридный масс-анализатор Orbitrap 3 Орбитальная ионная ловушка https://www.youtube.com/watch?v=RsFsaCkVqxM
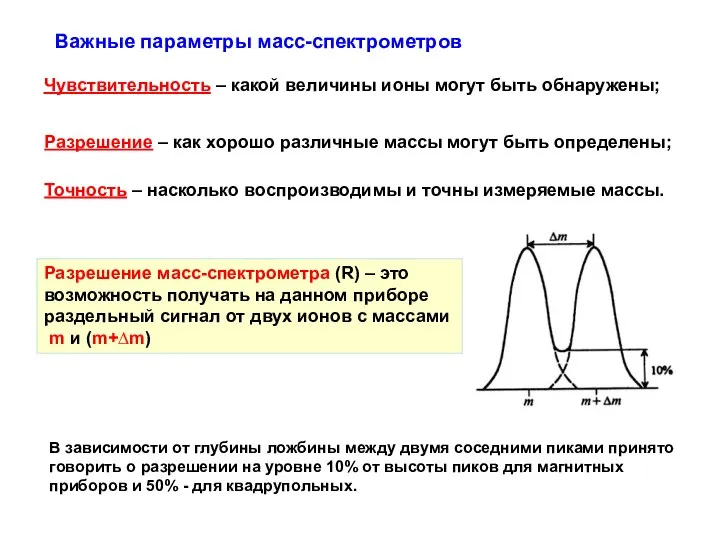
- 29. Важные параметры масс-спектрометров Чувствительность – какой величины ионы могут быть обнаружены; Разрешение – как хорошо различные
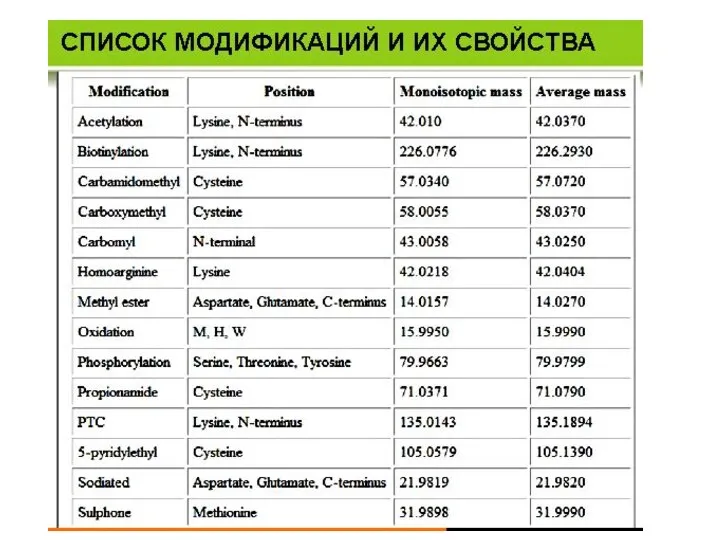
- 30. Принцип масс-спектрометрии Моноизотопные массы аминокислотных остатков пептидная связь аминокислотный остаток Трипсин K-X и R-X, за исключением,
- 31. Типичные данные MALDI-TOF
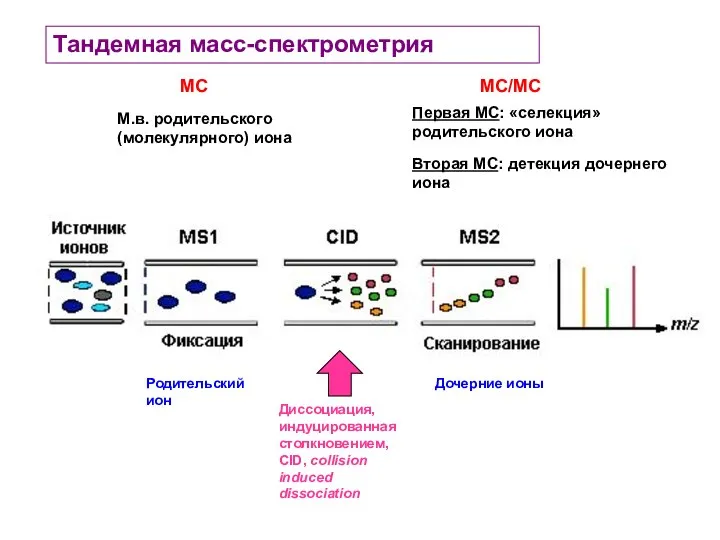
- 32. Тандемная масс-спектрометрия Первая МС: «селекция» родительского иона Вторая МС: детекция дочернего иона МС/МС МС М.в. родительского
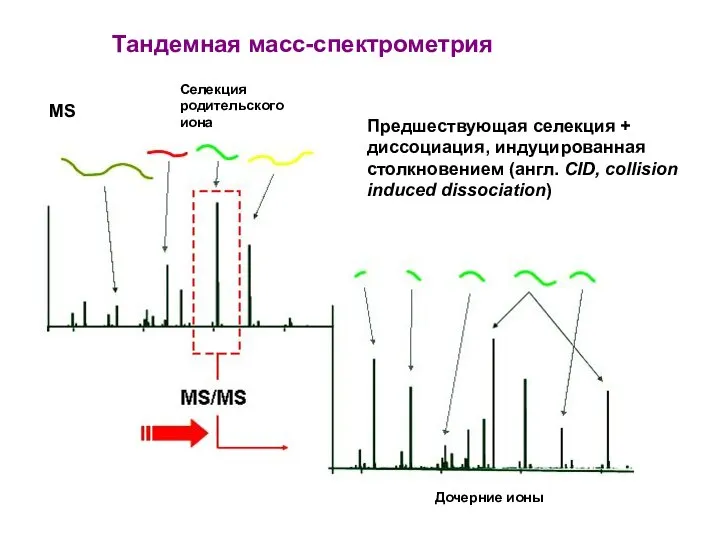
- 33. Предшествующая селекция + диссоциация, индуцированная столкновением (англ. CID, collision induced dissociation) Тандемная масс-спектрометрия Селекция родительского иона
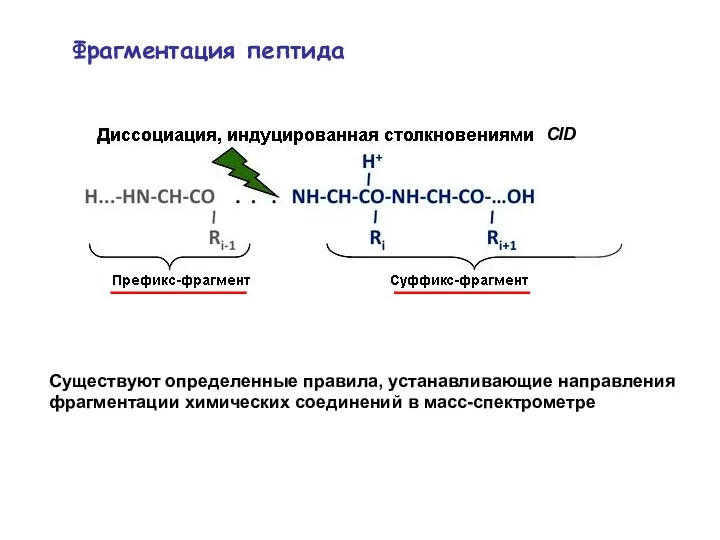
- 34. Фрагментация пептида Существуют определенные правила, устанавливающие направления фрагментации химических соединений в масс-спектрометре CID
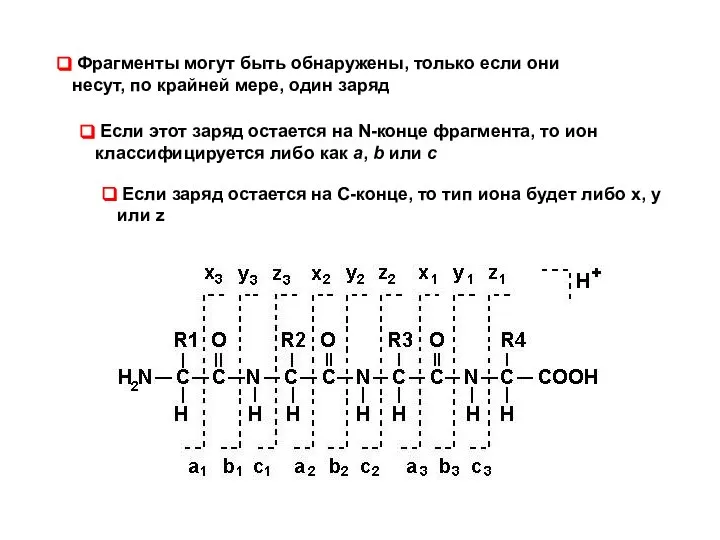
- 35. Фрагменты могут быть обнаружены, только если они несут, по крайней мере, один заряд Если этот заряд
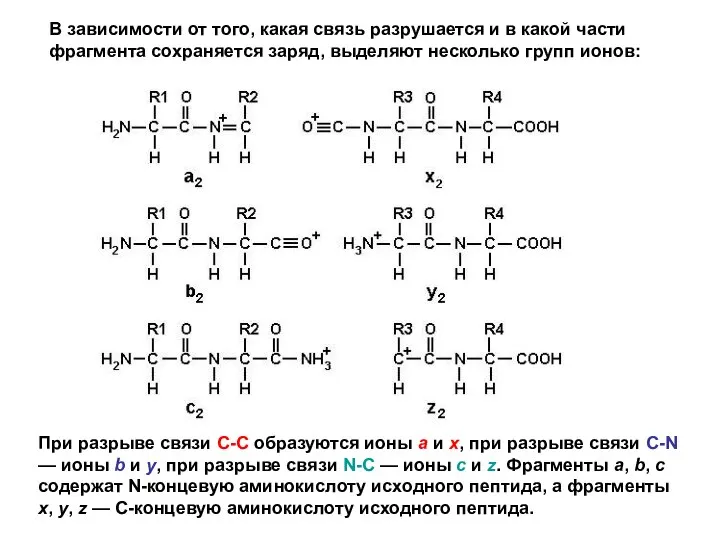
- 36. В зависимости от того, какая связь разрушается и в какой части фрагмента сохраняется заряд, выделяют несколько
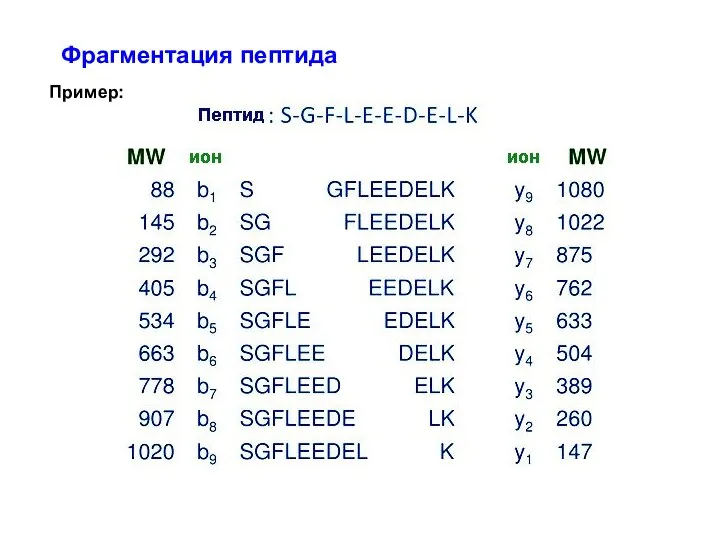
- 37. Фрагментация пептида Пример:
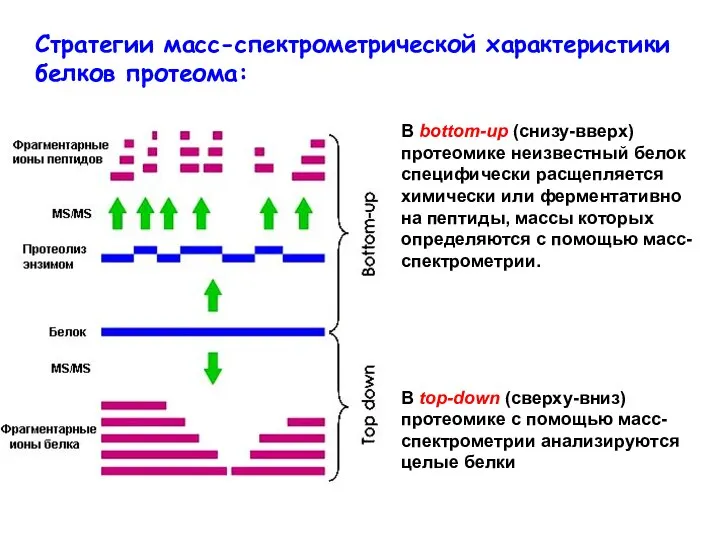
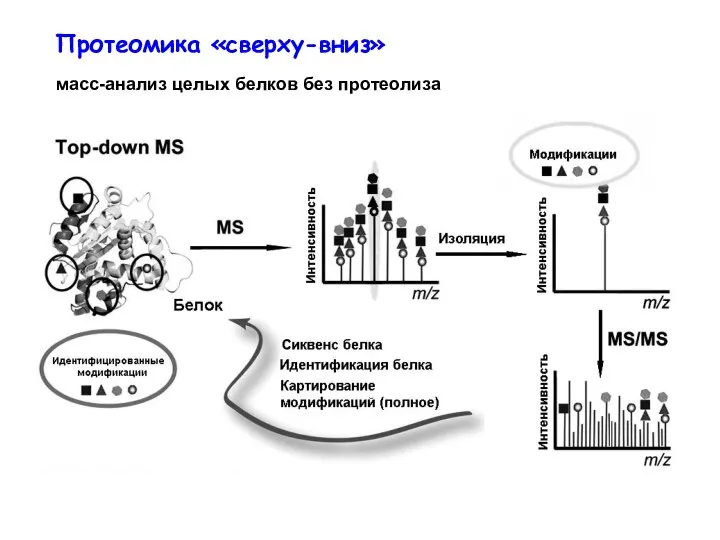
- 38. Стратегии масс-спектрометрической характеристики белков протеома: В top-down (сверху-вниз) протеомике с помощью масс-спектрометрии анализируются целые белки В
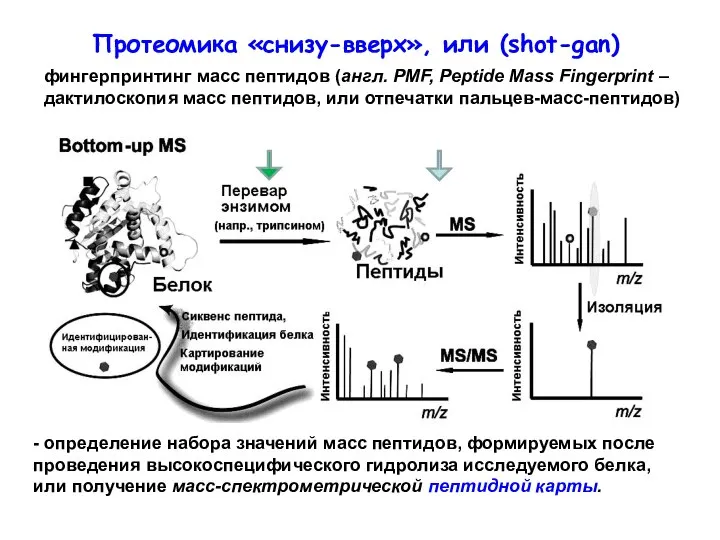
- 39. - определение набора значений масс пептидов, формируемых после проведения высокоспецифического гидролиза исследуемого белка, или получение масс-спектрометрической
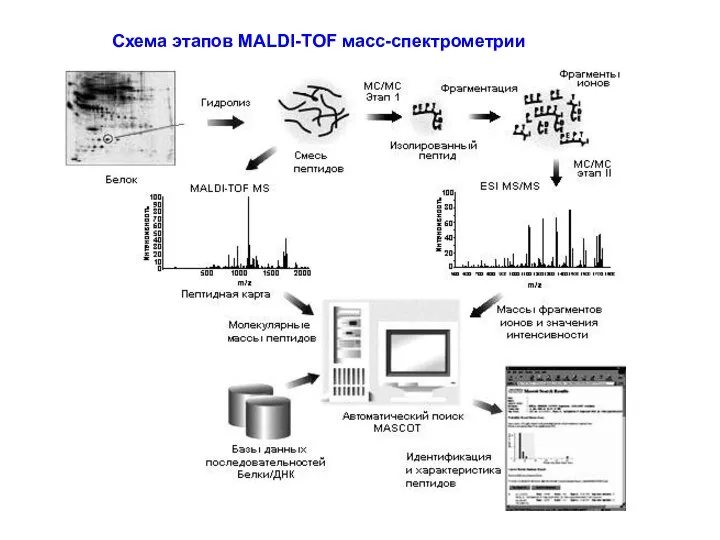
- 40. Схема этапов MALDI-TOF масс-спектрометрии
- 41. Протеомика «сверху-вниз» масс-анализ целых белков без протеолиза
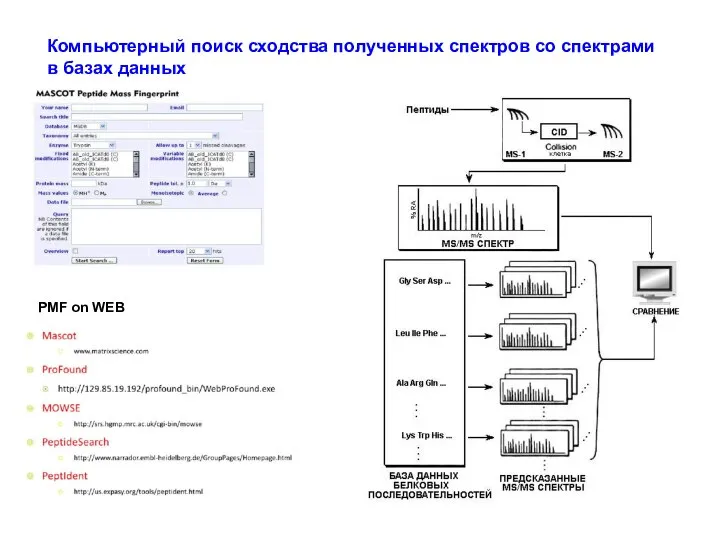
- 42. PMF on WEB Компьютерный поиск сходства полученных спектров со спектрами в базах данных
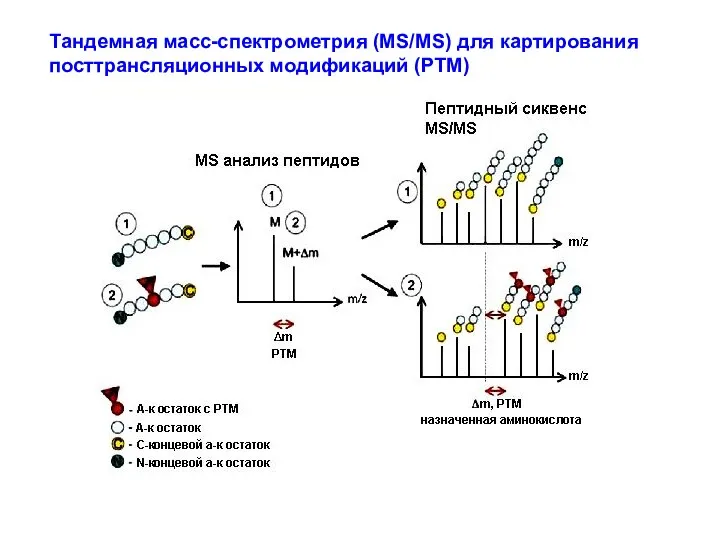
- 43. Тандемная масс-спектрометрия (MS/MS) для картирования посттрансляционных модификаций (PTM)
- 46. Modeller - компьютерная программа, которая моделирует трехмерные структуры белков и строит их со всеми необходимыми пространственными
- 47. Цель функциональной протеомики: определение функциональных свойств протеома. установление функций каждого из белков протеома; предсказание функциональной роли
- 48. Функция белка — очень широкий термин: роли белков варьируют от катализа биохимических реакций до передачи сигнала
- 49. pRb - белок ретинобластомы (англ. retinoblastoma protein) – белок супрессора опухоли, дисфункционального при некоторых тяжелых формах
- 50. 1. Методы, основанные на гомологии Белки, сходные по последовательности, могут иметь также и сходную функцию. Однако
- 51. 5. Функция, основанная на клеточном процессе RBP является обильным, растворимым, секретируемым 6. Функция, основанная на биологическом
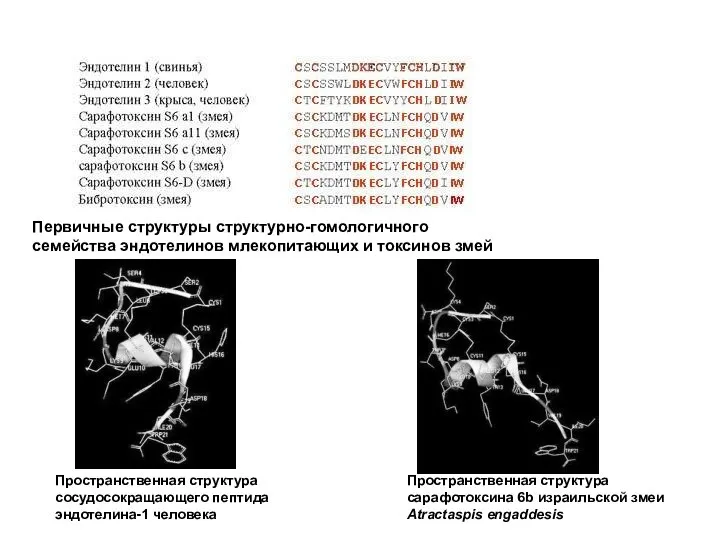
- 52. Первичные структуры структурно-гомологичного семейства эндотелинов / токсинов Первичные структуры природных пептидов брадикининов, полученных из разных живых
- 53. Первичные структуры структурно-гомологичного семейства эндотелинов млекопитающих и токсинов змей Пространственная структура сосудосокращающего пептида эндотелина-1 человека Пространственная
- 55. Белки могут «временно» связываться друг с другом или же образовывать «стабильные» мультибелковые комплексы. При этом белковые
- 56. Интерактом – сложная биомолекулярная сеть, которая должна быть: - точно картирована (найдены все PPI, которые имеют
- 57. Белок-белковые взаимодействия (PPI) PPI методы Экспериментальные Двугибридная дрожжевая система Ко-иммунопреципитация Масс-спектрометрия Рентгеновская кристаллография ЯМР–спектроскопия Геномный контекст
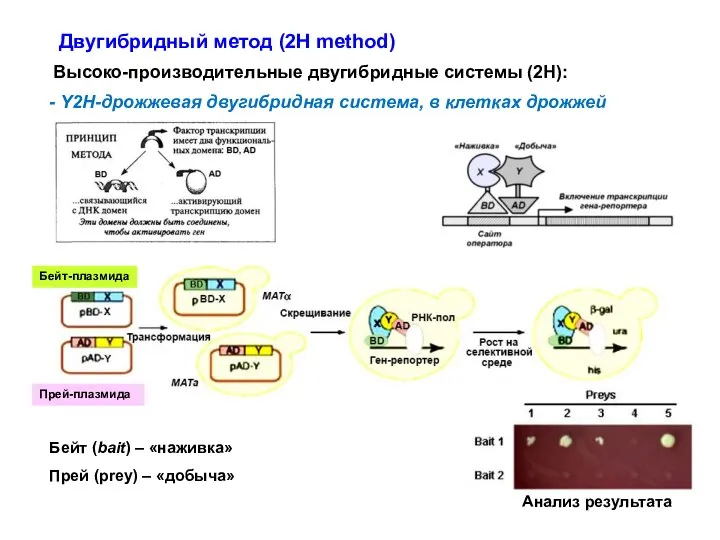
- 58. Двугибридный метод (2Н method) Высоко-производительные двугибридные системы (2Н): - Y2H-дрожжевая двугибридная система, в клетках дрожжей Бейт-плазмида
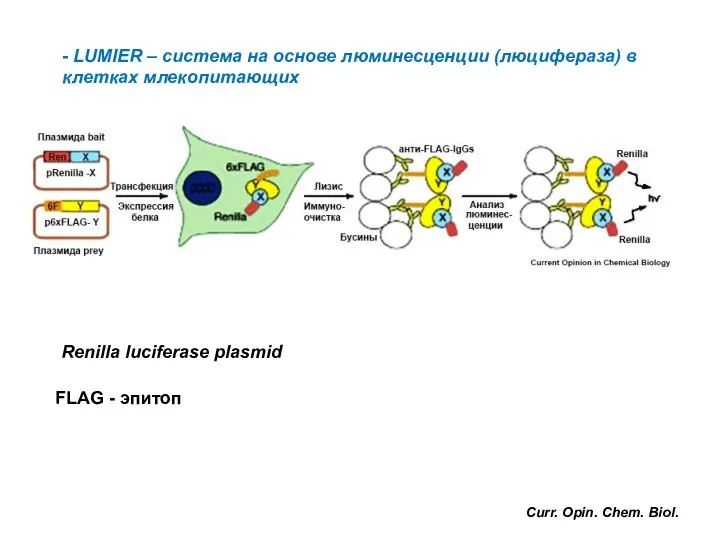
- 59. - LUMIER – система на основе люминесценции (люцифераза) в клетках млекопитающих Renilla luciferase plasmid Curr. Opin.
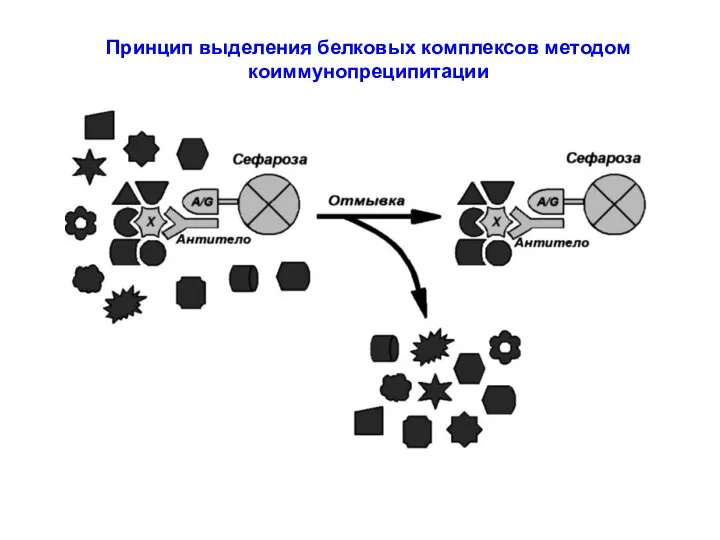
- 60. Принцип выделения белковых комплексов методом коиммунопреципитации
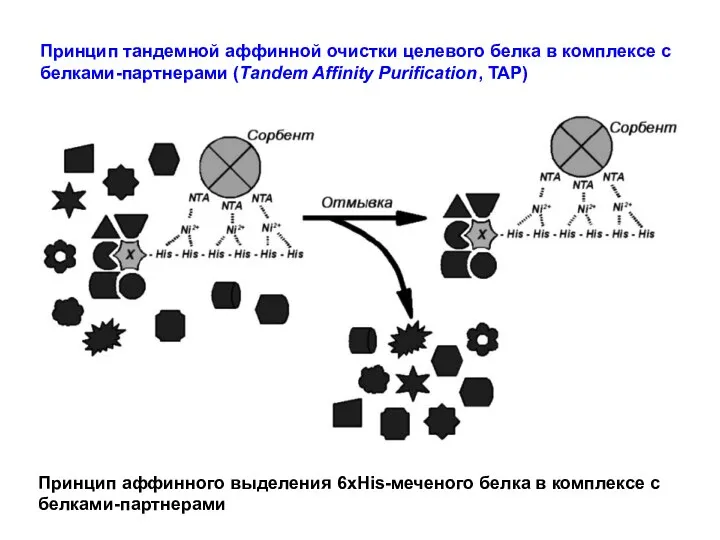
- 61. Принцип тандемной аффинной очистки целевого белка в комплексе с белками-партнерами (Tandem Affinity Purification, TAP) Принцип аффинного
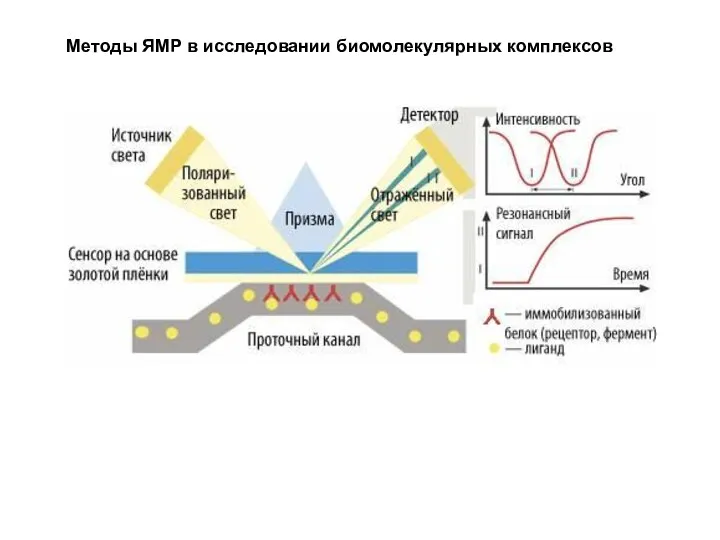
- 62. Методы ЯМР в исследовании биомолекулярных комплексов
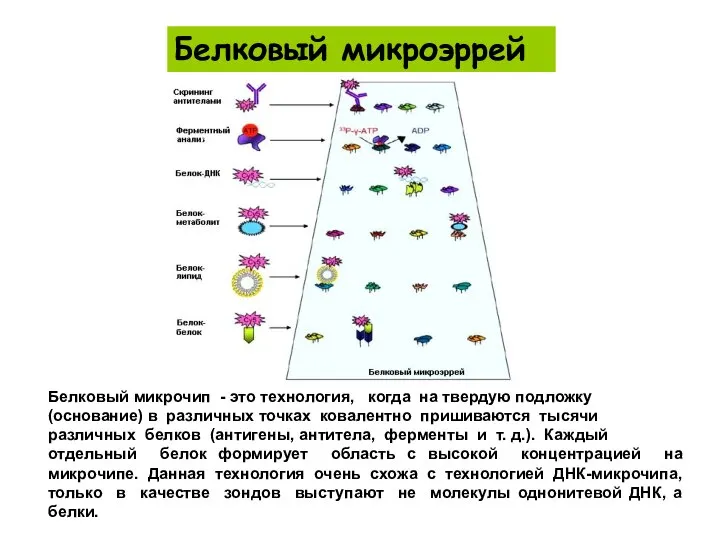
- 63. Белковый микрочип - это технология, когда на твердую подложку (основание) в различных точках ковалентно пришиваются тысячи
- 64. Белковый микроэррей Типы белкового микроэррея В настоящее время для изучения биохимической активности белков используются три типа
- 65. Аналитический микроэррей Различные типы лигандов, включая антитела, антигены, ДНК- или РНК-аптамеры, карбогидраты или маленькие молекулы (метаболиты),
- 66. Эти чипы используются для анализа белковой активности, связывающих свойств и посттрансляционных модификаций. Функциональный белковый микроэррей может
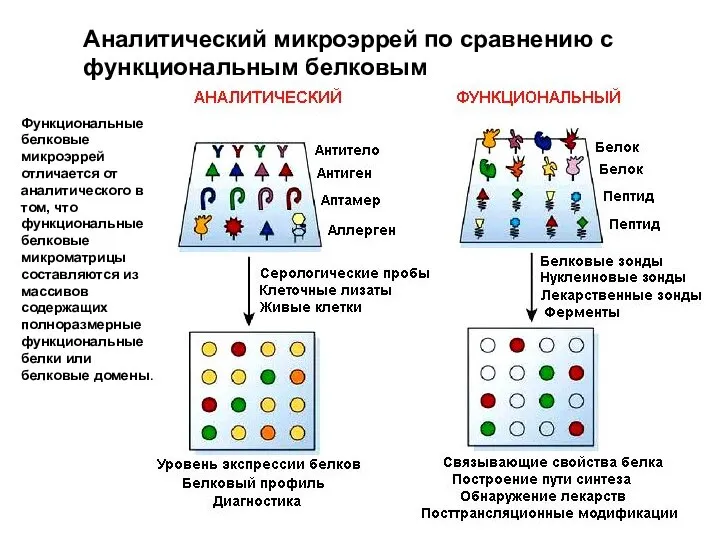
- 67. Аналитический микроэррей по сравнению с функциональным белковым Функциональные белковые микроэррей отличается от аналитического в том, что
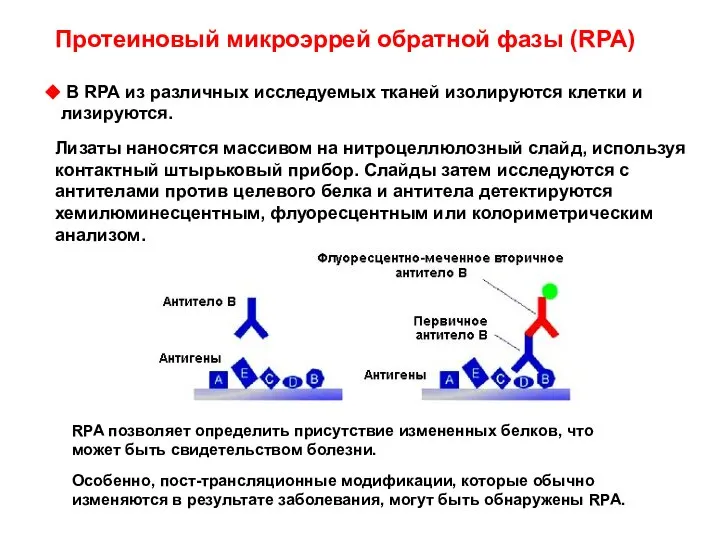
- 68. Протеиновый микроэррей обратной фазы (RPA) В RPA из различных исследуемых тканей изолируются клетки и лизируются. Лизаты
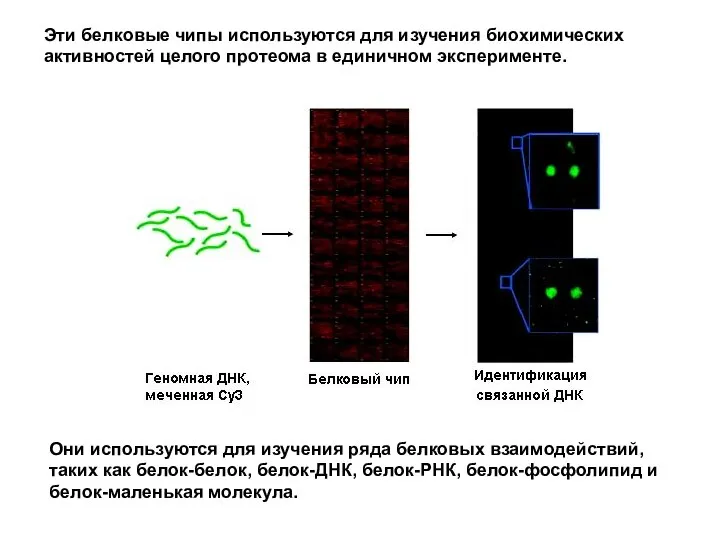
- 69. Они используются для изучения ряда белковых взаимодействий, таких как белок-белок, белок-ДНК, белок-РНК, белок-фосфолипид и белок-маленькая молекула.
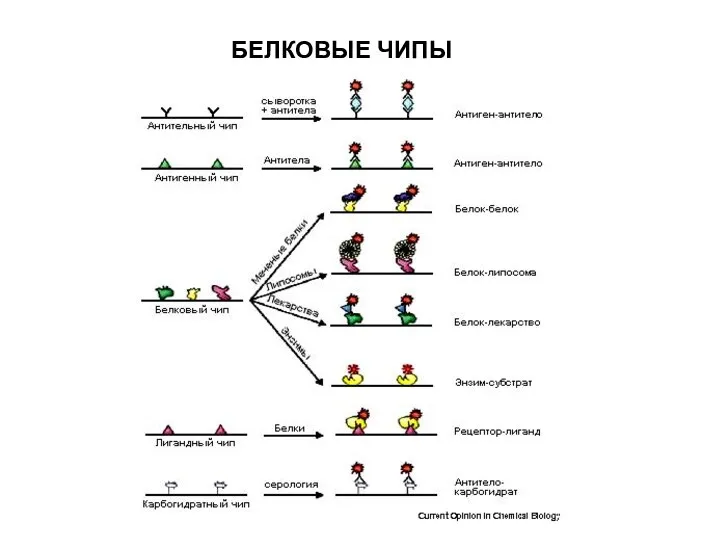
- 70. БЕЛКОВЫЕ ЧИПЫ
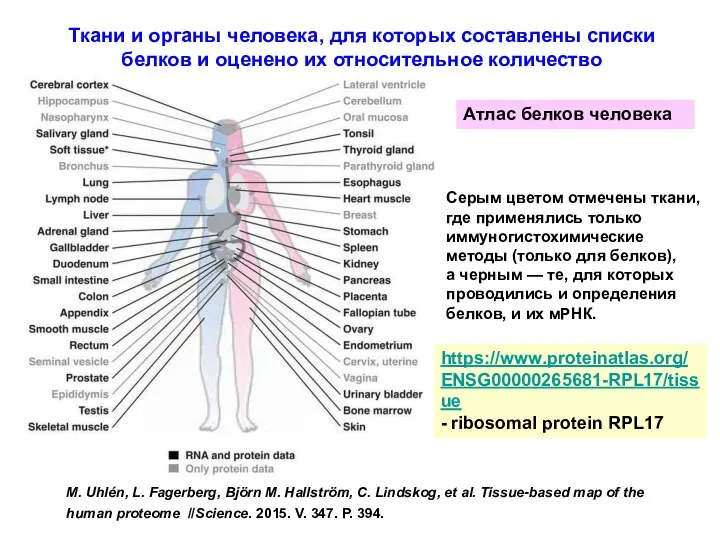
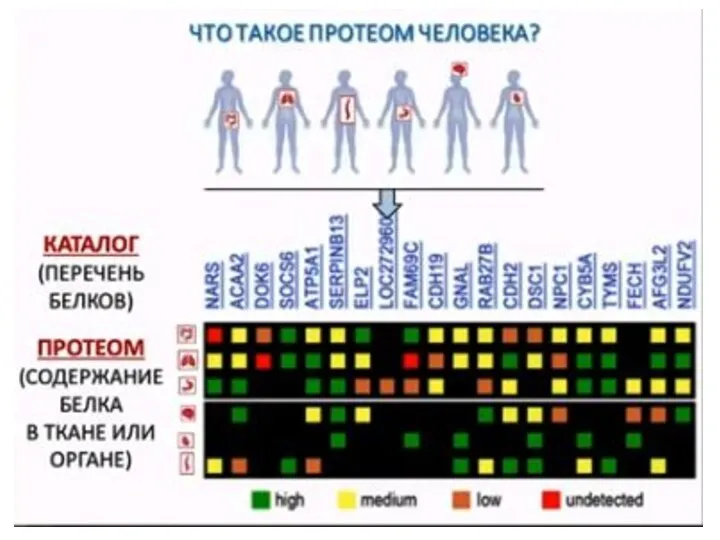
- 71. Ткани и органы человека, для которых составлены списки белков и оценено их относительное количество M. Uhlén,
- 73. M. Uhlén, L. Fagerberg, Björn M. Hallström, C. Lindskog, et al. Tissue-based map of the human
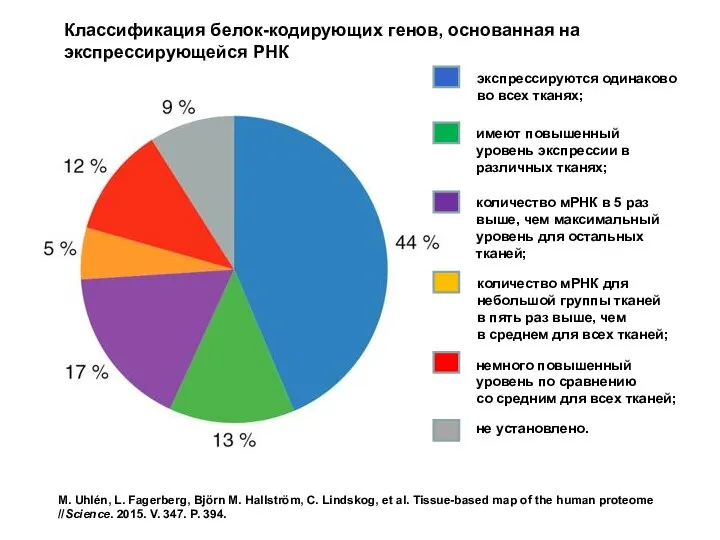
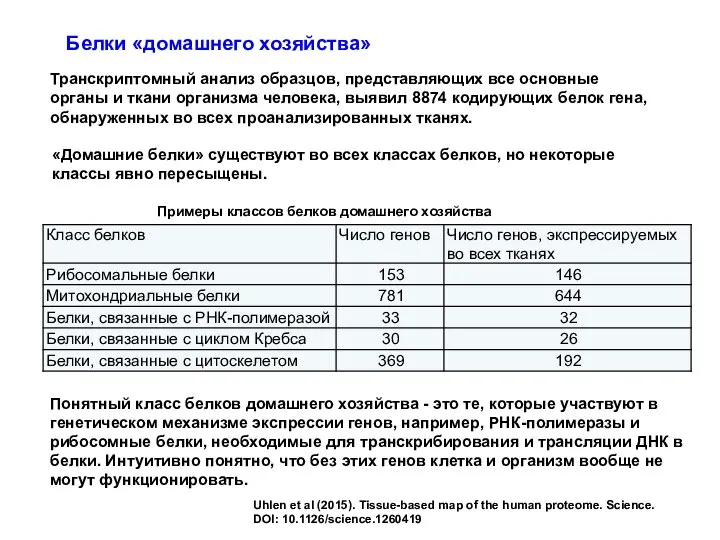
- 74. Транскриптомный анализ образцов, представляющих все основные органы и ткани организма человека, выявил 8874 кодирующих белок гена,
- 75. Сравнительный анализ транскриптомов, протеомов и транслятомов в клетках млекопитающих Транскриптом клеток (совокупность мРНК) не определяет автоматически
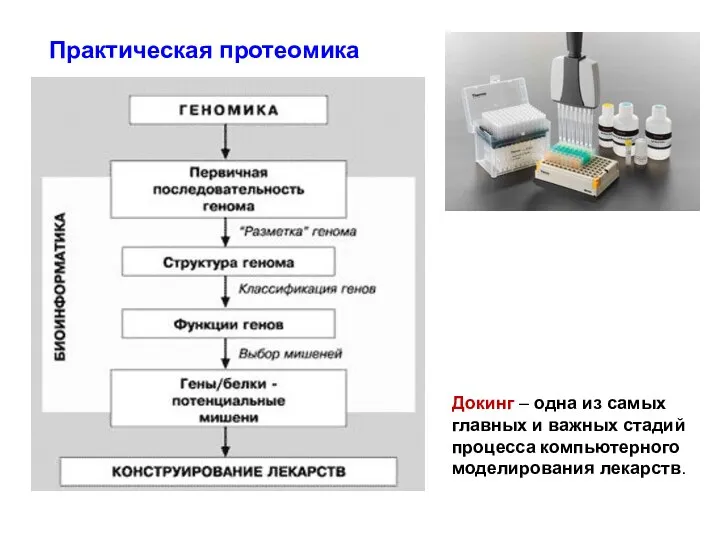
- 76. Практическая протеомика Докинг – одна из самых главных и важных стадий процесса компьютерного моделирования лекарств.
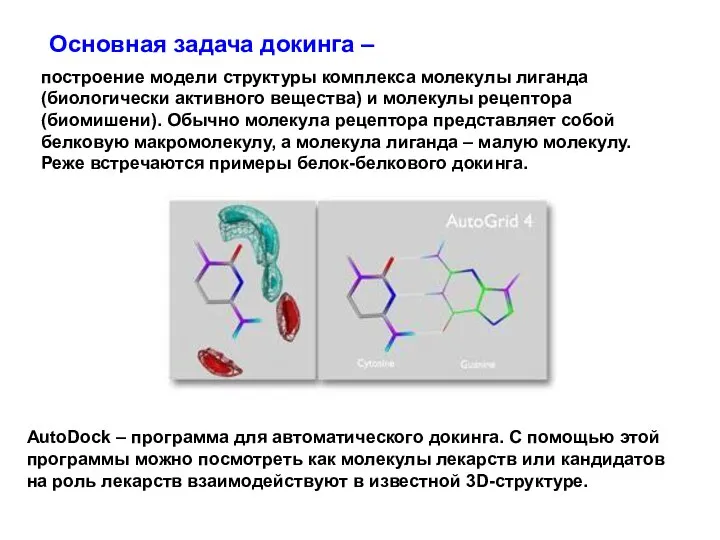
- 77. построение модели структуры комплекса молекулы лиганда (биологически активного вещества) и молекулы рецептора (биомишени). Обычно молекула рецептора
- 78. Применение в биологии Протеомные карты ‒ начальная точка для главного исследования в геномике. Изучаемые вопросы: Как
- 79. - Конструирование устойчивости к патогенам / паразитам разных растений; большинство из этих механизмов устойчивости включают экспрессию
- 80. Отслеживание сложности взаимодействий хозяин-патоген или хозяин-паразит: например: фиксация азота у бобовых путем ассоциации с бактериями (Rhizobium)
- 81. - Ретиноевая кислота (использовали в дерматологии и онкогематологии) ацилирование белков ретиноевой кислотой (ПТМ) и определение этих
- 82. Заключение А Б В Г Е Ф ? Если все буквы «Война и мир» высыпать в
- 84. Скачать презентацию



































 Виороиды. Инфекционные молекулы РНК, способные вызывать заболевания высших растений
Виороиды. Инфекционные молекулы РНК, способные вызывать заболевания высших растений Методы микроскопии
Методы микроскопии Строение и видовые особенности воздухопроводящих путей у животных
Строение и видовые особенности воздухопроводящих путей у животных Грибы
Грибы Сравнение Голосеменных и Покрытосеменных растений
Сравнение Голосеменных и Покрытосеменных растений Лисы
Лисы Ферментативная функция. Фермент
Ферментативная функция. Фермент Снегирь
Снегирь Проектирование визуальной информации по теме о липидах
Проектирование визуальной информации по теме о липидах Строение тела человека как единая система
Строение тела человека как единая система Законы Н.И.Вавилова
Законы Н.И.Вавилова Млекопитающие. 3 класс
Млекопитающие. 3 класс День снежного барса
День снежного барса Этапы эволюции человека
Этапы эволюции человека Биотический индекс Линкольна
Биотический индекс Линкольна Комунікація тварин
Комунікація тварин Простейшие
Простейшие Факторы среды
Факторы среды Род лиственница
Род лиственница Нервная регуляция. Строение и значение нервной системы
Нервная регуляция. Строение и значение нервной системы Дикие предки свиней
Дикие предки свиней Вклад И.И. Мечникова в развитие отечественной микробиологии
Вклад И.И. Мечникова в развитие отечественной микробиологии Кровеносная система. Движение крови и лимфы в организме
Кровеносная система. Движение крови и лимфы в организме Особенности родословных при аутосомно-доминантном, аутосомно-рецессивном и сцепленным с полом наследовании
Особенности родословных при аутосомно-доминантном, аутосомно-рецессивном и сцепленным с полом наследовании Законы Менделя
Законы Менделя Влияние йода на организм человека
Влияние йода на организм человека Птицы Австралии
Птицы Австралии Условия для проведения практических занятий посредством дистанционного курса Общее знакомство с цветковыми растениями
Условия для проведения практических занятий посредством дистанционного курса Общее знакомство с цветковыми растениями