Содержание
- 2. Физиология сердца Общие представления Кровеносная система служит для доставки к тканям необходимых веществ и их распределения
- 3. Рис. 6-1. Общие представления о системе кровообращения. А - камеры сердца и магистральные сосуды. Б -
- 4. Структура сердечно-сосудистой системы Кровь, поступающая в правый желудочек из правого предсердия, через легочную артерию прокачивается в
- 5. Рис. 6-2. Кровеносные сосуды. На рисунке изображены большой (красным) и малый (синим) круги кровообращения с параллельным
- 6. Типы и характеристика потенциалов действия кардиомиоцитов Изменения потенциала, отводимого от типичного мышечного волокна желудочка, показаны на
- 7. Рис. 6-3. Изменения трансмембранного потенциала, отводимого от сердечных волокон с быстрым и медленным ответом в изолированной
- 8. Типы ионных токов, формирующие фазы ПД рабочего кардиомиоцита Потенциал покоя рабочего кардиомиоцита (Vm) составляет примерно -90
- 9. Рис. 6-4. Ионные токи, текущие через основные ионные каналы, активирующиеся в различные фазы потенциала действия рабочего
- 10. Ионные токи, формирующие потенциал действия рабочего кардиомиоцита Любой стимул, который делает Vm менее негативным, стремится открыть
- 11. Рис. 6-5. Изменение проводимости мембраны рабочих кардиомиоцитов предсердий и желудочков для ионов (А) и основные ионные
- 12. Ионные токи, формирующие потенциал действия пейсмейкерной клетки У медленного же ответа (рис. 6-6 А) нарастание гораздо
- 13. Рис. 6-6. Основные ионные токи, активирующиеся в различные фазы потенциала действия пейсмейкерной клетки в синоатриальном узле.
- 14. Ионные механизмы автоматии Несколько ионных токов вносят вклад в медленную диастолическую деполяризацию, которая характерна для клеток
- 15. Рис. 6-7. Изменение проводимости мембраны пейсмейкерных клеток синоатриального узла для ионов (А) и основные ионные токи,
- 16. Истинные и латентные пейсмейкерные комплексы Свойство автоматии - ведущей пейсмейкерной активности - позволяет сердцу сокращаться даже
- 17. Рис. 6-8. Потенциалы действия ведущего пейсмейкера. А - клетки синусового узла и латентного пейсмейкера. Б -
- 18. Возможные пути изменения частоты разрядов пейсмейкерных клеток Частота разрядов пейсмейкерных клеток, определяющих частоту сердечных сокращений, может
- 19. Рис. 6-9. Основные пути, обусловливающие изменения частоты возбуждения пейсмейкерных клеток. А - причины изменения частоты пейсмейкерной
- 20. Влияние величины мембранного потенциала покоя на скорость распространения потенциала действия Уровень потенциала покоя мембраны управляет скоростью
- 21. Рис. 6-10. Зависимость мембранного потенциала и потенциала действия клеток Пуркинье от внеклеточной концентрации калия (St -
- 22. Взаимосвязь частоты стимуляции и длительности потенциала действия кардиомицита Изменения частоты стимулирующих импульсов изменяют длительность потенциалов действия
- 23. Рис. 6-11. Влияние длительности межстимуляционного интервала (CL) на длительность потенциала действия (APD) клеток Пуркинье
- 24. Влияние стимуляции вегетативных нервов на форму потенциалов клеток синусного, атриовентрикулярного узлов и кардиомиоцитов предсердий Обычно частота
- 25. Рис. 6-12. Влияния парасимпатической и симпатической стимуляции на форму потенциалов действия клеток синоатриального узла (А1, Б1),
- 26. Влияние нейтротрансмиттеров, их агонистов и антагонистов на клетки синоатриального узла Нейротрансмиттеры вегетативной нервной системы воздействуют на
- 27. Рис. 6-13. Изменение ритма пейсмейкерной активности изолированной синоатриальной клетки под действием низких концентраций агониста β-адренорецепторов изопротеренола
- 28. Механизм влияния норадреналина и ацетилхолина Различные факторы, такие как нейротрансмиттеры и лекарственные средства, могут существенно влиять
- 29. Рис. 6-14. Влияние агонистов α1- и β-адренорецепторов и М2-холинорецепторов через вторичные внутриклеточные посредники на потенциал-зависимые ионные
- 30. Структура проводящей системы сердца Автоматия - это способность к самовозбуждению, или способность генерировать свое собственное возбуждение
- 31. Рис. 6-15. Проводящая система сердца. А - строение проводящей системы сердца: 1 - синоатриальный узел, 2
- 32. Функции и свойства проводящей системы сердца Проводящая система сердца обеспечивает генерацию ритма возбуждений, последовательность и синхронность
- 33. Рис. 6-16. Последовательная регистрация потенциалов действия от различных участков сердечной мышцы и сопоставление их с электрокардиограммой,
- 34. Автоматия различных отделов сердца Проводящая система холоднокровных животных включает два узла автоматии: синусный, расположенный в венозном
- 35. Рис. 6-17. Изучение автоматии различных отделов сердца лягушки - опыт Станниуса. А - выключение отдельных узлов
- 36. Влияние температуры на частоту сокращений сердца Доказательством автоматии сердца служит тот факт, что вырезанное из организма
- 37. Рис. 6-18. Влияние нагревания и охлаждения венозного синуса на частоту сокращений сердца лягушки (опыт Гаскелла). А
- 38. Условия необходимые для возникновения возбуждения Сердечная мышца обладает рядом свойств, характерных для любой мышцы, в том
- 39. Рис. 6-19. Получение желудочковой экстрасистолы на сердце лягушки. А - схема сердца с серфином. Б -
- 40. Понятие о реентри При определенных условиях сердечный импульс может снова возбудить некоторую область миокарда, через которую
- 41. Рис. 6-20. Циркуляция волны возбуждения (re-entry - повторный вход) в кольце возбудимой ткани (по Mayer и
- 42. Ранние и задержанные деполяризации Триггерная (пусковая или запускающая) активность называется так потому, что она всегда сопряжена
- 43. Рис. 6-21. Триггерная активность, вызванная в сердечных клетках ранними постдеполяризациями (РПД), или иначе early afterdepolarization (EAD),
- 44. Возможности фармакологического влияния на длительность потенциалов действия кардиомиоцитов Длительность потенциала действия в основном зависит от активности
- 45. Рис. 6-22. Изменение длительности потенциала действия (ДПД) под действием различных веществ. А - ДПД волокна правого
- 46. Фазовые изменения возбудимости во время возбуждения кардиомиоцита В процессе потенциала действия возбудимость клетки меняется, что определяется
- 47. Рис. 6-23. Фазовые изменения возбудимости (фиолетовая кривая) и их связь с потенциалом действия рабочего кардиомиоцита (зеленая
- 48. Механизм электромеханического сопряжения в кардиомиоцитах Сопряжение возбуждения - сокращения иначе называется электромеханическим сопряжением. Его идею отражают
- 49. Рис. 6-24. Электромеханическое сопряжение в сердце. А - кривая, отражающая процесс сопряжения возбуждения и сокращения в
- 50. Механоэлектрическая обратная связь в сердце Обратный электромеханическому сопряжению процесс носит название механоэлектрическая обратная связь. Механоэлектрическая обратная
- 51. Рис. 6-25. Механоиндуцированная деполяризация кардиомиоцита. А - монофазный потенциал действия (МАР) нерастянутого левого предсердия, зарегистрированный при
- 52. Иллюстрации механоиндуцированной деполяризации Растяжение полоски предсердия здоровых животных вызывает появление механоиндуцированной деполяризации SID (стрелки на фрагментах
- 53. Рис. 6-26. Механоиндуцированная деполяризация в здоровом сердце и после инфаркта миокарда. А - механоиндуцированная деполяризация и
- 54. Влияние растяжения на возникновение механоиндуцированной деполяризации На рис. 6-27 А, Б представлена динамика развития одного экстрапотенциала
- 55. Рис. 6-27. Динамика преобразования механоиндуцированной деполяризации в потенциал действия (АР) при различных степенях (1-5) растяжения препарата.
- 56. Влияние растяжения мембраны на потенциалы покоя и действия В нормальном растворе Тироде с использованием метода patch-clamp
- 57. Рис. 6-28. Растяжение изолированного кардиомиоцита левого желудочка при исследовании методом patchclamp в конфигурации whole-cell. А -
- 58. Характеристика механоуправляемых токов Влияние растяжения на временной курс базового мембранного тока в реальных физиологических условиях, т.е.
- 59. Рис. 6-29. Вольтамперные характеристики механочувствительных ионных токов (К+ токи не заблокированы). А - поддерживаемый потенциал -45
- 60. Характеристика механоуправляемых токов в кардиомиоцитах сердца после инфаркта Дальнейшие исследования были посвящены разделению базового тока IMGC
- 61. Рис. 6-30. Активация растяжением Gd3+-чувствительного неселективного катионного тока при растяжении на 4 мкм кардиомиоцита левого желудочка
- 62. Суммарный механоуправляемый ток при различных величинах растяжения клетки У изолированных кардиомиоцитов потенциал фиксировали на уровне -45
- 63. Рис. 6-31. При растяжении активируется суммарный входящий ток, который пропорционален величине растяжения и при возвращении к
- 64. Зависимость механочувствительности кардиомиоцитов от возраста животного или человека и патологии сердца Как было показано выше, у
- 65. Рис. 6-32. Оригинальные кривые токов, зарегистрированных до растяжения и при растяжении кардиомиоцитов. IK подавлен. А -
- 66. Механоуправляемые каналы кардиомиоцитов Впервые SAC были выявлены и описаны в экспериментах с использованием метода patch-clamp в
- 67. Рис. 6-33. Механосенситивные ионные каналы сердца. А - активируемые растяжением ионные каналы клеток сердца. Одноканальная запись
- 68. Электрокардиография Процесс возбуждения сердца сопровождается возникновением в его тканях разности потенциалов, закономерно изменяющихся по величине и
- 69. Рис. 6-34. Электрокардиография. А - потенциалы действия, характерные для основных частей сердца, и их соответствие во
- 70. Стандартные и грудные отведения ЭКГ Отведение в электрокардиографии - это электрическое соединение кожной поверхности пациента с
- 71. Рис. 6-35. Расположение электродов на поверхности тела для записи стандартных (I, II и III) электрокардиографических отведений
- 72. Основные виды электрокардиографических отведений Регистрация временных изменений разности потенциалов между двумя точками на поверхности кожи называется
- 73. Рис. 6-36. Основные виды электрокардиографических отведений. А - стандартные двухполюсные отведения от конечностей: I, II, III
- 74. Принцип формирования электрокардиограммы Хотя первые попытки создания теории, объясняющей механизм формирования ЭКГ, были предприняты практически одновременно
- 75. Рис. 6-37. Принцип формирования электрокардиограммы. А - последовательные изменения направления и величины ЭДС сердца во время
- 76. Результирующий вектор сердца Суммарный вектор всей электрической деятельности сердца в любой момент времени называется результирующим вектором
- 77. Рис. 6-38. Результирующий вектор сердца. А - треугольник Эйнтховена, иллюстрирующий соединения электрокардиографа при стандартных отведениях I,
- 78. Шестиосевая система координат При электрокардиографическом обследовании обычно используют двенадцать отведений: шесть отведений от конечностей - это
- 79. Рис. 6-39. Шестиосевая система координат. А - направление осей трех стандартных отведений Эйнтховена (I, II, III)
- 80. Нарушения ритма Аритмии Аритмии сердца отражают нарушения в возникновении импульса или в его распространении. Нарушения возникновения
- 81. Рис. 6-40. Синоатриальные ритмы. A - нормальный синусный ритм. Б - синусовая тахикардия. В - синусовая
- 82. Нарушение атриовентрикулярной проводимости Атриовентрикулярные блокады проведения Различные физиологические, фармакологические воздействия и патологические процессы могут препятствовать распространению
- 83. Рис. 6-41. Атриовентрикулярные (AV) блокады. А - схематическое представление положения катетеров-электродов при внутрисердечных регистрациях электрограмм. ВОПП
- 84. Внеочередные сокращения сердца Экстрасистолы Внеочередные деполяризации (экстрасистолы) возникают иногда у здоровых людей, но чаще всего они
- 85. Рис. 6-42. Экстрасистолы и пароксизмальные тахикардии. А - внеочередные деполяризации. Внеочередная предсердная деполяризация (A1) и внеочередная
- 86. Фибрилляция предсердий и желудочков Фибрилляция При некоторых условиях сердечная мышца начинает сокращаться некоординировано и полностью не
- 87. Рис. 6-43. Фибрилляция. Предсердная фибрилляция (А) и желудочковая фибрилляция (Б)
- 88. Клапанный аппарат сердца Сердечные клапаны. Клапаны сердца состоят из тонких листков гибкой, упругой, покрытой эндотелием фиброзной
- 89. Рис. 6-44. Схема перпендикулярного разреза сердца вдоль межжелудочковой перегородки, иллюстрирующая анатомическую взаимосвязь створок атриовентрикулярных и аортальных
- 90. Ультразвуковое исследование клапанного аппарата сердца Движения створок митрального клапана в течение сердечного цикла показаны на эхокардиограмме
- 91. Рис. 6-45. Принцип эхокардиографии. Датчик испускает и улавливает ультразвуковые сигналы, т.е. работает по принципу эха. Стрелками
- 92. Закон сердца Старлинга К внутриклеточным механизмам регуляции силы сокращений относится механизм Франка- Старлинга, называемый также закон
- 93. Рис. 6-46. Внутрисердечные механизмы регуляции работы сердца. Закон сердца Старлинга - первый принцип внутриклеточного механизма регуляции
- 94. Ритмоинотропная регуляция Ритмоинотропная зависимость - это зависимость силы сокращений от частоты сокращений, которая рассматривается как внутриклеточный
- 95. Рис. 6-47. Внутрисердечные механизмы регуляции работы сердца. Ритмо-инотропная зависимость - второй принцип внутриклеточного механизма регуляции работы
- 96. Внутрисердечная нервная система Сердце способно к автоматическому контролю своей деятельности. Автоматический контроль осуществляется как за счет
- 97. Рис. 6-48. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система. А - принципиальная схема организации внутрисердечной
- 98. Влияние ацетилхолина на работу сердца Показано, что во внутрисердечной нервной системе определенную роль играют холинергические нейроны,
- 99. Рис. 6-49. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система. Влияние ацетилхолина на работу изолированного сердца.
- 100. Влияние адреналина на деятельность сердца Для изучения действия адреналина на механическую работу сердца лягушки пользуются препаратом
- 101. Рис. 6-50. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система. Влияние адреналина на работу изолированного сердца.
- 102. Влияние отдельных ионов на работу сердца Наряду с нервной регуляцией деятельности органов существует так называемая гуморальная
- 103. Рис. 6-51. Ионы как пример гуморальной регуляции сердца. А - сердце на канюле Штраубе. Б -
- 104. Влияние вегетативной нервной системы на деятельность сердца Внешние регулирующие факторы можно подразделить на нервные и гуморальные.
- 105. Рис. 6-52. Симпатическая и парасимпатическая иннервация сердца. 1 - правый блуждающий нерв, 2 - левый блуждающий
- 106. Влияние раздражения блуждающего нерва на автоматию и инотропную функцию миокарда Блуждающие нервы вызывают угнетение сердечного пейсмейкера
- 107. Рис. 6-53. Внесердечная регуляция работы сердца - влияние парасимпатической нервной системы. А - электрическая активность кардиомиоцитов.
- 108. Влияние раздражения симпатических нервов на деятельность сердца Влияние симпатической нервной системы Деятельность симпатической нервной системы увеличивает
- 109. Рис. 6-54. Внесердечная регуляция работы сердца - влияние симпатической нервной системы. А - регистрация электрической активности.
- 110. Взаимодействие влияний симпатической и парасимпатической систем на сердце Экстракардиальные нервные механизмы регуляции реализуются через симпатическую и
- 111. Рис. 6-55. Взаимодействие в пределах вегетативной (симпатической и парасимпатической) нервной систем и внутриклеточные механизмы, ответственные за
- 113. Рис. 6-56. Схема, иллюстрирующая принцип Фика для измерения сердечного выброса. Изменение цвета от легочной артерии к
- 114. Фазовый анализ сердечного цикла Систола желудочков начинается после окончания систолы предсердий. Волна сокращения, постепенно распространяясь по
- 115. Вслед за фазой изгнания наступает диастола желудочков. Они начинают расслабляться, поэтому давление в аорте становиться выше,
- 116. Обычно сердце производит четыре тона, но, как правило, через стетоскоп прослушиваются только два из них. При
- 119. Скачать презентацию
Слайд 2Физиология сердца Общие представления
Кровеносная система служит для доставки к тканям необходимых веществ
Физиология сердца Общие представления
Кровеносная система служит для доставки к тканям необходимых веществ

Сердечно-сосудистая система состоит из насоса - сердца, системы распределяющих и собирающих трубок - кровеносных сосудов и обширной системы тонких сосудов, обеспечивающих быстрый обмен веществ между тканями и сосудами - капилляров. Поступление крови к тканям регулируется определенными механизмами, и эти регулирующие механизмы способны удовлетворять меняющиеся потребности различных тканей в соответствии с различными физиологическими и патологическими состояниями.
Сердце
Сердце (рис. 6-1 А) состоит из двух последовательных насосов (рис. 6-1 Б): один насос проталкивает кровь через легкие для обеспечения обмена кислорода и углекислого газа. Это так называемая легочная циркуляция или легочный круг кровообращения.Через другой насос кровь движется ко всем остальным тканям тела. Это системная циркуляция. Кровь может двигаться через сердце только в одном направлении. Одностороннее движение крови через сердце обеспечивается соответствующим устройством створок клапанов. Хотя сердечный выброс имеет прерывистый или пульсирующий характер, к тканям тела (на периферию) кровь движется сплошным (непрерывным) потоком за счет растяжения аорты и ее ветвей во время сокращения желудочков (систола) и за счет эластической тяги стенок крупных артерий при поступательном проталкивании крови во время релаксации желудочков (диастола).
Слайд 3Рис. 6-1. Общие представления о системе кровообращения.
А - камеры сердца и магистральные
Рис. 6-1. Общие представления о системе кровообращения.
А - камеры сердца и магистральные
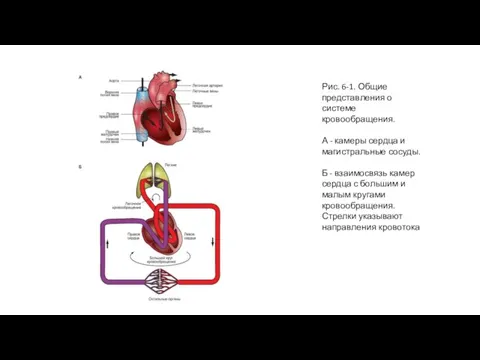
Б - взаимосвязь камер сердца с большим и малым кругами кровообращения. Стрелки указывают направления кровотока
Слайд 4Структура сердечно-сосудистой системы
Кровь, поступающая в правый желудочек из правого предсердия, через легочную
Структура сердечно-сосудистой системы
Кровь, поступающая в правый желудочек из правого предсердия, через легочную

Возвращаясь из капилляров к сердцу, кровь проходит через венулы, затем через вены все большего размера. Ближе к сердцу количество вен уменьшается, меняются толщина и строение стенок вен, уменьшается общая площадь поперечного сечения венозного русла. Кровь в сердце поступает по двум полым венам - верхней и нижней. Обе впадают в правое предсердие. Оттуда кровь поступает в правый желудочек.
Таким образом, большой круг кровообращения начинается аортой, выходящей из левого желудочка и заканчивается двумя полыми венами, впадающими в правое предсердие. Малый круг кровообращения начинается легочной артерией, выходящей из правого желудочка, и заканчивается четырьмя легочными венами, впадающими в левое предсердие.
При нормальном кровообращении в здоровом организме общий объем крови остается постоянным, и увеличение объема крови в одном участке должно сопровождаться уменьшением объема крови в другом. Тем не менее распределение циркулирующей крови по различным участкам тела определяется сердечным выбросом левого желудочка и состоянием сократительной способности резистивных сосудов (артериол), расположенных в этих участках.
Система кровообращения состоит из последовательно и параллельно расположенных каналов - сосудов (рис. 6-2). Такое расположение оказывает значительное влияние на показатели сопротивления сосудов, давления и движения крови в кровеносных сосудах.
Слайд 5Рис. 6-2. Кровеносные сосуды.
На рисунке изображены большой (красным) и малый (синим) круги
Рис. 6-2. Кровеносные сосуды.
На рисунке изображены большой (красным) и малый (синим) круги

Слайд 6Типы и характеристика потенциалов действия кардиомиоцитов
Изменения потенциала, отводимого от типичного мышечного волокна
Типы и характеристика потенциалов действия кардиомиоцитов
Изменения потенциала, отводимого от типичного мышечного волокна

В точке c клетка желудочка возбуждается электрическим стимулом, и клеточная мембрана быстро деполяризуется. Во время деполяризации разность потенциалов фактически меняет знак таким образом, что потенциал внутри клетки превышает таковой снаружи приблизительно на 20 мВ. Быстрое нарастание потенциала действия обозначается как фаза 0. За нарастанием мгновенно следует короткий период частичной ранней реполяризации (фаза 1) и затем плато (фаза 2), которое удерживается приблизительно от 0,1 до 0,2 с. Мембрана затем реполяризуется (фаза 3) до тех пор, пока поляризация снова не достигнет (в точке e) состояния покоя (фаза 4). Окончательная реполяризация (фаза 3) развивается более медленно, чем деполяризация (фаза 0).
В сердце регистрируют два основных типа по-тенциалов действия, которые показаны на рис. 6-3. Один тип, быстрый ответ (рис. 6-3 А), возникает в рабочих миоцитах предсердий и желудочков и в специализированных проводящих волокнах (волокна Пуркинье сердца). Другой тип потенциала действия, медленный ответ (рис. 6-3 Б), встречается в синоатриальном (SA) узле, области естественного водителя ритма сердца, и в атриовентрикулярном (AV) узле, специализированной ткани, проводящей импульсы сердца из предсердий в желудочки.
Сравним эти два принципиальных типа потенциалов действия (рис. 6-3). Потенциал покоя (фаза 4) у быстрого ответа значительно более отрицателен, чем потенциал покоя у медленного ответа. Кроме этого, крутизна нарастания (фаза 0), амплитуда потенциала действия и величина овершута быстрого ответа больше, чем медленного ответа. Амплитуда потенциала действия и крутизна нарастания являются важными факторами, определяющими то, как быстро будет распространяться потенциал действия. В ткани сердца с медленным ответом потенциал действия распространяется более медленно, чем в ткани сердца с быстрым ответом. К тому же проведение возбуждения, скорее всего, будет заблокировано в сердечной ткани с медленным ответом, а не в ткани с быстрым ответом. Медленное проведение и склонность к блоку проведения увеличивает вероятность развития некоторых нарушений ритма.
Далее на панелях представлены типичные потенциалы действия, зарегистрированные от клеток SA-узла (B), предсердия (Г) и желудочка (Д).
Заметьте, что нумерация фаз потенциала действия дана в соответствии с международными принципами.
Слайд 7Рис. 6-3. Изменения трансмембранного потенциала, отводимого от сердечных волокон с быстрым и
Рис. 6-3. Изменения трансмембранного потенциала, отводимого от сердечных волокон с быстрым и

А - во время a микроэлектрод был в растворе, который окружает сердечное волокно. Во время b микроэлектрод вошел в клетку. Во время c возник потенциал действия в волокне, в которое введен микроэлектрод. Время от c до d представляет собой фазу абсолютной рефрактерности или эффективный рефрактерный период (ЭРП), а время от d до e представляет относительный рефрактерный период (ОРП).
Б - потенциал действия, отводимый от сердечного волокна с медленным ответом. Обратите внимание на то, что по сравнению с волокном, в котором был зарегистрирован быстрый ответ, потенциал покоя медленного волокна менее негативен, фаза 0 (нарастание) потенциала действия менее крутая, амплитуда потенциала действия меньше, фаза 1 отсутствует и ОРП продолжается в значительной мере и в течение фазы 4, после того как волокно полностью реполяризовалось.
На панелях В, Г, Д продемонстрированы типичные потенциалы действия, зарегистрированные от клеток СA-узла (B),предсердия (Г) и желудочка (Д). Развертка в B составляет половину от таковой в Г или Д
Слайд 8Типы ионных токов, формирующие фазы ПД рабочего кардиомиоцита
Потенциал покоя рабочего кардиомиоцита (Vm)
Типы ионных токов, формирующие фазы ПД рабочего кардиомиоцита
Потенциал покоя рабочего кардиомиоцита (Vm)

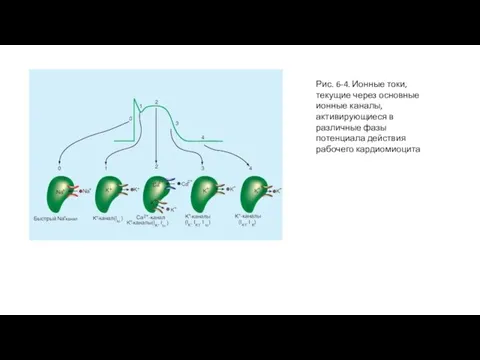
Ионы Na+ входят в кардиомиоциты через существующие в мембране селективные быстрые Na+-каналы. Быстрая деполяризация - фаза 0 - связана с входом ионов Na+ в кардиомиоцит за счет резкого увеличения GNa. По мере того как Na+ стремительно входит в клетку сердца в течение фазы 0, отрицательные заряды внутри клетки нейтрализуются, и Vm становится менее отрицательным. Когда Vmпадает до нуля, электростатическая сила, необходимая для перемещения Na+ в клетку, перестает существовать. Тем не менее пока быстрые Na+-каналы открыты, Na+ продолжает поступать в клетку из-за большого концентрационного градиента. Это пролонгирование входящего Na+ тока приводит к тому, что внутренняя часть клетки становится заряженной положительно. Эта реверсия полярности мембраны и есть так называемый овершут потенциала действия сердца. Такая реверсия электростатического градиента будет, конечно, способствовать ограничению входа дополнительного Na+. Тем не менее на протяжении всего времени, когда направленные внутрь химические силы превосходят направленные вовне электростатические силы, результирующий поток Na+ направлен внутрь, хотя скорость, с которой Na+ поступает в клетку, уменьшается. Поскольку быстрые Na+-каналы являются потенциал-управляемыми, они инактивируются при определенном потенциале и фаза 0 завершится (рис. 6-4).
Далее наступает фаза 1 - ранняя реполяризация. Реполяризация происходит быстро вследствие активации транзиторного выходящего тока (Ito) создаваемого главным образом K+. Активация К+-каналов во время фазы 1 вызывает непродолжительный выброс K+ из клетки, потому что внутренняя часть клетки позитивно заряжена и потому, что внутренняя концентрация K+ значительно превосходит внешнюю концентрацию K+. В результате такого транзиторного выхода позитивно заряженных ионов клетка на короткое время частично реполяризуется.Во время фазы 2 - плато потенциала действия - Ca2+ входит в кардиомиоциты через кальциевые каналы, которые активируются и инактивируются гораздо медленнее, чем это делают быстрые Na+-каналы. Во время горизонтального участка фазы 2 такой вход положительного заряда, переносимого Ca2+, сбалансирован выходом положительного заряда, переносимого K+. K+ выходит через каналы, которые проводят в основном Ito, IK и IK1 токи. Как было сказано ранее, ток Ito ответственен за фазу 1, но он не инактивируется полностью до тех пор, пока не закончится фаза 2.
Процесс окончательной реполяризации - фаза 3 - начинается в конце фазы 2, когда выход K+ из клетки сердца начинает превышать вход Ca2+. Как мы уже отмечали, по крайней мере, три К+ тока направленных наружу (Ito IK и IK1) вносят вклад в окончательную реполяризацию (фаза 3) клеток сердца (рис. 6-4).
В завершение избыток Na+, который входит в клетку в течение фазы 0, активно удаляется Na+/К+-АТФазой. Этот фермент переносит 3 Na+ в обмен на 2 K+, который вышел из клетки главным образом в течение фаз 2 и 3. Точно так же большая часть излишка Ca2+, который вошел в клетку главным образом в течение фазы 2, удаляется преимущественно Na+-Ca2+-обменником, который обменивает 3 Na+ на 1 Ca2+. Восстановление концентраций знаменует фазу 4 - потенциал покоя.
Напомним, что IK1 - это inwardly rectifying K+-current, который проводится через К+-кана- лы аномального выпрямления с током входящего направления. Это, inward rectifiers K+-chan- neks - каналы, названные сокращенно Kir (для детализации см. Атлас по физиологии - том 1, рис. 1-16, с. 42 и рис. 1-77, с. 160). Напомним также, что Ito - это fast transient K+-current или transient outward current,который проводится через быстро инактивирующиеся (и поэтому транзиторные) K+-каналы выходящего тока. Это группа потенциал-управляемых K+-каналов - KV. Каналы этого типа обычно образованы членами подсемейств KV1.4, KV3.3, KV3.4, KV4.1 - KV4.3 и вспомогательной β-субъединицы, часто необходимой для феномена быстрой инактивации (для детализации см. Атлас по физиологии - том 1, рис. 1-14, с. 38 и рис. 1-15, с. 40, а также рис. 1-76, с. 158). Напомним, что delayed rectifier K+-channels - K+-каналы задержанного выпрямления, через которые идет ток IK. Это также КV, -каналы, например
KV1.1 - KV1.3, KV1.5 - KV1.8, KV2.2, KV3.1, KV3.2
(для детализации см. Атлас по физиологии - том 1, рис. 1-15, с. 40, а также рис. 1-76, с. 158).
Слайд 9Рис. 6-4. Ионные токи, текущие через основные ионные каналы, активирующиеся в различные
Рис. 6-4. Ионные токи, текущие через основные ионные каналы, активирующиеся в различные
Слайд 10Ионные токи, формирующие потенциал действия рабочего кардиомиоцита
Любой стимул, который делает Vm менее
Ионные токи, формирующие потенциал действия рабочего кардиомиоцита
Любой стимул, который делает Vm менее

Фаза 1 - короткий период ограниченной реполяризации происходит быстро вследствие активации транзиторного выходящего тока (ito) создаваемого главным образом K+. Непродолжительный выброс K+ из клетки уменьшает амплитуду потенциала действия.
Во время плато - (фаза 2) Ca2+ входит в кардиомиоциты через кальциевые каналы, которые активируются и инактивируются гораздо медленнее, чем это делают быстрые Na+-каналы. Во время фазы 2 такой вход положительного заряда, переносимого Ca2+, сбалансирован выходом положительного заряда, переносимого K+. K+ выходит через каналы, которые проводят в основном Ito, IK и IK1токи. Различные типы Ca2+-каналов были идентифицированы в тканях сердца, но наиболее распространены так называемые, Ca2+-каналы L-типа (long lasting). Открытие Ca2+-каналов приводит к увеличению Ca2+ проводимости (GCa) сразу же после нарастания потенциала действия (рис. 6-5, А2).
Во время плато потенциала действия трансмембранный концентрационный градиент K+ фактически такой же, как и во время фазы 4, но Vm положителен, поэтому обе силы, химическая и электростатическая, способствуют выходу K+ из клетки. Если бы GK была во время плато такая же, как во время фазы 4, то выход K+ во время фазы 2 значительно превосходил бы вход Ca2+ , и устойчивое плато не возникало бы. Однако по мере того как Vm приближается, а затем достигает положительных значений около пика нарастания потенциала действия, GK внезапно уменьшается. Уменьшенный K+ ток, связанный с понижением GK, предотвращает избыточную потерю K+ из клетки во время плато.
Снижение GK как при положительных, так и при небольших отрицательных значениях Vm называется аномальным выпрямлением с током входящего направления (inward rectification). Аномальное выпрямление с током входящего направления присуще нескольким типам K+ токов, включая IK1 ток.
Другие K+-каналы - К+-каналы задержанного выпрямления (delayed rectifier channels). Протекающие через них токи обозначаются как IK. Эти каналы закрыты в течение фазы 4, но они активируются потенциалами, которые преобладают к концу фазы 0. Однако активация развивается медленно в течение плато. Следовательно, активация этих каналов ведет к постепенному увеличению GK в течение фазы 2. Таким образом, указанные каналы играют в течение фазы 2 небольшую роль, но вносят определенный вклад в процесс окончательной реполяризации (фаза 3), как это описано ниже.
Процесс окончательной реполяризации (фаза 3) начинается в конце фазы 2, когда выход K+ из клетки сердца начинает превышать вход Ca2+. Как мы уже отмечали, по крайней мере, три K+ тока, направленных наружу (Ito IK и IK1), вносят вклад в окончательную реполяризацию (фаза 3) клеток сердца. Необходимо отметить, что определенный вклад вносит ток через катион-неселективные ионные каналы - INS (рис. 6-5 Б).
Слайд 11Рис. 6-5. Изменение проводимости мембраны рабочих кардиомиоцитов предсердий и желудочков для ионов
Рис. 6-5. Изменение проводимости мембраны рабочих кардиомиоцитов предсердий и желудочков для ионов

На панели Б в центре - потенциал действия миокардильной клетки желудочка, вверху и внизу - относительная проводимость для входящих и выходящих ионных токов соответственно. Прямые жирные линии для ICl, Ipump и IК(АТФ) указывают лишь на присутствие тока, обусловленного этими каналами или насосами, величины этих токов изменяются при различных физиологических состояниях
Слайд 12Ионные токи, формирующие потенциал действия пейсмейкерной клетки
У медленного же ответа (рис. 6-6
Ионные токи, формирующие потенциал действия пейсмейкерной клетки
У медленного же ответа (рис. 6-6

Типичный трансмембранный потенциал действия, зарегистрированный от клетки в SA-узле, изображен на рис. 6-6 А, а реконструированный с помощью компьютерной модели DiFrancescoNoble на рис. 6-6 Б. По сравнению с трансмембранным потенциалом, записанным от кардиомиоцита желудочка, потенциал покоя клетки SA-узла обычно менее негативен, нарастание потенциала действия (фаза 0) менее крутое, плато непродолжительно и реполяризация (фаза 3) более постепенна. Все эти черты характерны для медленного ответа. Нарастание потенциала действия не создается током, направленным внутрь через быстрые Na+-каналы. В таких клетках деполяризация достигается главным образом за счет входа Ca2+ через Ca2+-каналы. Реполяризация в этих волокнах сопровождается инактивацией Ca2+-каналов и увеличенной K+ проводимостью через IK1 и IK каналы (рис. 6-6 В).
Трансмембранный потенциал в течение фазы 4 намного менее негативен у клеток, обладающих автоматией в SA- (и AV) узлах, чем у предсердных или желудочковых кардиомиоцитов, потому что IKl (К+-ток аномального выпрямления входящего направления) через К+-каналы аномального выпрямления редко встречается у клеток узлов. Ввиду этого отношение GK к GNa в течение фазы 4 намного меньше у клеток узлов, чем у кардиомиоцитов. Следовательно, во время фазы 4, Vm отклоняется намного больше от равновесного K+потенциала (EK) у клеток узлов, чем у кардиомиоцитов.
Однако принципиальное свойство пейсмейкерного волокна, которое отличает его от других рассмотренных нами волокон, заключается в фазе 4. У клеток, не обладающих автоматией, мембранный потенциал остается постоянным в течение этой фазы, в то время как пейсмейкерное волокно характеризуется медленной диастолической деполяризацией в течение фазы 4. Деполяризация развивается с постоянной скоростью до достижения порога, запуская потенциал действия.
Слайд 13Рис. 6-6. Основные ионные токи, активирующиеся в различные фазы потенциала действия пейсмейкерной
Рис. 6-6. Основные ионные токи, активирующиеся в различные фазы потенциала действия пейсмейкерной
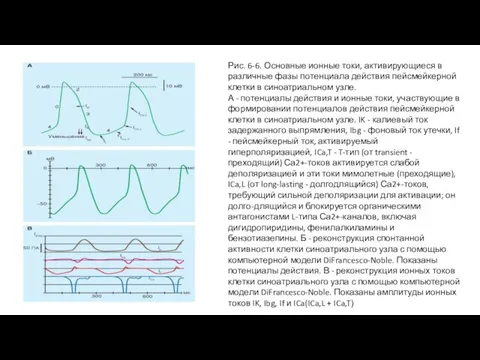
А - потенциалы действия и ионные токи, участвующие в формировании потенциалов действия пейсмейкерной клетки в синоатриальном узле. IK - калиевый ток задержанного выпрямления, Ibg - фоновый ток утечки, If - пейсмейкерный ток, активируемый гиперполяризацией, ICa,T - T-тип (от transient - преходящий) Са2+-токов активируется слабой деполяризацией и эти токи мимолетные (преходящие), ICa,L (от long-lasting - долгодлящийся) Са2+-токов, требующий сильной деполяризации для активации; он долго-длящийся и блокируется органическими антагонистами L-типа Са2+-каналов, включая дигидропиридины, фенилалкиламины и бензотиазепины. Б - реконструкция спонтанной активности клетки синоатриального узла с помощью компьютерной модели DiFrancesco-Noble. Показаны потенциалы действия. В - реконструкция ионных токов клетки синоатриального узла с помощью компьютерной модели DiFrancesco-Noble. Показаны амплитуды ионных токов IK, Ibg, If и ICa(ICa,L + ICa,T)
Слайд 14Ионные механизмы автоматии
Несколько ионных токов вносят вклад в медленную диастолическую деполяризацию, которая
Ионные механизмы автоматии
Несколько ионных токов вносят вклад в медленную диастолическую деполяризацию, которая

Входящий ток If (funny) активируется ближе к концу реполяризации. Этот «странный» ток переносится главным образом Na+ через специфические каналы, которые отличаются от быстрых №+-каналов. Току был пожалован титул «странного», потому что его первооткрыватели не ожидали обнаружить направленный внутрь Na+ ток в пейсмейкерных клетках после завершения реполяризации. Этот ток активируется по мере того, как мембранный потенциал становится более негативным, чем приблизительно -50 мВ. Чем более негативен мембранный потенциал в это время, тем больше активация If тока.
Второй ток, ответственный за диастолическую деполяризацию, Ca 2+ ток, ICa. Этот ток активируется к концу фазы 4 по мере того, как трансмембранный потенциал достигает величины около - 55 мВ. Как только каналы активированы, вход Ca2+ в клетку увеличивается. Этот приток ускоряет диастолическую деполяризацию, которая затем приводит к фазе нарастания потенциала действия. Уменьшение концентрации внешнего Ca2+ или добавление антагонистов кальциевого канала уменьшает амплитуду потенциала действия и крутизну медленной диастолической деполяризации в клетках SA-узла.
Прогрессивной диастолической деполяризации, опосредованной двумя входящими токами, If и ICa, противодействует выходящий ток K+- ток задержанного аномального выпрямления IK. Эта утечка K+ стремится реполяризовать клетку после нарастания потенциала действия. K+ продолжает выходить наружу в течение значительного времени после максимальной реполяризации, но этот выход уменьшается на всем протяжении фазы 4. Как только ток уменьшается, его противодействие деполяризующим влияниям двух входящих токов (ICa и If) также постепенно уменьшается.
Ионные основы автоматии в пейсмейкерных клетках AV-узла похожи на таковые в клетках SA-узла. Подобные механизмы также отвечают за автоматию в волокнах Пуркинье желудочков, за исключением того, что в них не участвует Ca2+ ток. Другими словами, медленная диастолическая деполяризация опосредована преимущественно неустойчивостью между влиянием вызванного гиперполяризацией входящего тока If и постепенно уменьшающимся выходящим K+ током IK.
Слайд 15Рис. 6-7. Изменение проводимости мембраны пейсмейкерных клеток синоатриального узла для ионов (А)
Рис. 6-7. Изменение проводимости мембраны пейсмейкерных клеток синоатриального узла для ионов (А)

На панели Б в центре - потенциал действия клетки синоатриального узла, вверху и внизу - входящие и выходящие ионные токи соответственно. Прямые жирные линии для Ipump и Ibg указывают лишь на присутствие тока, обусловленного этими каналами или насосами, величины этих токов изменяются при различных физиологических состояниях. Знак вопроса указывает на то, что роль этих токов в формировании потенциала действия синоатриальных клеток до конца не выяснена, тогда как знак «0» говорит о том, что этот ток отсутствует
Слайд 16Истинные и латентные пейсмейкерные комплексы
Свойство автоматии - ведущей пейсмейкерной активности - позволяет
Истинные и латентные пейсмейкерные комплексы
Свойство автоматии - ведущей пейсмейкерной активности - позволяет

Областью сердца млекопитающих, которая обычно генерирует импульсы с самой большой частотой (рис. 6-8 А), являетсясиноатриальный (SA) узел. Это главный водитель ритма сердца. Детализированное картирование электрических потенциалов на поверхности правого предсердия показывает, что существуют две или три области автоматии, находящиеся в 1 или 2 см от SA-узла, и составляют совместно с SA-узлом предсердный пейсмейкерный комплекс. Иногда все эти локусы одновременно инициируют импульсы. Однако принципиальное свойство пейсмейкерного волокна, которое отличает его от других рассмотренных нами волокон, заключается в фазе 4. У клеток, не обладающих автоматией, потенциал остается постоянным в течение этой фазы, в то время как пейсмейкерное волокно характеризуется медленной диастолической деполяризацией в течение фазы 4. Деполяризация развивается с постоянной скоростью до достижения порога, запуская потенциал действия.
Однако существуют и латентные пейсмейкеры. Когда SA-узел или другие составляющие предсердного пейсмейкерного комплекса удалены или разрушены, клетки водителя ритма AV-узла обычно берут на себя пейсмейкерную функцию всего сердца. Через некоторое время клетки предсердий, обладающие автоматией, обычно становятся доминирующими. Волокна Пуркинье представляют специализированную проводящую систему желудочков, которая также способна проявлять автоматию. Как правило, эти волокна разряжаются с очень низкой частотой. Когда AV-узел не может проводить импульсы от предсердий к желудочкам (рис. 6-8 Б), собственный желудочковый водитель ритма в сети волокон Пуркинье инициируют сокращения желудочков, но только с частотой от 30 до 40 ударов в минуту.
Слайд 17Рис. 6-8. Потенциалы действия ведущего пейсмейкера.
А - клетки синусового узла и латентного
Рис. 6-8. Потенциалы действия ведущего пейсмейкера.
А - клетки синусового узла и латентного
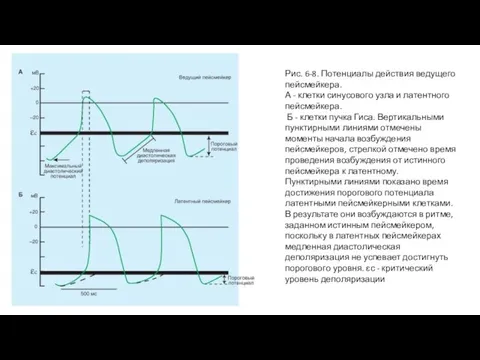
Б - клетки пучка Гиса. Вертикальными пунктирными линиями отмечены моменты начала возбуждения пейсмейкеров, стрелкой отмечено время проведения возбуждения от истинного пейсмейкера к латентному.
Пунктирными линиями показано время достижения порогового потенциала латентными пейсмейкерными клетками. В результате они возбуждаются в ритме, заданном истинным пейсмейкером, поскольку в латентных пейсмейкерах медленная диастолическая деполяризация не успевает достигнуть порогового уровня. ɛс - критический уровень деполяризации
Слайд 18Возможные пути изменения частоты разрядов пейсмейкерных клеток
Частота разрядов пейсмейкерных клеток, определяющих частоту
Возможные пути изменения частоты разрядов пейсмейкерных клеток
Частота разрядов пейсмейкерных клеток, определяющих частоту

Когда скорость медленной диастолической деполяризации увеличивается (от 2 до 1 на рис. 6-9 А1), потенциал порога достигается раньше и частота сердечных сокращений увеличивается. Повышение порогового потенциала (от Ес-1 до Ес-2 на рис. 6-9 А2) задерживает начало фазы 0 (от момента времени 2 до момента времени 3) и частота сердечных сокращений соответственно уменьшается. Точно так же, когда максимальный, негативный потенциал увеличен (от 1 до 4 на рис. 6-9 А2), то требуется больше времени, чтобы достигнуть порога Ес-2, когда крутизна фазы 4 остается неизменной, а частота сердечных сокращений, следовательно, уменьшается.
Слайд 19Рис. 6-9. Основные пути, обусловливающие изменения частоты возбуждения пейсмейкерных клеток.
А - причины
Рис. 6-9. Основные пути, обусловливающие изменения частоты возбуждения пейсмейкерных клеток.
А - причины

А1 - изменение частоты спонтанной активности за счет изменения скорости медленной диастолической деполяризации (1 и 2).
А2 - изменение частоты спонтанной активности за счет изменения порогового уровня деполяризации (Ес-1, Ес-2 - 1 и 4). Изменение частоты спонтанной активности за счет изменения уровня максимального диастолического потенциала (2, 3 и 5).
Б - влияние кратковременного раздражения блуждающего нерва (стрелка) на трансмембранный потенциал, регистрируемый от пейсмейкерной клетки SA-узла препарата изолированного предсердия кошки. Длительности сердечного цикла, в миллисундах, обозначены числами наверху рисунка
Слайд 20Влияние величины мембранного потенциала покоя на скорость распространения потенциала действия
Уровень потенциала покоя
Влияние величины мембранного потенциала покоя на скорость распространения потенциала действия
Уровень потенциала покоя

Скорость распространения потенциала действия по миокарду определяют следующие факторы: (1) величина мембранного потенциала покоя, (2) амплитуда ПД и (3) скорость нарастания его переднего фронта в фазу 0.
(1) Чем более деполяризована мембрана, тем меньше скорость распространения независимо от причин возникновения. В основе этого явления лежит инактивация потенциал-управляемых h-ворот. А именно, когда начинается регенеративная деполяризация, то часть быстрых натриевых каналов могут быть уже инактивированы.
(2) Амплитуда ПД определяет разность потенциалов между возбужденным и невозбужденным участком, т.е. величину локальных токов, которые деполяризуют мембрану до порогового уровня.
(3) Скорость нарастания переднего фронта влияет на величину разности потенциалов между возбужденным и еще не возбужденным участками. Иными словами, если ПД развивается медленно, то это сопровождается снижением возникающей разности потенциалов, поскольку покоящаяся часть деполяризуется постепенно по отношению к активной зоне.
Этими механизмами можно объяснить более медленное распространение возбуждения потенциалов с медленным ответом. Следует учитывать, что блокируются в первую очередь потенциалы с медленным ответом. Трансмембранный потенциал может изменяться в сторону деполяризации по следующим причинам: (1) изменилась внеклеточная концентрация K+; (2) у волокон сердца, способных к автоматии, Vm постепенно становится менее негативным во время фазы 4; и (3) при преждевременном возбуждении мембрана клетки полностью не реполяризуется после предыдущего возбуждения. Вообще говоря, чем менее отрицателен уровень Vm, тем меньше скорость распространения импульса, независимо от причины изменения Vm.
Уровень Vm влияет на скорость проведения, потому что инактивация h-ворот быстрых Na+-каналов, является потенциал-управляемой. Чем менее отрицателен Vm, тем больше количество h-ворот, которые стремятся закрыться. В течение нормального процесса возбуждения, деполяризация развивается так быстро в течение фазы 0, что сравнительно медленные h-ворота не закрываются до конца этой фазы. Однако если неполная деполяризация произведена постепенно, например, как при повышении уровня внешнего K+, то ворота имеют вполне достаточное время, чтобы закрыться и таким образом инактивировать некоторые из Na+-каналов. Когда клетка не полностью деполяризована, многие из Na+-каналов уже инактивированы; таким образом, только часть Na+-каналов способна проводить направленный внутрь Na+ ток в течение фазы 0.
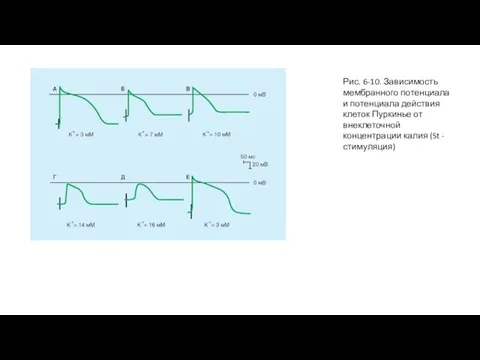
На рис. 6-10 показаны результаты эксперимента, в котором потенциал покоя пучка волокон Пуркинье уменьшали, изменяя величину [K+]o. Ткань стимулируется на некотором удалении от клетки с вживленным электродом, и артефакт от раздражения (St) появляется как двухфазное отклонение перед фазой 0. Интервал от этого артефакта до начала фазы 0 обратно пропорционален скорости проведения. Когда [K+]o равна 3 мМ (A и Е), Vm составляет -82 мВ, и наблюдается крутой наклон в фазе 0. В конце фазы 0, овершут достигает 30 мВ. Следовательно, амплитуда потенциала действия составляет 112 мВ.
Когда [K+]o постепенно увеличивается до 16 мМ (от Б к Д), потенциал покоя постепенно становится менее негативным. В то же самое время и амплитуды, и длительности потенциалов действия, и крутизны нарастания уменьшаются. Как следствие, скорость проведения прогрессивно снижается. При уровнях [K+]o в 14 и 16 мМ (Д и E), Vm достигает значений, достаточных, чтобы инактивировать все быстрые Na+-каналы. Потенциалы действия на рис. 6-9 Д и E являются характерными медленными ответами.
Слайд 21Рис. 6-10. Зависимость мембранного потенциала и потенциала действия клеток Пуркинье от внеклеточной
Рис. 6-10. Зависимость мембранного потенциала и потенциала действия клеток Пуркинье от внеклеточной
Слайд 22Взаимосвязь частоты стимуляции и длительности потенциала действия кардиомицита
Изменения частоты стимулирующих импульсов изменяют
Взаимосвязь частоты стимуляции и длительности потенциала действия кардиомицита
Изменения частоты стимулирующих импульсов изменяют

Ток IK активируется при значениях Vm близких к нулю, но ток активируется медленно и остается активированным сотни миллисунд. Ток IK также очень медленно инактивируется. Следовательно, поскольку длительность межстимуляционного интервала уменьшается, каждый следующий потенциал действия имеет тенденцию возникать в начале периода инактивации тока IK предшествующего потенциала действия. Таким образом, чем короче длительность межстимуляционного интервала, тем больше направленный наружу K+-ток в течение фазы 2, и, следовательно, короче длительность потенциала действия.
Ток Ito влияет на связь между частотой стимуляции и длительностью потенциала действия. Ток Ito также активируется при значениях потенциалов, близких к нулю, и его величина изменяется обратно пропорционально длине сердечного цикла. Следовательно, при уменьшении межстимуляционного интервала, результирующее увеличение направленного наружу K+ тока сокращает плато.
Относительные вклады IK и Ito во взаимосвязь между длительностью потенциала действия и длиной сердечного цикла варьируют в сердцах разных видов животных.
Слайд 23Рис. 6-11. Влияние длительности межстимуляционного интервала (CL) на длительность потенциала действия (APD)
Рис. 6-11. Влияние длительности межстимуляционного интервала (CL) на длительность потенциала действия (APD)

Слайд 24Влияние стимуляции вегетативных нервов на форму потенциалов клеток синусного, атриовентрикулярного узлов и
Влияние стимуляции вегетативных нервов на форму потенциалов клеток синусного, атриовентрикулярного узлов и

Обычно частота разряда водителя ритма регулируется действием обоих отделов вегетативной нервной системы. Усиленная симпатическая нервная активность, посредством высвобождения норадреналина, повышает частоту сердечных сокращений, увеличивая, преимущественно, крутизну медленной диастолической деполяризации рис. 6-12 А1, А2, А3). Этот механизм увеличения частоты сердечных сокращений осуществляется при физической нагрузке, беспокойстве, или при некоторых заболеваниях.
Повышенная активность блуждающего нерва, посредством высвобождения ацетилхолина, уменьшает частоту сердечных сокращений, гиперполяри-
зуя клеточную мембрану пейсмейкера и уменьшая крутизну медленной диастолической деполяризации (рис. 6-12 Б1, Б2, Б3). Эти механизмы уменьшения частоты сердечных сокращений осуществляются, когда преобладает действие блуждающего нерва. Примером крайнего случая является вазовагальный обморок: короткий период головокружения или потери сознания, вызванного интенсивным всплеском вагусной активности. Этот тип обморока является рефлекторным ответом на боль или некоторые психологические стимулы.
Изменения активности внутрисердечной нервной системы обычно не изменяют частоту сердечных сокращений посредством изменения порогового значения Vm, что инициирует разряд пейсмейкерной клетки узла. Однако некоторые антиаритмические препараты, например, хинидин и прокаинамид, поднимают пороговый потенциал клеток, обладающих автоматией до менее негативных величин за счет смещения ɛс.
Слайд 25Рис. 6-12. Влияния парасимпатической и симпатической стимуляции на форму потенциалов действия клеток
Рис. 6-12. Влияния парасимпатической и симпатической стимуляции на форму потенциалов действия клеток
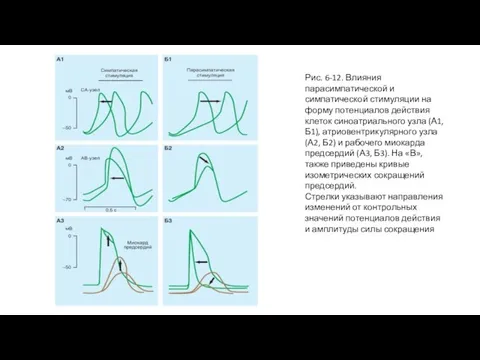
Стрелки указывают направления изменений от контрольных значений потенциалов действия и амплитуды силы сокращения
Слайд 26Влияние нейтротрансмиттеров, их агонистов и антагонистов на клетки синоатриального узла
Нейротрансмиттеры вегетативной нервной
Влияние нейтротрансмиттеров, их агонистов и антагонистов на клетки синоатриального узла
Нейротрансмиттеры вегетативной нервной

Гиперполяризация (рис. 6-13 Б), вызванная ацетилхолином, который высвобождается из окончаний блуждающего нерва, достигается увеличением GK. Это изменение в проводимости опосредуется через активацию специфических K+-каналов, регулируемых ацетилхолином. Эти каналы регулируются под действием ацетилхолина (например, внеклеточной концентрацией ацетилхолина). В сердце имеются мускариновые K+-каналы (KACh) - тип KG каналов, активирующийся G-белками, ответственными за эффект ацетилхолина. Возникающий ток обозначают как IKACh. В сердце ацетилхолин также понижает If и ICa токи.
У здоровых людей, находящихся в спокойном состоянии, преобладает обычно тоническое влияние парасимпатической нервной системы. Когда здоровому человеку вводят атропин, антагонист мускариновых рецепторов, который блокирует воздействия парасимпатической нервной системы, частота сердечных сокращений обычно значительно возрастает. Если здоровому человеку вводятпропранолол, антагонист β-адренергических рецепторов, который блокирует воздействия симпатической нервной системы, частота сердечных сокращений незначительно уменьшается. Когда оба отдела вегетативной нервной системы блокированы, частота сердечных сокращений у молодых людей в среднем достигает значения 100 ударов в минуту. Частота сердечных сокращений, которая устанавливается при полной блокаде вегетативной нервной системы, называется собственной частотой сердечных сокращений.
Слайд 27Рис. 6-13. Изменение ритма пейсмейкерной активности изолированной синоатриальной клетки под действием низких
Рис. 6-13. Изменение ритма пейсмейкерной активности изолированной синоатриальной клетки под действием низких
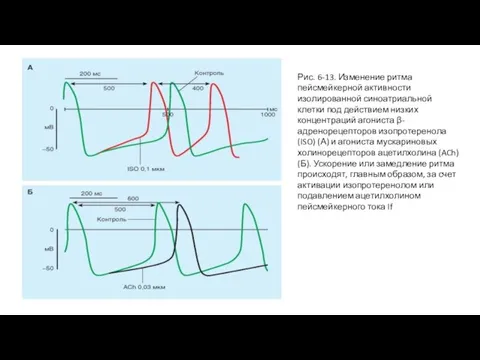
Слайд 28Механизм влияния норадреналина и ацетилхолина
Различные факторы, такие как нейротрансмиттеры и лекарственные средства,
Механизм влияния норадреналина и ацетилхолина
Различные факторы, такие как нейротрансмиттеры и лекарственные средства,

Чтобы усилить Ca2+ проводимость, катехоламины сначала взаимодействуют с β-адренергическими рецепторами мембраны клетки сердца. Это взаимодействие стимулирует мембранно-связанный фермент аденилилатциклазу, что повышает внутриклеточную концентрацию циклического аденозин монофосфата (цАМФ). Повышение уровня цАМФ усиливает активацию Ca2+-каналов L-типа в клеточной мембране и таким образом увеличивает вход Ca2+ в клетки из межклеточной жидкости.
Ацетилхолин взаимодействует с мускариновыми рецепторами клеточной мембраны, чтобы наоборот ингибировать аденилилатциклазу. Таким путем ацетилхолин противодействует активации Ca2+-каналов, уменьшая, таким образом, GCa.
Синоатриальный и атриовентрикулярный узлы содержат много холиностеразы, фермента, разрушающего ацетилхолин. Ацетилхолин, высвобожденный из окончаний блуждающих нервов быстро гидролизируется. Благодаря быстрому разрушению ацетилхолина воздействия, вызываемые любой стимуляцией блуждающего нерва, очень быстро прекращаются после окончания стимуляции. Кроме того, влияние блуждающего нерва на деятельность синоатриального или атриовентрикулярного узлов имеет очень короткий латентный период (от 50 до 100 мс), потому что выделяемый ацетилхолин активирует специфические ацетилхолин-регулируемые К+-каналы (IKACh) в клетках сердца. Эти каналы открываются так быстро потому, что ацетилхолин действует минуя систему вторичных мессенджеров такую, как система аденилатциклазы. Сочетание двух характерных особенностей блуждающих нервов - короткого латентного периода и быстрого угасания ответной реакции - позволяет блуждающим нервам регулировать деятельность синоатриального и атриовентрикулярного узлов при каждом сокращении сердца.
В области синоатриального узла влияние парасимпатической нервной системы обычно превосходит влияние симпатической нервной системы.
Слайд 29Рис. 6-14. Влияние агонистов α1- и β-адренорецепторов и М2-холинорецепторов через вторичные внутриклеточные
Рис. 6-14. Влияние агонистов α1- и β-адренорецепторов и М2-холинорецепторов через вторичные внутриклеточные
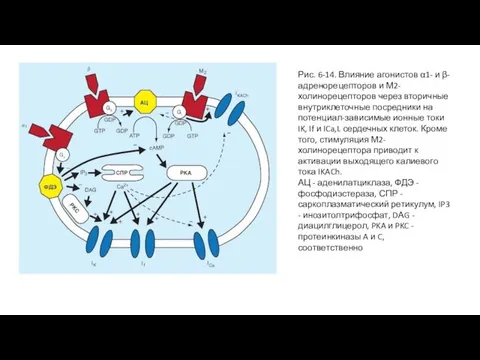
АЦ - аденилатциклаза, ФДЭ - фосфодиэстераза, СПР - саркоплазматический ретикулум, IP3 - инозитолтрифосфат, DАG - диацилглицерол, PKA и PKC - протеинкиназы A и C, соответственно
Слайд 30Структура проводящей системы сердца
Автоматия - это способность к самовозбуждению, или способность генерировать
Структура проводящей системы сердца
Автоматия - это способность к самовозбуждению, или способность генерировать

Областью сердца млекопитающих, которая обычно генерирует импульсы с самой большой частотой, является синоатриальный (SA) узел, это главный водитель ритма сердца. Детализированное картирование электрических потенциалов на поверхности правого предсердия показывает, что существуют две или три области автоматии, находящиеся в 1 или 2 см от SA-узла, и составляют совместно с SA-узлом предсердный пейсмейкерный комплекс. Иногда все эти локусы одновременно инициируют импульсы. А иногда, область самого раннего возбуждения сдвигается от локуса к локусу, в зависимости от определенных условий, таких как уровень активности автономной нервной системы.
Из SA-узла сердца импульсы радиально распространяются по всему правому предсердию по обычным предсердным волокнам миокарда со скоростью проведения около 1 м/с. Специальный путь, передний межпредсердный пучок миокарда (или пучок Бахмана), проводит импульс из SA-узла непосредственно к левому предсердию. Волна возбуждения, которая направляется вниз через правое предсердие, в конечном счете, достигает атриовентрикулярного (AV) узла, который является обычно единственным путем прохождения сердечного импульса к желудочкам.
Волна возбуждения из предсердий достигает желудочков через AV-узел. У взрослых людей этот узел около 22 мм в длину, 10 мм в ширину и 3 мм в толщину. Узел расположен сзади, на правой стороне межпредсердной перегородки, вблизи устья коронарного синуса. AV-узел содержит те же самые два типа клеток, что и SA-узел, но круглые клетки в AV-узле менее распространены, а преобладают удлиненные.
AV-узел состоит из трех функциональных областей: (1) область AN (atrium-nodus), переходная зона между предсердием и остальной частью узла; (2) N (nodus) средняя часть AV-узла; и (3) NH (nodus-His) - зона, в которой волокна узла постепенно сливаются с пучком Гиса, и которая представляет собой верхнюю часть специализированной проводящей системы желудочков. Обычно AV-узел и пучок Гиса являются единственными проводящими путями, по которым импульсы сердца проходят от предсердий к желудочкам.
Пучок Гиса проходит субэндокардиально вниз, приблизительно на 1 см, по правой стороне межжелудочковой перегородки и затемразделяется на правую и левую ножки пучка. Правая ножка пучка, которая является прямым продолжением пучка Гиса, направляется вниз по правой стороне межжелудочковой перегородки. Левая ножка пучка, которая значительно толще, чем правая, отходит почти перпендикулярно от пучка Гиса и проникает через межжелудочковую перегородку. На субэндокардиальной поверхности левой стороны межжелудочковой перегородки, левая ножка пучка разделяется на тонкую переднюю и толстую заднюю ветви.
Правая ножка пучка и две ветви левой ножки пучка в конечном счете ветвятся, образуя сложную сеть проводящих волокон, названныхволокнами Пуркинье, которые распространяются по субэндокардиальным поверхностям обоих желудочков. У некоторых видов млекопитающих, например у крупного рогатого скота, сеть волокон Пуркинье организована в виде дискретных, инкапсулированных волокон.
Волокна Пуркинье имеют множество линейно организованных саркомеров, таких же, как у кардиомиоцитов. Однако T-тубулярная система отсутствует в волокнах Пуркинье у многих видов, хотя она хорошо развита в кардиомиоцитах. Волокна Пуркинье - самые крупные клетки сердца: они имеют диаметр от 70 до 80 мкм, в то время как диаметр кардиомиоцитов желудочков лежит в диапазоне от 10 до 15 мкм. Частично из-за своего большого диаметра, скорость проведения возбуждения (от 1 до 4 м/с) в волокнах Пуркинье превышает таковую у любого другого типа сердечных волокон. Более высокая скорость проведения обеспечивает быструю активацию всей эндокардиальной поверхности желудочков.
Слайд 31Рис. 6-15. Проводящая система сердца.
А - строение проводящей системы сердца:
1 -
Рис. 6-15. Проводящая система сердца.
А - строение проводящей системы сердца:
1 -
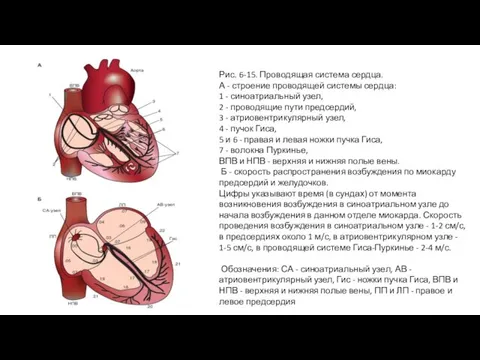
2 - проводящие пути предсердий,
3 - атриовентрикулярный узел,
4 - пучок Гиса,
5 и 6 - правая и левая ножки пучка Гиса,
7 - волокна Пуркинье,
ВПВ и НПВ - верхняя и нижняя полые вены.
Б - скорость распространения возбуждения по миокарду предсердий и желудочков.
Цифры указывают время (в сундах) от момента возникновения возбуждения в синоатриальном узле до начала возбуждения в данном отделе миокарда. Скорость проведения возбуждения в синоатриальном узле - 1-2 см/с, в предсердиях около 1 м/с, в атриовентрикулярном узле - 1-5 см/с, в проводящей системе Гиса-Пуркинье - 2-4 м/с.
Обозначения: СА - синоатриальный узел, АВ - атриовентрикулярный узел, Гис - ножки пучка Гиса, ВПВ и НПВ - верхняя и нижняя полые вены, ПП и ЛП - правое и левое предсердия
Слайд 32Функции и свойства проводящей системы сердца
Проводящая система сердца обеспечивает генерацию ритма возбуждений,
Функции и свойства проводящей системы сердца
Проводящая система сердца обеспечивает генерацию ритма возбуждений,

Атриовентрикулярный узел помимо проведения возбуждения при необходимости может взять на себя функцию водителя ритма. Кроме того, особые свойства АУ-узла обеспечивают неполную блокаду при проведении возбуждения свыше 180-200 в минуту. Далее возбуждение идет по пучку Гиса и его ножкам со скоростью 2-3 м/с, переходит на волокна Пуркинье, здесь скорость максимальная - 4-5 м/с и, наконец, достигает клеток рабочего миокарда. Скорость распространения возбуждения от субэндокардиальных окончаний волокон Пуркинье по рабочему миокарду желудочков составляет около 1 м/с.
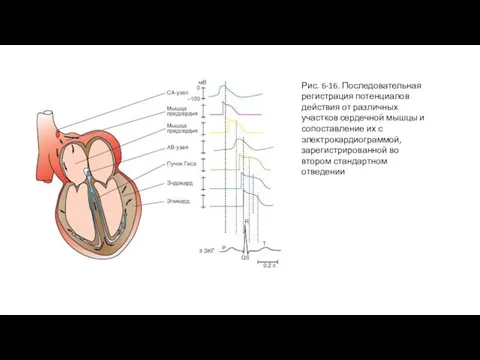
На рис. 6-16 продемонстрированы различные типы потенциалов действия, зарегистрированные последовательно от различных участков сердца и сопоставлены с одновременной записью электрокардиограммы. На данном рисунке отчетливо видно, что наибольшая задержка проведения возбуждения имеет место на участке: предсердие - атриовентрикулярный узел
Слайд 33Рис. 6-16. Последовательная регистрация потенциалов действия от различных участков сердечной мышцы и
Рис. 6-16. Последовательная регистрация потенциалов действия от различных участков сердечной мышцы и
Слайд 34Автоматия различных отделов сердца
Проводящая система холоднокровных животных включает два узла автоматии: синусный,
Автоматия различных отделов сердца
Проводящая система холоднокровных животных включает два узла автоматии: синусный,

Все участки проводящей системы обладают способностью к автоматии, которая изменяется от основания сердца к верхушке (градиент автоматии). Наибольшей автоматией обладает синоатриальный узел (синусный - у холоднокровных). Его называют центром автоматии первого порядка.
При нарушении функции синоатриального узла какими-либо факторами проявляется автоматия атриовентрикулярного узла. Ритм сокращений сердца, задаваемый этим узлом, вдвое и более раз реже, чем в норме. После выключения атриовентрикулярного узла роль водителя ритма переходит к пучку Гиса, сокращения сердца становятся еще реже и т.д.
Автоматия вторичных узлов проявляется не сразу после выключения узла высшего порядка, а через промежуток времени, который длится от нескольких сунд до нескольких минут, - это так называемая преавтоматическая пауза.
Для изучения проводящей системы сердца лягушки используют метод наложения лигатур на области расположения центров автоматии (лигатуры Станниуса). Применяют две лигатуры Станниуса (рис. 6-17 A). Первая лигатура накладывается в виде тугой перевязки между венозным синусом и предсердиями. Она отделяет синусный узел от остальных отделов сердца и препятствует доступу возбуждения к ним. Вследствие этого сокращения предсердий и желудочка прекращаются. Венозный синус продолжает сокращаться в исходном ритме. Опыт доказывает наличие в венозном синусе ведущего узла автоматии.
Вторая лигатура Станниуса накладывается между предсердиями и желудочком, она служит для раздражения атриовентрикулярного узла и пробуждения его автоматии. После наложения второй лигатуры возникают сокращения предсердий и желудочка, но в ином ритме, чем сокращения синуса. Опыт доказывает существование второго узла автоматии, расположенного в атриовентрикулярной области.
Регистрируют работу сердца в норме с подведенными лигатурами Станниуса. Затем туго завязывают лигатуру на границе между предсердиями и венозным синусом (рис. 6-17 Б). Сразу после перетяжки предсердия и желудочек останавливаются, а сокращения венозного синуса продолжаются в прежнем ритме. Результаты наложения первой лигатуры регистрируют на самописце. Слабые сокращения венозного синуса можно записать только при очень хорошо отпрепарированном препарате.
На некоторых препаратах удается иногда обнаружить самостоятельное проявление автоматии атриовентрикулярного узла через какое-то время после наложения первой лигатуры Станниуса (иногда через несколько минут). Ритм спонтанно возникающих сокращений меньше исходного синусного ритма.
Если же автоматия атриовентрикулярного узла спонтанно не восстанавливается, можно ускорить ее проявление каким-либо внешним стимулом. Таким раздражителем может служить вторая лигатура Станниуса, которая накладывается в области атриовентрикулярной борозды (рис. 6-17 Б). Вторую лигатуру затягивают нетуго, до появления сокращений сердца. Вначале эти сокращения, как правило, довольно часты, но постепенно урежаются, и вскоре устанавливается истинный атриовентрикулярный ритм, который в 2-3 раза реже исходного ритма сердца (рис. 6-17 В2).
Слайд 35Рис. 6-17. Изучение автоматии различных отделов сердца лягушки - опыт Станниуса.
А -
Рис. 6-17. Изучение автоматии различных отделов сердца лягушки - опыт Станниуса.
А -

1 - подведение лигатуры для перевязки венозного синуса;
2 - венозный синус отделен лигатурой от предсердий;
3 - подведена вторая лигатура для отделения предсердий от желудочков;
4 - предсердия отделены от желудочков.
Б - схема наложения лигатур Станниуса на сердце лягушки. Принцип наложения лигатур Станниуса с целью получения искусственного блока сердца (I - первая лигатура Станниуса; II - вторая лигатура Станниуса): 1 - подведение первой и второй лигатур Станниуса, 2 - затягивание первой лигатуры Станниуса, 3 - затягивание второй лигатуры Станниуса. В - механограмма сердца лягушки: 1 - механограмма сердца лягушки в норме, 2 - механограмма после искусственного поперечного блока сердца
Слайд 36Влияние температуры на частоту сокращений сердца
Доказательством автоматии сердца служит тот факт, что
Влияние температуры на частоту сокращений сердца
Доказательством автоматии сердца служит тот факт, что

У обездвиженной лягушки обнажают сердце (рис. 6-18 А) собирают установку по схеме, представленной на рис. 6-18 Б. Захватывают серфином или лигатурой верхушку сердца и устанавливают штырь регистратора в горизонтальном положении, опуская или поднимая дощечку с лягушкой. К основанию сердца, находящегося в вертикальном положении (к зоне синусного узла), подводят термод, заполненный водой комнатной температуры. С помощью механоэлектрического преобразователя записывают на самописце кривую сокращений сердца - механограмму (рис. 6-18 В1).
По термоду пропускают воду температурой 4 °С и продолжают запись механограммы, регистрируя изменение механограммы сердца (рис. 6-18 В2). После получения устойчивого эффекта вновь пропускают через термод воду комнатной температуры для получения исходной механограммы (рис. 6-18 В3). Затем пропускают через термод воду температурой около 36 °С и продолжают запись механограммы, регистрируя изменение механограммы сердца (рис. 6-18 В4). После получения эффекта пропускают через термод воду комнатной температуры для получения исходной механограммы (рис. 6-18 В5).
Аналогичным образом проводят исследование влияния температуры на частоту сокращений сердца, перемещая термод к другим участкам сердца (желудочку).
После прекращения температурного воздействия изолируют сердце из организма, для чего предварительно перевязывают сосуды и перерезают их ниже места перевязки. Перерезают полую вену, следя за тем, чтобы не повредить венозный синус. Если изоляция сделана правильно, то сердце, вырезанное из тела лягушки и помещенное в физиологический раствор, будет сокращаться продолжительное время.
Слайд 37Рис. 6-18. Влияние нагревания и охлаждения венозного синуса на частоту сокращений сердца
Рис. 6-18. Влияние нагревания и охлаждения венозного синуса на частоту сокращений сердца

А - схема сердца с серфином, соединенным с регистратором.
Б - схема постановки опыта по изучению влияния температуры на автоматию сердца.
В - непрерывная запись механической активности сердца
Слайд 38Условия необходимые для возникновения возбуждения
Сердечная мышца обладает рядом свойств, характерных для любой
Условия необходимые для возникновения возбуждения
Сердечная мышца обладает рядом свойств, характерных для любой

Абсолютная рефрактерность сменяется состоянием пониженной возбудимости или относительной рефрактерности, которая продолжается в мышце желудочка около 0,03 с и совпадает с фазой его расслабления. Возбудимость сердца в этот период постепенно нарастает, но остается ниже нормы. В это время можно возбудить сердечную мышцу, нанося раздражения большей, чем обычно, силы. В основе механизма относительной рефрактерности лежит явление снятия инактивации всех каналов входящего тока и параллельное приближение потенциала клеток к уровню мембранного потенциала. Именно поэтому в поздний период относительной рефрактерности сердце легче возбудить, чем в ранний.
Наконец, возбудимость сердца возвращается к норме. С развитием в сердце новой волны возбуждения повторяются вышеописанные изменения возбудимости. Выражением возбуждения сердечной мышцы является потенциал действия. При соотношении изменения возбудимости мышцы сердца и потенциала действия можно видеть, что абсолютная рефрактерность занимает большую часть потенциала действия. Относительная рефрактерность приходится на фазу реполяризации. Раздражение, нанесенное на сердечную мышцу в период нормальной возбудимости и относительной рефрактерности, вызывает добавочное, внеочередное сокращение - экстрасистолу. Если внеочередное раздражение подается на венозный синус, то оно вызывает преждевременное возникновение импульса возбуждения в синусном узле и развитие внеочередного сердечного цикла. Следующий импульс возбуждения и соответствующий ему сердечный цикл возникают через обычный интервал времени. После желудочковой экстрасистолы наступает удлиненная, так называемая компенсаторная пауза. Происхождение ее связано с тем, что очередной импульс, приходящий в желудочек из синусного узла, попадает в рефрактерную фазу экстрасистолы. Этот импульс не может вызвать сокращения желудочка, оно наступает лишь в ответ на следующий импульс водителя ритма. Выпадение одного сокращения и создает удлиненную паузу.
У лягушки обнажают сердце (рис. 6-19 А). Собирают установку по схеме, представленной на рис. 6-19 Б. Захватывают серфином или лигатурой верхушку сердца и соединяют с механоэлектрическим преобразователем. На макроманипуляторе закрепляются вилочковые электроды, соединенные со стимулятором, которые подводятся к желудочку. Записывают кривую сокращений сердца - механограмму.
Исследование изменений возбудимости сердца производят путем получения экстрасистолы и определения интенсивности (раздражения, вызывающего ее в различные моменты деятельности желудочка). Внеочередное раздражение подают на желудочек в виде прямоугольных импульсов электрического тока от электростимулятора.
Слайд 39Рис. 6-19. Получение желудочковой экстрасистолы на сердце лягушки.
А - схема сердца с
Рис. 6-19. Получение желудочковой экстрасистолы на сердце лягушки.
А - схема сердца с

Б - схема постановки опыта.
В - запись механограммы лягушки. Отметка времени 1 с. Видны две экстрасистолы.
Г - желудочковая экстрасистола и компенсаторная пауза. Схематическое изображение моментов нанесения внеочередных раздражений (1, 2, 3), желудочковая экстрасистола (4), компенсаторная пауза (5), несостоявшееся сокращение обозначено пунктиром (6). Внизу отметка времени
Слайд 40Понятие о реентри
При определенных условиях сердечный импульс может снова возбудить некоторую область
Понятие о реентри
При определенных условиях сердечный импульс может снова возбудить некоторую область

Хотя однонаправленный блок является необходимым условием для реентри, сам он не может вызвать циркуляции возбуждения. Чтобы возникло реентри, эффективный рефрактерный период области реентри должен быть короче, чем время проведения по петле. Функциональные компоненты петель реентри, ответственные за специфические аритмии в интактном сердце, разнообразны. Некоторые петли - большие и включают все специализированные проводящие пути, в то время как другие - микроскопические. Петля может включать кардиомиоциты, специализированные волокна проводящей системы, клетки узлов и атриовентрикулярные ткани почти в любой мыслимой компоновке. К тому же клетки сердца в петле могут быть нормальными или патологическими. Следовательно, условиями, которые поддерживают реентри, являются те, которые продлевают время проведения или сокращают эффективный рефрактерный период.
У пациентов с нерегулярными преждевременными деполяризациями, время появления этих внеочередных сокращений может обуславливать их клиническое состояние. Если они происходят на поздней стадии периода относительной рефрактерности, предшествующей деполяризации, или после полной реполяризации, то преждевременная деполяризация, вероятно, несущественна. Однако если преждевременные деполяризации происходят на ранней стадии периода относительной рефрактерности, проведение преждевременного импульса от места возникновения будет медленным, и, следовательно, возникновение реентри более вероятно. Если реентри нерегулярено (т.е. если наступает фибрилляция), последствия могут быть очень серьезными.
Слайд 41Рис. 6-20. Циркуляция волны возбуждения (re-entry - повторный вход) в кольце возбудимой
Рис. 6-20. Циркуляция волны возбуждения (re-entry - повторный вход) в кольце возбудимой

А - циркуляция волны возбуждения.
А1 - при стимуляции кольца в определенной точке распространяющиеся импульсы сталкиваются.
А2 - во время стимуляции на короткое время сдавливается заштрихованный участок, при этом возбуждение распространяется только в одном направлении, так как в области сжатия распространение импульса блокируется.
A3 - кольцо больше не пережимается, импульс возвращается к исходной точке и затем продолжает свое движение по кольцу, начинается циркуляция возбуждения. Длина волны (ДВ) для re-entry равна произведению скорости проведения (СП) возбуждения на эффективный рефрактерный период (ЭРП). Значения СП и ЭРП, взяты для нормальной ткани рабочего миокарда человека. Циркуляция возбуждения по кольцу возможна только при условии, если ДВ меньше, чем путь, по которому двигается волна (длина окружности - 2πr). Б - циркуляция волны возбуждения вокруг анатомического препятствия. В - циркуляция волны возбуждения вокруг функционального препятствия. На (Б) и (В) стрелкой отмечено направление распространение волны. Синим цветом закрашены участки ткани, находящиеся в состоянии абсолютной рефрактерности. Рядом с каждым участком показаны фазы потенциала действия в данный момент. Циркуляция возбуждения возможна только при наличии возбудимого окна между «головой» и «хвостом» волны
Слайд 42Ранние и задержанные деполяризации
Триггерная (пусковая или запускающая) активность
называется так потому, что она
Ранние и задержанные деполяризации
Триггерная (пусковая или запускающая) активность
называется так потому, что она

Ранние постдеполяризации. РПД имеют тенденцию возникать ближе к концу плато потенциала действия или в течение фазы реполяризации, но прежде чем в клетке полностью закончится реполяризация. Чаще всего РПД возникают тогда, когда преобладает медленная частота сердечных сокращений; высокая частота сердечных сокращений их подавляет РПД. В эксперименте, показанном на рис. 6-21 Б, в препарате изолированного волокна Пуркинье РПД вызваны цезием. Явных следовых деполяризаций не наблюдается, когда препарат искусственно стимулируется импульсами с межстимуляционным интервалом в 2 с. Если период стимуляции увеличивается до 4 с, то появляются РПД. Большинство РПД - подпороговые (первые две стрелки), но одна из РПД достигает порога и запускает потенциал действия. Когда период стимуляции увеличивается до 6 с, каждый вызванный стимуляцией потенциал действия генерирует РПД, которая запускает второй потенциал действия. Кроме того, когда длительность межстимуляционного интервала увеличивается до 10 с, каждый вызванный стимуляцией потенциал действия запускает залп из четырех или пяти дополнительных потенциалов действия.
Прямая корреляция между длительностью потенциала действия клетки и ее способности к развитию РПД вероятно связана со временем, требуемым для Ca2+-каналов в мембранах клетки, чтобы восстановиться от инактивации. Когда длительность потенциала действия увеличена, Ca2+-каналы, которые были активированы в начале плато, имеют достаточное время, чтобы восстановиться от инактивации, прежде чем клетка полностью реполяризуется. Эта вторичная активация может запустить раннюю постдеполяризацию.
Задержанные постдеполяризации. В отличие от РПД, ЗПД чаще происходят, когда частота сердечных сокращений высока. Наиболее важные характеристики ЗПД показаны на рис. 6-21 В. В эксперименте, представленном на этом рисунке, трансмембранные потенциалы зарегистрированы от волокон Пуркинье, подвергнутых воздействию высокой концентрации ацетил-строфантидина, вещества подобного дигиталису. В отсутствие каких-либо сильных раздражителей, эти волокна являются молчащими.
В каждой записи на рис. 6-21 В последовательность из шести вызванных стимуляцией деполяризаций вызывалась импульсами с определенным периодом. При длительности межстимуляционного интервала в 800 мс, последняя вызванная стимуляцией деполяризация сопровождается краткой деполяризацией (ЗПД), которая не достигает порога.
При уменьшении длительности межстимуляционного интервала до 700 мс, ЗПД, которая следовала за последним вызванным стимуляцией сокращением, достигает порога, и в результате наступает не вызванная стимуляцией деполяризация (или экстрасистола). Эта экстрасистола сама сопровождается подпороговым потенциалом последействия. Уменьшение длительности межстимуляционного интервала до 600 мс также вызывает экстрасистолу после последней вызванной стимуляцией деполяризации. Однако потенциал последействия, который следует за экстрасистолой, достигает порога и возникает вторая экстрасистола. Когда шесть вызванных стимуляцией деполяризаций отделены интервалами в 500 мс, вызывает последовательность из трех экстрасистол. Более короткий период стимуляции или немного большие концентрации ацетил-строфантидина вызывают длинную последовательность не вызванных стимуляцией сокращений; такая последовательность напоминает пароксизмальную тахикардию.
ЗПД связаны с повышением внутриклеточной концентрации Ca2+ [Ca2+]in, например, при увеличении концентрации внеклеточного Ca2+и введении токсических количеств гликозидов наперстянки. Повышение концентрации [Ca2+]in вызывает осциллирующий выброс Ca2+ из саркоплазматического ретикулума. Следовательно, в кардиомиоцитах DADs сопровождаются малыми, ритмическими изменениями в развиваемой силе. Высокая [Ca2+]in также активируют некоторые мембранные каналы, которые проводят Na+ и K+. Суммарный поток этих катионов составляет транзиторный входящий ток, Iti, который является, по крайней мере, частично ответственным за следовую деполяризацию мембраны клетки. Повышенная концентрация [Ca2+]in может также активировать электрогенный обменник 3Na+in/Ca2+out. Он также создает суммарный ток катионов внутрь, который вносит вклад в ЗПД.
Наконец, на рис. 6-21 Г показано возникновение триггерной активности, обусловленной появлением ЗПД, вызванных оубаином.
Слайд 43Рис. 6-21. Триггерная активность, вызванная в сердечных клетках ранними постдеполяризациями (РПД), или
Рис. 6-21. Триггерная активность, вызванная в сердечных клетках ранними постдеполяризациями (РПД), или
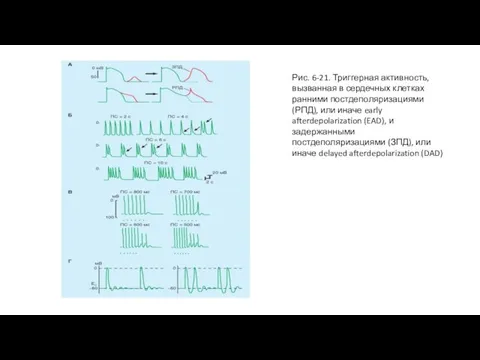
Слайд 44Возможности фармакологического влияния на длительность потенциалов действия кардиомиоцитов
Длительность потенциала действия в основном
Возможности фармакологического влияния на длительность потенциалов действия кардиомиоцитов
Длительность потенциала действия в основном

Длительность потенциалов действия имеет существенное значение для нормальной работы сердца, так как от нее зависят фазы невозбудимости сердечных клеток. В случаях нарушения ритма, когда сокращен эффективный рефрактерный
период, могут возникать дополнительные внеочередные эктопические возбуждения, что снижает эффективность работы сердца как насоса. Для предотвращения подобных явлений в клинике применяют антиаритмические препараты, которые удлиняют потенциал действия, не изменяя остальные его параметры, за счет избирательного снижения калиевого тока задержанного выпрямления. На рис. 6-22 А показано действие антиаритмического препарата - нибентана, который в результате подавления калиевого тока увеличил длительность потенциала действия.
В некоторых случаях необходимо добиться обратного эффекта, а именно сократить длительность потенциалов действия. В этих случаях используют препараты, которые активируют калиевые токи и тем самым укорачивают длительность потенциалов, уменьшая тем самым эффективный рефрактерный период. К таким препаратам относится карбахол. Это м- и н-холиностимулятор, синтетическое производное холина. Он связывается с м- и н-холинорецепторами и возбуждает их, имитируя эффект ацетилхолина. На рис. 6-22 Б наглядно представлен эффект карбахола, выражающийся в значительном укорочении потенциала действия кардиомиоцита предсердия.
Слайд 45Рис. 6-22. Изменение длительности потенциала действия (ДПД) под действием различных веществ.
А -
Рис. 6-22. Изменение длительности потенциала действия (ДПД) под действием различных веществ.
А -

Б - уменьшение ДПД волокна правого предсердия кролика за счет активации выходящего калиевого тока (IKACh) холинергическим агонистом карбахолом. При действии карбахола за счет активации IKACh, происходит также смещение потенциала покоя - гиперполяризация
Слайд 46Фазовые изменения возбудимости во время возбуждения кардиомиоцита
В процессе потенциала действия возбудимость клетки
Фазовые изменения возбудимости во время возбуждения кардиомиоцита
В процессе потенциала действия возбудимость клетки

На рис. 6-23 в верхней части представлен потенциал действия рабочего кардиомиоцита. На уровне потенциала покоя мембрана клетки имеет нормальную возбудимость (принятую условно за 100%). Далее, для того, что бы возбудить клетку требуется пороговый импульс электрического тока, который открывает все Na+-каналы. Начинается фаза деполяризации потенциала действия. В этот период, именно из-за активации всех потенциал-управляемых Na+-каналов, клетку невозможно вторично возбудить. То есть возбудимость сразу же падает до 0%, и начинается поддерживаемая фаза абсолютной рефрактерности. Эта фаза длится до того момента, пока фаза реполяризации потенциала действия не пересечет нулевую линю. Чем ближе реполяризация потенциала действия подходит к уровню потенциала покоя, тем проще вторично вызвать процесс возбуждения мембраны клетки. Все это время мембрана клетка находится в фазе относительной рефрактерности. Наконец, реполяризация пересает потенциал покоя. Если в этой точке мы подадим тестовый импульс, ответом будет полноценный потенциал действия. Следовательно, при возврате к уровню потенциала покоя возбудимость будет вновь нормальной и равной 100%.
Следует отметить, что у рабочего кардиомиоцита фаза относительной рефрактерности начинается позже, чем у других типов клеток, поскольку выход из инактивации Na+-каналов начинается приблизительно с -30 мВ. Разумеется, рисунки представлены схематично.
Слайд 47Рис. 6-23. Фазовые изменения возбудимости (фиолетовая кривая) и их связь с потенциалом
Рис. 6-23. Фазовые изменения возбудимости (фиолетовая кривая) и их связь с потенциалом
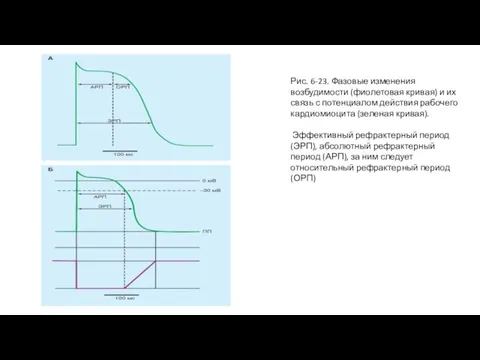
Эффективный рефрактерный период (ЭРП), абсолютный рефрактерный период (АРП), за ним следует относительный рефрактерный период (ОРП)
Слайд 48Механизм электромеханического сопряжения в кардиомиоцитах
Сопряжение возбуждения - сокращения иначе называется электромеханическим сопряжением.
Механизм электромеханического сопряжения в кардиомиоцитах
Сопряжение возбуждения - сокращения иначе называется электромеханическим сопряжением.

Ca2+ существенно важен для сокращения сердца. Удаление Ca2+ из внеклеточной жидкости приводит к уменьшению силы сердечных сокращений и последующей остановке сердца в диастоле. Напротив, увеличение концентрации внеклеточного Ca2+ увеличивает силу сердечных сокращений, и очень высокие концентрации Ca2+ приводят к остановке сердца в систоле. Свободный внутриклеточный Ca2+ является ионом, отвечающим за сократительную способность миокарда.
Волна возбуждения в сердечной мышце быстро распространяется вдоль сарколеммы клеток миокарда от клетки к клетке через щелевые контакты. Возбуждение также распространяется внутрь клеток через поперечные трубки, которые инвагинированы в сердечные волокна на полосах Z (рис. 6-24 Б). Во время плато (фаза 2) потенциала действия повышается проницаемость сарколеммы для Са2+. Са2+ входит в клетку по его электрохимическому градиенту через Са2+-каналы сарколеммы и ее инвагинаций, то есть через мембраны Т-системы.
Считается, что открытие Са2+-каналов происходит в результате фосфорилирования протеинов каналов с помощью циклической аденозинмонофосфат-зависимой протеинкиназы (цАМФ-зависи- мой протеинкиназы). Первоначальным источником внеклеточного Са2+является интерстициальная жидкость (10-3 М Са2+). Некоторое количество Са2+ может также быть связано с сарколеммой и сгликокаликсом, мукополисахаридом, покрывающим сарколемму. Количество Са2+, который попадает внутрь клетки из внеклеточного пространства, недостаточно для того, чтобы вызвать сокращение миофибрилл. Вошедший внутрь Са2+ («запускающий» Са2+) вызывает высвобождение Са2+ из саркоплазматического ретикулума. [Ca2+]in возрастает от уровня покоя примерно в 10-7 М до уровней от 10-6 до 10-5 во время возбуждения. Затем Са2+ связывается с белком тропонином-С. Кальциево-тропониновый комплекс взаимодействует с тропомиозином, чтобы снять блок с активных участков между актиновыми и миозиновыми филаментами. Это снятие блока позволяет образовываться циклическим поперечным связям между актином и миозином и, следовательно, позволяет миофибриллам сокращаться.
Механизмы, которые повышают [Ca2+]in, увеличивают развиваемую силу сердечных сокращений, а механизмы, которые снижают [Ca2+]in, уменьшают ее.
В конце систолы приток Са2+ в клетку прекращается и саркоплазматический ретикулум не получает дальнейшей стимуляции для высвобождения Са2+. Фактически саркоплазматический ретикулум начинает активно поглощать Са2+ благодаря кальциевому насосу, который работает за счет энергии аденозинтрифосфата. Работа этого насоса стимулируется фосфоламбаном в результате фосфорилирования фосфоламбана цАМФ-зависимой протеинкиназой. К тому же фосфорилирование тропонина I подавляет связывание Са2+ тропонином-С. Этот процесс позволяет тропомиозину снова заблокировать участки взаимодействия актиновых и миозиновых нитей, что приводит к расслаблению (диастоле).
И сокращения, и расслабления сердечной мышцы ускоряются катехоламинами и активацией аденилатциклазы. Увеличение цАМФстимулирует цАМФ-зависимую протеинкиназу, которая фосфорилирует кальциевый канал в сарколемме. Эти процессы приводят к тому, что больше Са2+ поступает в клетку, ускоряя, таким образом, сердечные сокращения. Однако эти процессы также ускоряют ирелаксацию путем фосфорилирования фосфоламбана, который увеличивает захват Са2+ саркоплазматическим ретикулумом, и путем фосфорилирования тропонина I, что угнетает связывание Са2+ с тропонином-С. Таким образом, процессы фосфорилирования, вызванные цАМФ-зависимой протеинкиназой, служат для увеличения как скорости сердечных сокращений, так и скорости релаксации.
Митохондрии также поглощают и высвобождают Са2+, но этот процесс протекает слишком медленно, чтобы влиять на нормальный процесс сопряжения возбуждения и сокращения (электромеханическое сопряжение). Лишь при очень высоких уровнях внутриклеточного Са2+ (при патологических состояниях) митохондрии всасывают значительное количество Са2+.
Са2+, поступающий в клетку для инициирования сокращения, должен быть удален во время диастолы. Это удаление из цитозоля осуществляется прежде всего за счет 3Na+/1Са2+-обменника. Также Са2+ удаляется из клетки электрогенным насосом, который использует АТФ для переноса Са2+ через сарколемму.
Слайд 49Рис. 6-24. Электромеханическое сопряжение в сердце.
А - кривая, отражающая процесс сопряжения возбуждения
Рис. 6-24. Электромеханическое сопряжение в сердце.
А - кривая, отражающая процесс сопряжения возбуждения
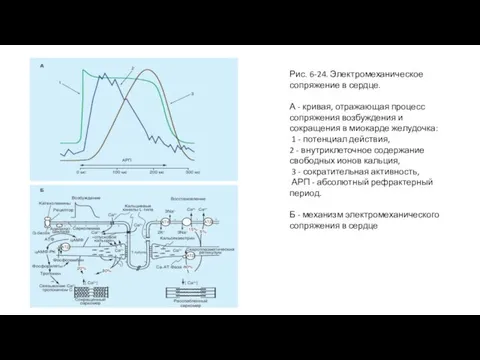
1 - потенциал действия,
2 - внутриклеточное содержание свободных ионов кальция,
3 - сократительная активность,
АРП - абсолютный рефрактерный период.
Б - механизм электромеханического сопряжения в сердце
Слайд 50Механоэлектрическая обратная связь в сердце
Обратный электромеханическому сопряжению процесс носит название механоэлектрическая обратная
Механоэлектрическая обратная связь в сердце
Обратный электромеханическому сопряжению процесс носит название механоэлектрическая обратная

Для оценки механоиндуцированной деполяризации анализу подвергали монофазный потенциал действия на уровне 25, 50 и 90% фазы реполяризации монофазного потенциала (MAPD25, MAPD50, MAPD90). На фоне растяжения сердца МАР демонстрировал увеличение MAPD90, типичный пример которого представлен на рис. 6-25 А. Кроме этого, наблюдали уменьшение MAPD25 и MAPD50. Изменения МАР90 при механической нагрузке наблюдаются как в здоровом сердце, так и в патологических сердцах. Когда механическая нагрузка приводила к тому, что МАР90 достигал порогового потенциала, возникали экстрасистолы. Но метод регистрации монофазного потенциала считается очень неточным, поэтому позднее был применен метод стандартной микроэлектродной техники.
В этих экспериментах было показано, что растяжение полоски правого предсердия здоровых животных до 2 мН вызывало небольшое укорочение APD50, но значительное увеличение APD90 (рис. 6-25 Б). Рисунок демонстрирует влияние длительного растяжения полоски миокарда на потенциал действия на трех различных уровнях фазы реполяризации. Из рисунка следует, что в условиях растяжения ткани APD25 не изменялась, APD50 была укорочена, в то время как APD90 значительно увеличивалась. Увеличение APD90 было следствием развития механоиндуцированной деполяризации (stretch-induced depolarization - SID). В противоположность ранней или задержанной автодеполяризации, SID, которая увеличивала APD90, не запускалась предыдущим потенциалом действия, т.е. SID была результатом растяжения клеток миокарда.
Среди изменений электрических свойств миокарда при его растяжении или изменении силы сокращений по механизму механоэлектрической обратной связи можно схематически выделить следующее: (1) деполяризация мембраны, (2) изменение продолжительности потенциала действия (ПД) /монофазного потенциала действия (МПД) кардиомиоцита, главным образом за счет (3) иного протекания процесса реполяризации на разных ее уровнях, часто проявляющееся в (4) развитии stretch-induced/activated depolarization (SID/SAD) или, механоиндуцированной деполяризации, (5) изменение возбудимости и времени протекания фаз рефрактерности, (6) изменение скорости проведения возбуждения, (7) модуляции сократительной функции сердца. В результате может меняться или частота сердечной деятельности или возникают аритмии.
Слайд 51Рис. 6-25. Механоиндуцированная деполяризация кардиомиоцита.
А - монофазный потенциал действия (МАР) нерастянутого левого
Рис. 6-25. Механоиндуцированная деполяризация кардиомиоцита.
А - монофазный потенциал действия (МАР) нерастянутого левого
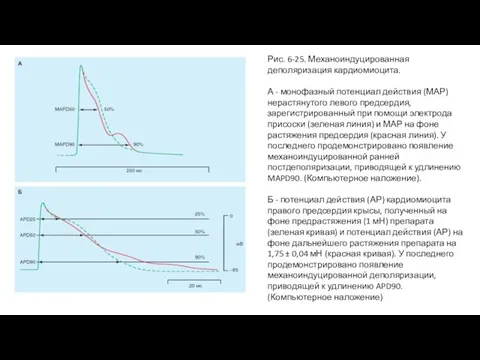
Б - потенциал действия (АР) кардиомиоцита правого предсердия крысы, полученный на фоне предрастяжения (1 мН) препарата (зеленая кривая) и потенциал действия (АР) на фоне дальнейшего растяжения препарата на 1,75 ± 0,04 мН (красная кривая). У последнего продемонстрировано появление механоиндуцированной деполяризации, приводящей к удлинению APD90. (Компьютерное наложение)
Слайд 52Иллюстрации механоиндуцированной деполяризации
Растяжение полоски предсердия здоровых животных вызывает появление механоиндуцированной деполяризации SID
Иллюстрации механоиндуцированной деполяризации
Растяжение полоски предсердия здоровых животных вызывает появление механоиндуцированной деполяризации SID

После инфаркта миокарда в предсердиях обнаруживаются два типа потенциалов действия. Первый тип удлиненных потенциалов действия оказался подобным по величине APD25 и APD50 потенциалам действия контрольной группы, но был значительно удлинен на уровне APD90. Второй тип показывал значительное увеличение в APD25, APD50 и APD90 по сравнению с контролем.
У сердец, имеющих патологию, например как результат предшествующего инфаркта миокарда, значительно меньшее по величине растяжение препарата, по сравнению с препаратами здоровых сердец, вызывало появление SID. Рис. 6-26 Б показывает связь между SID на уровне APD90 и степенью растяжения препарата ткани сердца после инфаркта миокарда. Рис. 6-26 Б1 демонстрирует потенциалы действия, зарегистрированные при стандартном предрастяжении препарата, равном 0,2 мН. Хотя небольшое растяжение препарата в контрольной группе не вызывало SID, тот же самый уровень растяжения у животных после инфаркта миокарда вызывал появление SID (рис. 6-26 Б2). Более того, увеличение растяжения вызывало SID, которая развивалась в дополнительные потенциалы действия (рис. 6-26 Б3). В этом случае экстра потенциалы имели уменьшенную амплитуду потенциала действия, как это и ожидается при частично деполяризованной мембране. Необходимо подчеркнуть, что наблюдаемые изменения потенциалов в группе животных с патологиями сердца наступали при значительно меньшей степени растяжения препарата по сравнению с контролем (примерно в 10 раз). Возвращение к исходной длине препарата демонстрировало полное исчезновение этих механозависимых изменений (рис. 6-26 Б4).
Слайд 53Рис. 6-26. Механоиндуцированная деполяризация в здоровом сердце и после инфаркта миокарда.
А -
Рис. 6-26. Механоиндуцированная деполяризация в здоровом сердце и после инфаркта миокарда.
А -

На (А) и (Б) символы () показывают моменты растяжения препарата, а символы () - моменты возвращения величины растяжения препарата к исходному уровню. AF - active force, RF - resting force, Em - величина потенциала покоя, AP - потенциал действия
Слайд 54Влияние растяжения на возникновение механоиндуцированной деполяризации
На рис. 6-27 А, Б представлена динамика
Влияние растяжения на возникновение механоиндуцированной деполяризации
На рис. 6-27 А, Б представлена динамика

SID, которая появляется на уровне APD90, соответствует поздней фазе реполяризации, где инактивация потенциал-управляемых Na+-каналов уже исчезла. Сравнительно большие различия между мембранным потенциалом, принадлежащим APD90 и равновесным потенциалом для механосенситивных токов, могут способствовать генерации развития эффективной движущей силы для токов, входящих через МСК и, соответственно, способствовать развитию SID. SID на уровне APD90 может деполяризовать мембрану до уровня порога вследствие активации быстрых Na+-токов и приводить к генерации дополнительных потенциалов действия
Слайд 55Рис. 6-27. Динамика преобразования механоиндуцированной деполяризации в потенциал действия (АР) при различных
Рис. 6-27. Динамика преобразования механоиндуцированной деполяризации в потенциал действия (АР) при различных
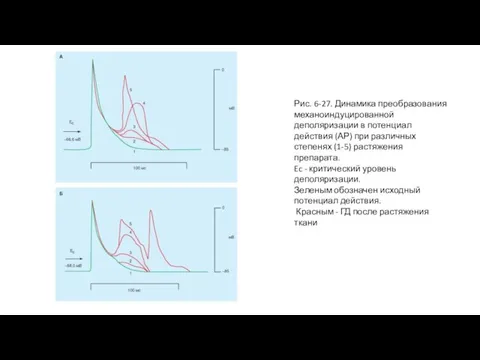
Ec - критический уровень деполяризации.
Зеленым обозначен исходный потенциал действия.
Красным - ГД после растяжения ткани
Слайд 56Влияние растяжения мембраны на потенциалы покоя и действия
В нормальном растворе Тироде с
Влияние растяжения мембраны на потенциалы покоя и действия
В нормальном растворе Тироде с

При тех же экспериментальных условиях при компьютерной регистрации изолированные кардиомиоциты здорового желудочка морской свинки отвечают на растяжение изменением величины потенциала покоя и длительности потенциала действия. Растяжение на 2 мкм и 4 мкм не меняет величину потенциала покоя и форму ПД кардиомиоцитов. Растяжение на 6 мкм деполяризует покоящуюся мембрану в среднем на 3 мВ (рис. 6-28 В), а растяжение на 8 мкм деполяризует в среднем на 6 мВ (рис. 6-28 Г). Растяжение на 8 мкм удлиняют средние значения APD90 от 360 мс до 502 мс. Кроме того, растяжение на 8 мкм и, далее на 10 мкм запускает экстра-ПД, которые начинаются от диастолической деполяризации.
Слайд 57Рис. 6-28. Растяжение изолированного кардиомиоцита левого желудочка при исследовании методом patchclamp в
Рис. 6-28. Растяжение изолированного кардиомиоцита левого желудочка при исследовании методом patchclamp в
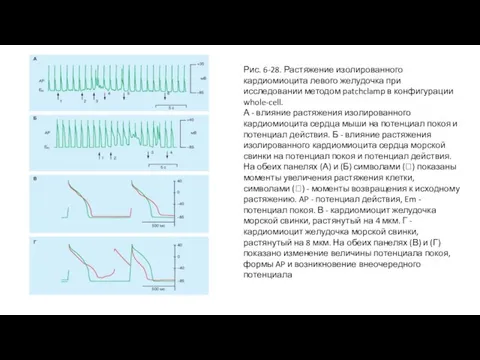
А - влияние растяжения изолированного кардиомиоцита сердца мыши на потенциал покоя и потенциал действия. Б - влияние растяжения изолированного кардиомиоцита сердца морской свинки на потенциал покоя и потенциал действия. На обеих панелях (А) и (Б) символами () показаны моменты увеличения растяжения клетки, символами () - моменты возвращения к исходному растяжению. AP - потенциал действия, Em - потенциал покоя. В - кардиомиоцит желудочка морской свинки, растянутый на 4 мкм. Г - кардиомиоцит желудочка морской свинки, растянутый на 8 мкм. На обеих панелях (В) и (Г) показано изменение величины потенциала покоя, формы AP и возникновение внеочередного потенциала
Слайд 58Характеристика механоуправляемых токов
Влияние растяжения на временной курс базового мембранного тока в реальных
Характеристика механоуправляемых токов
Влияние растяжения на временной курс базового мембранного тока в реальных

Растяжение на 12 мкм меняет holding current от +0,15 нА (начало зеленой кривой - C на рис. 6-29 А1) до -0,65 нА (начало красной кривой - S на рис. 6-29 А1). Это свидетельствует, что растяжение индуцирует входящий ток, причем этот входящий ток равен -0,80 нА при -45 мВ. Этот ток представлен в виде дифференциальной кривой, отражающей разность между кривыми C и S (фиолетовая кривая - D на рис. 6-29 А1) и представляет собой истинный ток, текущий через МСК при растяжении кардиомиоцита. В течение ступеньки до 0 мВ растяжение смещает ток (т.е. ток, регистрируемый в конце ступеньки) от 0,30 нА (синяя кривая - С на рис. 6-29 А1) до 0,50 нА (красная кривая - S на рис. 6-29 А). Таким образом, механоиндуцированный дифференциальный ток равен +0,20 нА (рис. 6-29 А1, кривая D). Из рисунка следует, что растяжение клетки резко уменьшает ток Ca2+ через L-тип каналы (ICa-L), возникающий на фоне ступеньки до 0 мВ. Это связано с увеличением внутриклеточной концентрации ионов Ca2+ на фоне растяжения и, следовательно, снижения концентрационного градиента для ионов Ca2+.
Аналогичным образом можно проанализировать рис. 6-29 А2, где смещение поддерживаемого потенциала проходило от -45 до -80 мВ.
Результаты экспериментов были представлены как вольт-амперные характеристики (I-V кривые). Поскольку из внешней и внутренней среды не устранялся калий (Kin/Kout) интерпретация I-V кривых достаточно сложна и специфична. До растяжения клетки I-V кривая имела N-форму (рис. 6-29 Б1). В точке пересечения I-V кривой с осью потенциала ток равен нулю, и эта точка эквивалентна диастолическому мембранному потенциалу (V0), который обычно измеряется методом фиксации тока (примерно V0 = -80 - -85 мВ). В точке пересечения кривой с осью потенциала, т.е. при калиевом равновесном потенциале IK1 равен нулю. Поэтому отрицательный механоиндуцированный ток I (EK) может быть интерпретирован как механоиндуцированный катион-неселективный ток Ins в разное время названный как ISAC (stretch-activeted current)или IMGC (mechanically gated current). Горб на I-V кривой на уровне -60 мВ приписывается inwardly rectifying K+-current IK1. При V, более отрицательных, чем -20 мВ вклад в I-V кривую вносят ∆GK1 и катион-неселективная ∆Gns, определяемая работой MGCs. При V, более положительных, чем - 20 мВ механосенситивные токи переносятся ионами K+ через TRPC6 - outwardly rectifying channels и TREK1 (K2P2,1) и TREK2 (K2P10,1) - leak channels.
Растяжение смещает I-V кривую вниз, уменьшает или устраняет пик IK1 и деполяризует V0. Модуляция растяжением вольт-амперной характеристики клетки приведена на рис. 6-29 Б1. До растяжения (синие треугольники, объединенные кривой), кривая имела типичную N-образную форму и пересала ось потенциала при V0 = -76 мВ, что соответствует диастолическому мембранному потенциалу в условиях типичных растворов внешней и внутренней среды. Растяжение клетки на 6 мкм смещает величину токов в более негативную область, а мембранный потенциал до -70 мВ, т.е. в более позитивную область (зеленые треугольники, объединенные кривой). Растяжение до 10 мкм смещает вольт-амперную характеристику клетки при негативных потенциалах еще в большую отрицательную область (красные кружечки, объединенные кривой) и деполяризует мембрану до -35 мВ. Значительное растяжение в 12 мкм практически устраняет N-образную форму вольт-амперной характеристики увеличивая входящий ток в негативной области и деполяризуя мембранный потенциал до -20 мВ (коричневые квадраты, объединенные кривой).
Таким образом, и на клетках предсердий, и на клетках желудочков выявляется базовый мембранный IMGC, который увеличивался при увеличении степени прямого растяжения клетки (рис. 6-29 Б2) и уменьшался вплоть до полного исчезновения при снятии растяжения с клетки.
Слайд 59Рис. 6-29. Вольтамперные характеристики механочувствительных ионных токов (К+ токи не заблокированы).
А -
Рис. 6-29. Вольтамперные характеристики механочувствительных ионных токов (К+ токи не заблокированы).
А -

Б1 - вольтамперная характеристика позднего тока (измеренного в конце импульса) до растяжения (пустые треугольники) и после растяжения на 6 мкм (заполненные треугольники), 10 мкм (заполненные кружочки) или 12 мкм (заполненные квадраты).
Б2 - дифференциальные токи, активируемые при растяжении на 10 мкм (заполненные кружочки, Erev= 5 мВ) и 12 мкм (заполненные квадраты, Erev = 0 мВ)
Слайд 60Характеристика механоуправляемых токов в кардиомиоцитах сердца после инфаркта
Дальнейшие исследования были посвящены разделению
Характеристика механоуправляемых токов в кардиомиоцитах сердца после инфаркта
Дальнейшие исследования были посвящены разделению

Рис. 6-30 A1, A2, A3 демонстрируют модуляцию растяжением мембранных токов в течение 140 мс импульса от -45 мВ до -30 мВ, до -20 мВ и до 0 мВ. На рис. 6-30 Б сравниваются IV-кривые мембранных токов до растяжения (пустые символы) с мембранными токами на фоне растяжения (заполненные символы). Растяжение клетки уменьшает ICa-L ток (кружки). Более важно, что поздние токи, измеренные в конце 140 мс импульса (IL, отмеченные треугольниками), были выражено изменены на фоне растяжения клетки. В этих условиях растяжение кардиомиоцитов человека на 4 мкм вызывало поздний дифференциальный ток, который выражался как линейная IV-кривая и пересал V-ось координат при потенциале реверсии -16 мВ (-11±5 мВ) (рис. 6-30 В).
У кардиомиоцитов желудочков крыс, морских свинок и человека ISAC во всех случаях был блокирован введением в перфузионный раствор 5 мкмоль Gd3+. На рис. 6-30 Г представлены типичные примеры изменения I-V кривой кардиомиоцита человека при его растяжении (заполненные символы) и при последующем добавлении на фоне растяжения в омывающий клетку раствор 5 мкмоль Gd3+ (пустые символы). На фоне растяжения поздние токи, измеренные в отсутствии и присутствии Gd3+ пересались при Еrev = -1±4 мВ. Линейная I-V зависимость, Еrev = -11 мВ и Gd3+ чувствительность предполагают, что ISAC - это ток, который течет через неселективные катионные механо-сенситивные каналы.
Слайд 61Рис. 6-30. Активация растяжением Gd3+-чувствительного неселективного катионного тока при растяжении на 4
Рис. 6-30. Активация растяжением Gd3+-чувствительного неселективного катионного тока при растяжении на 4

А - модуляция растяжением мембранных токов на фоне ступеньки импульсного тока длительностью 140 мс от поддерживаемого потенциала -45 мВ до -30 мВ (А1), до -20 мВ (А2) и до 0 мВ (A3). Б - I-V кривые поздних токов, измеренных в конце 140 мс импульса (IL - отмечены треугольниками), и I-V кривые, характеризующие работу L-типа Ca2+ каналов (ICa-L - отмечены кружочками). I-V кривые мембранных токов до растяжения отмечены пустыми символами, а на фоне растяжения клетки на 4 мкм - заполненными символами.
В - растяжение клетки индуцирует дифференциальный ток, характеризующийся линейной I-V кривой и потенциалом реверсии (Erev), равным -16 мВ. Г - механоиндуцированный поздний (треугольники) и входящий ICa-L ток (кружочки) до (заполненный) и после (пустые) добавления в перфузионный раствор 5 мкмоль гадолиния. Примечание: гадолиний, как это и должно быть, ингибирует входящий ICa-L
Слайд 62Суммарный механоуправляемый ток при различных величинах растяжения клетки
У изолированных кардиомиоцитов потенциал фиксировали
Суммарный механоуправляемый ток при различных величинах растяжения клетки
У изолированных кардиомиоцитов потенциал фиксировали

На рис. 6-31 А, Б, В, Г показано, что растяжение клетки здорового сердца на 6 мкм вызывало появление входящего через МСК тока величиной 0.16 нА и дальнейшее увеличение растяжения до 8 мкм, 10 мкм, 12 мкм вызывало увеличение этого тока до 0.48 нА, 0.80 нА, 1.44 нА, соответственно. Растяжение клеток здорового сердца на 2 мкм и 4 мкм не приводило к какой либо реакции со стороны МСК. (Растяжение клетки от исходного уровня до конечных значений длилось очень быстро и определялось только скоростью движения микроманипулятора). У растянутой до определенного значения клетки, ISAC был постоянным в течение нескольких минут регистрации, т.е. инактивация или адаптация не наблюдалась (рис. 6-31 Д). Отсутствие инактивации МСК в течение длительного растяжения было и у кардиомиоцитов, полученных от больных сердец.
Слайд 63Рис. 6-31. При растяжении активируется суммарный входящий ток, который пропорционален величине растяжения
Рис. 6-31. При растяжении активируется суммарный входящий ток, который пропорционален величине растяжения

A-Г - амплитуда входящего тока увеличивается с увеличением степени растяжения.
Д - при растяжении входящий ток в течение 10 мин остается постоянным (не инактивируется). После того как растяжение убирают, амплитуда тока возвращается к исходному значению. При растяжении на 2 и 4 мкм амплитуда тока не изменялась (не показано)
Слайд 64Зависимость механочувствительности кардиомиоцитов от возраста животного или человека и патологии сердца
Как было
Зависимость механочувствительности кардиомиоцитов от возраста животного или человека и патологии сердца
Как было

Для сравнения, у кардиомиоцитов молодых и здоровых морских свинок ISAC вообще не возникал при растяжении на 2 мкм и 4 мкм. При дальнейшем увеличении степени растяжения ISAC реагировали у всех исследуемых клеток. На растяжение величиной 6 мкм клетки отвечали возникновением ISAC величиной до -300 пA, при растяжении на 8 мкм ISAC был равен около -557 пА, а при растяжении на 10 мкм ISAC был равен в среднем -1050 пA (рис. 6-32 Б).
Таким образом, кардиомиоциты больных людей имеют несравнимо большую чувствительность к растяжению, чем кардиомиоциты здоровых морских свинок. Высокая чувствительность к растяжению клеток больных людей может быть объяснена за счет гипертрофии, которая возникает в течение заболевания и экспрессии SAC.
Чтобы проверить связана ли чувствительность кардиомиоцитов к растяжению с вентрикулярной гипертрофией изучали эффект растяжения клеток, полученных от здоровых молодых крыс, здоровых старых крыс и также от старых спонтанно гипертензивных животных (рис. 6-32 В). У гипертензивных крыс не было симптомов сердечной недостаточности, однако их сердца были гипертрофированны. Растяжение кардиомиоцитов желудочков молодых крыс (3 мес) на 2 и 4 мкм не приводило к появлению ISAC. При дальнейшем увеличении степени растяжения клетки ISAC регистрировали у всех исследованных клеток. Так, растяжение кардиомиоцита на 8 мкм индуцирует входящий ток величиной примерно равной - 269 пА (при поддерживаемом потенциале -45 мВ). Аналогичное растяжение на 8 мкм кардиомиоцитов желудочков здоровых старых крыс (15 месяцев) вызывает значительно больший ISAC, равный около -460 пA. А растяжение кардиомиоцитов желудочков старых крыс (15 мес) со спонтанной гипертензией вызывает ISAC, среднее значение которого равно -420 пА уже при растяжении клетки на 2 мкм. У этих же животных растяжение клеток на 4 мкм вызывало ISAC, равный -1205 пА, а на 6 мкм ISAC, равный -1500 пА.
Графики зависимости величины ISAC от степени растяжения у здоровых и больных крыс представлены на рис. 6-32 Г, а у человека на рис. 6-32 Д.
Рис. 6-32 Г демонстрирует зависимость величины ISAC (пА) от величины растяжения клетки (мкм). Показана реакция кардиомиоцитов желудочка сердца здоровой крысы возрастом 3 мес, здоровой крысы возрастом 15 мес, гипертензивной крысы возрастом 15 мес. На рис. 6-32 Д показана зависимость величины ISAC (пА) от величины растяжения клетки (мкм). Показана реакция кардиомиоцитов желудочка сердца здорового молодого человека, и кардиомиоцитов желудочков и предсердий старого человека после инфаркта миокарда.
Эти изменения являются важнейшими физиологическими данными и показывают, что чувствительность клеток к растяжению увеличивается с гипертрофией, которая развивается в течение возраста, но сильнее с гипертензией. Чувствительность к растяжению, определенная для клеток больных человеческих сердец, была сходной с величиной, полученной у кардиомиоцитов от спонтанно гипертензивных старых крыс. В целом, результаты демонстрируют, что чувствительность кардиомиоцитов к растяжению увеличивается с возрастом и крайне высока при гипертрофии сердца.
Слайд 65Рис. 6-32. Оригинальные кривые токов, зарегистрированных до растяжения и при растяжении кардиомиоцитов.
Рис. 6-32. Оригинальные кривые токов, зарегистрированных до растяжения и при растяжении кардиомиоцитов.

А - кардиомиоциты желудочка человека после инфаркта миокарда.
Б - кардиомиоциты желудочка морской свинки возрастом 3 мес.
В - кардиомиоциты желудочка сердца здоровой крысы. В возрасте 3 мес (верхняя кривая), здоровая крыса в возрасте 15 мес (средняя кривая), гипертензивная крыса в возрасте 15 мес (нижняя кривая). Примечание к обозначениям: на каждой кривой растяжение клетки с указанием степени растяжения показано линией сверху.
Графики зависимости величины ISAC от степени растяжения у здоровых и больных крыс представлены на панели (Г), а у человека на панели (Д)
Слайд 66Механоуправляемые каналы кардиомиоцитов
Впервые SAC были выявлены и описаны в экспериментах с использованием
Механоуправляемые каналы кардиомиоцитов
Впервые SAC были выявлены и описаны в экспериментах с использованием

Казалось бы, что изучение одиночных каналов, реагирующих на механическое воздействие, отвечает на все вопросы, связанные с работой SAC в клетке. Однако это не так. Приложение положительного или отрицательного давления в пипетку вызывает не физиологическое растяжение мембраны, а ее деформацию в ту или иную сторону на локальном участке мембраны. Кроме того, не ясно, может ли открытие такого количества каналов (штук на диаметр пипетки) в пересчете на размер клетки, вызвать выраженную деполяризацию и возникновение AP. Хотя косвенно, используя методы математического моделирования, это возможно рассчитать.
Рис. 6-33 А2 (увеличенный фрагмент регистрации) демонстрирует активацию SAC с проводимостью 21 пС при регистрации методом patch-clamp в конфигурации cell-attached от свежеизолированных вентрикулярных клеток эмбриона цыпленка. Разумеется, что речь идет не о прямом растяжении клетки, а о деформации клеточной мембраны под пипеткой отрицательным давлением -25 мм рт.ст. в пипетке.
Используя метод patch-clamp в конфигурации cell-attached в 1988 году Craelius и соавт впервые зарегистрировали SAC у вентрикулярных миоцитов неонатальных крыс, которые открывались в ответ на отрицательное давление от -1 до -6 см рт.ст. (рис. 6-33 Б). Эти каналы имели проводимость 120 пС в изотоническом растворе KCl и средний реверсный потенциал 31 мВ, деполяризованный от потенциала покоя. Каналы не требовавали внешнего Са2+ для активации и были сравнительно неселективны для катионов.
В дальнейших исследованиях на этой же модели и аналогичным методом деформации мембраны под пипеткой в конфигурации cell-attached приложение отрицательного давления запускало возникновение AP, которые зарегистрировали как «токи действия». Была изучена временная корреляция между возможностью открытия SAC и токами действия. На основе этих данных авторы предположили, что ток через небольшое число SAC достаточен (0,2 пС в течение 50 мс) чтобы запустить AP в кардиомиоцитах. Эти результаты свидетельствуют о том, что пассивное механическое растяжение миокарда может быть аритмогенным.
Слайд 67Рис. 6-33. Механосенситивные ионные каналы сердца.
А - активируемые растяжением ионные каналы клеток
Рис. 6-33. Механосенситивные ионные каналы сердца.
А - активируемые растяжением ионные каналы клеток
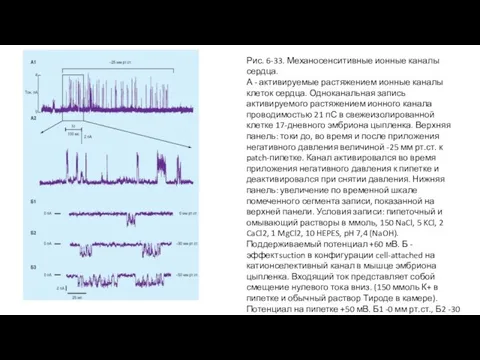
Слайд 68Электрокардиография
Процесс возбуждения сердца сопровождается возникновением в его тканях разности потенциалов, закономерно изменяющихся
Электрокардиография
Процесс возбуждения сердца сопровождается возникновением в его тканях разности потенциалов, закономерно изменяющихся

В общих чертах кривая ЭКГ состоит из волн: P, QRS, и T (рис. 6-34 Б, В). Интервал P-Q - это промежуток времени от начала активации предсердий до начала активации желудочков, он обычно колеблется в пределах от 0,12 до 0,20 с. Значительная часть этого времени включает прохождение импульса через AV-узел (Патологическое удлинение интервала P-Q связано с нарушениями проведения черезAV-узел, которое может быть вызвано воспалительными процессами, патологией сосудов, фармакологическими веществами или влиянием нервной системы).
Конфигурация и амплитуда QRS комплекса варьирует в значительной мере у разных индивидуумов. Продолжительность обычно составляет 0,06-0,10 с. Аномально удлиненный QRS комплекс может указывать на блокаду в проводящей системе желудочков (типа блокады правой
или левой ножек пучка). В течение ST-сегмента весь миокард желудочков деполяризован. Поэтому, ST-сегмент обычно находится наизоэлектрической линии. (Любое заметное отклонение ST-сегмента от изоэлектрической линии может указывать на ишемическое повреждение миокарда). Интервал Q-T иногда рассматривается как период «электрической систолы» желудочков; интервал Q-T тесно коррелирует со средней продолжительностью потенциала действия кардиомиоцитов желудочков. Интервал Q-T имеет продолжительность около 0.4 сунд, и он изменяется обратно пропорционально частоте сердечных сокращений главным образом потому, что продолжительность потенциала действия кардиомиоцитов изменяется пропорционально частоте сердечных сокращений.
В большинстве отведений, T-волна отклоняется в том же самом направлении от изоэлектрической линии, как и большинство компонентов QRS комплекса, хотя бифазные или направленные в противоположную сторону T-волны являются совершенно нормальным явлением в некоторых отведениях. Отклонение в одном направлении от изоэлектрической линии T-волны и QRSкомплекса указывает на то, что процесс реполяризации развивается в противоположном направлении. (T-волны, которые являются атипичными по направлению или по амплитуде, могут указывать на повреждение миокарда, нарушения электролитного баланса или на гипертрофию сердца).
ЭКГ позволяет сделать заключение о пути распространения волны возбуждения в сердце, регистрируя изменения электрического потенциала от различных участков поверхности тела. Анализируя детали этих флуктуаций электрического потенциала, можно получить важные сведения об: (1) анатомической ориентации сердца; (2) относительных размерах камер; (3) различных нарушениях ритма и проведения; (4) степени, местоположении и прогрессе ишемического повреждения миокарда; (5) эффектах измененных концентраций электролита; и (6) влиянии определенных препаратов (особенно наперстянки, антиаритмических средств, и антагонистов Ca2+-каналов).
Слайд 69Рис. 6-34. Электрокардиография.
А - потенциалы действия, характерные для основных частей сердца, и
Рис. 6-34. Электрокардиография.
А - потенциалы действия, характерные для основных частей сердца, и
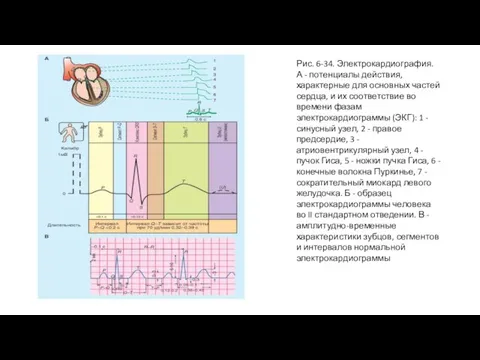
Слайд 70Стандартные и грудные отведения ЭКГ
Отведение в электрокардиографии - это электрическое соединение кожной
Стандартные и грудные отведения ЭКГ
Отведение в электрокардиографии - это электрическое соединение кожной

Следует подчеркнуть, что ЭКГ отражает именно процесс возбуждения в сердце, а не сокращения его структур. Эти два процесса в известной мере разделены во времени, так как второй является следствием первого. При определенных экспериментальных условиях (например, при перфузии сердца бескальциевым раствором) сократительный акт можно устранить, однако при этом продолжает регистрироваться нормальная ЭКГ, отражающая процесс распространения возбуждения.
Амплитуда и направленность зубцов ЭКГ зависят от ряда факторов, таких как расстояние электродов от сердца, степени электропроводности ткани между электродами и сердцем, а также величиной вектора ЭДС и соотношение с осью отведений. (Ось отведения - воображаемая линия между электродами, расположенными на кожной поверхности конечностей и соединенными с прибором для регистрации). Поэтому, для того чтобы можно было сравнивать ЭКГ между собой, необходимо стандартизировать методы их регистрации. С этой целью отводящие электроды накладываются на строго определенные участки тела - в зависимости от этого говорят о том или ином способе отведения.
Основными способами являются отведения от конечностей, или стандартные отведения, усиленные отведения и однополюсные отведения от грудной клетки. Стандартные отведения приняты как обязательный метод, так как они регистрируют колебания потенциалов во фронтальной плоскости от больших поверхностей сердца.
Определенные международные соглашения диктуют способ, которым эти стандартные отведения от конечностей связаны с гальванометром электрокардиографа (рис. 6-35 А). Отведение I регистрирует разность потенциалов между левой (LA) и правой (RA)руками. Соединения гальванометра устроены таким образом, что когда потенциал в LA (VLA) превышает потенциал в RA (VRA), пищик гальванометра отклоняется вверх от изоэлектрической линии. На рис. 6-35 А и Б, это расположение соединений гальванометра для отведения I обозначено (+) в LA и (-) в RA. Отведение II регистрирует разность потенциалов между RA и LL (левая нога), и пищик отклоняется вверх, когда VLL превышает VRA. Наконец, отведение III регистрирует разность потенциалов между LA и LL, и пищик отклоняется вверх, когда VLL превышает VRA. Эти соединения гальванометра были произвольно выбраны так, чтобы QRS-комплексы были направлены вверх во всех трех стандартных отведениях от конечностей у большинства нормальных индивидуумов.
В дополнение к стандартным отведениям от конечностей: I, II, и III. проводят регистрацию также и от грудных отведений, чтобы определить проекции вектора сердца на сагиттальных и поперечных плоскостях тела. Эти грудные отведения регистрируют от шести выбранных точек на передней и латеральной поверхностях груди около сердца.
Слайд 71Рис. 6-35. Расположение электродов на поверхности тела для записи стандартных (I, II
Рис. 6-35. Расположение электродов на поверхности тела для записи стандартных (I, II
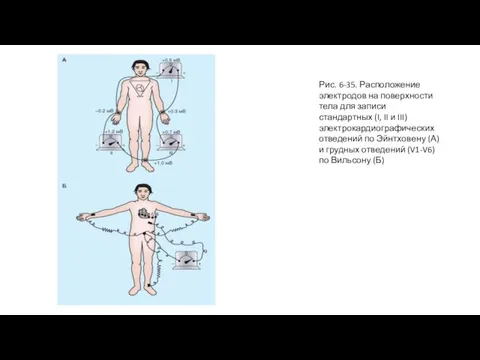
Слайд 72Основные виды электрокардиографических отведений
Регистрация временных изменений разности потенциалов между двумя точками на
Основные виды электрокардиографических отведений
Регистрация временных изменений разности потенциалов между двумя точками на

Разность потенциалов правой и левой руки обозначается как I отведение, разность потенциалов правой руки и левой ноги - как II отведение, разность потенциалов левой руки и левой ноги - как III отведение ЭКГ (рис. 6-36).
При грудных отведениях (рис. 6-36) один из электродов накладывают на определенную точку грудной клетки, а второй электрод представляет объединенный электрод от конечностей, поскольку электроды от правой, левой рук и от левой нижней конечности соединяют в приборе через сопротивление. В результате этого регистрируется разность потенциалов между активным электродом, расположенным на грудной клетке, и объединенным «нулевым» электродом от конечностей. Электрод, расположенный на грудной клетке, является активным (так называемым дифферентным электродом). В связи с тем что активный электрод располагается в непосредственной близости от сердца, колебания потенциала под ним значительно превышают колебания потенциала под вторым, удаленным сердца электродом (так называемым индифферентным электродом). Колебания потенциала, возникающие под индифферентным электродом, условно считают близкими к нулю. При этом форма ЭКГ в основном определяется локализацией активного электрода, расположенного на грудной клетке. Даже незначительные смещения этого электрода существенно изменяют форму ЭКГ в связи с тем, что при этом происходит дифференцированная регистрация колебаний потенциалов от локальных участков миокарда, расположенных непосредственно под данным электродом.
Используют шесть позиций грудных электродов: V1 - четвертое межреберье справа от грудины, V2 - четвертое межреберье слева от грудины, V3 - на равном расстоянии от левого края грудины и среднеключичной линии, на линии, соединяющей положение 2-й и 4-й позиций, V4 - пятое межреберье по средней ключичной линии, V5 - пятое межреберье по левой передней подмышечной линии, V6 - пятое межреберье. V1 и V2 отражают активность правого желудочка, V5 и V6 - активность левого желудочка, причем самых близких к электроду участков сердца. В клинике и в физиологических экспериментах помимо указанных выше отведений используется целый ряд других способов регистрации ЭКГ: униполярные отведения от конечностей и грудной клетки, пищеводные отведения (активный электрод локализуется в пищеводе в области расположения тех или иных отделов сердца), внутриполостные отведения (в качестве активного электрода служит электрод-катетер, который вводится через яремную вену в полость сердца) и др.
Амплитуда и длительность зубцов, а также величина интервалов ЭКГ закономерно меняются при различных физических и физиологических воздействиях на сердце - при физической нагрузке, изменении положения тела и др. Эти изменения могут быть обусловлены, с одной стороны, чисто физическими явлениями, например изменением положения сердца в грудной клетке при дыхании, при перемене позы, изменением электропроводности тканей между сердцем и отводящими электродами при дыхании. С другой стороны, они могут быть обусловлены и физиологическими причинами: изменением венозного притока, рефлекторными влияниями на работу сердца и на скорость проведения в нем.
Таким образом, при нормальном функционировании сердца форма ЭКГ может варьировать в определенных пределах. В связи с этим непременным условием правильного толкования ЭКГ при различных видах сердечной патологии является умение распознавать нормальную электрокардиографическую кривую во всех ее разновидностях.
Слайд 73Рис. 6-36. Основные виды электрокардиографических отведений.
А - стандартные двухполюсные отведения от конечностей:
Рис. 6-36. Основные виды электрокардиографических отведений.
А - стандартные двухполюсные отведения от конечностей:

Слайд 74Принцип формирования электрокардиограммы
Хотя первые попытки создания теории, объясняющей механизм формирования ЭКГ, были
Принцип формирования электрокардиограммы
Хотя первые попытки создания теории, объясняющей механизм формирования ЭКГ, были

Дополнительные трудности возникают также в связи с тем, что отводящие электроды регистрируют активность участков, расположенных как непосредственно под электродом, так и вдали от него. Количественные соотношения ЭДС прилежащих и удаленных участков неизвестны для любого положения отводящего электрода. Все названные выше факторы не поддаются количественной оценке и затрудняют создание полного представления о механизме генерации ЭКГ. Тем не менее основные моменты формирования ЭКГ могут быть объяснены в рамках существующих в настоящее время теорий, гипотез, моделей.
Одной из основных теорий, на основе которой в настоящее время ведется векторный анализ ЭКГ
и строят математические модели генераторов сердца, является дипольная теория. Дипольная теория и ее различные модификации исходят из представлений о том, что граница между возбужденными и невозбужденными участками миокарда представляет собой линию, вдоль которой как бы выстроен двойной слой электрических зарядов - диполей. На протяжении сердечного цикла двойной слой непрерывно перемещается, изменяет свою конфигурацию и в некоторые моменты может состоять из нескольких фрагментов (рис. 6-37 А). Совокупность этих диполей можно представить в виде одного суммарного диполя, отражающего ЭДС сердца. Величина и ориентация в пространстве суммарного диполя в каждый момент сердечного цикла непрерывно меняются, т.е. ЭДС сердца является векторной величиной. В проводящей среде, окружающей суммарный диполь, будет возникать переменное электрическое поле (рис. 6-37 Б, В). Потенциал любой точки этого поля в каждый конкретный момент времени определяется законами электрического поля.
При этом потенциал точек, расположенных ближе к положительному полюсу, положителен, а точек, расположенных ближе к отрицательному полюсу, отрицателен. Если точка одинаково удалена от обоих полюсов, то ее потенциал равен нулю.
На рис. 6-37 Г показана разность потенциалов электрического поля. На поверхности груди она формируется вследствие распространения деполяризации по миокарду желудочков.
Основные представления дипольной теории используются в настоящее время для интерпретации клинического материала и для построения различных биофизических моделей генераторов ЭДС сердца. Эти модели имеют своей целью уточнить представления о генезе ЭКГ, но ввиду их сложности имеют пока лишь специальный теоретический интерес и в практической электрокардиографии используются мало.
Слайд 75Рис. 6-37. Принцип формирования электрокардиограммы.
А - последовательные изменения направления и величины ЭДС
Рис. 6-37. Принцип формирования электрокардиограммы.
А - последовательные изменения направления и величины ЭДС
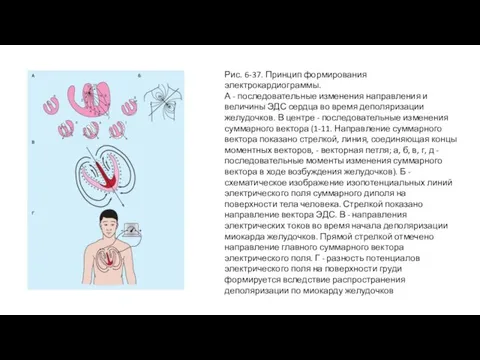
Слайд 76Результирующий вектор сердца
Суммарный вектор всей электрической деятельности сердца в любой момент времени
Результирующий вектор сердца
Суммарный вектор всей электрической деятельности сердца в любой момент времени

Определенные международные соглашения диктуют способ, которым эти стандартные отведения от конечностей связаны с гальванометром электрокардиографа. Отведение I регистрирует разность потенциалов между левой (LA) и правой (RA) рукой. На рис. 6-38 Б это расположение соединений гальванометра для отведения I обозначено (+) в LA и (-) в RA. Отведение II регистрирует разность потенциалов между RA и LL (левая нога). Наконец, отведение III регистрирует разность потенциалов между LA и LL.
Допустим, что фронтальная проекция результирующего вектора сердца в некоторый момент времени представлена стрелкой (хвост - негативен, острие стрелки - позитивно), как это изображено на рис. 6-38 А. Разность потенциалов, VLA-VRA, зарегистрированная в отведении I, представлена компонентой проекции вектора на горизонтальной линии между LA и RA, также показанной на рис. 6-38 А. Если вектор составляет угол θ в 60° с горизонтальной линией (как на рис. 6-38 Б1), величина потенциала, зарегистрированного в отведении I, равняется векторной величине умноженной на косинус 60°. Отклонение, зарегистрированное в отведении I, направлено вверх, потому что позитивный конец стрелки лежит ближе к LA, чем к RA. Отклонение в отведении II также направлено вверх, потому что конец стрелки лежит ближе к LL, чем к RA. Величина отклонения в отведении II больше чем в отведении I, потому что величина проекции в отведении II превышает таковую в I отведении. Точно так же в отведении III: отклонение направлено вверх и его величина такая же, как в отведении I.
Если вектор на рис. 6-38 Б1 является результатом электрических событий, которые происходят в течение пика QRS-комплекса, то говорят, что ориентация этого вектора, представляет главную электрическую ось сердца во фронтальной плоскости. В качестве положительного направления этой оси принято вращение по часовой стрелке от горизонтальной плоскости (вопреки соглашению принятому в математике). У нормальных индивидуумов, среднее значение электрической оси составляет приблизительно + 60° (как на рис. 6-38 Б1).
Отклонения главной электрической оси могут происходить, если анатомическое положение сердца изменено, или при некоторых сердечно-сосудистых нарушениях, которые меняют относительную массу правого и левого желудочка. Например, ось имеет тенденцию смещения влево (более горизонтально) у коренастых людей небольшого роста и вправо (более вертикально) у высоких, худых людей. Также, при левой или правой желудочковой гипертрофии (увеличение массы миокарда любого желудочка), ось смещается в сторону гипертрофированного желудочка.
Если главная электрическая ось существенно смещается вправо (как на рис. 6-38 Б2, где α = 120°), проекции QRS-комплексов в стандартных отведениях значительно изменяются. В этом случае самое большое отклонение вверх происходит в отведении III, а отклонение в отведении I инвертировано, потому что конец стрелки ближе к RA, чем к LA. Когда ось смещена влево (рис. 6-38 Б3, где α = 0°) самое большое отклонение вверх происходит в отведении I, а QRS-комплекс в отведении III инвертирован.
В дополнение к стандартным отведениям от конечностей: I, II, и III, у пациентов часто производят регистрацию от других отведений, тоже от конечностей, которые также ориентированы во фронтальной плоскости. Оси таких униполярных отведений от конечностиобразуют углы в +90°, -30°, и -150° с горизонтальной осью. Кроме того, проводят регистрацию также и от грудных отведений, чтобы определить проекции вектора сердца на сагиттальных и поперечных плоскостях тела. Эти грудные отведения регистрируют от шести выбранных точек на передней и латеральной поверхностях груди около сердца.
Слайд 77Рис. 6-38. Результирующий вектор сердца.
А - треугольник Эйнтховена, иллюстрирующий соединения электрокардиографа при
Рис. 6-38. Результирующий вектор сердца.
А - треугольник Эйнтховена, иллюстрирующий соединения электрокардиографа при

Слайд 78Шестиосевая система координат
При электрокардиографическом обследовании обычно используют двенадцать отведений: шесть отведений от
Шестиосевая система координат
При электрокардиографическом обследовании обычно используют двенадцать отведений: шесть отведений от

Для более наглядного представления об отклонении ЭДС сердца во фронтальной плоскости Bayley в 1943 году предложил шестиосевую систему координат. Она создается при совмещении осей трех стандартных отведений Эйнтховена и трех усиленных отведений от конечностей Гольдбергера, которые проведены через электрический центр сердца. Две ветви одной и той же оси, исходящие из центра, составляют положительную (обращенную к активному или положительному электроду) и отрицательную (обращенную к индифферентному или отрицательному электроду) части (рис. 6-39 А).
Амплитуда электрокардиографических зубцов в разных отведениях есть не что иное, как проекция одной и той же ЭДС сердца на ось данного отведения. В связи с этим при сопоставлении полярности и величины зубцов в различных отведениях, входящих в состав шестиосевой системы координат, можно с достаточно высокой точностью определить величину и направление главного вектора ЭДС сердца во фронтальной плоскости.
Направление осей обычно определяют в градусах. Началом отсчета (0°) условно служит прямая, проведенная строго горизонтально из электрического центра влево по направлению к активному положительному полюсу первого стандартного отведения. Положительный полюс второго стандартного отведения расположен под углом +60°, отведения aVF - под углом +90°, третьего стандартного отведения - под углом +120°, aVL - под углом -30°, aVR - под углом -150° (рис. 6-39 А).
Возбуждение желудочков начинается с возбуждения межжелудочковой перегородки (рис. 6-39 Б1). После этого деполяризация распространяется вдоль эндокардиальной поверхности стенки обоих желудочков (рис. 6-39 Б2,3) и наконец возбуждение охватывает наружную поверхность желудочков (рис. 6-39 Б3-5). Для каждой стадии этого процесса на рис. 6-39 Б1-5 моментный результирующий вектор показан черной стрелкой на схематическом изображении желудочков.
Слайд 79Рис. 6-39. Шестиосевая система координат.
А - направление осей трех стандартных отведений Эйнтховена
Рис. 6-39. Шестиосевая система координат.
А - направление осей трех стандартных отведений Эйнтховена
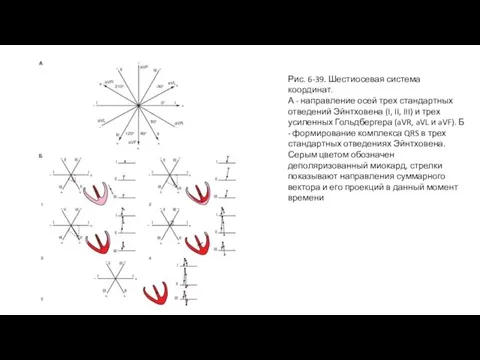
Слайд 80Нарушения ритма Аритмии
Аритмии сердца отражают нарушения в возникновении импульса или в его
Нарушения ритма Аритмии
Аритмии сердца отражают нарушения в возникновении импульса или в его

Нарушения возникновения импульса включают те, которые исходят из SA-узла и те, которые происходят от различных эктопических фокусов. Основными нарушениями распространения импульса являются блокады проведения и ритмы, в основе которых лежит возникновение реентри.
Нарушение синоатриального ритма
Примеры ЭКГ с нормальным ритмом, с синусовой тахикардией и синусовой брадикардией показаны на рис. 6-40. P-, QRS- и T-отклонения - нормальные, но продолжительность сердечного цикла (интервал RR) изменена. Характерно, что в ответ на синусную брадикардию или развитие тахикардии, изменения частоты сокращений сердца наступают постепенно и требуется несколько циклов сокращений, чтобы достигнуть величины нового устойчивого состояния. Признак дыхательной аритмии сердца на ЭКГ общеизвестен и проявляется как ритмическое изменение RR-интервала, совпадающее с частотой дыхания.
Слайд 81Рис. 6-40. Синоатриальные ритмы.
A - нормальный синусный ритм.
Б - синусовая тахикардия.
Рис. 6-40. Синоатриальные ритмы.
A - нормальный синусный ритм.
Б - синусовая тахикардия.
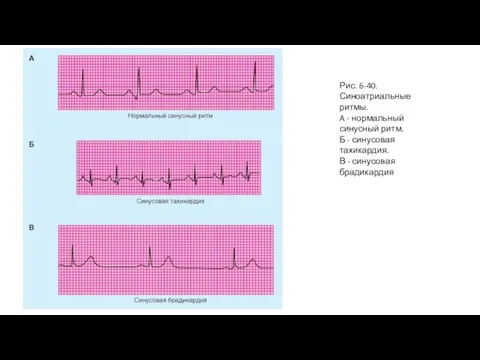
В - синусовая брадикардия
Слайд 82Нарушение атриовентрикулярной проводимости
Атриовентрикулярные блокады проведения
Различные физиологические, фармакологические воздействия и патологические процессы могут
Нарушение атриовентрикулярной проводимости
Атриовентрикулярные блокады проведения
Различные физиологические, фармакологические воздействия и патологические процессы могут

По электрокардиограмме различают три степени AV-блокады, как это показано на рис. 6-41 Б, В и Г. AV-блокада первой степенихарактеризуется длительным интервалом P-Q(R). На рис. 6-41 Б интервал P-Q(R) составляет 0.28 сунды; а интервал больше чем 0,20 с является отклонением от нормы. В большинстве случаев блокады первой степени, интервал A-H удлинен а интервал H-V нормальный. Следовательно, задержка при
AV-блокаде первой степени расположена выше пучка Гиса (т.е. в AV-узле).
В AV-блокаде второй степени, всем QRS-комп- лексам предшествуют P-волны, но не все P-волны сопровождаются QRS-комплексами. Отношение P-волн к QRS-комплексам обычно выражается отношением двух малых целых чисел (например: 2:l, 3:l или 3:2). Рис. 6-41 В иллюстрирует типичную блокаду 2:l. Место блокады может быть расположено выше или ниже пучка Гиса. В тех случаях, когда место блокады ниже пучка Гиса это последствия бывают более серьезные, чем в тех случаях, когда место блокады расположено выше пучка Гиса, потому что в первом случае развивается блокада третьей степени. Когда место блока расположено ниже пучка Гиса, то часто имплантируют электрокардиостимулятор.
AV-блокада третьей степени часто именуется как полная блокада сердца, потому что импульс полностью не способен преодолеть AV-путь проведения от предсердий к желудочкам. Чаще всего область полной блокады располагается дистальнее пучка Гиса. При полной блокаде сердца, предсердные и желудочковые ритмы полностью независимы, как показано на рис. 6-41 Г. Из-за медленного желудочкового ритма (в данном случае 32 уд/мин), кровоснабжение оказывается недостаточным, особенно при мышечной нагрузке. Блокада третьей степени часто сопровождается обмороком (резко выраженным головокружением), причиной которого в большинстве случаев является недостаточный мозговой кровоток. Блокада третьей степени - одно из наиболее часто встречаемых состояний, которые требуют применения искусственных водителей ритма.
Слайд 83Рис. 6-41. Атриовентрикулярные (AV) блокады.
А - схематическое представление положения катетеров-электродов при внутрисердечных
Рис. 6-41. Атриовентрикулярные (AV) блокады.
А - схематическое представление положения катетеров-электродов при внутрисердечных
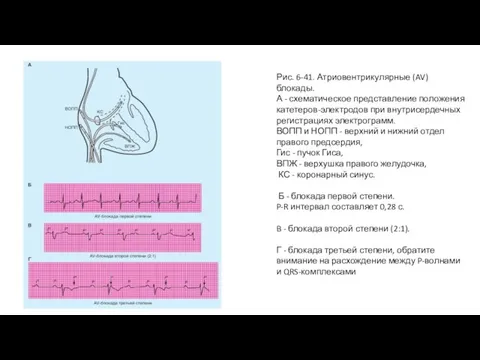
ВОПП и НОПП - верхний и нижний отдел правого предсердия,
Гис - пучок Гиса,
ВПЖ - верхушка правого желудочка,
КС - коронарный синус.
Б - блокада первой степени.
P-R интервал составляет 0,28 с.
B - блокада второй степени (2:1).
Г - блокада третьей степени, обратите внимание на расхождение между P-волнами и QRS-комплексами
Слайд 84Внеочередные сокращения сердца Экстрасистолы
Внеочередные деполяризации (экстрасистолы) возникают иногда у здоровых людей, но
Внеочередные сокращения сердца Экстрасистолы
Внеочередные деполяризации (экстрасистолы) возникают иногда у здоровых людей, но

Внеочередная предсердная деполяризация показана на рис. 6-42 A1. На этой записи нормальный интервал между сокращениями составляет 0,89 с (частота сердечных сокращений - 68 уд/мин). Внеочередная предсердная деполяризация (вторая P-волна на рисунке) следует за предшествующей P-волной всего через 0,56 с. Конфигурация внеочередной P-волны отличается от конфигурации другой, нормальной P-волны, потому что ход предсердного возбуждения, которое возникает в некотором эктопическом фокусе предсердия, отличается от нормального распространения возбуждения, которое возникает в SA-узле. Конфигурация комплекса QRS при внеочередной предсердной деполяризации обычно бывает нормальной, потому что возбуждение в желудочке распространяется по обычным проводящим путям.
Внеочередная желудочковая деполяризация представлена на рис. 6-42 А2. Распространение импульса происходит аномально, и конфигурации QRS и T-волны полностью отличаются от таковых на нормальной электрокардиограмме, потому что внеочередное возбуждение возникает в некотором эктопическом фокусе в желудочках. Внеочередной QRS-комплекс следует за предшествующим нормальным QRS-комплексом всего через 0,47 с. Интервал после экстрасистолы составляет 1,28 с, что значительно длиннее нормального интервала между ударами (0,89 с). Интервал (1,75 с) от QRS-комплекса сразу перед экстрасистолой до QRS-комплекса сразу после него фактически равен длительности двух нормальных сердечных циклов (0,89 + 0,89 = 1,78 с).
Длительный интервал, который обычно следует за внеочередной желудочковой деполяризацией, называется компенсаторной паузой.Эта пауза происходит, потому что эктопический желудочковый импульс не нарушает естественного ритма SA-узла, так как эктопический желудочковый импульс не проводится ретроградно через AV-узел. Импульс SA-узла, возникший сразу до или после желудоч-
ковой экстрасистолы, обычно не оказывает влияние на желудочек, потому что AV-узел и, возможно, также желудочки являются все еще рефрактерными из-за внеочередного возбуждения. На рис. 6-42 А2 P-волна, связанная с экстрасистолой, совпадает с T-волной внеочередной желудочковой деполяризации, и, следовательно, ее не так-то легко идентифицировать на записи.
Эктопические тахикардии
В отличие от постепенных изменений в частоте, которые служат отличительным признаком синусовой тахикардии, тахикардии, которые происходят из эктопического центра, обычно начинаются и кончаются резко. Поэтому такие эктопические тахикардии обычно называютпароксизмальными тахикардиями. Приступы пароксизмальной тахикардии могут продолжаться всего лишь в течение нескольких сокращений или в течение многих часов и дней, причем приступы часто повторяются. Пароксизмальные тахикардии могут быть следствием: (1) высокочастотных разрядов из эктопического водителя ритма, (2) вторичной пусковой активности, обусловленной потенциалами последействия достигших порога, или (3) циркуляции возбуждающего импульса по петле реентри.
Пароксизмальные тахикардии, которые возникают в предсердиях или в тканях AV-узла (рис. 6-42 Б1) обычно неразличимы и поэтому обе обозначаются термином пароксизмальная суправентрикулярная тахикардия. При этой форме тахикардии, импульс часто ходит по кругу (реентри), который включает в себя предсердную и AV-узловую ткань. QRS-комплексы часто бывают нормальными, потому что возбуждение желудочков происходит по традиционному проводящему пути.
Как следует из самого названия, желудочковая пароксизмальная тахикардия возникает в эктопическом фокусе желудочков. В этих случаях ЭКГ характеризуется частыми, измененными QRS-ком- плексами, которые отражают аномальное внутрижелудочковое проведение импульса (рис. 6-42 Б2). Желудочковая пароксизмальная тахикардия гораздо более грозное нарушение ритма, чем суправентрикулярная тахикардия, потому что первая часто является предшественником желудочковой фибрилляции, смертельной аритмии, описываемой в следующем разделе.
Слайд 85Рис. 6-42. Экстрасистолы и пароксизмальные тахикардии.
А - внеочередные деполяризации. Внеочередная предсердная деполяризация
Рис. 6-42. Экстрасистолы и пароксизмальные тахикардии.
А - внеочередные деполяризации. Внеочередная предсердная деполяризация

Б - пароксизмальные тахикардии. Суправентрикулярная тахикардия ( Б1) и вентрикулярная тахикардия (Б2)
Слайд 86Фибрилляция предсердий и желудочков
Фибрилляция
При некоторых условиях сердечная мышца начинает сокращаться некоординировано и
Фибрилляция предсердий и желудочков
Фибрилляция
При некоторых условиях сердечная мышца начинает сокращаться некоординировано и

Изменения в ЭКГ при предсердной фибрилляции показаны на рис. 6-43 А. Эта аритмия происходит при различных типах хронических заболеваний сердца. Предсердия не сокращаются и не расслабляются последовательно в течение каждого сердечного цикла, и, таким образом, они не способствуют наполнению желудочков. Вместо этого предсердия совершают непрерывные, некоординированные пульсирующие сокращения. P волны не появляются на ЭКГ; они заменены непрерывными неправильными колебаниями потенциала, которые называются f-волнами. AV-узел активируется с интервалами времени, которые могут значительно изменяться от цикла к циклу. Следовательно, отсутствует постоянный интервал между последовательными QRS-комплексами или между последовательными желудочковыми сокращениями. Так как сила желудочкового сокращения зависит от интервала времени между сокращениями, то объем и периодичность ритма становятся нерегулярными. У многих больных предсердный цикл реентри и проведение импульса через AV-узел являются более регулярными, чем при предсердной фибрилляции. Поэтому этот ритм получил название «трепетание предсердий».
Предсердная фибрилляция и трепетание не опасны для жизни некоторые люди с этими расстройствами могут даже полноценно трудиться. Желудочковая фибрилляция, наоборот, ведет к потере сознания в течение нескольких сунд. Постоянные, беспорядочные, несогласованные сокращения желудочковых мышечных волокон не способны перекачивать кровь. Если не произведена немедленная, действенная реанимация и если не произошло спонтанного восстановления ритма, что происходит редко, то наступает смерть.
Желудочковая фибрилляция может развиться, когда весь желудочек, или некоторая часть его, лишена нормального кровоснабжения. Она может также возникнуть в результате электрического удара или в ответ на действие некоторых лекарств и анестезирующих средств. На ЭКГ (рис. 6-43 Б) при этом регистрируются нерегулярные колебания потенциала.
Желудочковая фибрилляция часто инициируется, когда внеочередной импульс приходит во время так называемого уязвимого периодасердечного цикла, который совпадает с нисходящей волной зубца T на ЭКГ. В течение этого периода возбудимость клеток сердца разная в разных его участках. Некоторые волокна все еще находятся в эффективном рефрактерном периоде, другие почти полностью восстановили свою возбудимость и они по-прежнему способны проводить импульсы, но только с очень медленными скоростями проведения. Следовательно, потенциалы действия распространяются в виде множества нерегулярных волн возбуждения, которые перемещаются по обходным путям с различными скоростями проведения. Когда кардиомиоциты определенной области становится снова возбудимыми, то в конечном счете какая-нибудь перемещающаяся волна возбуждения начинает циркулировать по кругу. Следовательно, процесс является самоподдерживающимся.
Предсердная фибрилляция может быть изменена на нормальный синусный ритм препаратами, которые продлевают рефрактерный период. Тогда, по мере того как импульс сердца завершает цикл реентри, он поступает к волокнам миокарда, которые еще не возбудимы. При желудочковой фибрилляции необходимо иное воздействие. Преобразование патологического ритма в нормальный синусовый ритм осуществляется посредством применения сильного электрического тока, который на короткое время приводит все клетки миокарда в рефрактерное состояние. Были разработаны приемы безопасного воздействия током через интактную грудную клетку. В успешных случаях, SA-узел снова берет на себя функцию нормального нейсмейкера для всего сердца. Когда действие препаратов не приводит к удовлетворительным результатам при предсердной дефибрилляции, то для коррекции этого состояния также может быть использована электрическая дефибрилляция.
Слайд 87Рис. 6-43. Фибрилляция. Предсердная фибрилляция (А) и желудочковая фибрилляция (Б)
Рис. 6-43. Фибрилляция. Предсердная фибрилляция (А) и желудочковая фибрилляция (Б)
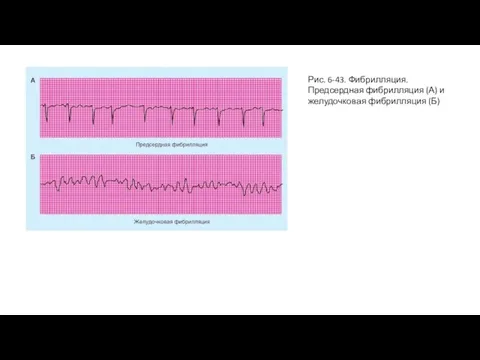
Слайд 88Клапанный аппарат сердца
Сердечные клапаны. Клапаны сердца состоят из тонких листков гибкой, упругой,
Клапанный аппарат сердца
Сердечные клапаны. Клапаны сердца состоят из тонких листков гибкой, упругой,

Атриовентрикулярные клапаны. AV-клапан, расположенный между правым предсердием и правым желудочком, сформирован тремя створками (трехстворчатый клапан), тогда как клапан, расположенный между левым предсердием и левым желудочком, имеет две створки (митральный клапан). Общая площадь створок каждого AV-кла- пана примерно вдвое больше соответствующего AV-отверстия, так что в закрытом положении имеет место значительное взаимное перекрывание створок клапана (рис. 6-44). К свободным кромкам этих клапанов прикреплены тонкие, сильные связки (сухожильные нити), которые отходят от мощных папиллярных мышц соответствующих желудочков и не позволяют клапанам выворачиваться наружу во время сокращения желудочков.
В нормальном сердце во время наполнения желудочков створки клапана располагаются относительно близко друг к другу и, таким образом, служат воронкой для перехода крови из
предсердия в желудочек. Частичное сближение поверхностей клапана во время диастолы вызывается вихревыми потоками позади створок, а также некоторым напряжением свободных кромок клапанов. Это напряжение вызывают сухожильные нити и папиллярные мышцы, растянутые наполняющимся желудочком.
Полулунные клапаны. Полулунные клапаны расположены между правым желудочком и легочной артерией и между левым желудочком и аортой. Они представлены тремя чашеобразными створками, прикрепленными к клапанному кольцу (рис. 6-44). В конце фазы медленного изгнания систолы желудочков кровоток быстро меняет направление в сторону желудочков. Этот обратный ток крови сближает створки вместе, закрывая отверстие и препятствуя забрасыванию крови в желудочки. Во время систолы желудочков створки не примыкают плотно к стенкам легочной артерии и аорты, а плавают в кровотоке, находясь примерно посередине между стенками сосуда и положением, когда клапан находится в закрытом состоянии. Позади полулунных клапанов находятся маленькие закрытые участки легочной артерии и аорты (пазухи Вальсальвы), где создаются вихревые потоки, удерживающие створки клапана на расстоянии от стенок сосуда. К тому же отверстия правой и левой коронарных артерий расположены позади соответственно правой и левой створок аортального клапана. Если бы не пазухи Вальсальвы и не вихревые потоки, образующиеся в них, коронарные отверстия могли бы быть блокированы створками клапана.
Слайд 89Рис. 6-44. Схема перпендикулярного разреза сердца вдоль межжелудочковой перегородки, иллюстрирующая анатомическую взаимосвязь
Рис. 6-44. Схема перпендикулярного разреза сердца вдоль межжелудочковой перегородки, иллюстрирующая анатомическую взаимосвязь
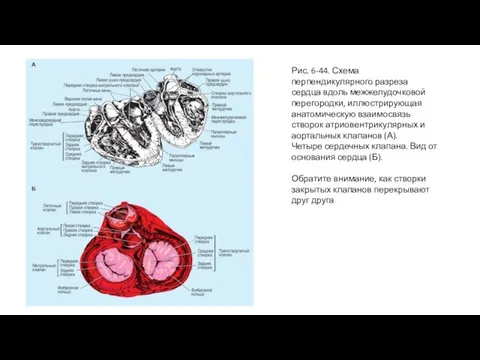
Четыре сердечных клапана. Вид от основания сердца (Б).
Обратите внимание, как створки закрытых клапанов перекрывают друг друга
Слайд 90Ультразвуковое исследование клапанного аппарата сердца
Движения створок митрального клапана в течение сердечного цикла
Ультразвуковое исследование клапанного аппарата сердца
Движения створок митрального клапана в течение сердечного цикла

На рис. 6-45 эхокардиограмма расположена так, чтобы показать движение передней створки митрального клапана. Движения задней створки представляют собой зеркальное отражение движений передней створки, но в проекции, представленной на рис. 6-45, ее движения кажутся гораздо меньшими. В точке D митральный клапан открывается, и во время быстрого наполнения (от точки D до точки Е) передняя створка движется по направлению к межжелудочковой перегородке. В течение фазы медленного наполнения (от Е до F) створки клапанов движутся навстречу друг другу, но клапан не закрывается. Наполнение желудочка вследствие сокращения предсердия (от F до А) раздвигает створки; затем наступает второе сближение створок клапана (от А до С). В точке С клапан закрыт сокращением желудочка. Створки клапана, выгнутые в направлении предсердия, остаются сжатыми вместе в течение систолы желудочка (от С до D).
Слайд 91Рис. 6-45. Принцип эхокардиографии. Датчик испускает и улавливает ультразвуковые сигналы, т.е. работает
Рис. 6-45. Принцип эхокардиографии. Датчик испускает и улавливает ультразвуковые сигналы, т.е. работает

Слайд 92Закон сердца Старлинга
К внутриклеточным механизмам регуляции силы сокращений относится механизм Франка- Старлинга,
Закон сердца Старлинга
К внутриклеточным механизмам регуляции силы сокращений относится механизм Франка- Старлинга,

Механизм Франка-Старлинга является идеальным средством для поддержания соответствия сердечного выброса венозному возврату.
Физиологическая сущность этого эффекта заключается в обеспечении согласованности величины притока крови и сердечного выброса. Причем соответствие достигается не только при любом изменении притока крови к предсердиям, т.е. при изменении преднагрузки, но также и в результате изменения ритма сердца, например, при брадикардии. Впоследствии заметили, что увеличение объема желудочков связано с увеличением длины каждого мышечного волокна миокарда, образующего камеры желудочков. Был сделан вывод, что увеличение длины волокон влияет на работу сердца, главным образом, за счет изменения количества взаимодействующих перекрещивающихся соединений миофиламентов. Позднее показали, что основной механизм, с помощью которого осуществляется влияние на сердечную деятельность, заключается в изменении чувствительности сердечных миофиламентов к Ca2+ в связи с растяжением миокарда желудочков. Существует оптимальная длина мышечных волокон. Чрезмерно высокие значения наполняющего давления, когда мышечные волокна миокарда растягиваются слишком сильно, скорее понижают, чем увеличивают насосную мощность желудочков.
Старлинг также показал, что препараты изолированного сердца способны приспосабливаться к изменениям силы, противодействующей выбросу крови из желудочков во время систолы. При сокращении левого желудочка выброс крови в аорту не производится, пока желудочек не разовьет давление, которое будет выше давления в аорте. Давление в аорте во время желудочкого выброса в основном и составляет постнагрузку левого желудочка. В экспериментах, проведенных Старлингом, артериальное давление контролировалось с помощью гидравлического устройства, находившегося в трубке, которая соединяла восходящую часть аорты с резервуаром крови, соединенным с правым предсердием. Постоянный объем венозного возврата в правое предсердие поддерживался на постоянном уровне путем поддержания гидростатического уровня крови в резервуаре. Когда Старлинг повышал артериальное давление до нового постоянного уровня, левый желудочек сначала реагировал на увеличившуюся постнагрузку, уменьшением систолического объема. Так как поддерживался постоянный объем венозного возврата, то уменьшение систолического объема сопровождалось увеличением диастолического объема желудочка и удлинением мышечных волокон миокарда. Это изменение конечно-диастолической длины волокон в результате давало возможность желудочку прокачивать нормальный систолический объем при большем периферическом сопротивлении. Хотя изменение количества циклических поперечных связей (cross-bridges) между толстыми и тонкими филаментами, возможно, способствует адаптации сердечной мышцы к изменившимся условиям, основным фактором здесь является изменение чувствительности сократительных белков к кальцию, вызванное растяжением миокарда.
Механизм Франка-Старлинга является идеальным средством для поддержания соответствия сердечного выброса венозному возврату. Любой внезапный, слишком большой выброс из одного желудочка вызывает увеличение венозного возврата к другому желудочку. Последующее увеличение длины мышечных волокон в диастолу увеличивает выброс из второго желудочка для соответствия выбросу, сделанному первым желудочком. Так механизм Франка-Старлинга позволяет поддерживать точное равновесие между выбросами из правого и левого желудочков. Так как два последовательно расположенных желудочка являются частью замкнутой цепи, то любое, пусть маленькое, но продолжительное нарушение равновесия между выбросами из обоих желудочков имело бы катастрофические последствия.
Слайд 93Рис. 6-46. Внутрисердечные механизмы регуляции работы сердца. Закон сердца Старлинга - первый
Рис. 6-46. Внутрисердечные механизмы регуляции работы сердца. Закон сердца Старлинга - первый

А - сердце на канюле Штраубе. Б - подсоединенное к механоэлектрическому преобразователю сердце на канюле Штраубе. В - увеличение амплитуды сократительной активности сердца в ответ на увеличение к нему притока раствора. Стрелками обозначено увеличение притока и возвращение его к норме
Слайд 94Ритмоинотропная регуляция
Ритмоинотропная зависимость - это зависимость силы сокращений от частоты сокращений, которая
Ритмоинотропная регуляция
Ритмоинотропная зависимость - это зависимость силы сокращений от частоты сокращений, которая

Эффект широкого диапазона интервалов между сокращениями на достигнутые постоянные значения развиваемой силы показан на рис. 6-47 Б. При уменьшении интервала между сокращениями с 300 до 20 с развиваемая сила сокращений изменялась незначительно. При дальнейшем укорочении интервала до 0,5 с развиваемая сила сокращений резко возрастала. Дальнейшее уменьшение паузы между сокращениями до 0,2 с производило уже незначительный дополнительный эффект на развиваемую силу сокращений.
Прогрессирующее увеличение силы вначале, когда интервал между сокращениями резко уменьшается (например, с 20 до 0,63 с на рис. 6-47 Б), вызвано постепенным увеличением концентрации внутриклеточного Са2+. Увеличению концентрации внутриклеточного Са2+способствуют два механизма: (1) увеличение числа деполяризаций в минуту и (2) увеличение входящего Са2+-тока за одну деполяризацию.
Действие первого механизма заключается в следующем: Са2+ входит в клетку миокарда в период плато каждого потенциала действия. Когда интервал между сокращениями уменьшается, количество фаз плато в минуту возрастает.
Второй механизм действует следующим образом: когда интервал между сердечными сокращениями резко уменьшается, входящий Са2+- ток (ICa) прогрессивно увеличивается с каждым последующим сокращением до тех пор, пока не будет достигнут новый устойчивый максимум силы при новой длительности между стимулами, вызывающими сокращение. На рис. 6-47 В показано, что в изолированной мышечной клетке желудочка, подвергнутой повторяющимся деполяризациям, вход Са2+ в кардиомиоцит возрастал с каждым последующим сокращением. Например, максимальный уровень ICa был значительно выше во время седьмой деполяризации, чем во время первой. Кроме того, скорость его инактивации во время седьмой деполяризации происходила значительно медленнее, чем во время первой. Обе из этих характеристик ICa приведут к большему входу Са2+ в кардиомиоцит во время седьмой деполяризации, чем при первой деполяризации. Больший вход Са2+, естественно, увеличивает силу сокращений.
Кратковременное изменение интервалов между сокращениями также сильно влияет на силу сокращений. Когда левый желудочек сокращается раньше времени (рис. 6-47 Г, сокращение 1), такое внеочередное сокращение (экстрасистола) само по себе является слабым, тогда как сокращение (2) (следующее сокращение после экстрасистолы) после компенсаторной паузы является очень сильным. Эта реакция частично зависит от механизма Франка-Старлинга. Неадекватное наполнение желудочка непосредственно перед внеочередным сокращением частично является причиной его слабости. Следовательно, увеличенное наполнение, связанное с компенсаторной паузой, частично объясняет значительную силу постэкстрасистолического сокращения.
Хотя объем левого желудочка оставался постоянным на протяжении всего наблюдения, внеочередное сокращение (1) было слабым, а постэкстрасистолическое сокращение (2) было сильнее обычного. Это усиление сокращения у следующего за экстрасистолой сокращения служит примером постэкстрасистолической потенциации и может проявляться на протяжении одного и более последующих сокращений (например, в сокращении 3).
Слайд 95Рис. 6-47. Внутрисердечные механизмы регуляции работы сердца. Ритмо-инотропная зависимость - второй принцип
Рис. 6-47. Внутрисердечные механизмы регуляции работы сердца. Ритмо-инотропная зависимость - второй принцип
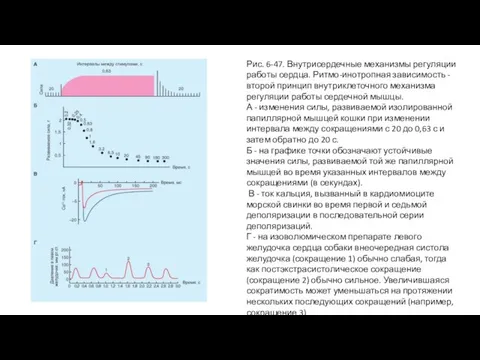
А - изменения силы, развиваемой изолированной папиллярной мышцей кошки при изменении интервала между сокращениями с 20 до 0,63 с и затем обратно до 20 с.
Б - на графике точки обозначают устойчивые значения силы, развиваемой той же папиллярной мышцей во время указанных интервалов между сокращениями (в секундах).
В - ток кальция, вызванный в кардиомиоците морской свинки во время первой и седьмой деполяризации в последовательной серии деполяризаций.
Г - на изоволюмическом препарате левого желудочка сердца собаки внеочередная систола желудочка (сокращение 1) обычно слабая, тогда как постэкстрасистолическое сокращение (сокращение 2) обычно сильное. Увеличившаяся сократимость может уменьшаться на протяжении нескольких последующих сокращений (например, сокращение 3)
Слайд 96Внутрисердечная нервная система
Сердце способно к автоматическому контролю своей деятельности. Автоматический контроль осуществляется
Внутрисердечная нервная система
Сердце способно к автоматическому контролю своей деятельности. Автоматический контроль осуществляется

Внутрисердечная нервная система - это совокупность нервных сплетений и ганглиозных клеточных структур, расположенных в тканях сердца. Ганглиозно-синаптические структуры внутрисердечной нервной системы участвуют в процессах саморегуляции сердца как периферический нервный аппарат, в котором происходит замыкание местных внутрисердечных рефлекторных дуг (рис. 6-48 А).
Внутрисердечная нервная система включает афферентные нейроны, дендриты которых образуют рецепторы растяжения на миокардиальных волокнах и коронарных сосудах, вставочные нейроны и эфферентные нейроны. Их аксоны иннервируют кардиомиоциты и коронарные сосуды. Все эти нейроны соединены между собой синаптическими связями.
На изолированных сердцах холоднокровных (М.Г. Удельнов с сотр.) и теплокровных (Г.И. Косицкий с сотр.) животных в 60-х годах ХХ века было доказано участие внутрисердечной нервной системы в рефлекторной регуляции силы сердечных сокращений, ритма, возбудимости, проводимости, расслаблении миокарда и регуляции тонуса коронарных сосудов. Существенным является факт разнонаправленных рефлекторных реакций при раздражении одних и тех же рецепторов в зависимости от исходного состояния деятельности рабочей камеры. В настоящее время в интрамуральных ганглиях сердца доказано наличие не только холинергических нейронов, но и нервных клеток, выделяющих дофамин, норадреналин и некоторые пептиды. На нейронах, расположенных в ганглиях сердца, обнаружены М-, Н-холинорецепторы и адренорецепторы. Ганглии в основном сгруппированы в предсердиях, меньшее их количество обнаружено в желудочках. На нейроны ВСНС конвергируют волокна парасимпатической, симпатической и интракардиальной нервной системы. Было показано, что экстракардиальные входы внутрисердечных нейронов составляют всего лишь 25%. Чувствительных клеток приблизительно в 5 раз больше, чем двигательных клеток. Путем избирательной блокады, фармакологического анализа было показано, что каждый ганглий иннервирует только определенную структуру сердца и соответственно регулирует какой-то параметр деятельности: ЧСС, проводимость, силу сокращений.
В естественных условиях ВСНС не является автономной, а подчиняется вышележащим регулирующим системам. Однако ее функционирование показывает возможность приспособительных реакций уже на уровне самого органа.
После экстракардиальной денервации (например, при трансплантации сердца) именно внутрисердечные рефлексы совместно с миогенными механизмами обеспечивают приспособление работы сердца к изменяющимся гемодинамическим потребностям организма.
В интактном организме экстракардиальные и внутрисердечные механизмы регуляции функционируют как единый регуляторный аппарат.
Особенностью внутрисердечной нервной системы лягушки является наличие двух внутрисердечных нервных стволов, идущих по межпредсердной перегородке от ганглиозных структур венозного синуса к атриовентрикулярной воронке и к желудочку. В состав этих стволов входят афферентные волокна рецепторов желудочка, постганглионарные нервные волокна симпатической нервной системы, преганглионарные и постганглионарные нервные волокна парасимпатической нервной системы. Афферентные волокна могут направляться в ЦНС или принадлежать ганглиям вегетативной и внутрисердечной нервной системы. В последнем случае возможно замыкание внутрисердечного рефлекса.
Слайд 97Рис. 6-48. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система.
А - принципиальная
Рис. 6-48. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система.
А - принципиальная
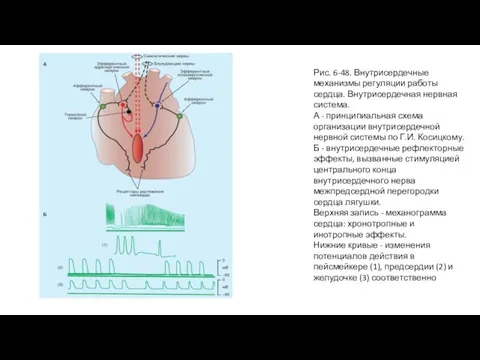
Б - внутрисердечные рефлекторные эффекты, вызванные стимуляцией центрального конца внутрисердечного нерва межпредсердной перегородки сердца лягушки.
Верхняя запись - механограмма сердца: хронотропные и инотропные эффекты.
Нижние кривые - изменения потенциалов действия в пейсмейкере (1), предсердии (2) и желудочке (3) соответственно
Слайд 98Влияние ацетилхолина на работу
сердца
Показано, что во внутрисердечной нервной системе определенную роль играют
Влияние ацетилхолина на работу
сердца
Показано, что во внутрисердечной нервной системе определенную роль играют

Для изучения действия ацетилхолина на механическую работу сердца лягушки пользуются препаратом изолированного на канюле Штраубе (рис. 6-49 А, Б). Верхушка сердца через серфин или лигатуру соединяется со штырем механоэлектрического преобразователя.
На рис. 6-49 В показан контрольный период, во время которого записывают работу желудочка сердца при нахождении в нем постоянно сменяемого физиологического раствора. Стрелка показывает момент смены физиологического раствора на раствор, содержащий 10-6 г/мл ацетилхолина.
На рис. 6-49 Г показан контрольный период, во время которого записывают работу желудочка сердца при нахождении в нем постоянно сменяемого физиологического раствора. Первая стрелка показывает момент смены физиологического раствора на раствор, содержащий 10-7 г/мл ацетилхолина, а вторая стрелка показывает момент смены физиологического раствора на раствор, содержащий 10-8 г/мл ацетилхолина
Действие ацетилхолина выражается в снижении амплитуды и частоты сердечных биений. При избытке ацетилхолина может наступить остановка сердца в диастоле. Влияние блуждающего нерва на миокард желудочков осуществляется с помощью, по крайней мере, двух механизмов. Действие одного механизма заключается в том, что ацетилхолин, высвобожденный нервными окончаниями блуждающего нерва, получает возможность взаимодействовать с мускариновыми рецепторами мембраны кардиомиоцитов синусного узла. Это взаимодействие вызывает угнетение аденилатциклазы. Последующее уменьшение внутриклеточной концентрации циклического АМФ приводит к уменьшению Са2+ проводимости клеточной мембраны и, таким образом, приводит к уменьшению сократительной способности миокарда.
Во время действия другого механизма ацетилхолин (ACh), освобождаемый нервными окончаниями блуждающего нерва, может также угнетать освобождение норадреналина соседними окончаниями нервных волокон симпатической нервной системы (см. рис. 6-55). Эксперименты показывают, что стимуляция симпатических нервов сердца вызывает значительное увеличение поступления норадреналина в кровь коронарного синуса. Сопутствующая стимуляция блуждающего нерва снижает это усиленное поступление норадреналина примерно на 30%. Количество норадреналина, который попадает в кровь коронарного синуса, возможно, равно количеству норадреналина, освобождаемого нервными окончаниями симпатической нервной системы. Таким образом, активность блуждающих нервов может уменьшить сократительную способность желудочков частично противодействуя любым стимулирующим эффектам со стороны одновременно активной симпатической нервной системы. Подобным образом нервные волокна симпатической нервной системы высвобождают норадреналин и некоторые нейропептиды, включая нейропептид Y (NPY). Оба вещества, норадреналин и NPY, угнетают высвобождение ацетилхолина из соседних нервных волокон блуждающих нервов (рис. 6-55).
Слайд 99Рис. 6-49. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система. Влияние ацетилхолина
Рис. 6-49. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система. Влияние ацетилхолина

А - сердце на канюле Штраубе.
Б - подсоединенное к механоэлектрическому преобразователю сердце на канюле Штраубе.
В - влияние на изолированное на канюле Штраубе сердце лягушки ацетилхолина
Слайд 100Влияние адреналина на деятельность
сердца
Для изучения действия адреналина на механическую работу сердца лягушки
Влияние адреналина на деятельность
сердца
Для изучения действия адреналина на механическую работу сердца лягушки

На рис. 6-50 В показан контрольный период, во время которого записывают работу желудочка сердца при нахождении в нем постоянно сменяемого физиологического раствора. Стрелка показывает момент смены физиологического раствора на раствор, содержащий 10-6 г/мл адреналина.
Механизм действия катехоламинов через β-рецепторы
Известно, что КА влияют на аденилатциклазный путь. КА соединяется с рецептором, расположенным на наружной поверхности мембраны. Через G-белки, которые находятся в ассоциации с ГДФ, на внутренней стороне мембраны G-белок получает способность после обмена ГДФ на ГТФ диссоциировать и активировать аденилатциклазу. Она стимулирует образование цАМФ из АТФ, которая в свою очередь активирует образование протеинкиназ в цитоплазме клетки, которые приводят к фосфорилированию многочисленных внутриклеточных белков, меняющих проницаемость мембраны и активность ферментов. Активация происходит через взаимодействие с β-рецеторами. В результате, адреналин увеличивает сократимость за счет увеличения поступления кальция во время фазы плато. Ионы Ca++ в саркомерах взаимодействуют с С-тропонином. Количество образующихся кальций тропониновых комплексов зависит от концентрации Ca++, от количества молекул тропонина и от сродства тропонина к кальцию. Число образовавшихся кальций-тропониновых комплексов определяет активацию миофибрилл и их инотропное состояние, т.е. количество образовавшихся актомиозиновых связей.
Одновременно катехоламины приводят к фосфорилированию тропонина и фосфоламбана - белка ретикулума. Фосфорилирование тропонина увеличивает скорость распада кальций-тропонинового комплекса, снижает механическое напряжение, развиваемое сократительными белками, а также увеличивает скорость обратного захвата кальция, тем самым, ускоряя расслабление. Способность сердца к расслаблению влияет на насосную функцию сердца, поскольку степень и скорость диастолического расслабления определяют величину венозного возврата и последующий ударный выброс.
Таким образом суммарный эффект катехоламинов состоит не только в положительном инотропном действии, но и в ускорении расслабления.
Слайд 101Рис. 6-50. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система. Влияние адреналина
Рис. 6-50. Внутрисердечные механизмы регуляции работы сердца. Внутрисердечная нервная система. Влияние адреналина

А - сердце на канюле Штраубе.
Б - подсоединенное к механоэлектрическому преобразователю сердце на канюле Штраубе.
В - влияние на изолированное на канюле Штраубе сердце лягушки ацетилхолина
Слайд 102Влияние отдельных ионов на работу
сердца
Наряду с нервной регуляцией деятельности органов существует так
Влияние отдельных ионов на работу
сердца
Наряду с нервной регуляцией деятельности органов существует так

Важная роль в регуляции состояния сердечной мышцы принадлежит некоторым ионам. Особенно существенно для нормального функционирования сердца содержание в плазме крови и межклеточных пространствах ионов калия, натрия и кальция и правильное их соотношение.
Амплитуда сердечных сокращений зависит и от изменения в окружающей ее среде концентрации иона калия. В мышечной клетке концентрация калия в 40-50 раз выше, чем в межклеточном пространстве. Увеличение калия в наружном растворе приведет к уменьшению градиента концентраций калия внутри и снаружи мышечной клетки и вызовет уменьшение (деполяризацию) ее мембранного потенциала. Это в свою очередь приведет к уменьшению амплитуды и укорочению потенциала действия клетки. В результате в мышечные клетки при их возбуждении проникнет меньшее количество ионов кальция (поскольку потенциал действия укорочен, то и время повышенной ионной проницаемости будет короче). В связи с этим амплитуда сердечных сокращений будет уменьшаться.
Кальций из омывающей клетку межклеточной жидкости входит внутрь мышечного волокна, стимулируя процесс сокращения мышцы: чем больше кальция входит в мышечную клетку при ее возбуждении, тем больше амплитуда мышечного сокращения. Экспериментально показано, что амплитуда сокращений сердца зависит от количества кальция в омывающем его растворе. Удаление кальция из раствора приводит к падению силы сердечных сокращений, увеличение концентрации кальция - к повышению силы сокращений сердечной мышцы. Кроме того, кальций рассматривается как важнейший вторичный мессенджер.
При действии на сердце избыточных количеств ионов калия и кальция наблюдаются нарушения в ритме сердечных сокращений. Это связано с их влиянием на пейсмейкерные структуры. При использовании канюли Штраубе при наличии неповрежденного клапанного аппарата между правым предсердием и желудочком исследуемый раствор не должен попадать в предсердие и венозный синус. И, следовательно, не могут возникать хронотропные эффекты. Однако на практике при отмывании изолированного сердца клапанный аппарат часто повреждается. И как следствие выявляются влияния исследуемого раствора на ритм. При использовании круговой и проточной перфузии возникают как хронотропные, так и инотропные эффекты, т.к. перфузионный раствор проходит через все камеры сердца. В пейсмейкерных структурах ионы калия затягивают время достижения диастолической деполяризацией критического уровня. В результате интервалы между возникающими в пейсмейкере потенциалами действия увеличиваются и ритм сердечных сокращений уменьшается. При действии избытка ионов кальция, наоборот, этот интервал уменьшается и ритм сердечных сокращений увеличивается.
Для изучения действия ионов на механическую работу сердца лягушки пользуются препаратом изолированного сердца на канюле Штраубе (рис. 6-51 А). Верхушка сердца через серфин или лигатуру соединяется со штырем механоэлектрического преобразователя.
На рис. 6-51 Б показан контрольный период, во время которого записывают работу желудочка сердца при нахождении в нем постоянно сменяемого физиологического раствора. Первая стрелка показывает момент смены физиологического раствора на раствор, содержащий 0,65% NaCl, а вторая стрелка - на возврат протока физиологическим раствором. На рис. 6-51 В показано влияние на механическую активность сердца CaCl2. На рис. 6-51 Е в качестве примера показано влияние разной концентрации ионов K+ на параметры потенциала действия. Этот вопрос обсуждался ранее.
Слайд 103Рис. 6-51. Ионы как пример гуморальной регуляции сердца.
А - сердце на канюле
Рис. 6-51. Ионы как пример гуморальной регуляции сердца.
А - сердце на канюле

Б - перфузия изотоничным раствором хлористого натрия (недостаток ионов кальция).
В - добавление 1% раствора хлористого кальция.
Г - связывание ионов кальция 5% щавелевокислым аммонием.
Д - добавление 1% раствора хлористого калия.
Е - влияние различных концентраций ионов калия в растворе на параметры потенциала действия кардиомиоцита
Слайд 104Влияние вегетативной нервной системы на деятельность сердца
Внешние регулирующие факторы можно подразделить на
Влияние вегетативной нервной системы на деятельность сердца
Внешние регулирующие факторы можно подразделить на

Парасимпатические нервные волокна, иннервирующие сердце, берут начало в продолговатом мозге, в клетках, которые находятся вдорсальном ядре блуждающего нерва (nucleus dorsalis nervi vagi) или в двойном ядре (nucleus ambiguus) Х черепного нерва. У людей эфферентные волокна блуждающего нерва (рис. 6-52) проходят вниз по шее вблизи общих сонных артерий и затем через средостение и образуют синапсы с постганглионарными клетками. Эти клетки располагаются либо на поверхности эпикарда, либо в толще стенок сердца. Большинство клеток сердечных ганглиев располагаются вблизи синоатриального узла и атриовентрикулярного (AV) узла.
Правый и левый блуждающие нервы распределяются среди разных сердечных структур. Правый блуждающий нерв оказывает влияние преимущественно на синоатриальный узел. Стимуляция этого нерва замедляет возникновение процесса возбуждения синоатриального узла и может даже остановить его на несколько секунд.
Левый блуждающий нерв, главным образом, подавляет атриовентрикулярный узел, вызывая предсердно-желудочковую блокаду различной степени.
Синоатриальный и атриовентрикулярный узлы содержат много холинестеразы фермента, разрушающего нейротрансмиттер ацетилхолин. Ацетилхолин, высвобожденный из окончаний блуждающих нервов быстро гидролизируется. Благодаря быстрому разрушению ацетилхолина воздействия, вызываемые любой стимуляцией блуждающего нерва, очень быстро прекращаются после прекращения стимуляции. Кроме того, влияние блуждающего нерва на деятельность синоатриального или атриовентрикулярного узлов имеет очень короткий латентный период (от 50 до 100 мс), потому что выделяемый ацетилхолин активирует специфические ацетилхолин-регулируемые К+-каналы в клетках сердца. Эти каналы открываются так быстро потому, что ацетилхолин действует минуя систему вторичных мессенджеров, такую как система аденилатциклазы. Сочетание двух характерных особенностей блуждающих нервов - короткого латентного периода и быстрого угасания ответной реакции - позволяет блуждающим нервам регулировать деятельность синоатриального и атриовентрикулярного узлов при каждом сокращении сердца.
В области синоатриального узла влияние парасимпатической нервной системы обычно превосходит влияние симпатической нервной системы.
Симпатические нервы, иннервирующие сердце, берут начало в пяти или шести верхних грудных и одном или двух нижних шейных ганглиях симпатической цепочки. В средостении постганглионарные волокна симпатических нервов и преганглионарные волокна парасимпатических нервов соединяются вместе, образуя сложное нервное сплетение смешанных эфферентных нервов, идущих к сердцу.
Постганглионарные сердечные волокна симпатических нервов этого сплетения достигают основания сердца в составе адвентиции крупных сосудов. Дойдя до основания сердца, эти волокна распределяются по различным камерам сердца, образуя обширное нервное сплетение эпикарда. Затем они проходят сквозь миокард, обычно вдоль коронарных сосудов.
Как и блуждающие нервы, правые и левые симпатические нервы распределены по разным зонам сердца. У собак, например, нервные волокна на левой стороне сердца оказывают более выраженное влияние на сократительную способность миокарда, чем волокна на правой стороне сердца, тогда как на частоту сердечных сокращений нервные волокна на левой стороне сердца влияют гораздо меньше, чем нервные волокна на правой стороне. Воздействие, вызываемое стимуляцией симпатических нервов, после прекращения этой стимуляции ослабевает постепенно. Начало ответной реакции сердца на стимуляцию нервных волокон симпатической НС протекает медленно по двум основным причинам. Во-первых, норадреналин, судя по всему, вырабатывается нервными окончаниями сердечных нервных волокон симпатической НС довольно медленно. Во-вторых, норадреналин, выделенный из нервных окончаний, влияет на сердце, главным образом, через относительно медленную систему вторичных мессенджеров, в основном, через систему аденилатциклазы. Таким образом, влияние симпатической нервной системы изменяет частоту сердечных сокращений и проведение возбуждения по атриовентрикулярному узлу гораздо медленнее, по сравнению с влиянием блуждающего нерва.
Слайд 105Рис. 6-52. Симпатическая и парасимпатическая иннервация сердца.
1 - правый блуждающий нерв,
2
Рис. 6-52. Симпатическая и парасимпатическая иннервация сердца.
1 - правый блуждающий нерв,
2
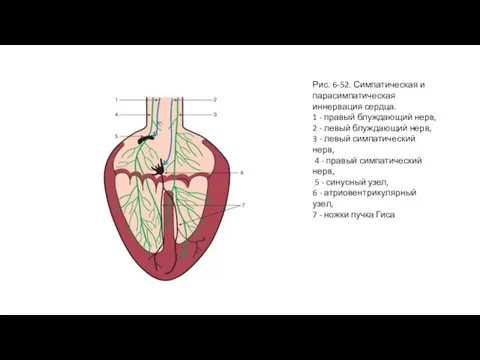
3 - левый симпатический нерв,
4 - правый симпатический нерв,
5 - синусный узел,
6 - атриовентрикулярный узел,
7 - ножки пучка Гиса
Слайд 106Влияние раздражения блуждающего нерва на автоматию и инотропную функцию миокарда
Блуждающие нервы вызывают
Влияние раздражения блуждающего нерва на автоматию и инотропную функцию миокарда
Блуждающие нервы вызывают

Влияние блуждающего нерва на миокард желудочков осуществляется с помощью, по крайней мере, двух механизмов. Действие одного механизма заключается в том, что ацетилхолин (ACh),
высвобожденный нервными окончаниями блуждающего нерва, получает возможность взаимодействовать с мускариновыми рецепторами (М) мембраны кардиомиоцитов. Это взаимодействие вызывает угнетение аденилатциклазы. Последующее уменьшение внутриклеточной концентрации циклического АМФ приводит к уменьшению Са2+ проводимости клеточной мембраны и, таким образом, приводит к уменьшению сократительной способности миокарда.
Во время действия другого механизма ацетилхолин, освобождаемый нервными окончаниями блуждающего нерва, может также угнетать освобождение норадреналина соседними окончаниями нервных волокон симпатической нервной системы.
На рис. 6-53 А показано влияние раздражения блуждающего нерва на мембранный потенциал клеток водителя ритма. Отчетливо видна гиперполяризация мембранного потенциала и подавление автоматии. На рис. 6-53 Б зарегистрировано влияние раздражения блуждающего нерва на сердце лягушки.
Слайд 107Рис. 6-53. Внесердечная регуляция работы сердца - влияние парасимпатической нервной системы.
А -
Рис. 6-53. Внесердечная регуляция работы сердца - влияние парасимпатической нервной системы.
А -
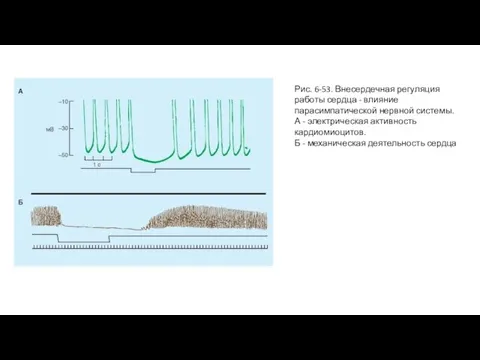
Б - механическая деятельность сердца
Слайд 108Влияние раздражения симпатических нервов на деятельность сердца
Влияние симпатической нервной системы
Деятельность симпатической нервной
Влияние раздражения симпатических нервов на деятельность сердца
Влияние симпатической нервной системы
Деятельность симпатической нервной

Влияние симпатической нервной системы усиливает деятельность сердечной мышцы с помощью активации Са2+-каналов, расположенных в мембранах кардиомиоцитов. Норэпинефрин, освобождаемый нервными окончаниями, или катехоламины, находящиеся в циркулирующей крови, взаимодействуют с бета-адренергическими рецепторами мембран клеток сердца. Это взаимодействие активирует аденилатциклазу, которая вызывает увеличение внутриклеточной концентрации циклического АМФ. В результате происходит активация протеинкиназы, что вызывает фосфорилирование различных белков в кардиомиоцитах. Фосфорилирование особых белков сарколеммы активирует Са2+-каналы мембраны кардиомиоцитов.
Активация Са2+-каналов увеличивает вход Са2+ во время фазы плато потенциала действия, и большее количество Са2+ освобождается из саркоплазматического ретикулума в ответ на каждое возбуждение сердца. Сила сердечных сокращений, таким образом, увеличивается.
Общий эффект от увеличения влияния на сердце симпатической нервной системы у интактных животных лучше всего виден на примере сразу нескольких кривых желудочковой функции. Когда проводят электростимуляцию левого звездчатого ганглия с нарастающей частотой, кривые желудочковой функции выраженно сдвигаются влево. Эти изменения параллельны изменениям, происходящим при введении норэпинефрина. Таким образом, при любом заданном значении конечно-диастолического давления в левом желудочке этот желудочек способен выполнять больше работы при увеличении активности симпатической нервной системы.
При стимуляции сердечной деятельности симпатической нервной системой увеличение выполняемой сердцем работы обычно сопровождается уменьшением конечно-диастолического давления в левом желудочке. Характерен пример ответной реакции сердца на стимуляцию звездчатого ганглия в условиях, когда сердце стимулировалось с постоянной частотой. В этом эксперименте работа, выполняемая сердцем при выбросе, увеличилась примерно на 50%, несмотря на уменьшение конечно-диастолического давления в левом желудочке.
На рис. 6-54 А показано влияние раздражения симпатического нерва на мембранный потенциал кардиомиоцита водителя ритма лягушки. На рис. 6-54 Б продемонстрирован положительный инотропный и хронотропный эффект зарегистрированный на сердце лягушки при раздражении симпатического нерва.
Слайд 109Рис. 6-54. Внесердечная регуляция работы сердца - влияние симпатической нервной системы.
А -
Рис. 6-54. Внесердечная регуляция работы сердца - влияние симпатической нервной системы.
А -
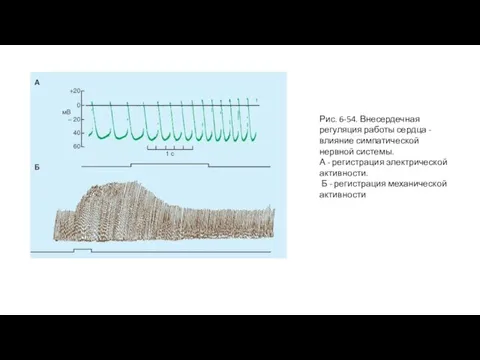
Б - регистрация механической активности
Слайд 110Взаимодействие влияний симпатической и парасимпатической систем на сердце
Экстракардиальные нервные механизмы регуляции реализуются
Взаимодействие влияний симпатической и парасимпатической систем на сердце
Экстракардиальные нервные механизмы регуляции реализуются

При одновременном раздражении вагосимпатического ствола вначале проявляется эффект раздражения блуждающего нерва, а затем симпатический эффект. Объясняется это следующим образом: ацетилхолин, выделяясь из нервных окончаний и взаимодействуя с м-холинорецепторами, может непосредственно без посредников влиять на к-каналы (лигандуправляемые). Это обеспечивает короткий латентный период влияния парасимпатической нервной системы. Реакция же на раздражение симпатического нерва имеет более длительный латентный период и большую продолжительность, так как действует через систему вторичных посредников и более медленно инактивируется.
Следует почеркнуть, что симпатическая и парасимпатическая нервные системы взаимодействуют друг с другом (рис. 6-55). Возбуждение парасимпатической нервной системы не только активирует м-холинорецепторы, но и угнетает высвобождение норадреналина из окончаний симпатических нервов. В свою очередь норадреналин способен угнетать высвобождение АХ (рис. 6-55).
В целом организме влияния блуждающего и симпатического нервов реализуются посредством рефлекторных реакции на сердце. Это собственные рефлексы сердечно-сосудистой системы. Рефлексы могут возникать и с рецептивных полей любого другого органа (сопряженные рефлексы).
Слайд 111Рис. 6-55. Взаимодействие в пределах вегетативной (симпатической и парасимпатической) нервной систем и
Рис. 6-55. Взаимодействие в пределах вегетативной (симпатической и парасимпатической) нервной систем и
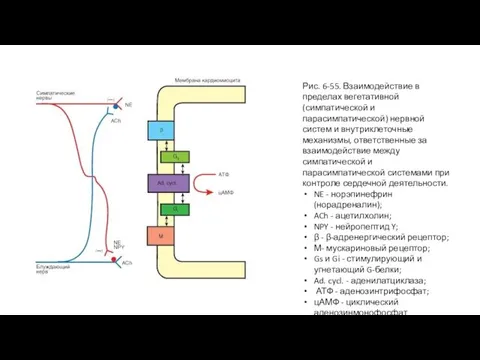
NE - норэпинефрин (норадреналин);
ACh - ацетилхолин;
NPY - нейропептид Y;
β - β-адренергический рецептор;
М- мускариновый рецептор;
Gs и Gi - стимулирующий и угнетающий G-белки;
Ad. cycl. - аденилатциклаза;
АТФ - аденозинтрифосфат;
цАМФ - циклический аденозинмонофосфат
Слайд 113Рис. 6-56. Схема, иллюстрирующая принцип Фика для измерения сердечного выброса. Изменение цвета
Рис. 6-56. Схема, иллюстрирующая принцип Фика для измерения сердечного выброса. Изменение цвета
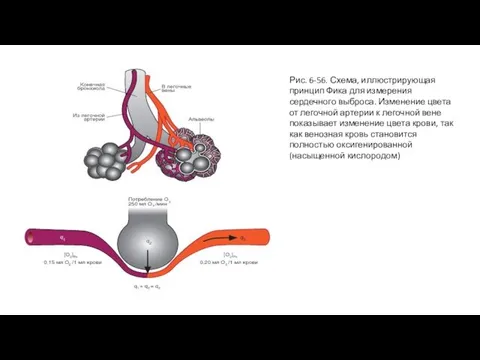
Слайд 114Фазовый анализ сердечного цикла
Систола желудочков начинается после окончания систолы предсердий. Волна сокращения,
Фазовый анализ сердечного цикла
Систола желудочков начинается после окончания систолы предсердий. Волна сокращения,

Далее следует фаза изометрического сокращения (напомним, что изометрическим называют такое сокращение мышцы, при котором мышечные волокна развивают напряжение, но не укорачиваются), имеющая следующую феноменологию. Эта фаза развивается при закрытых клапанах. После того как все мышечные волокна желудочков охвачены сокращением, давление крови в полости желудочков начинает увеличиваться, что вызывает закрытие атриовентрикулярных клапанов. Полулунные клапаны в это время также закрыты, потому что давление в желудочках пока еще ниже, чем в аорте и легочной артерии. Поэтому в течение короткого времени - 0,03 с - мышца желудочков напрягается, но их объем не меняется (так как кровь в желудочках, подобно всякой жидкости, практически несжимаема) до тех пор, пока давление в желудочке не превысит давления в аорте и легочной артерии и пока под влиянием напора крови не откроются полулунные клапаны. По другой терминологии время между началом сокращения желудочков и открытием полулунных клапанов (когда желудочковое давление резко повышается) называется изоволюмическим сокращением(«изоволюмический» буквально означает «того же объема»). Данный термин также является подходящим, так как желудочковый объем остается неизменным в течение этого короткого периода. На рис. 6-57 показано, что начало сокращения желудочков совпадает с пиком зубца R на ЭКГ и с начальной вибрацией первого сердечного тона. Это можно видеть на кривой желудочкового давления как начало подъема внутрижелудочкового давления после сокращения предсердия.
Фазы асинхронного и изометрического сокращений вместе называют периодом напряжения желудочков. Когда в результате изометрического сокращения давление в желудочках становится выше, чем давление в аорте и легочной артерии, клапаны аорты и легочной артерии открываются и наступает период изгнания крови из желудочков, и кровь поступает из желудочков в аорту и легочную артерию.
Период изгнания (выброса) крови начинается с открытия полулунных клапанов, свидетельствует о начале фазы желудочкового выброса, которую можно подразделить на раннюю, более короткую - фазу быстрого изгнания и на позднюю, более длительную фазу медленного изгнания. Фаза быстрого изгнания отличается от фазы медленного изгнания тремя факторами: (1) резким повышением внутрижелудочкового и аортального давлений, которое завершается на высшей точке желудочкового и аортального давления, (2) более резким уменьшением объема желудочков и (3) более сильным аортальным кровотоком (рис. 6-57). Резкий спад кривой давления в левом предсердии в начале выброса происходит из-за опущения основания сердца и растягивания предсердий. Во время фазы медленного изгнания отток крови из аорты на периферию превышает выброс из желудочка, и поэтому аортальное давление понижается. На протяжении систолы желудочков кровь, поступающая по венам в предсердия, вызывает повышение давления в предсердиях.
Показатель состояния сократительной способности миокарда можно вычислить по скорости кровотока в восходящей части аорты во время сердечного цикла (начальный наклон кривой аортального кровотока) (рис. 6-57). Фракция выброса, которая представляет собой отношение объема крови, выбрасываемой из левого желудочка за 1 удар (объем систолического выброса) к объему крови в левом желудочке в конце диастолы (конечный диастолический объем), широко применяется клинике в качестве индекса сократительной способности.
Полулунные клапаны расположены между правым желудочком и легочной артерией и между левым желудочком и аортой. Они представлены тремя чашеобразными створками. В конце фазы медленного изгнания систолы желудочков кровоток быстро меняет направление в сторону желудочков (показан как негативный поток на кривой фазового аортального кровотока на рис. 6-57).
Слайд 115Вслед за фазой изгнания наступает диастола желудочков. Они начинают расслабляться, поэтому давление
Вслед за фазой изгнания наступает диастола желудочков. Они начинают расслабляться, поэтому давление

Далее следует период наполнения желудочков кровью. Поступление крови в желудочки идет вначале быстро, так как давление в них после их расслабления падает до 0 - фаза быстрого наполнения, длящаяся 0,08 с. По мере наполнения желудочков давление в них немного увеличивается и наполнение замедляется - фаза медленного наполнения, продолжающаяся 0,17 с. В конце диастолы желудочков происходит систола предсердий длительностью 0,1 с - которая носит название пресистола желудочков.
Рассмотрим фазу быстрого наполнения. Главная часть наполнения желудочка происходит сразу после открытия AV-клапанов. В этот момент кровь, возвратившаяся в предсердия во время предшествующей желудочковой систолы, стремительно поступает в расслабленные желудочки. Этот этап наполнения желудочков называется фазой быстрого наполнения. На рис. 6-57 начало фазы быстрого наполнения обозначено падением давления в левом желудочке ниже давления в левом предсердии. Это изменение направления давления вызывает открытие митрального клапана. Быстрое поступление крови из предсердий в расслабленные желудочки вызывает понижение давления в предсердиях и желудочках и резкое увеличение объема желудочков.
Рассмотрим фазу медленного наполнения. За фазой быстрого наполнения следует фаза, называемая фазой медленного наполнения. При фазе медленного наполнения кровь, возвращающаяся с периферии, поступает в правый желудочек, а кровь из легких поступает в левый желудочек. Это небольшое, медленное дополнение к желудочковому наполнению проявляется постепенным ростом предсердного, желудочкового и венозного давления и увеличением объема желудочков (рис. 6-57).
Во время диастолы желудочков давление крови в аорте и легочной артерии постепенно снижается по мере оттока из них крови и к концу диастолы оно равно в аорте 65-75 мм рт.ст., а в легочной артерии - 5-10 мм рт.ст. Так как это конечно-диастолическое давление выше давления в желудочках, то полулунные клапаны остаются закрытыми до тех пор, пока давление в желудочках при их сокращении не превысит уровня давления в крупных артериальных стволах
Слайд 116Обычно сердце производит четыре тона, но, как правило, через стетоскоп прослушиваются только
Обычно сердце производит четыре тона, но, как правило, через стетоскоп прослушиваются только

Второй сердечный тон, который появляется при резком закрытии полулунных клапанов (рис. 6-57), состоит из колебаний более высокой частоты (с большей высотой звука), имеет более короткую продолжительность и меньшую интенсивность и более «щелкающий» характер, чем первый сердечный тон. Закрытие полулунного клапана вызывает осцилляции крови в сосуде и приводит к напряжению(tension) стенок сосуда вследствие растяжения и отдаче (recoil) закрытого клапана. Часть второго сердечного тона, производимая закрытием легочного клапана, лучше всего прослушивается во втором межреберном промежутке слева от грудины, тогда как звук, производимый закрытием аортального клапана, лучше всего слышен в том же самом межреберном промежутке, только справа от грудины. Причиной, по которой полулунные клапаны закрываются быстрее, чем обычно, может быть повышение давления в легочной артерии или аорте (например, при легочной или системной гипертензии). При этом увеличивается громкость второго сердечного тона. Звук аортального клапана обычно громче, чем легочного, но в случаях легочной гипертензии наблюдается обратное соотношение.
Четвертый, или предсердный сердечный тон состоит из нескольких низкочастотных колебаний. Этот тон иногда прослушивается у здоровых людей. Данный тон производится пульсацией крови и пульсовыми колебаниями стенок камер, вызванными сокращением предсердий (рис. 6-57).
На рис. 6-57 показана запись кривой венозного пульса, снятого на яремной вене. Зубец С этой кривой появляется следствием влияния пульсации общей сонной артерии на примыкающую яремную вену и, в какой-то мере, из-за быстрого закрытия трехстворчатого клапана в начале систолы желудочка. Обратите внимание, что, за исключением зубца С, кривая венозного пульса точно следует за кривой давления в предсердиях.


 Эндокринная система. Железы внутренней секреции
Эндокринная система. Железы внутренней секреции Функциональная анатомия мышц и суставов туловища. Грудная клетка, живот
Функциональная анатомия мышц и суставов туловища. Грудная клетка, живот Дыхательные движения. Регуляция дыхания
Дыхательные движения. Регуляция дыхания Методы идентификации чистых культур микробов
Методы идентификации чистых культур микробов Изучение внешнего строения, скелета и зубной системы млекопитающих. Лабораторная работа № 7
Изучение внешнего строения, скелета и зубной системы млекопитающих. Лабораторная работа № 7 Сердечно-сосудистая система человека. (Лекция 4)
Сердечно-сосудистая система человека. (Лекция 4) Происхождение и эволяция собаки
Происхождение и эволяция собаки Животные леса
Животные леса Моделирование Изучение нервной ткани
Моделирование Изучение нервной ткани Летняя и осенняя окраска листьев
Летняя и осенняя окраска листьев Перелетные птицы и кормушки
Перелетные птицы и кормушки Строение побега
Строение побега Перспективы использования Campsis lour. в озеленении агломерации Саратов-Энгельс
Перспективы использования Campsis lour. в озеленении агломерации Саратов-Энгельс Среды жизни
Среды жизни Обонятельный анализатор
Обонятельный анализатор Законы Менделя
Законы Менделя Поли- и гетерофункциональность, как причина появления специфических свойств у гидрокси-амино и кетокислот. (Лекция 11)
Поли- и гетерофункциональность, как причина появления специфических свойств у гидрокси-амино и кетокислот. (Лекция 11) Sectional Anatomy II
Sectional Anatomy II Метаболізм ліпідів. Метаболізм білків. Стероїди. (Лекція 2)
Метаболізм ліпідів. Метаболізм білків. Стероїди. (Лекція 2) Рейтинг самых опасных животных в мире
Рейтинг самых опасных животных в мире Неклеточные формы жизни. Вирусы и бактериофаги
Неклеточные формы жизни. Вирусы и бактериофаги Классификация овощей
Классификация овощей Царство бактерий
Царство бактерий Многообразие сельскохозяйственных растений
Многообразие сельскохозяйственных растений 22
22 Индоутки – мои новые питомцы
Индоутки – мои новые питомцы Методы селекции
Методы селекции Эмбриологические доказательства эволюции
Эмбриологические доказательства эволюции