Содержание
- 2. План лекции Уровни структурной организации белковой молекулы Физико – химические свойства белков и белковых растворов Практическое
- 3. УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКОВОЙ МОЛЕКУЛЫ
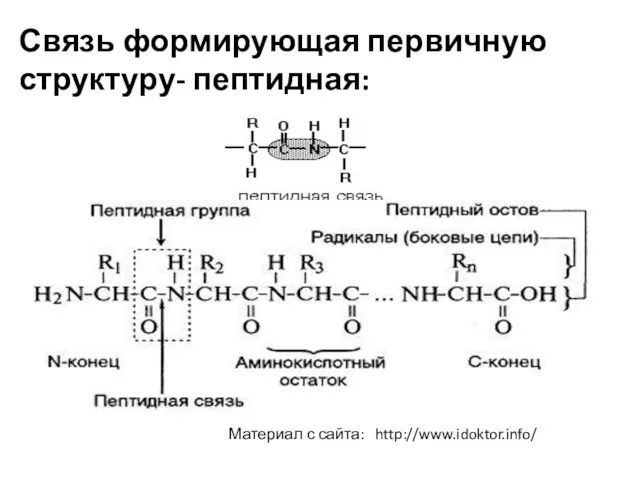
- 4. Первичная структура белка - представляет собой линейную последовательность аминокислотных остатков (свыше 50), связанных пептидными связями в
- 5. Связь формирующая первичную структуру- пептидная: Материал с сайта: http://www.idoktor.info/
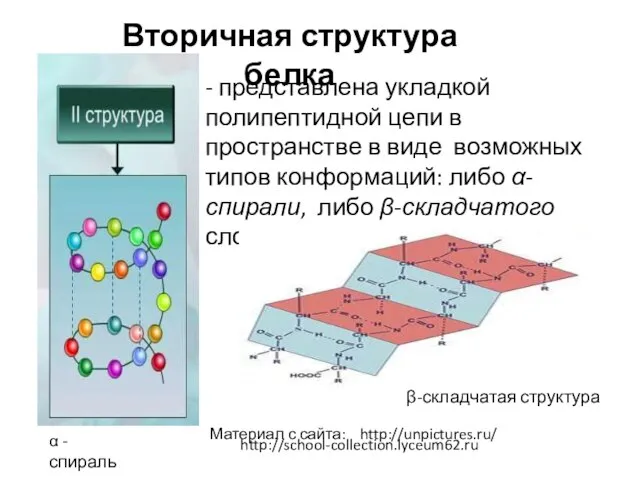
- 6. - представлена укладкой полипептидной цепи в пространстве в виде возможных типов конформаций: либо α-спирали, либо β-складчатого
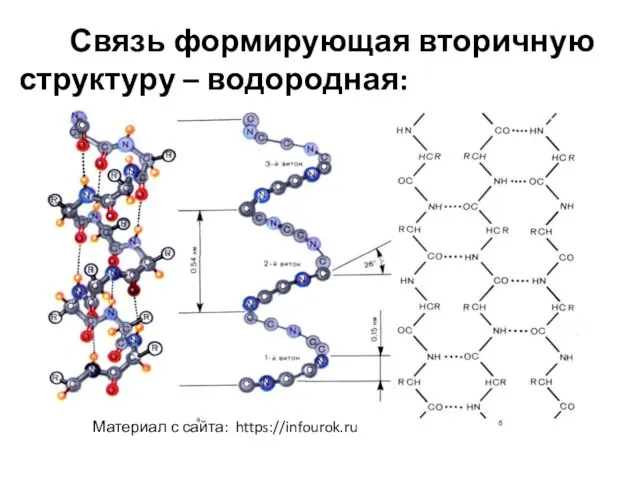
- 7. Связь формирующая вторичную структуру – водородная: Материал с сайта: https://infourok.ru
- 8. называют трехмерную пространственную структуру, образующуюся за счет взаимодействий между радикалами аминокислот полипептидной цепи, расположенных на значительном
- 9. глобула фибрилла http://www.studfiles.ru/ http://24-sports.ru Типы конформаций
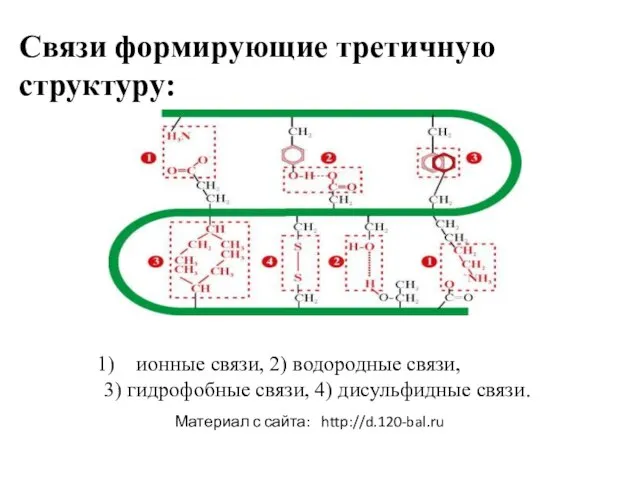
- 10. Связи формирующие третичную структуру: ионные связи, 2) водородные связи, 3) гидрофобные связи, 4) дисульфидные связи. Материал
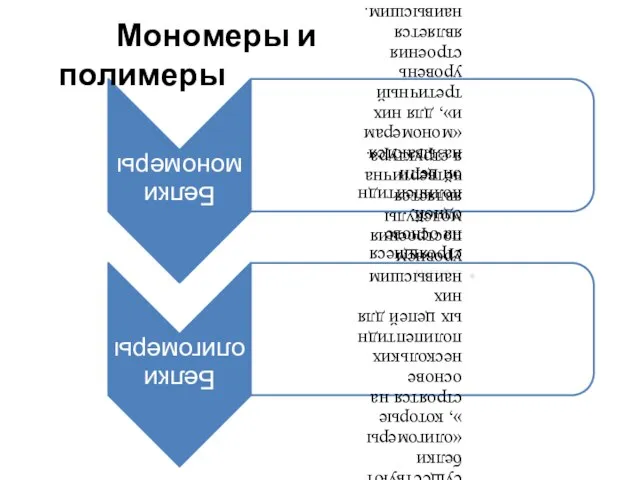
- 11. Мономеры и полимеры
- 12. – это способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой третичной структурой (глобулярной или фибриллярной),
- 13. Физико – химическим свойствам белков
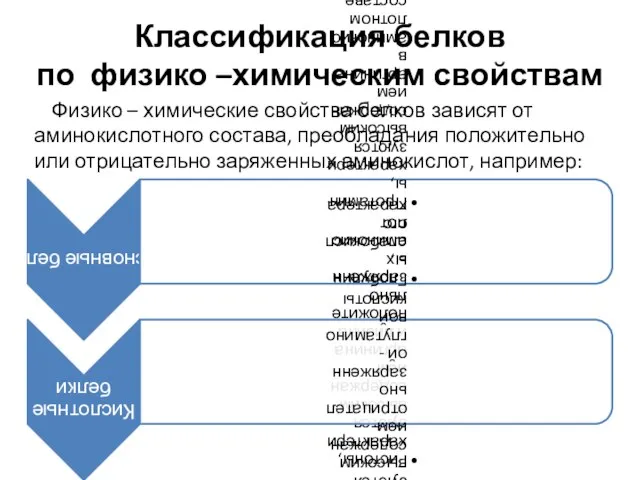
- 14. Классификация белков по физико –химическим свойствам Физико – химические свойства белков зависят от аминокислотного состава, преобладания
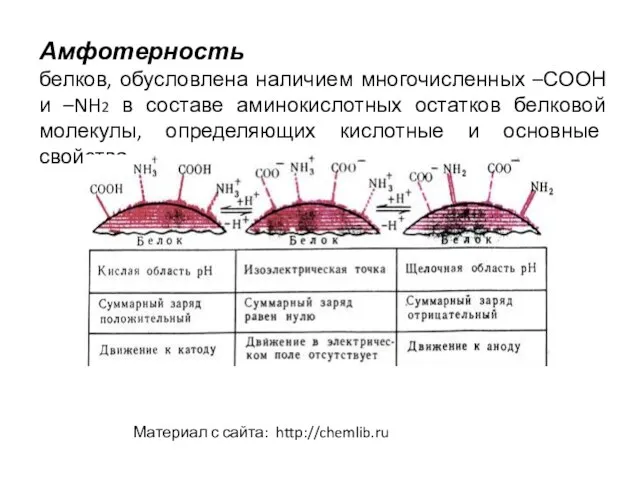
- 15. Амфотерность белков, обусловлена наличием многочисленных –СООН и –NH2 в составе аминокислотных остатков белковой молекулы, определяющих кислотные
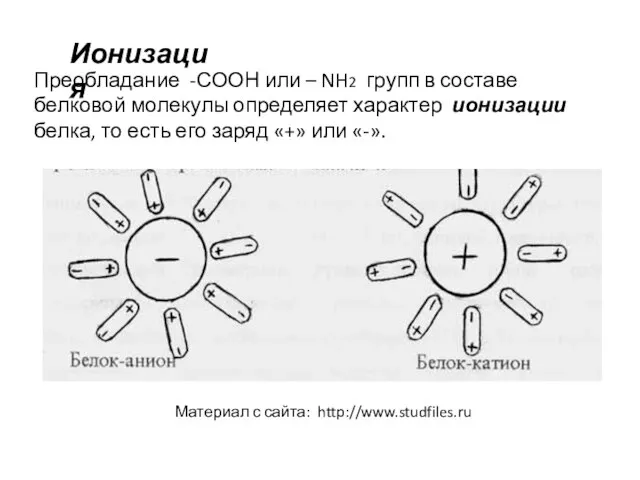
- 16. Преобладание -СООН или – NH2 групп в составе белковой молекулы определяет характер ионизации белка, то есть
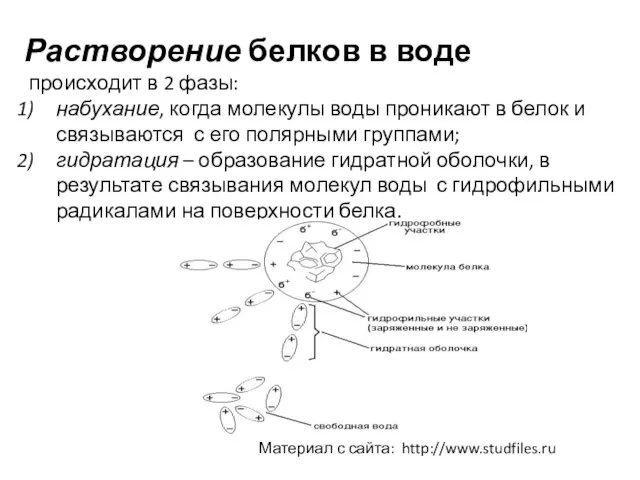
- 17. Растворение белков в воде происходит в 2 фазы: набухание, когда молекулы воды проникают в белок и
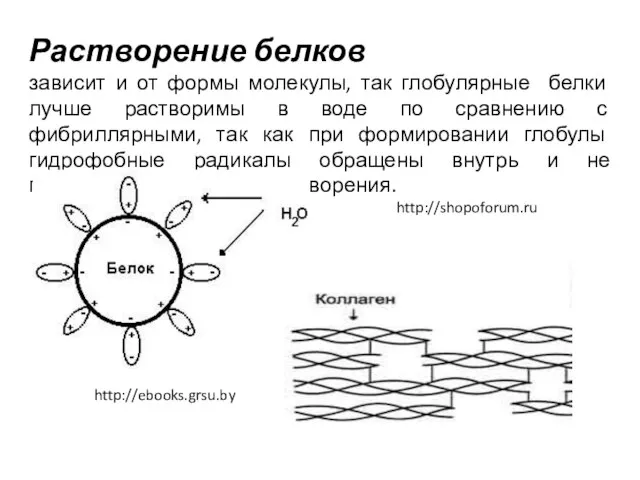
- 18. Растворение белков зависит и от формы молекулы, так глобулярные белки лучше растворимы в воде по сравнению
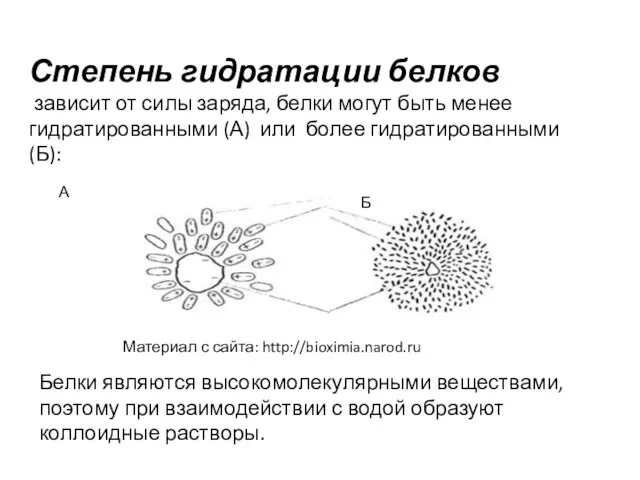
- 19. Степень гидратации белков зависит от силы заряда, белки могут быть менее гидратированными (А) или более гидратированными
- 20. Свойства коллоидных растворов: Опалесценция растворов (способность рассеивать луч видимого света) Малая скорость диффузии Неспособность проникать через
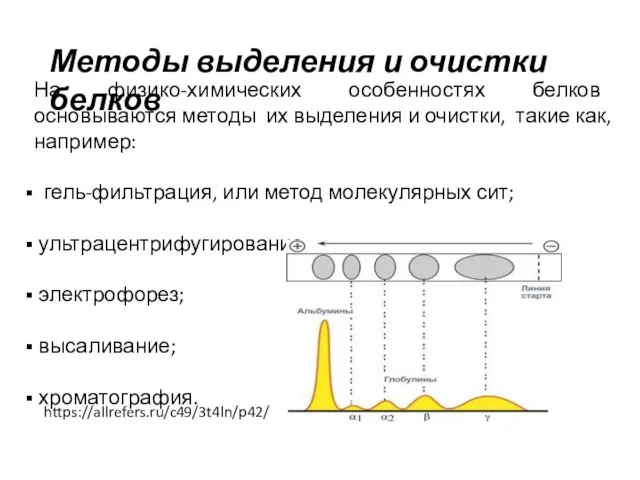
- 21. На физико-химических особенностях белков основываются методы их выделения и очистки, такие как, например: гель-фильтрация, или метод
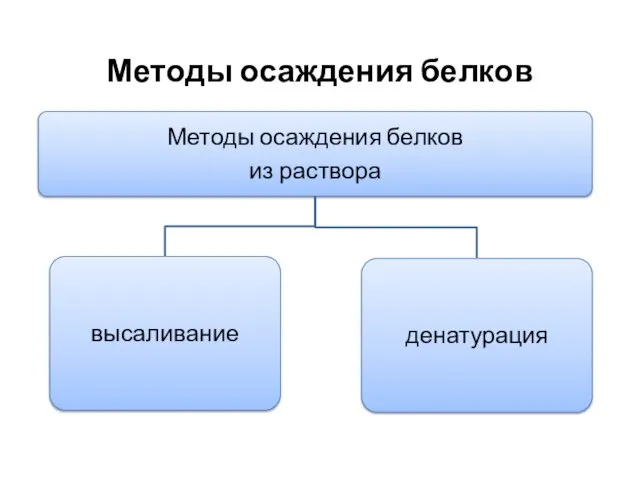
- 22. Методы осаждения белков
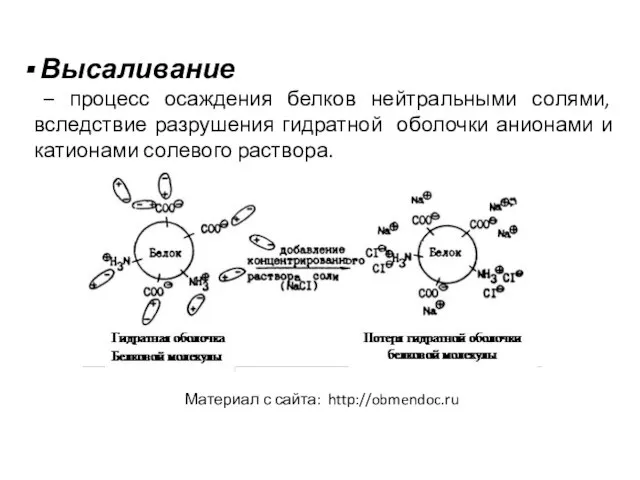
- 23. Высаливание – процесс осаждения белков нейтральными солями, вследствие разрушения гидратной оболочки анионами и катионами солевого раствора.
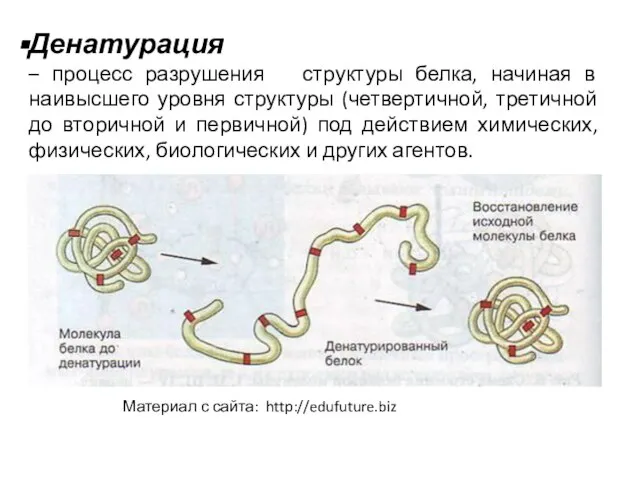
- 24. Денатурация – процесс разрушения структуры белка, начиная в наивысшего уровня структуры (четвертичной, третичной до вторичной и
- 25. Практическое применение денатурации в медицине
- 26. Практическое применение денатурации
- 27. Антисептические средства Материал с сайта: http://saf-14.ru/
- 28. Стерильные растворы Материал с сайта: http://mo.r-b.ru/
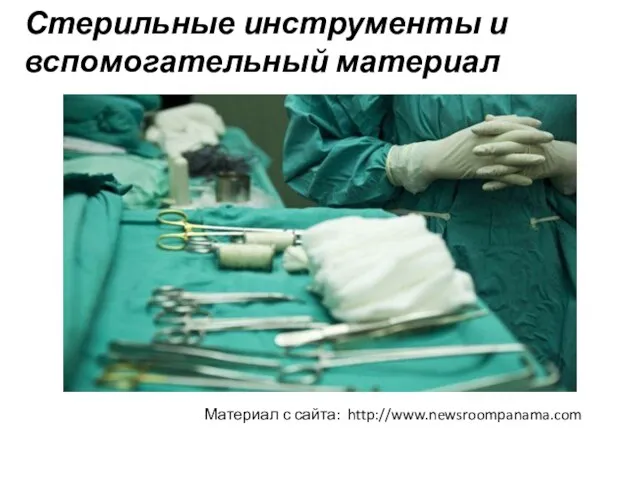
- 29. Стерильные инструменты и вспомогательный материал http://matopat.ru/ Материал с сайта: http://www.newsroompanama.com
- 30. Дезинфицирующие средства Материал с сайта: http://www.palmsbeachresort.net/
- 32. Скачать презентацию












 Canlılarda ifrazat. Çoxalma. Qıcıqlanma
Canlılarda ifrazat. Çoxalma. Qıcıqlanma Lektsia_12_Obmen_i_funktsii_vitaminov (1)
Lektsia_12_Obmen_i_funktsii_vitaminov (1) Микроорганизмы и человек
Микроорганизмы и человек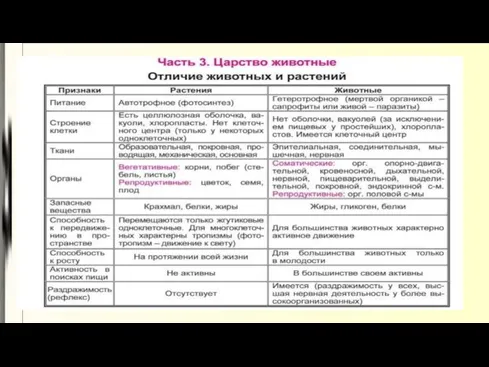 Царство Животные
Царство Животные Молекулярная биология. Лекция 3
Молекулярная биология. Лекция 3 Характеристика класса Marattiopsida
Характеристика класса Marattiopsida Звери запасаются
Звери запасаются 4. 1. Характеристика и систематика растений
4. 1. Характеристика и систематика растений 14 сентября - Всемирный день защиты пчёл
14 сентября - Всемирный день защиты пчёл Микробиологя. Представители
Микробиологя. Представители Воздушное питание. Фотосинтез
Воздушное питание. Фотосинтез Лекарственные растения
Лекарственные растения Приспособление животных к экстремальным значения солёности
Приспособление животных к экстремальным значения солёности Проект Берегите птиц. Большой пестрый дятел
Проект Берегите птиц. Большой пестрый дятел Изображение и реальность
Изображение и реальность Пищеварительная система человека
Пищеварительная система человека Основы генетики. Моногибридное скрещивание
Основы генетики. Моногибридное скрещивание Презентация на тему Доказательство эволюции органического мира
Презентация на тему Доказательство эволюции органического мира  Задачи генетика
Задачи генетика Углеводы. Липиды. 9 класс
Углеводы. Липиды. 9 класс Работа сердца. Урок
Работа сердца. Урок Паттерны микроорганизмов
Паттерны микроорганизмов Задание 44. Тема: гербарий
Задание 44. Тема: гербарий Зачет по Теме: Тип Плоские, Круглые, Кольчатые Черви. Тест
Зачет по Теме: Тип Плоские, Круглые, Кольчатые Черви. Тест Трофическая структура БГЦ
Трофическая структура БГЦ Презентация на тему Хвойные леса умеренного пояса и их обитатели
Презентация на тему Хвойные леса умеренного пояса и их обитатели  Презентация на тему Костные рыбы
Презентация на тему Костные рыбы 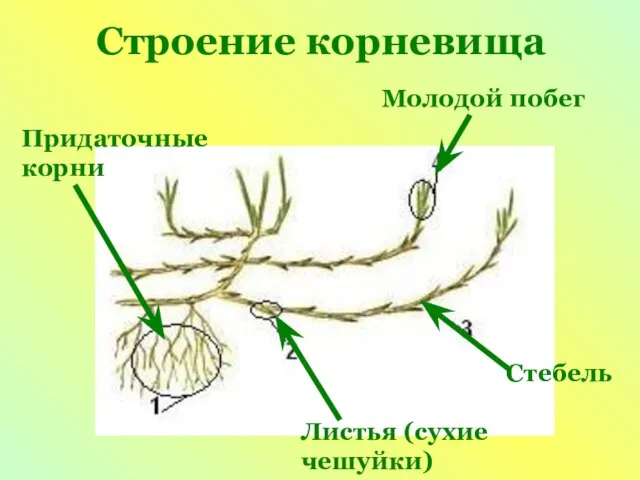 Презентация на тему Строение корневища
Презентация на тему Строение корневища