Содержание
- 2. ФЕРМЕНТЫ (ЭНЗИМЫ) – ВЕЩЕСТВА БЕЛКОВОЙ ПРИРОДЫ, СПОСОБНЫЕ КАТАЛИТИЧЕСКИ УСКОРЯТЬ ПРОТЕКАНИЕ ХИМИЧЕСКИХ РЕАКЦИЙ Модель фермента нуклеозидфосфорилазы
- 3. Значение для изучения: Ферменты - биологические регуляторы химических процессов в клетке (основа жизнедеятельности) Нарушения в их
- 4. Сходство ферментов с небиологическими катализаторами заключается в том, что: Небиологические катализаторы и энзимы ускоряют энергетически возможные
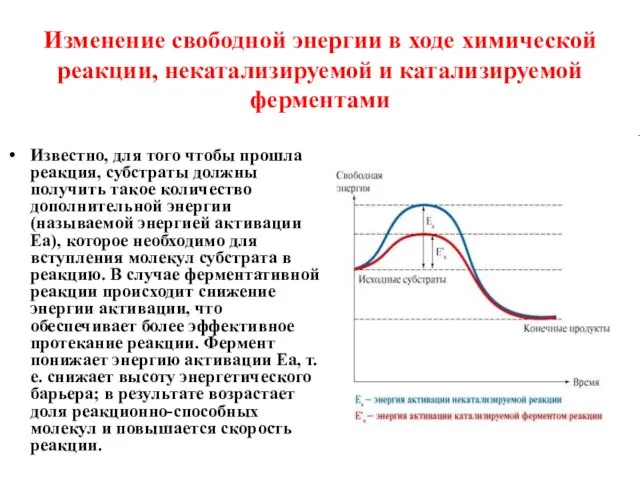
- 5. Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами Известно, для того чтобы прошла
- 6. Сходство ферментов с небиологическими катализаторами заключается в том, что: В ходе катализа направление реакции не изменяется;
- 7. Отличие ферментов от небиологических катализаторов заключается в том, что: Скорость ферментативных реакций выше, чем реакций, катализируемых
- 8. Пять основных свойств ферментов как биологических катализаторов Субстратная специфичность Каталитическая эффективность Конформационная лабильность Способность ферментов к
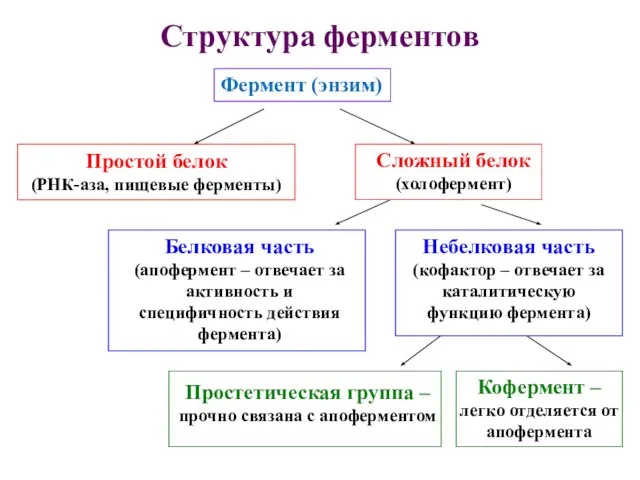
- 9. Структура ферментов Фермент (энзим) Простой белок (РНК-аза, пищевые ферменты) Сложный белок (холофермент) Белковая часть (апофермент –
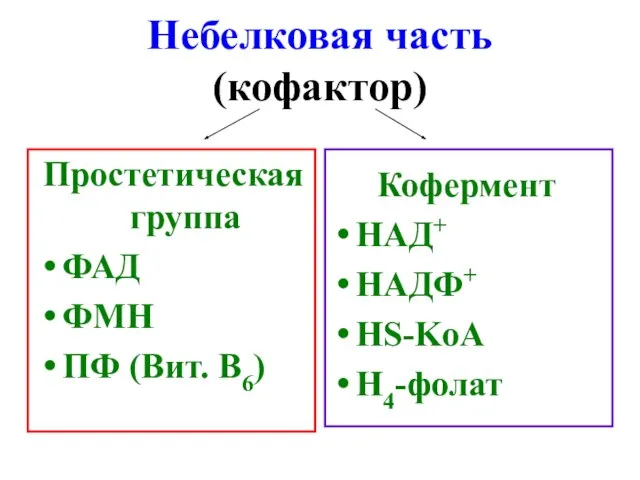
- 10. Небелковая часть (кофактор) Простетическая группа ФАД ФМН ПФ (Вит. В6) Кофермент НАД+ НАДФ+ HS-KoA Н4-фолат
- 11. Небелковая часть Производные витаминов Гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической
- 12. Функции небелковой части фермента Перенос атомов водорода, электронов (окислительно-восстановительные реакции – НАД, ФАД и др.). Перенос
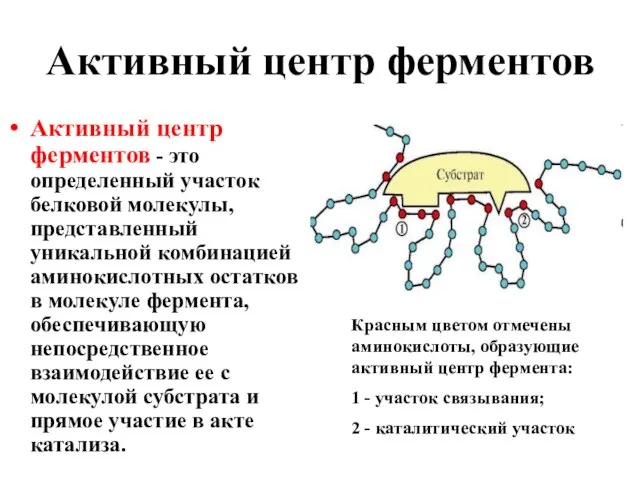
- 13. Активный центр ферментов Активный центр ферментов - это определенный участок белковой молекулы, представленный уникальной комбинацией аминокислотных
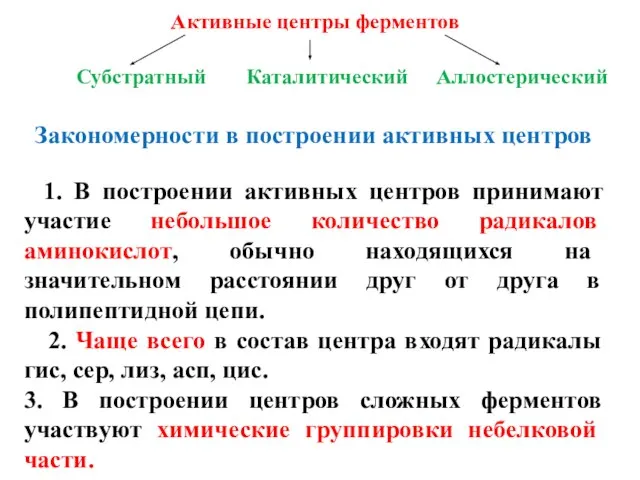
- 14. Активные центры ферментов Субстратный Каталитический Аллостерический Закономерности в построении активных центров 1. В построении активных центров
- 15. Активные центры ферментов Субстратный Каталитический Аллостерический Закономерности в построении активных центров 4. Если фермент является олиго-
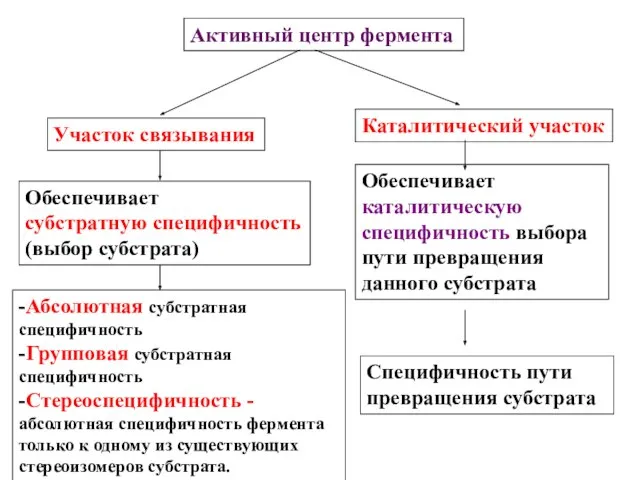
- 16. Активный центр фермента Участок связывания Каталитический участок Обеспечивает субстратную специфичность (выбор субстрата) -Абсолютная субстратная специфичность -Групповая
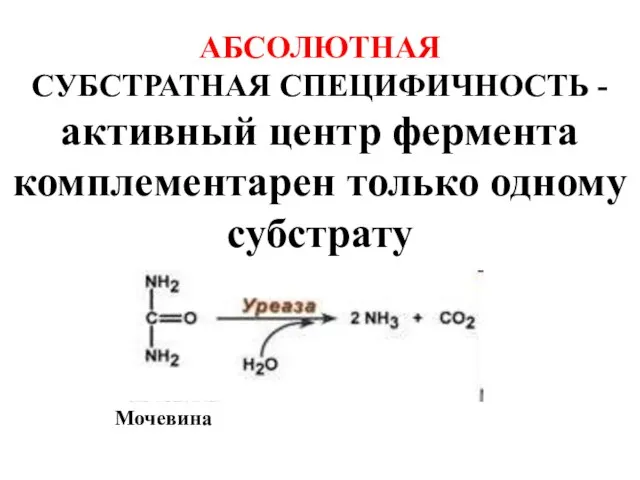
- 17. АБСОЛЮТНАЯ СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ - активный центр фермента комплементарен только одному субстрату Мочевина
- 18. ГРУППОВАЯ СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ - фермент катализирует однотипную реакцию с небольшим количеством (группой) структурно похожих субстратов. Гидролиз
- 19. СТЕРЕОСПЕЦИФИЧНОСТЬ - фермент проявляет абсолютную специфичность только к одному из существующих стереоизомеров субстрата Стереоспецифичность к D-сахарам
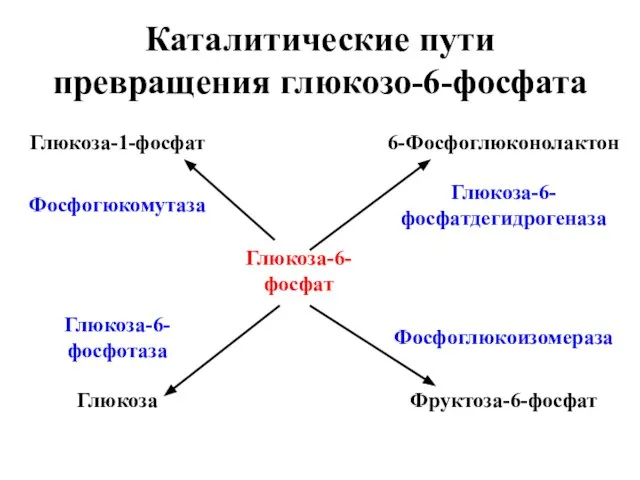
- 20. Каталитические пути превращения глюкозо-6-фосфата
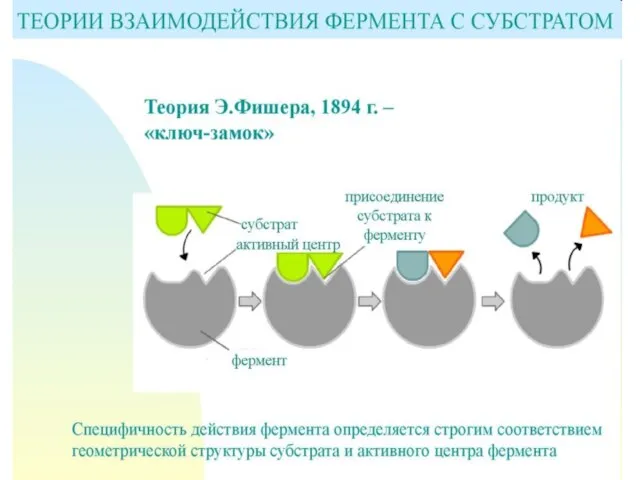
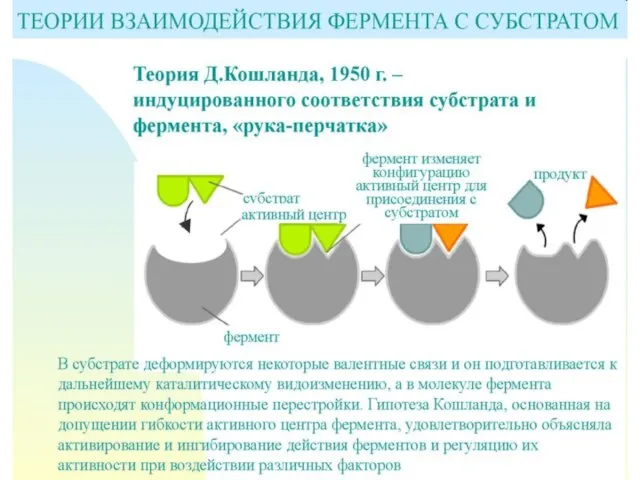
- 21. Механизмы специфичности Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата
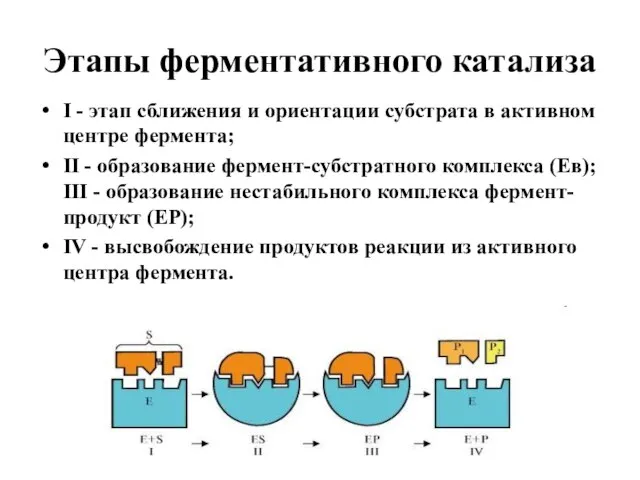
- 23. Этапы ферментативного катализа I - этап сближения и ориентации субстрата в активном центре фермента; II -
- 24. Факторы, влияющие на активность ферментов Концентрация фермента (энзима) [E] Концентрация субстрата [S] Температура Концентрация ионов Н
- 25. Влияние [E] [S] - const 1. Рассмотрим зависимость скорости реакции от количества фермента. При условии избытка
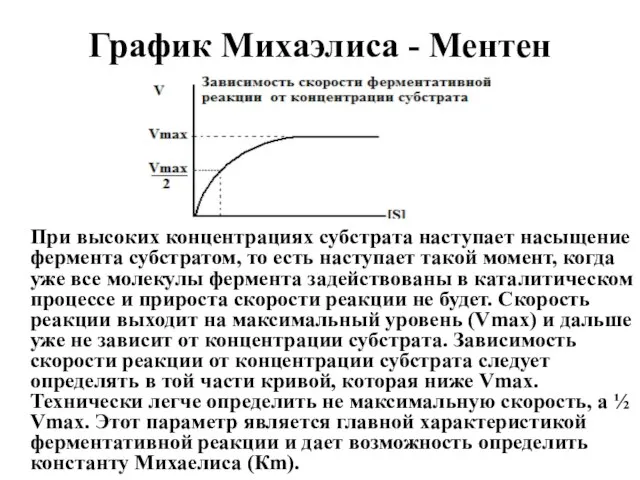
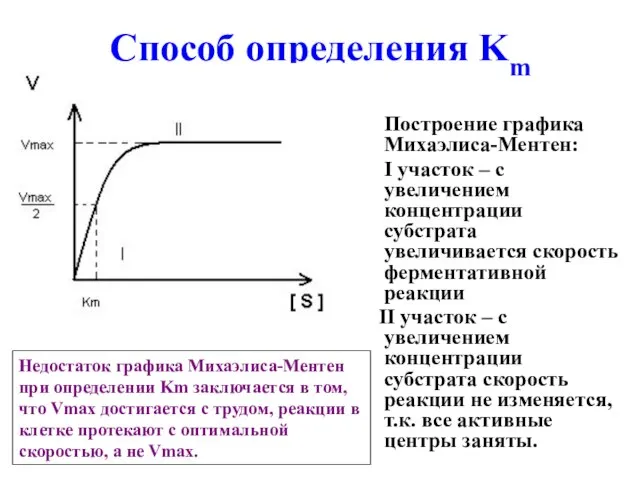
- 26. График Михаэлиса - Ментен При высоких концентрациях субстрата наступает насыщение фермента субстратом, то есть наступает такой
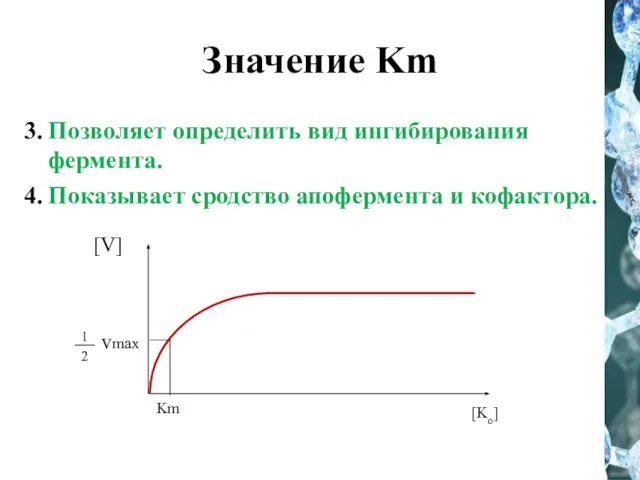
- 27. Кm (константа Михаэлиса) – это такая концентрация субстрата, при которой скорость ферментативной реакции равна половине максимальной.
- 28. Уравнение Михаэлиса - Ментен где Vmax — максимальная скорость реакции; Km — константа Михаэлиса, равная концентрации
- 29. Значение Km 1. Показывает сродство [E] и [S]
- 30. Например, этиленгликоль – составная часть антифриза и алкогольдегидрогеназа (АДГ) будет превращать его в щавелевую кислоту, которая
- 31. Значение Km 2. Km – важная количественная характеристика фермента, определяет с каким [S] будет наиболее эффективно
- 32. Значение Km 3. Позволяет определить вид ингибирования фермента. 4. Показывает сродство апофермента и кофактора.
- 33. Способ определения Km Построение графика Михаэлиса-Ментен: I участок – с увеличением концентрации субстрата увеличивается скорость ферментативной
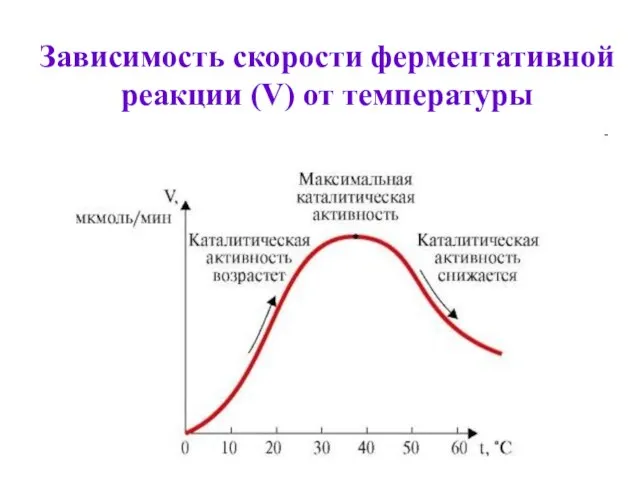
- 34. Зависимость скорости ферментативной реакции от температуры При t=36-380С ферменты обладают наибольшей активностью. Эта температура называется температурный
- 35. Зависимость скорости ферментативной реакции (V) от температуры
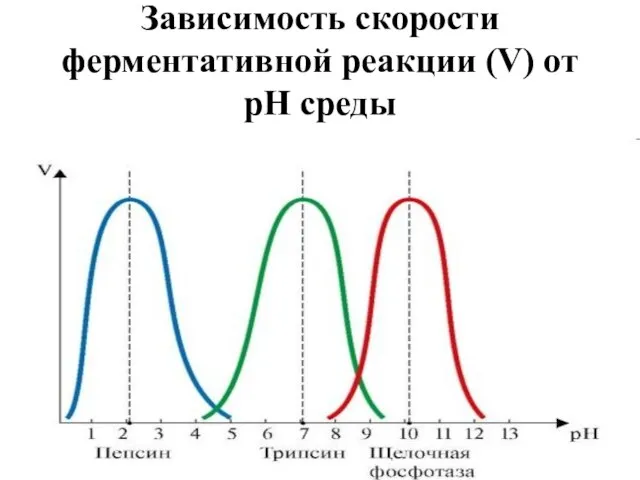
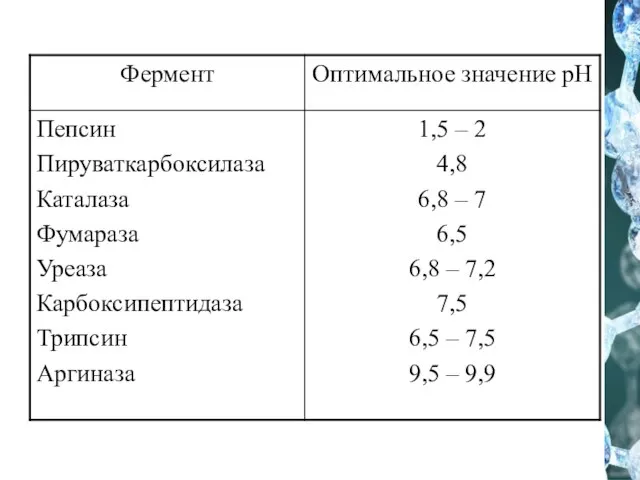
- 36. Зависимость скорости ферментативной реакции (V) от рН среды
- 38. Классификация и номенклатура ферментов
- 41. 1. Оксидоредуктазы катализируют различные окислительно-восстановительные реакции. Класс делится на подклассы: а) дегидрогеназы катализируют реакции дегидрирования (отщепления
- 42. 1. Оксидоредуктазы б) оксидазы - катализируют реакции окисления с участием молекулярного кислорода
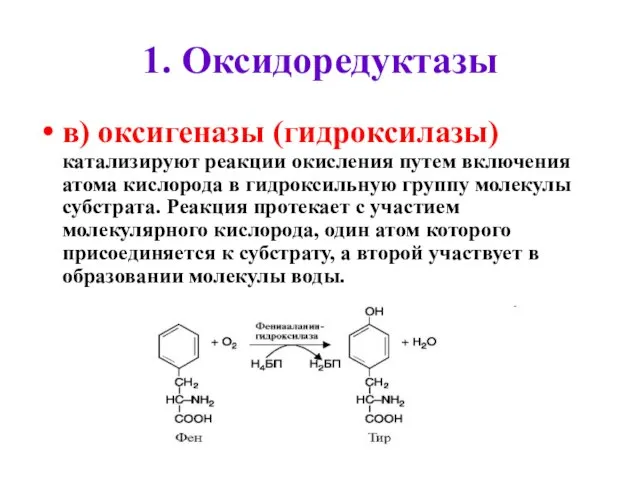
- 43. 1. Оксидоредуктазы в) оксигеназы (гидроксилазы) катализируют реакции окисления путем включения атома кислорода в гидроксильную группу молекулы
- 44. 2. Трансферазы - катализируют реакции переноса функциональных групп. В зависимости от переносимой группы подразделяются на подклассы:
- 45. 3. Гидролазы катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Разделяются
- 46. 4. Лиазы К лиазам относятся ферменты, отщепляющие от субстратов негидролитическим путем определенные группы, такие, как СО2,
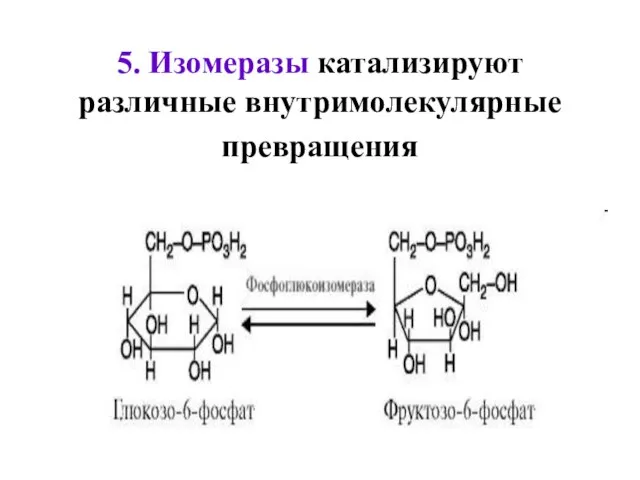
- 47. 5. Изомеразы катализируют различные внутримолекулярные превращения
- 49. Скачать презентацию











![Факторы, влияющие на активность ферментов Концентрация фермента (энзима) [E] Концентрация субстрата [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/907273/slide-23.jpg)
![Влияние [E] [S] - const 1. Рассмотрим зависимость скорости реакции от количества](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/907273/slide-24.jpg)


![Значение Km 1. Показывает сродство [E] и [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/907273/slide-28.jpg)










 Силы в природе
Силы в природе Презентация на тему Редкие виды животных и растений Пермского края
Презентация на тему Редкие виды животных и растений Пермского края  Презентация на тему Интеграция математических понятий
Презентация на тему Интеграция математических понятий  Природные сообщества
Природные сообщества Становление человеческого общества
Становление человеческого общества Опытническая работа Методика проращивания кофе аравийского (cofféa arábica) в условиях учебной теплицы
Опытническая работа Методика проращивания кофе аравийского (cofféa arábica) в условиях учебной теплицы Атмосфера. Тепловые процессы в атмосфере. Динамика атмосферы. Влагооборот. Лекция 9-10
Атмосфера. Тепловые процессы в атмосфере. Динамика атмосферы. Влагооборот. Лекция 9-10 Современная ззология
Современная ззология Стволовые клетки и выращивание органов и тканей
Стволовые клетки и выращивание органов и тканей Иммунный ответ
Иммунный ответ Слуховой анализатор
Слуховой анализатор Показатели обилия унитарных организмов
Показатели обилия унитарных организмов Птицы Красноярского края занесенные в красную книгу
Птицы Красноярского края занесенные в красную книгу Значение дыхания, органы дыхания. 8 класс
Значение дыхания, органы дыхания. 8 класс Роль бактерий в нашем организме
Роль бактерий в нашем организме Животный мир Югры
Животный мир Югры Complex analysis of metabolic status, intracellular pH, viscosity and cytoskeleton of human
Complex analysis of metabolic status, intracellular pH, viscosity and cytoskeleton of human Животный мир
Животный мир Живая и неживая природа
Живая и неживая природа Пищевод ≈ 25 см
Пищевод ≈ 25 см Открытый национальный архитектурный конкурс на разработку проектов приюта для безнадзорных животных
Открытый национальный архитектурный конкурс на разработку проектов приюта для безнадзорных животных Южнорусский тарантул
Южнорусский тарантул Условия, необходимые для роста растений
Условия, необходимые для роста растений Многообразие жизненных форм растений
Многообразие жизненных форм растений Забота о потомстве в мире рыб
Забота о потомстве в мире рыб Монокарпический побег
Монокарпический побег Санитарное состояние участка леса
Санитарное состояние участка леса Нуклеиновые кислоты
Нуклеиновые кислоты